En pathologie humaine, les môles hydatiformes se caractérisent par une prolifération anormale des tissus extra-embryonnaires avec présence de villosités trophoblastiques vésiculeuses. Leur fréquence varie selon les ethnies : 1/250 grossesses en Extrême- Orient, 1/1 500 aux États-Unis.
Dans 25 % des cas, ce sont des môles partielles (un embryon très malformé et non viable peut exister) qui sont dues à un accident de fécondation de type triploïdie, avec un lot de chromosomes supplémentaires d’origine paternelle. Lorsque la triploïdie est d’origine maternelle, les tissus extra-embryonnaires sont, à l’inverse, très hypoplasiques
Dans la plupart des autres cas, il s’agit de môles complètes, survenant de façon sporadique mais pouvant être à l’origine de choriocarcinomes [
7]. L’étude génétique révèle une absence d’héritage maternel [
8]. La diploïdie correspond à une duplication d’un spermatozoïde haploïde (90 % des cas) ou à la fécondation d’un ovule - anucléé - par deux spermatozoïdes. Il est facile de vérifier la dispermie car, dans ce cas, les allèles étudiés sont différents, alors qu’on trouve une homozygotie pour tous les allèles quand il s’agit d’une duplication du lot haploïde d’un spermatozoïde.
Cependant, quelques cas de récurrence avaient été rapportés dans des familles consanguines où les femmes ne réussissaient pas à avoir une seule grossesse normale [
9]. Les môles étudiées s’étaient révélées différentes : elles avaient une constitution diploïde avec un héritage maternel et un héritage paternel, comme les zygotes normaux [
10].
Pour ces môles dites « biparentales », il fallait donc chercher ailleurs la cause de la prolifération anormale du trophoblaste sans développement d’embryon. La recherche d’une mutation autosomique récessive, vraisemblable chez ces femmes consanguines, fut bientôt confirmée par les analyses de ségrégation familiale : un locus fut trouvé en 19q13.3-q13.4 [
11]. L’hypothèse d’une anomalie d’un gène maternel intervenant dans les processus d’empreinte fut alors proposée.
C’est pourquoi, chez une femme pakistanaise de la région de Mirpur Khas, qui avait eu successivement 6 grossesses molaires, une analyse des empreintes parentales fut réalisée sur les tissus de la sixième môle [
12].
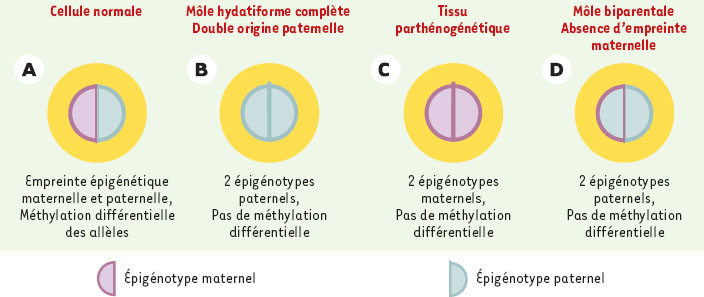
Après avoir démontré qu’il s’agissait bien d’une môle biparentale, avec héritages maternel et paternel, diverses régions non contiguës où s’exercent les empreintes parentales furent analysées : 11p15, 15q, 7q32 et 19q13- 4. Des tissus parthénogénétiques et des trophoblastes de môles androgénétiques furent utilisés comme témoins ainsi que du tissu normal (cellules diploïdes et villosités choriales ou VC) (Figure 2).
 | Figure 2.
Épigénotypes normaux et pathologiques dans des cellules diploïdes. A. Cellule normale avec la double empreinte. B. Dans la môle hydatiforme, deux lots paternels ont été transmis. C. Dans le tissu parthénogénétique, deux lots maternels ont été transmis. D. Dans la môle biparentale, dans le lot maternel, l’empreinte parentale ne s’exerce pas, par déficit d’un gène intervenant sur la méthylation. |
Si l’hypothèse était bonne, on devait trouver une méthylation différentielle pour les zones à empreinte paternelle, et une absence de méthylation sur les deux allèles pour les zones à empreinte maternelle.
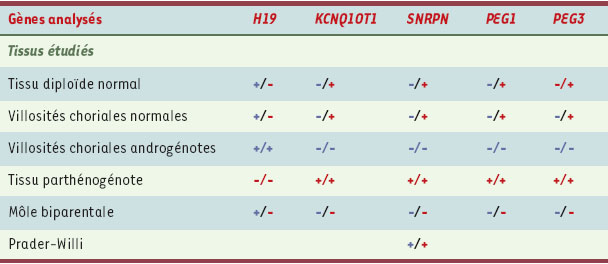
Dans la région Beckwith-Wiedemann (voir encadré), dans les tissus molaires, le gène H19, soumis à l’empreinte paternelle, révéla effectivement une méthylation différentielle entre les deux allèles, comme chez le témoin normal. Chez le témoin androgénote, le gène était complètement méthylé à tous les dinucléotides CpG. À l’opposé, la méthylation était complètement absente chez le témoin parthénogénote (Tableau I).
 | Tableau I.
Étude de la méthylation dans différents tissus de gènes soumis à empreinte parentale. Les gènes soumis à empreinte paternelle sont en bleu, à empreinte maternelle en rouge. Pour chaque tissu, la couleur indique l’origine du lot: bleu pour le lot paternel, rouge pour le lot maternel. + indique une méthylation; - indique une absence de méthylation. |
Dans cette même région, le gène KCNQ1OT1 est soumis à empreinte maternelle. Il donna les résultats attendus : la méthylation différentielle observée chez le témoin normal ne fut pas retrouvée. La môle biparentale se comporte comme si elle avait un épigénotype paternel, avec absence de méthylation sur les deux allèles, de la même façon que le témoin androgénote. Les autres gènes soumis à empreinte maternelle (SNRPN, PEG1, PEG3) testés ont donné les mêmes profils, en montrant chaque fois une absence d’empreinte maternelle (Tableau I). Ces résultats furent confirmés par l’étude du statut de méthylation du locus complexe GNAS (guanine nucleotide-binding protein, alpha-stimulating activity polypeptide 1) (voir OMIM 139320), où plusieurs régions séparées sont soumises à empreinte, l’une primaire, établie pendant la gamétogenèse, les autres secondaires, survenant au stade blastocyste [
13].
Cette impossibilité d’imprimer l’empreinte maternelle, phénomène baptisé immaculate misconception par Surani [14], doit donc être le fait de mutations dans un gène essentiel à l’empreinte maternelle, présentes à l’état homozygote chez ces femmes consanguines qui se trouvent dans l’incapacité totale d’avoir des enfants. Malheureusement, ce gène est complètement inconnu, car il ne correspond ni à DNMT3L qui est intact, ni au locus 19q qui semble exclu dans cette famille.
On le voit, il reste encore beaucoup à apprendre des mécanismes épigénétiques maternel et paternel, passionnants du point de vue fondamental et peut-être plus souvent impliqués qu’on ne l’imagine dans les échecs de grossesses.