| |
| Med Sci (Paris). 2003 October; 19(10): 943–949. Published online 2003 October 15. doi: 10.1051/medsci/20031910943.Obésité et maladies cardiovasculaires Paul Poirier* and Jean-Pierre Després Institut universitaire de cardiologie et de pneumologie, Centre de recherche de l’Hôpital Laval, 2725, chemin Sainte-Foy, Sainte-Foy, Québec, G1V 4G5, Canada |
Un bilan énergétique positif, en partie attribuable à une prise alimentaire excessive, s’avère l’un des facteurs ayant contribué à l’augmentation de la prévalence de l’obésité. En effet, les individus des populations des pays industrialisés sont de plus en plus nombreux à présenter un surplus de poids résultant de changements majeurs dans leurs habitudes de vie. Ainsi, l’obésité est en voie de devenir le problème de santé le plus commun du XXIe siècle [
1–
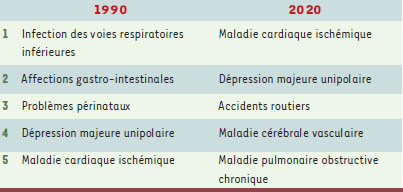
3], puisqu’elle contribuera de façon importante à la prévalence, malgré tout élevée, des maladies cardiovasculaires dans les pays en voie de développement. En dépit de ce constat, déjà relativement ancien, ce n’est que récemment que l’obésité a été considérée avec la même attention que les autres facteurs de risque associés aux maladies cardiovasculaires (MCV). En effet, le groupe de travail du Public health approaches to the prevention of obesity (PHAPO) de l’International obesity task force (IOTF) a énoncé le constat suivant: « Dans chaque pays du monde d’aujourd’hui, dépendant de son niveau d’évolution épidémiologique, les maladies chroniques non transmissibles comme les MCV, le cancer, le diabète et l’ostéoporose commencent soit à apparaître, soit à augmenter rapidement quand elles ne sont pas déjà bien installées à un niveau élevé » [3]. Par conséquent, l’obésité contribue de façon importante au problème global de l’apparition des maladies chroniques d’origine métabolique puisqu’elle est un facteur de risque susceptible de déclencher de nombreuses affections comme les MCV, le diabète, l’hypertension artérielle (HTA), les accidents vasculaires cérébraux, les embolies pulmonaires, certains cancers, l’ostéoarthrite, les affections de la vésicule biliaire et des anomalies respiratoires, notamment l’apnée du sommeil [1]. Il est d’ailleurs prévu que les décès causés par des maladies non transmissibles aillent augmenter de façon marquée passant de 28,1millions à 49,7 millions d’individus par année, une augmentation de 77% [3]. Dans cet ensemble, la maladie coronarienne va devenir la pathologie numéro un en 2020 (Tableau I)
 | Tableau I.
Problèmes de santé majeurs observés au niveau mondial en 1990 et anticipés en 2020 (adapté de [ 3]). |
|
Le syndrome métabolique (obésité «à risque») Un indice de masse corporelle élevé (IMC) constitue une variable anthropométrique simple permettant d’estimer de façon grossière l’adiposité des individus en fonction de leur poids (kg) et de leur taille (m2). Un IMC élevé augmente le risque d’infarctus du myocarde, d’insuffisance coronarienne et de mort subite, l’association semblant plus étroite avec la mort subite [1,
4]. En conséquence, l’obésité devrait être considérée en tant que facteur de risque modifiable majeur pour la maladie cardiaque ischémique [
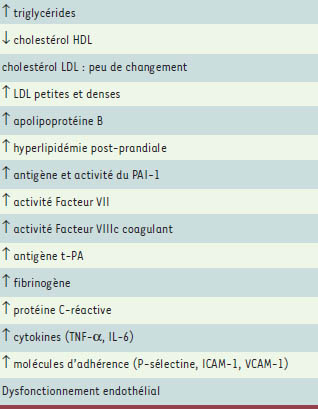
2]. Il est toutefois important de se rappeler qu’il existe une remarquable hétérogénéité dans la population obèse. Par exemple, la présence de l’obésité viscérale aggrave considérablement le profil métabolique résultant d’un surpoids. Cette forme d’obésité, surtout celle marquée par une accumulation sélective de tissu adipeux dans la cavité abdominale, est reliée à un ensemble de facteurs de risque traditionnels et non traditionnels qui sont potentiellement synergiques et délétères (Tableau II) [
5]. Comme tous les obèses ne sont pas égaux face au risque de MCV, le défi pour le clinicien consiste à dépister de façon précoce l’individu obèse « à risque » c’est-à-dire atteint d’une obésité associée à un regroupement de facteurs de risque défini sous le terme de syndrome métabolique. Utilisant les critères récemment établis par le National cholesterol education program américain, le syndrome métabolique se définit sur la base de trois des cinq critères suivants: circonférence de la taille pour les hommes > 102 cm et pour les femmes >88 cm; triglycérides (TG) à jeun ≥1,7 mmol/l, HDL (high density lipoprotein) cholestérol < 1,0 mmol/l pour les hommes et < 1,3 mmol/l pour les femmes ; pression artérielle > 130/85 mmHg ; et glycémie à jeun ≥ 6,1mmol/l [
6].
 | Tableau II.
Anomalies métaboliques associées à l’obésité abdominale. HDL : lipoprotéines de haute densité ; LDL : lipoprotéines de basse densité ; PAI-1 : inhibiteur-1 de l’activateur du plasminogène ; TNF-α: tumor necrosis factor α; IL-6 : interleukine- 6 ; ICAM-1 : molécule-1 d’adhérence intercellulaire ; VCAM-1 : molécule-1 d’adhérence vasculaire; t-PA: activateur tissulaire du plasminogène. |
De nombreuses données suggèrent qu’une accumulation excessive de tissu adipeux abdominal constitue un facteur de risque indépendant de MCV [
7–
9] et que les caractéristiques du syndrome métabolique résultent souvent d’un excès de graisse abdominale, spécialement lorsqu’il s’accompagne d’une accumulation importante de tissu adipeux viscéral [
10–
12]. À titre d’exemple, dans un groupe d’individus relativement homogène pour leur niveau d’obésité, les patients présentant une accumulation élevée de tissu adipeux viscéral se distinguent par des anomalies de l’homéostasie du glucose sanguin, une élévation des TG et des concentrations d’apolipoprotéine B, ainsi que par des concentrations abaissées de HDL cholestérol, une proportion accrue de particules LDL (low density lipoprotein) petites et denses, et par une hyperlipidémie postprandiale reflétant un système saturé d’élimination des lipoprotéines riches en TG, tant d’origine exogène qu’endogène [10–12]. Ces altérations métaboliques sont également accompagnées par un état pro-thrombotique et inflammatoire [4]. En effet, l’« obésité abdominale» va de pair avec une augmentation plasmatique des concentrations de fibrinogène, de l’activité coagulante des facteurs VII et VIIIc, et de l’antigène du t-PA (activateur du plasminogène tissulaire) et de l’antigène du PAI-1 (inhibiteur-1 de l’activateur du plasminogène) et de son activité [4]. Cet état d’hypercoagulabilité, observé chez les patients avec obésité abdominale, peut également être accompagné d’une dysfonction endothéliale [
13,
14]. En conséquence, les patients avec obésité abdominale montrant un syndrome métabolique sont caractérisés par un profil athérogène pro-thrombotique et inflammatoire, qui contribue probablement à augmenter de façon marquée leur risque de présenter un syndrome coronarien aigu [
15]. Sur le plan physiopathologique, il est important de garder à l’esprit que le tissu adipeux n’est pas seulement un organe passif de stockage et de mobilisation des TG. En effet, celui-ci doit plutôt être considéré comme un organe endocrinien capable de synthétiser et de sécréter de nombreuses molécules [1]. Ainsi, les concentrations circulantes de PAI-1, d’angiotensine II, de protéine C-réactive (CRP), de fibrinogène et de facteur-α de nécrose cellulaire (TNF-α) ont toutes été reliées à l’IMC ou à d’autres indices d’obésité [4]. Il a été estimé qu’in vivo, environ 30% de la concentration circulante totale d’interleukine-6 (IL-6) pouvait provenir du tissu adipeux [1, 4]. Ce résultat s’avère important puisque l’IL-6 module la production de CRP dans le foie et que ce marqueur pourrait refléter un état inflammatoire chronique prédisposant au syndrome coronarien aigu [
16,
18]. Par conséquent, le clinicien devra faire preuve de vigilance en présence d’un syndrome métabolique chez un patient présentant une obésité abdominale. Le syndrome métabolique peut être observée chez environ 10- 20% des sujets manifestant une tolérance normale au glucose, 50% des sujets manifestant une intolérance au glucose et 80% des patients affectés d’un diabète de type 2 [
19]. D’un point de vue épidémiologique, il a été récemment estimé que 20-25% de la population américaine adulte présentait les caractéristiques du syndrome métabolique [
20]. Chez un individu donné, la présence d’un syndrome métabolique pourrait avoir les mêmes conséquences que celle d’une hypercholestérolémie au niveau du risque de développer une maladie coronarienne [
21]. Sur le plan clinique, l’obésité abdominale associée au syndrome métabolique peut être évaluée facilement. Ainsi, chez des hommes d’origine caucasienne, une circonférence de la taille ≥ 90 cm combinée à des taux de TG > 2,0 mmol/l peut permettre de dépister jusqu’à 80% des sujets porteurs des éléments du syndrome de résistance à l’insuline et présentant donc un risque élevé de développer une cardiopathie ischémique [10,
22]. |
Dans les phases initiales de l’athérosclérose, on note l’apparition d’une dysfonction endothéliale et de lésions inflammatoires dans la paroi du vaisseau. L’athérosclérose débute chez l’enfant avec des dépôts de cholestérol dans les macrophages et dans les cellules musculaires lisses localisées dans l’intima des larges artères musculaires lisses comme en témoigne la formation de stries lipidiques [
23,
24]. À mesure que l’individu avance en âge, la plaque fibreuse se développe et progresse provoquant ainsi des lésions athérosclérotiques plus complexes et fragiles. La rupture de ces lésions conduit à une hémorragie, puis à la formation d’un thrombus qui, en bouchant l’artère coronaire atteinte, cause un syndrome coronarien aigu [18]. Chez l’adulte, l’obésité est souvent associée à la présence d’une athérosclérose précoce. En effet, l’examen post-mortem d’artères de jeunes adultes (15-34 ans) décédés accidentellement a démontré que l’étendue des stries lipidiques et des lésions plus complexes (plaque fibreuse, plaque avec calcification ou ulcération) dans la coronaire droite et dans l’aorte abdominale était associée à l’obésité et à l’épaisseur du panicule adipeux [
25,
27]. La prévalence de l’obésité, définie par l’épaisseur du panicule adipeux et par un IMC ≥ 30 kg/m2 dans l’étude Pathobiological determinants of atherosclerosis in youth (PDAY) était de 14,3% [
28]. L’obésité chez les jeunes hommes était associée à une augmentation des stries lipidiques et à des lésions plus complexes dans la coronaire droite. En outre, on notait la présence plus fréquente d’athérosclérose microscopique dans la coronaire descendante antérieure des individus obèses. Les sujets de race noire présentaient des lésions plus extensives que les sujets de race blanche et les hommes montraient également des lésions plus avancées que les femmes [28]. La prévalence d’athérosclérose totale (stries lipidiques et lésions surélevées) dans la coronaire droite passait d’environ 60 % dans le groupe d’âge le plus jeune (15- 19ans) à plus de 80 % chez l’homme et atteignait environ 70 % chez la femme dans le groupe d’âge 30-34 ans [28]. Par ailleurs, lorsque l’IMC et le panicule adipeux étaient simultanément considérés chez l’homme, un IMC ≥ 30 kg/m2 était associé à des lésions évoluées dans la coronaire droite, seulement lorsque le panicule adipeux était important (≥ 17 mm) renforçant la notion selon laquelle l’obésité abdominale est un facteur de risque pour l’athérosclérose prématurée [28] plus important que l’obésité totale. La prévalence des lésions était la plus élevée dans le segment initial (2-3 cm) de l’artère coronaire droite chez les hommes, et l’effet de l’adiposité sur des lésions surélevées était évident même avant l’âge de 25 ans [
29]. De plus, l’association entre l’adiposité et les lésions coronariennes demeurait significative même après ajustement en fonction d’autres facteurs de risque, comme le cholestérol HDL et non-HDL, l’HTA, le tabagisme et la glycohémoglobine, puisque ces facteurs de risque n’expliquaient que 15 % de l’effet sur l’athérosclérose [29]. Par ailleurs, des associations plus modestes étaient notées entre l’adiposité et l’athérosclérose coronarienne chez la jeune femme ; une faible corrélation entre l’IMC et la présence de stries lipidiques a été rapportée chez la femme affectée d’obésité abdominale [29]. Par contre, l’apparition de lésions surélevées dans les artères coronaires chez les femmes survenait en moyenne 10 ans plus tard que chez les hommes et ce, indépendamment des facteurs de risque [29]. Cette situation s’applique probablement également aux femmes ménopausées chez lesquelles l’athérosclérose clinique significative est plus tardive de 10 ans par rapport aux l’hommes. Concernant l’artère descendante antérieure proximale, l’obésité et l’HTA ont été associées à la présence de lésions évoluées et complexes incluant une composante nécrotique pouvant avoir des répercussions cliniques [28,
30]. Ces résultats renforcent l’hypothèse selon laquelle l’obésité chez les adolescents et les jeunes adultes accélère la progression de l’athérosclérose plusieurs décennies avant l’apparition des manifestations cliniques. Par conséquent, la surveillance de l’obésité chez les enfants est justifiée pour la prévention des MCV au même titre que la prévention d’autres pathologies associées à l’obésité. Même si la relation de cause à effet entre l’obésité et l’athérosclérose pourrait être tributaire des co-morbidités associées à l’obésité, l’HTA, l’intolérance au glucose et la dyslipidémie, les études des cohortes de Framingham [
31] et du Manitoba [
32] ont toutes deux rapporté que l’obésité prédisait de façon indépendante les MCV, particulièrement chez la femme [31]. Cette association semblait plus prononcée chez les individus âgés de moins de 50 ans, renforçant ainsi l’idée que l’obésité induit une athérosclérose précoce. Sur la base de ces résultats, l’American heart association a statué que l’obésité constituait un facteur de risque majeur modifiable, plutôt qu’un facteur de risque indépendant, pour le développement des MCV [2]. |
Thérapie de revascularisation et maladie coronarienne Le syndrome métabolique devrait donc être pris en charge de manière énergique après une revascularisation coronarienne. En effet, l’intolérance au glucose pourrait avoir une valeur pronostique importante en réponse à une angioplastie coronarienne [
33] ou à une chirurgie de pontage aorto-coronarienne, puisque les composantes du syndrome métabolique sont associées à la progression angiographique de l’athérosclérose dans les artères d’origine [
34]. Au Centre de cardiologie de l’Université Duke, une augmentation de la prévalence de l’obésité (de 20% en 1986 à 33% en 1997) a été observée chez les patients adressés au laboratoire de cathétérisme cardiaque [
35]. Bien que l’obésité s’installe à un âge plus jeune, en concurrence avec de nombreuses co-morbidités et surtout qu’elle accompagne une maladie significative touchant souvent seulement un vaisseau [35,
36], elle était associée à un nombre d’événements cliniques non désirables 30 jours après la procédure de cathétérisation cardiaque [35]. De plus, elle entraînait des coûts médicaux hospitaliers globaux élevés [35]. Une prévalence augmentée des facteurs de risques de morbidité et de mortalité chez les patients obèses semble donc contrecarrer le bénéfice de survie propre à un plus jeune âge et à une maladie coronarienne provenant d’autres causes. Par conséquent, la surveillance clinique à long terme de la maladie coronarienne chez les patients obèses sera plus importante [35]. Par ailleurs, le rapport de cause à effet de l’excès de poids sur la mortalité cardiovasculaire ne peut être noté dans des études prospectives de courte durée [15,
17, 29]. En revanche, il devient significatif dans des études de plus longue durée [31, 32]. Finalement, la mortalité cardiovasculaire évaluée chez 3606 individus lors d’un suivi médian de 6,9 ans est considérablement plus élevée chez les sujets montrant les caractéristiques du syndrome métabolique (12,0 versus 2,2%) [19]. D’ailleurs, on a récemment rapporté que l’obésité abdominale s’accompagne d’un risque accru de syndrome coronarien aigu chez les hommes [17]. |
L’obésité constitue un désordre métabolique chronique associé aux MCV conduisant à une augmentation de la morbidité et de la mortalité. Il est clair qu’à mesure que s’accumule l’excès d’énergie dans le tissu adipeux, il existe une variété d’adaptations/altérations des structures et des fonctions cardiaques et ce même en l’absence de co-morbidités. Une tendance très nette vers des habitudes de vie incorporant moins d’activités physiques singularise de nombreuses populations. Or cette situation est associée à la présence d’une obésité, ce qui conduit à une augmentation de l’incidence et de la prévalence du syndrome métabolique. Cette évolution délétère pourrait fortement contrecarrer la diminution de la morbidité et de la mortalité cardiovasculaires acquise au cours des deux dernières décennies [
37]. Cette «épidémie» d’obésité, du syndrome métabolique et du diabète de type 2 représente un défi majeur pour notre système de soins dans lequel les médecins sont beaucoup mieux entraînés à traiter qu’à prévenir les maladies cardiovasculaires en modifiant les habitudes de vie [
38]. Finalement, il importe de souligner que l’obésité peut affecter le développement de l’athérosclérose par l’intermédiaire d’altérations métaboliques encore insoupçonnées ou via certains facteurs de risque connus comme la dyslipidémie, l’HTA, l’intolérance au glucose, un profil inflammatoire ou un état pro-thrombotique. Plusieurs de ces anomalies font partie du syndrome métabolique. Bien que nous ne disposions pas de preuves prospectives directes pour attester que la perte de poids puisse augmenter la survie, les publications disponibles nous indiquent par exemple, qu’une perte de poids volontaire chez l’obèse « à risque » réduit de près de 60% l’incidence du diabète [
39,
40]. Puisque le diabète est considéré comme un équivalent de MCV, il est légitime de présumer qu’une perte de poids puisse améliorer la survie. En modifiant favorablement le profil lipidique, en abaissant la pression artérielle, la glycémie, les concentrations des cytokines (TNF-α, IL-6), des marqueurs inflammatoires et des molécules d’adhérence comme la P-sélectine, la molécule-1 d’adhésion intercellulaire (ICAM-1) et la molécule-1 d’adhésion vasculaire (VCAM-1), une perte de poids pourrait prévenir la progression de l’athérosclérose et stabiliser la plaque athéromateuse, réduisant ainsi le risque de syndrome coronarien aigu [4]. Cette hypothèse demeure toujours à valider par un essai clinique randomisé qui pourrait confirmer les effets bénéfiques d’une perte de poids maintenue pendant des années, sous la forme d’une diminution de la morbidité et de la mortalité associée par maladies cardiovasculaires. |
1. Poirier P, Eckel RH. The heart and obesity. In: Fuster V, Alexander RW, King S, O’Rourke RA, Roberts R, Wellens HJJ, eds. Hurst’s the heart, 10e ed. New York: McGraw-Hill Companies, 2000: 2289–303. 2. Eckel RH, Krauss RM. American Heart Association call to action: obesity as a major risk factor for coronary heart disease. AHA Nutrition Committee. Circulation 1998; 97: 2099–100. 3. Kumanyika S, Jeffery RW, Morabia A, Ritenbaugh C, Antipatis VJ. Obesity prevention: the case for action. Int J Obes Relat Metab Disord 2002; 26: 425–36. 4. Poirier P, Després JP. Waist circumference, visceral obesity, and cardiovascular risk. J Cardiopulm Rehabil 2003; 23: 161–9. 5. Després JP. Health consequences of visceral obesity. Ann Med 2001; 33: 534–41. 6. Executive summary of the third report of the national cholesterol education program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (adult treatment panel III). JAMA 2001; 285: 2486–97. 7. Larsson B, Svardsudd K, Welin L, Wilhelmsen L, Bjorntorp P, Tibblin G. Abdominal adipose tissue distribution, obesity, and risk of cardiovascular disease and death: 13 year follow up of participants in the study of men born in 1913. Br Med J 1984; 288: 1401–4 8. Folsom AR, Kaye SA, Sellers TA, et al. Body fat distribution and 5-year risk of death in older women. JAMA 1993; 269: 483–7. 9. Rexrode KM, Carey VJ, Hennekens CH, et al. Abdominal adiposity and coronary heart disease in women. JAMA 1998; 280: 1843–8. 10. Lemieux I, Pascot A, Couillard C, et al. Hypertriglyceridemic waist. A marker of the atherogenic metabolic triad (hyperinsulinemia, hyperapolipoprotein B, small, dense LDL) in men ? Circulation 2000; 102: 179–84. 11. Pascot A, Lemieux I, Prud’homme D, et al. Reduced HDL particle size as an additional feature of the atherogenic dyslipidemia of abdominal obesity. J Lipid Res 2001; 42: 2007–14. 12. Lemieux S, Després JP. Metabolic complications of visceral obesity: contribution to the aetiology of type 2 diabetes and implications for prevention and treatment. Diabetes Metab 1994; 20: 375–93. 13. Steinberg HO, Chaker H, Leaming R, Johnson A, Brechtel G, Baron AD. Obesity/insulin resistance is associated with endothelial dysfunction. Implications for the syndrome of insulin resistance. J Clin Invest 1996; 97: 2601–10. 14. Hashimoto M, Akishita M, Eto M, et al. The impairment of flowmediated vasodilatation in obese men with visceral fat accumulation. Int J Obes Relat Metab Disord 1998; 22: 477–84. 15. Grundy SM. Obesity, metabolic syndrome, and coronary atherosclerosis. Circulation 2002; 105: 2696–98. 16. Ridker PM. Novel risk factors and markers for coronary disease. Adv Intern Med 2000; 45: 391–418. 17. Lakka TA, Lakka HM, Salonen R, Kaplan GA, Salonen JT. Abdominal obesity is associated with accelerated progression of carotid atherosclerosis in men. Atherosclerosis 2001; 154: 497–504. 18. Bogaty P, Poirier P, Simard S, Boyer L, Solymoss S, Dagenais GR. Biological profiles in subjects with recurrent acute coronary events compared with subjects with longstanding stable angina. Circulation 2001; 103: 3062–8. 19. Isomaa B, Almgren P, Tuomi T, et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care 2001; 24: 683–9. 20. Ford ES, Giles WH, Dietz WH. Prevalence of the metabolic syndrome among US adults: findings from the third National Health and Nutrition Examination Survey. JAMA 2002; 287: 356–9. 21. Pyorala M, Miettinen H, Laakso M, Pyorala K. Hyperinsulinemia predicts coronary heart disease risk in healthy middle-aged men: the 22-year followup results of the Helsinki policemen study. Circulation 1998; 98: 398–404. 22. Després JP, Lamarche B, Mauriège P, et al. Hyperinsulinemia as an independent risk factor for ischemic heart disease. N Engl J Med 1996; 334: 952–7. 23. McGill HC. Fatty streaks in the coronary arteries and aorta. Lab Invest 1968; 18: 560–4. 24. Skalen K, Gustafsson M, Rydberg EK, et al. Subendothelial retention of atherogenic lipoproteins in early atherosclerosis. Nature 2002; 417: 750–4. 25. McGill HC Jr, McMahan CA, Herderick EE, Malcom GT, Tracy RE, Strong JP. Origin of atherosclerosis in childhood and adolescence. Am J Clin Nutr 2000; 72: 1307S–15S. 26. Enos WF, Holmes RH, Beyer J. Coronary disease among United States soldiers killed in action in Korea. JAMA 1953; 152: 1090–3. 27. McGill HC, McMahan CA, Malcom GT, Oalmann MC, Strong JP. Relation of glycohemoglobin and adiposity to atherosclerosis in youth. Pathobiological determinants of atherosclerosis in youth (PDAY) research group. Arterioscler Thromb Vasc Biol 1995; 15: 431–40. 28. Zieske AW, Malcom GT, Strong JP. Natural history and risk factors of atherosclerosis in children and youth: the PDAY study. Pediatr Pathol Mol Med 2002; 21: 213–7. 29. McGill HC Jr, McMahan CA, Herderick EE, et al. Obesity accelerates the progression of coronary atherosclerosis in young men. Circulation 2002; 105: 2712–18. 30. McGill HC, McMahan CA, Zieske et al. Association of coronary heart disease risk factors with microscopic qualities of coronary atherosclerosis in youth. Circulation 2000; 102: 374–9. 31. Hubert HB, Feinleib M, McNamara PM, Castelli WP. Obesity as an independent risk factor for cardiovascular disease: a 26-year follow-up of participants in the Framingham heart study. Circulation 1983; 67: 968–77. 32. Rabkin SW, Mathewson FA, Hsu PH. Relation of body weight to development of ischemic heart disease in a cohort of young North American men after a 26 year observation period: the Manitoba Study. Am J Cardiol 1977; 39: 452–8. 33. Otsuka Y, Miyazaki S, Okumura H, et al. Abnormal glucose tolerance, not small vessel diameter, is a determinant of long-term prognosis in patients treated with balloon coronary angioplasty. Eur Heart J 2000; 21: 1790–96. 34. Korpilahti K, Syvanne M, Engblom E, Hamalainen H, Puukka P, Ronnemaa T. Components of the insulin resistance syndrome are associated with progression of atherosclerosis in nongrafted arteries 5 years after coronary artery bypass surgery. Eur Heart J 1998; 19: 711–9. 35. Eisenstein EL, Shaw LK, Nelson CL, Anstrom KJ, Hakim Z, Mark DB. Obesity and long-term clinical and economic outcomes in coronary artery disease patients. Obes Res 2002; 10: 83–91. 36. Gruberg L, Weissman NJ, Waksman R, et al. The impact of obesity on the short-term and long-term outcomes after percutaneous coronary intervention: the obesity paradox ? J Am Coll Cardiol 2002; 39: 578–84. 37. Gu K, Cowie CC, Harris MI. Diabetes and decline in heart disease mortality in US adults. JAMA 1999; 281: 1291–7. 38. Poirier P, Després JP. Exercise in weight management of obesity. Cardiol Clin 2001; 19: 459–70. 39. Knowler WC, Barrett-Connor E, Fowler et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002; 346: 393–403. 40. Tuomilehto J, Lindstrom J, Eriksson JG, et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001; 344: 1343–50. |