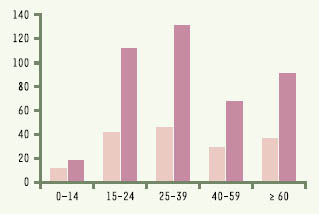| |
| Med Sci (Paris). 2003 November; 19(11): 1146–1151. Published online 2003 November 15. doi: 10.1051/medsci/200319111146.Quels sont les problèmes posés par la tuberculose en France en 2003 ? Elisabeth Bouvet* Service des maladies infectieuses et tropicales, Hôpital Bichat, 46, rue Henri Huchard, 75018 Paris, France |
Pour comprendre les problèmes liés à l’évolution épidémiologique de la tuberculose en France, il est bon de rappeler l’histoire naturelle de la maladie. La tuberculose est en effet une infection très particulière dans la mesure où la plupart des personnes infectées par le bacille ne développent pas la maladie (90%). Celles qui la développent peuvent le faire très rapidement après l’infection (dans les 2 ans) ou bien très longtemps après (plusieurs dizaines d’années). La survenue d’une maladie tuberculeuse qui témoigne obligatoirement d’une infection préalable peut donc être secondaire à une infection ancienne ou récente. Le contact contaminant avec un patient atteint de tuberculose pulmonaire contagieuse, seul mode actuel d’acquisition du bacille, représente, en cas de contamination récente, un événement sentinelle témoin d’un cas de tuberculose active qui aurait dû ou devrait être soumis à investigation [
1,
2]. Dans la plupart des cas, il n’est pas possible de distinguer les tuberculoses secondaires à une infection récente, des réactivations. Cependant, les méthodes génotypiques disponibles depuis peu peuvent dans certains cas aider à distinguer les réactivations des cas de transmission récente [
3]. En effet, la comparaison du profil génotypique des souches de Mycobacterium tuberculosis par spoligotyping
1 (spacer oligotyping) et RFLP (restriction fragment length polymorphism) donne la possibilité de reconnaître des clusters de cas lorsque les souches apparaissent identiques, ce qui témoigne d’une transmission récente. À l’inverse, lorsque les profils apparaissent uniques parmi les souches en cause dans une région et sur une période de temps suffisamment longue, on considère qu’il s’agit de réactivation [
4]. La lutte contre la tuberculose est fondée sur le dépistage des cas, la prise en charge et le traitement rapide des malades, en particulier des malades contagieux, et par la vaccination par le BCG. Celle-ci a pour but principal de protéger les jeunes enfants des formes graves de la tuberculose précoce que sont en particulier les méningites tuberculeuses et les miliaires [
5]. L’efficacité du BCG est discutée et beaucoup de pays développés ayant une incidence faible de tuberculose ne pratiquent pas une politique de vaccination généralisée des enfants. Il est admis généralement que même pour une efficacité significative, le BCG a surtout un effet protecteur direct, prévenant surtout les formes extrapulmonaires non contagieuses. Son impact sur le nombre de nouveaux cas de tuberculose est très limité. Le maintien d’une vaccination généralisée des enfants par le BCG en France est actuellement discuté. Pour amorcer la modification de la politique vaccinale, la revaccination va être supprimée dès 2003, ainsi que les tests tuberculiniques post-vaccinaux, ce qui devrait permettre de dégager des moyens pour renforcer les autres actions de la lutte. |
Histoire naturelle de la tuberculose et évolution après la primo-infection Transmission et pathogénie de l’infection
M.tuberculosis est véhiculé par les gouttelettes émises dans l’environnement aérien des patients atteints de tuberculose pulmonaire ou laryngée, lors de la toux, de l’éternuement, de la parole, du chant. Ces particules, dont la taille est comprise entre 1 à 5 micromètres sont très légères et peuvent rester en suspension dans l’air et diffuser dans un bâtiment ou une pièce. L’infection secondaire survient lorsqu’une personne réceptive inhale une ou plusieurs gouttelettes véhiculant Mycobacterium tuberculosis et que le bacille pénètre dans l’alvéole pulmonaire. Deux à dix semaines après l’infection initiale, la réponse immunitaire permet habituellement de limiter la multiplication et la diffusion du bacille. Pour une petite proportion de patients nouvellement infectés (en général moins de 1%), l’infection initiale progresse rapidement vers une tuberculose maladie. Cependant, pour 5 à 10% des individus infectés, l’affection peut se développer dans un délai de plusieurs mois, années, ou décennies lorsque la bactérie recommence à se répliquer pour produire une maladie. Le risque de progression vers une tuberculose active est plus important en cas d’immunodépression cellulaire, en particulier chez les patients infectés par le VIH (estimé à 5 à 10% par an en l’absence de traitement efficace de l’infection par le VIH). Ce risque apparaît pour des chiffres de lymphocytes CD4 proches de 350/mm3 et s’accroît lorsque ceux-ci baissent. Le risque d’infection et surtout d’évolution vers la tuberculose maladie est important chez les patients dont le nombre de CD4 est inférieur à 200/mm3. La probabilité qu’une personne soit infectée dépend de la concentration des gouttelettes contaminées dans l’air, de la proximité du contact avec le cas, de la durée du contact et des facteurs de protection de la personne exposée, en particulier de son immunité cellulaire [ 2]. Il est classique de considérer que les cas de tuberculose contagieuse correspondent aux cas de tuberculose pulmonaire bacillifère, c’est-à-dire dans lequels l’examen direct de l’expectoration révèle la présence des bacilles [1,
6]. En effet, la positivité à l’examen direct témoigne d’un inoculum important, supérieur à 10000 bactéries par ml de crachats. Le diagnostic de l’infection se fait uniquement sur la positivation du test cutané tuberculinique, seul témoin du contact avec le bacille de la tuberculose, qui par ailleurs est cliniquement muet sauf si l’infection évolue vers une tuberculose maladie active. Il est donc plus facile dans une population de surveiller les cas de tuberculose maladie que l’infection tuberculeuse. Cependant, l’évolution du nombre de cas de tuberculose maladie reflète très imparfaitement l’évolution de la transmission du bacille de la tuberculose dans la population, car elle dépend tout autant des réactivations d’infections tuberculeuses anciennes, elles-même favorisées par le vieillissement et l’immunodépression, que des infections récentes. Évolution de l’incidence de la tuberculose maladie En France, la tuberculose figure parmi les maladies à déclaration obligatoire (DO) depuis 1964. La surveillance au niveau national permet de suivre les tendances de la maladie et l’évolution des groupes à risque [
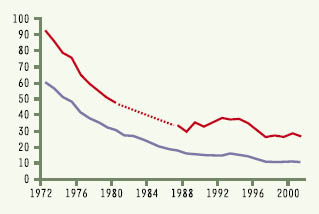
7]. Depuis cette date, l’incidence de la tuberculose a régulièrement décru d’environ 7% par an jusqu’en 1992. En 1993, le nombre de cas déclarés a augmenté de près de 10%, puis a décru à nouveau jusqu’en 1997. Entre 1997 et 1999, l’incidence a seulement décru de 4% et depuis 1999, l’incidence est stable, estimée à 11,1 pour 100000 habitants par an (Figure 1 et Tableau I). Plusieurs paramètres influencent le nombre de cas déclarés, en particulier l’exhaustivité de la déclaration qui est dépendante des médecins qui font le diagnostic et de leur sensibilisation à l’importance de la déclaration dans la prise en charge de la maladie. Il est pratiquement certain que l’augmentation du nombre de cas déclarés entre 1991 et 1994 a reflété une meilleure déclaration des cas de tuberculose par les médecins praticiens sensibilisés par le risque d’impact de l’épidémie de Sida sur la transmission et la réactivation de la tuberculose, comme cela avait été observé aux États- Unis. En comparant les données obtenues par la DO et les cultures positives fournies par le centre national de référence, on peut estimer que l’exhaustivité de la DO en France en 1997 est comprise entre 65 et 70%. On peut donc estimer qu’environ 11 000 cas de tuberculose surviennent par an en France.  | Figure 1.
Incidence de la tuberculose en France métropolitaine et en Ile-de-France (1972-2001). En abscisse figurent les années, en ordonnée les valeurs de l’incidence de la tuberculose (pour 100 000 habitants). La courbe représentant l’évolution de l’incidence de la tuberculose en Ile-de-France est en trait rouge (la portion de courbe en pointillés correspond à une période où les données n’ont pas été collectées), celle représentant l’évolution de l’incidence en France est en bleu. On observe ainsi une diminution régulière de l’incidence de la tuberculose jusqu’en 1997 puis une stagnation. |
 | Tableau I.
Caractéristiques de la tuberculose en Ile-de-France et au niveau national en 1997 et 2000.
|
Les principaux groupes à risque sont les personnes âgées de plus de 75 ans, qui ont un taux d’incidence de 28,3 pour 100000, les personnes infectées par le VIH, les hommes jeunes et surtout les migrants chez lesquels l’incidence est globalement de l’ordre de 53 pour 100000 en 2000. Les migrants de 25 à 39 ans sont les plus touchés avec un taux d’incidence de 78 cas pour 100000 en 2000. Les migrants en provenance d’Afrique subsaharienne représentent une part de plus en plus importante de ces cas. Par département, les taux d’incidence les plus élevés chez les migrants sont observés dans la région Ile-de-France, avec un taux de 117 pour 100 000 à Paris, 87 en Seine-Saint-Denis, 57 dans le Val-de-Marne et 55 dans le Val-d’Oise (Figure 2). Ces données corroborent l’observation selon laquelle l’incidence est très hétérogène selon les départements et les régions. En effet, cette stabilité actuelle de l’incidence au niveau national masque deux tendances évolutives très différentes : décroissance de l’incidence de la tuberculose dans tout le pays hormis l’Ile-de-France avec un taux d’incidence faible (inférieur à 10 pour 100000), et un taux élevé et croissant en Ile-de-France, en particulier à Paris.  | Figure 2.
Incidence de la tuberculose chez les étrangers selon l’âge, en Ile-de-France, et en France hors Ile-de-France, 2001. En abscisse figurent les tranches d’âge (en années), en ordonnée les valeurs de l’incidence de la tuberculose (pour 100 000 habitants). Rectangles roses: sujets de nationalité étrangère, France (hors Ile-de-France); rectangles violets : sujets de nationalité étrangère, Ile-de-France. On constate que la population étrangère atteinte de tuberculose est plus jeune que la population française tuberculeuse, en particulier en Ile-de-France. |
L’augmentation d’incidence à Paris et dans les départements de la couronne est en grande partie expliquée par la très forte incidence de la tuberculose chez les migrants originaires d’Afrique. Les données dont on dispose ne permettent pas de connaître avec précision la part des réactivations et des cas d’acquisition récente dans cette épidémie. La date d’arrivée en France des patients étrangers n’est pas mentionnée dans la DO. La situation actuelle est donc le fait de deux composantes bien distinctes:
-
une faible incidence de la tuberculose dans la population générale autochtone, avec une tendance continue à la baisse. Les personnes les plus à risque sont les personnes âgées de plus de 75 ans qui ont été infectées dans leur enfance ou leur adolescence et les personnes en situation de précarité, vivant en foyer;
-
une incidence élevée et qui continue de progresser chez les étrangers originaires d’Afrique vivant en Ilede- France et particulièrement à Paris, avec un impact relativement faible d’une co-infection par le VIH. Un phénomène similaire est observé dans de nombreuses grandes métropoles telles que Londres, New York, Amsterdam. Il reflète la situation de la tuberculose dans les pays en développement dont sont originaires les migrants [
8].
|
Évolution des résistances et des multirésistances Avant la mise à disposition de médicaments efficaces, 50% des patients atteints de tuberculose active mouraient en moins de 2 ans. La durée actuelle du traitement reste longue, au minimum 6 mois. Le schéma thérapeutique comporte toujours une association de plusieurs molécules, souvent difficiles à tolérer, et dont la toxicité, notamment hépatique, est élevée. La plupart des échecs sont liés soit à la mauvaise observance du traitement, soit aux résistances. Les médicaments antituberculeux sont peu nombreux et déjà anciens, ce qui limite les possibilités de choix, en particulier en cas de résistance ou de multirésistance et en cas de toxicité sévère engendrée par les médicaments dits de première ligne. Les stratégies thérapeutiques utilisables ont été définies par l’OMS (Organisation mondiale de la santé), les CDC (Centers for disease control and prevention) et les autorités sanitaires des pays. La mise en application de ces recommandations est le point crucial de la maîtrise de la tuberculose. En effet, l’efficience de la stratégie de traitement de la tuberculose intervient pour beaucoup dans le contrôle de la transmission de la tuberculose dans la population. Le contrôle de la tuberculose se heurte au problème de la résistance aux antituberculeux. Le traitement des malades présentant une multirésistance définie comme une résistance à l’isoniazide et à la rifampicine, avec ou sans résistance aux autres antituberculeux, est particulièrement difficile [
9]. Les patients atteints de tuberculose multirésistante peuvent rester contagieux pendant une période prolongée et être responsables d’épidémies, en particulier chez les personnes infectées par le VIH. La résistance aux antituberculeux provient de la sélection de bacilles mutants résistants lors d’un traitement inadapté. Il s’agit alors d’une résistance secondaire. Lorsque ce bacille résistant est transmis à un autre patient, on parle de résistance primaire. Au cours des dernières années, plusieurs épidémies de tuberculose multirésistante ont été rapportées en Europe et aux États-Unis [
10]. Elles concernaient le plus souvent des patients infectés par le VIH, avant l’ère des traitements antirétroviraux efficaces. Depuis 1997, il n’y a pas eu de description d’épidémie de tuberculose multirésistante en Europe et aux États-Unis. En France, quelques cas groupés de tuberculose multirésistante ont été observés dans les années 1990, sans que l’on puisse parler de véritable épidémie. L’évolution de la résistance en France est assez stable depuis plusieurs dizaines d’années. En effet, le taux de multirésistance est de l’ordre de 0,5% et n’a pas évolué depuis 10ans [
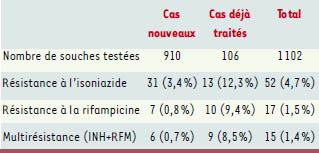
11]. Les taux de résistance vis à vis de chaque antituberculeux sont relativement faibles et stables, en comparaison avec les taux observés dans d’autres pays (Tableau II) [9]. La surveillance de la résistance aux antituberculeux est un moyen parmi d’autres d’évaluer l’efficacité des efforts de contrôle de la tuberculose dans une communauté. La prévalence de la résistance reflète la qualité du contrôle de la tuberculose maladie dans une communauté. L’échec thérapeutique, l’interruption de traitement et le taux de rechutes vont de pair avec une prévalence élevée de la résistance. La résistance aux antituberculeux est inversement associée aux bonnes pratiques thérapeutiques, à savoir un traitement court surveillé directement. Les données françaises sur la résistance aux antituberculeux sont assez rassurantes car les taux sont assez bas et stables, ce qui témoigne d’une bonne prise en charge thérapeutique des cas de tuberculose maladie. Le système de soins avec l’accès à l’hospitalisation de tout patient et la gratuité pour les démunis, la prise en charge à 100% par la sécurité sociale de la tuberculose maladie, la délivrance gratuite par les hôpitaux des antituberculeux pour les patients démunis, la possibilité d’une hospitalisation en structure de moyen séjour pour une période importante de la durée du traitement facilitent le bon déroulement du traitement lorsque le diagnostic est porté. La mise à disposition de formes associées comportant 2, 3 ou 4 antituberculeux dans le même comprimé facilite l’observance et surtout évite les monothérapies, particulièrement dangereuses pour ce qui concerne l’apparition des résistances. Néanmoins, la DOT (directly observed therapy) recommandée par l’OMS dans le traitement de la tuberculose n’est pas réellement appliquée en France.  | Tableau II.
Taux de résistance chez les cas traités et non traités (résistance primaire et secondaire) en France en 1999 (réseau de 20 hôpitaux universitaires dans 12 régions. Centre national de référence pour la surveillance des infections à mycobactéries et de leur résistance aux antituberculeux).INH : isoniazide; RFM: rifampicine. |
Tuberculose et VIH Au cours de l’infection par le VIH, la tuberculose est particulièrement fréquente, essentiellement par augmentation du risque de progression de l’infection tuberculeuse vers la tuberculose maladie. Ce risque de progression, qui est de 10 % sur la vie entière chez les patients non infectés par le VIH, est de 10% par an chez les personnes infectées par le VIH et non traitées. Les réponses immunitaires cellulaires incluant les réponses CD4 et CD8 qui sont perturbées dans l’infection VIH sont des éléments importants de la défense de l’organisme contre Mycobacterium tuberculosis [
12]. En facilitant la production d’interféron gamma et la prolifération des cellules mononucléées sanguines, le traitement antirétroviral restaure une réponse normale vis-à-vis de M.tuberculosis. Le risque immédiat de maladie primaire progressive après infection récente à M. tuberculosis approche les 40%. Cette interaction entre VIH et tuberculose rend compte en grande partie de la résurgence de la tuberculose dans le monde. En Afrique, 32% des cas de tuberculose maladie surviennent chez des patients infectés par le VIH [
13]. L’augmentation du taux de décès par tuberculose chez les patients infectés par le VIH est probablement attribuable en grande partie à d’autres infections opportunistes concomitantes déclenchées par la tuberculose. Le taux global de décès en Afrique par tuberculose dépasserait 50%. En Europe et aux États-Unis, le taux de décès par tuberculose est de l’ordre de 10%, et ne diffère pas au cours de l’infection par le VIH. L’introduction des traitements associés puissants a modifié l’interaction entre la tuberculose et l’infection par le VIH. En Afrique du Sud, il a été montré que le traitement antirétroviral de type HAART ( highly active anti-retroviral therapy) réduisait de 80% l’incidence de la tuberculose liée au VIH, en particulier chez les patients symptomatiques et fortement immunodéprimés [
14]. L’entrée dans le Sida par la tuberculose est de plus en plus fréquente en France [
15]. En 2001, 22,7% des cas de Sida étaient révélés par une tuberculose. Dans la majorité de ces cas, les patients étaient originaires d’Afrique subsaharienne. Néanmoins, la part du VIH parmi les cas de tuberculose diminue en France depuis plusieurs années. Globalement, la proportion de sujets infectés par le VIH parmi les cas de tuberculose est de 4,8% en 2000 et de 12,4% parmi les cas documentés [ 7]. Comment mieux maîtriser l’épidémiologie de la tuberculose en région parisienne ? Ce qui est observé à Paris n’est que le reflet de l’épidémie de tuberculose dans les pays pauvres du sud, en particulier l’Afrique. Vouloir faire diminuer l’incidence de la tuberculose en France et à Paris signifie avant tout intervenir dans les pays du sud pour lutter contre la tuberculose. Schématiquement, deux types d’intervention sont possibles pour diminuer la transmission de la tuberculose:
-
traiter et guérir les cas de tuberculose maladie afin de supprimer les réservoirs de bactéries en intervenant le plus rapidement possible et assurer un traitement complet et une bonne observance;
-
diminuer le risque de réactivation chez les personnes infectées par le dépistage et le traitement de l’infection, et en intervenant sur les facteurs qui influencent le risque de progression, tel que le traitement de l’infection par le VIH, par exemple.
En France, le volet «traitement des malades» est bien organisé et efficace, comme en témoigne le faible taux de résistance. La rapidité du diagnostic et de la mise en route du traitement sont cependant probablement à améliorer. Il n’est pas possible de savoir, à l’heure actuelle, la part des infections récentes et la part des réactivations dans les cas de tuberculose maladie observés chez les adultes et en particulier chez les migrants en Ile-de-France. Un travail récent effectué sur les cas de tuberculose survenus à New York sur une période de 10 ans, entre 1990 et 1999, montre que la majorité des souches de Mycobacterium tuberculosis isolées chez des patients nés à l’étranger sont uniques sur le plan génotypique, suggérant qu’elles sont associées à des réactivations [4]. Globalement, 48% des souches appartiennent à un cluster et 52% paraissent uniques. Cependant, le pourcentage de souches appartenant à un cluster diminue avec le temps. Il était de 63% en 1992. Il est de 31,4% en 1999. La plupart des cas récents de tuberculose maladie à New York sont donc liés à des réactivations. Les autorités sanitaires en déduisent qu’il faut mettre en oeuvre une politique de dépistage et de traitement des infections latentes. Nous manquons de données équivalentes en Ile-de-France pour évaluer ce point. Il est cependant flagrant que la prise en charge des infections latentes est négligée. Le nombre de cas de tuberculose chez les migrants pourrait être limité par des interventions en amont comportant le dépistage de l’infection latente par les tests tuberculiniques, le traitement de ces infections latentes et l’investigation autour des cas de tuberculose maladie avec recherche de tuberculose active et d’infections tuberculeuses à traiter. En effet, le traitement de l’infection tuberculeuse est efficace. Plusieurs schémas thérapeutiques sont utilisables. L’isoniazide pendant 9 mois est le schéma actuellement recommandé par le CDC et l’OMS [
16]. La réduction d’incidence de la tuberculose sur une période de 10 ans est proche de 70% chez les sujets exposés qui ont pris plus de 80% de leur traitement. Un schéma court de 2 mois associant rifampicine et pyrazinamide a été validé chez les sujets VIH positifs [
17] et peut être aussi proposé chez les sujets infectés par le VIH, mais comporte une toxicité hépatique non négligeable. L’investigation autour d’un cas de tuberculose et la recherche des infections ainsi que leur prise en charge thérapeutique devraient être revalorisées et renforcées [
18]. Une surveillance plus détaillée des cas de tuberculose active devrait aider à mieux cerner l’épidémiologie actuelle de la tuberculose et de sa transmission en Ile-de-France. Une stratégie de lutte contre la tuberculose doit être définie au niveau régional, mise en oeuvre et évaluée sur les données de la surveillance des cas, la prévalence de l’infection, l’analyse génotypique des souches isolées, les données de suivi et d’observance des patients traités, les données de résistance des souches. La réorientation des moyens départementaux qui étaient dévolus à la vaccination BCG et surtout aux contrôles tuberculiniques vers une politique active de dépistage autour d’un cas et de dépistage et traitement des infections devrait être rapidement envisagée au niveau des départements les plus concernés, essentiellement en Ile-de-France. |
Footnotes |
1. Schwoebel V, Hubert B, Desenclos JC. Investigations à conduire autour d’un cas de tuberculose ou de primo-infection tuberculeuse récente. BEH 1994; 9: 39–42. 2. Styblo K. Recent advances in epidemiological research in tuberculosis. Adv Tuberc Res 1980; 20: 1–63. 3. Van Soolingen D. Molecular epidemiology of tuberculosis and other mycobacterial infections: main methodologies and achievements. J Intern Med 2001; 249: 1–26. 4. Geng E, Kreiswirth B, Driver C, et al. Changes in the transmission of tuberculosis in New York City from 1990 to 1999. N Engl J Med 2002; 346: 1453–8. 5. INVS (Institut de veille sanitaire). Impact épidémiologique d’une modification de la politique de vaccination par le BCG en France. Revue de la littérature et analyse des données disponibles. Saint-Maurice: INVS, 2001. 6. Behr MA, Warren SA, Salamon H, et al. Transmission of Mycobactrium tuberculosis from patients smearnegative for acid-fast bacilli. Lancet 1999; 353: 444–9. 7. Decludt B, Campese C. Les cas de tuberculose déclarés en France en 2000. BEH 2002; 16-17: 68–70. 8. Infuso A, Antoine D, Barboza P, Euro TB. Surveillance européenne de la tuberculose en 1999 et tendances récentes. BEH 2002; 16-17: 66–7. 9. WHO (World health organization). Antituberculosis drug resistance in the world. Report n°2. Prevalence and trends. Genève: WHO, 2000. 10. CDC (Centers for disease control and prevention). Epidemiologic notes and reports. Nosocomial transmission of multidrugresistant tuberculosis among HIV-infected persons, Florida and New York, 1988-1991. MMWR Morb Mortal Wkly Rep 1991; 40: 585–91. 11. Robert J, Trystram D, Truffot-Pernot C, Jarlier V. Surveillance de la tuberculose à bacilles multirésistants en France en 1998. BEH 2002; 16-17: 73–6. 12. Schluger NW, Rom WN. The host immune response to tuberculosis. Am J Respir Crit Care Med 1998; 157: 679–91. 13. Dye C, Scheele S, Dolin P, Pathania V, Raviglione MC. Consensus statement. global burden of tuberculosis: estimated incidence, prevalence, and mortality by country. WHO global surveillance and monitoring project. JAMA 1999; 282: 677–86. 14. Badri M, Wilson D,Wood R. Effect of highly active antiretroviral therapy on incidence of tuberculosis in South Africa: a cohort study. Lancet 2002; 359: 2059–64. 15. INVS (Institut de veille sanitaire). Surveillance du SIDA en France. Situation au 31 mars 2002. BEH 2002; 27: 133–8. 16. CDC (Centers for disease control and prevention). Targeted tuberculin testing and treatment of latent tuberculosis infection. MMWR Recomm Rep 2000; 49: RR–6. 17. Gordin FM, Chaisson RE, Matts JP, et al. An international randomized trial of rifampin and pyrazinamide versus isoniazid for prevention of tuberculosis in HIVinfected persons. JAMA 2000; 283: 1445–50. 18. Bailey WC, Gerald LB, Kimerling ME, et al. Predictive model to identify positive tuberculosis skin test results during contact investigations. JAMA 2002; 287: 996–1002. |