Par ses actions concertées sur les vaisseaux, le rein et le cœur pour contrôler la pression artérielle, le système rénine-angiotensine est l’un des systèmes régulateurs les plus importants de l’organisme. Il est constitué de deux enzymes qui agissent successivement: (1) la rénine, qui, à partir de l’angiotensinogène d’origine hépatique, produit un décapeptide pratiquement inactif, l’angiotensine I ; (2) l’enzyme de conversion de l’angiotensine (ACE), qui clive les deux résidus carboxy-terminaux de l’angiotensine I pour produire l’angiotensine II, octapeptide effecteur du système essentiellement par ses effets vasoconstricteurs et stimulateurs de la production d’aldostérone par la surrénale. Outre ses effets physiologiques, l’angiotensine II est associée à de nombreux processus pathologiques comme l’hyperplasie des cellules musculaires lisses, l’hypertrophie des myocytes cardiaques, la fibrose, le stress oxydatif et l’apoptose de nombreux types de cellules du système cardiovasculaire.
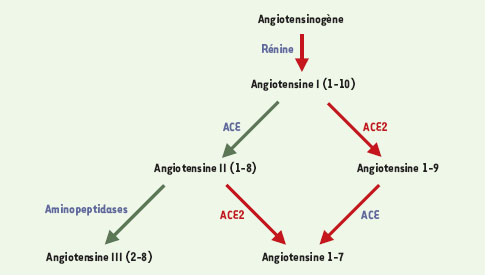
La caractérisation de cette enzyme a donné naissance, au cours des années 1980, à une classe thérapeutique majeure, celle des inhibiteurs de l’enzyme de conversion, qui a démontré sa grande efficacité dans des maladies aussi diverses que l’hypertension artérielle, l’insuffisance cardiaque ou la néphropathie diabétique. Le developement, au cours des années 1990, de molécules antagonistes des récepteurs de l’angiotensine II, qui constituent la famille des « sartans », a constitué un raffinement thérapeutique supplémentaire. On pensait donc tout savoir de ce système jusqu’à la publication, en l’an 2000, de deux articles qui ont révélé l’existence d’une seconde enzyme de conversion de l’angiotensine, appelée ACE2, dont l’expression est restreinte aux reins, au coeur et aux testicules et dont le rôle est encore mystérieux [ 1, 2]. Comme ACE, ACE2 est une carboxypeptidase, mais elle n’élimine qu’un acide aminé de l’angiotensine I, donnant naissance à l’angiotensine 1-9, d’effet inconnu, qui ne peut être convertie en angiotensine II par ACE2 mais peut être convertie par ACE en angiotensine 1-7, vasodilatatrice (Figure 1). ACE2 peut également produire l’angiotensine 1-7 en utilisant l’angiotensine II comme substrat.
Le rôle physiologique d’ACE2 était inconnu jusqu’à la publication de l’article de Crackower et al. [ 3] qui, comme souvent, apporte autant d’excitantes informations qu’il suscite de nouvelles questions. En révélant un nouvel échelon de régulation du système rénine-angiotensine, il en complique en fait sensiblement la physiologie.
Il est intéressant de suivre pas à pas la démarche de Crackower et al. dans le décryptage, encore partiel, de la fonction d’ACE2. Ils ont d’abord montré que le gène ace2 est localisé sur le chromosome X au niveau d’un locus de trait quantitatif (LTQ) associé, chez le rat, à des syndromes d’hypertension spontanée (rats SHR et rats SHR-SP) ou provoquée par un régime riche en sel (rats Sabra sensibles au sel). Le rein étant un organe important pour la régulation de la pression artérielle, ils ont étudié diverses souches de rats hypertendus et ont observé que le niveau d’expression d’ACE2 est diminué dans le rein des rats SHR et des rats Sabra soumis à un régime normosodé ou hypersodé.
L’inactivation d’ace conduisant à des souris hypotendues, Crackower et al. ont invalidé le gène ace2 chez la souris, pensant probablement obtenir des souris hypertendues. Mais les souris obtenues sont normotendues, au moins jusqu’à l’âge de 6 mois. Cela n’est pas dû à une compensation fonctionnelle par ACE puisque l’inhibition spécifique d’ACE par le captopril diminue la pression artérielle de façon identique chez les souris mutantes et sauvages. En revanche, l’invalidation du gène ace2 entraîne des anomalies cardiaques, contrairement à l’inactivation des gènes codant pour ACE ou pour l’angiotensinogène. Le ventricule gauche des souris dont le gène ace2 a été invalidé est dilaté, ses parois sont amincies et il ne présente aucune des caractéristiques phénotypiques et fonctionnelles des animaux hypertendus (hypertrophie concentrique, fibrose interstitielle, apoptose, réexpression du phénotype fœtal). Surtout, ses performances contractiles sont très diminuées spécifiquement à partir de l’âge de 6 mois, événement corrélé à une baisse de la pression artérielle qui serait donc secondaire à l’altération des performances contractiles cardiaques.
Pour progresser dans l’élucidation des mécanismes conduisant à cette curieuse cardiopathie, les auteurs rapprochent de façon sans doute un peu hardie ses caractéristiques de celles des coeurs dits sidérés ou hibernants, sièges d’un mécanisme adaptatif développé en réponse à une privation d’oxygène. Selon leur hypothèse, l’absence d’ACE2, normalement exprimée au niveau des cellules endothéliales, devrait entraîner une hypoxie des myocytes cardiaques et, par voie de conséquence, une expression accrue des gènes sensibles à l’hypoxie. C’est effectivement ce qu’ils observent : l’expression cardiaque de BNIP3 et de PAI- 1 (plasminogen activator inhibitor-I) est augmentée chez les souris mutantes par rapport aux souris témoins.
Quelle peut être la fonction d’ACE2 in vivo ? Les auteurs proposent qu’ACE2 pourrait jouer un rôle régulateur dans le système rénine-angiotensine par compétition avec ACE vis-à-vis de leurs substrats communs, les angiotensines I et II. En accord avec cette hypothèse, l’inactivation du gène ace2 provoque une augmentation modérée d’angiotensine I et II, sans augmentation d’expression d’ACE, confirmant que l’augmentation d’angiotensine II est bien liée à la perte de compétition entre ACE et ACE2 pour l’angiotensine I et non à une surproduction d’ACE. Dans ce contexte de compétition de deux enzymes vis-à-vis d’un même substrat, la tentation était grande de réaliser la double inactivation ace/ace2. Les souris doubles mutantes sont parfaitement viables et ont un phénotype et des performances contractiles cardiaques comparables à ceux des souris inactivées seulement pour ace. Par conséquent, l’inactivation du gène ace normalise le phénotype cardiaque des souris invalidées pour ace2, ce qui démontre un rôle pathogène direct d’ACE dans la cardiopathie des souris dépourvues d’ACE2.
Ce très important travail pose un certain nombre de questions. Quels sont exactement les rôles physiologiques et éventuellement pathologiques de l’ACE2 ? Quel est le mécanisme physiopathologique conduisant à la cardiopathie observée chez les souris invalidées pour ace2 ? Cette enzyme est-elle susceptible d’ouvrir des perspectives thérapeutiques aussi prometteuses que celles ouvertes en son temps par ACE, notamment dans le domaine des pathologies cardiaques et rénales ? Pour plusieurs souches de rats, des mutations de ce gène sont associées à une hypertension artérielle et à une expression réduite d’ACE2 dans le rein. Mais la délétion du gène n’a pas d’effet sur la pression artérielle des souris, même quand ACE1 est inhibée, suggérant un rôle plutôt tissulaire que systémique de l’enzyme. Il est cependant possible qu’ACE2 ne contribue que pour une faible part au niveau de la pression artérielle des souris et que le fond génétique des souris utilisées n’ait pas permis d’extérioriser cette fonction d’ACE2. À cet égard, il est surprenant que l’augmentation de la concentration plasmatique d’angiotensine II n’ait pas entraîné d’hypertension artérielle chez les souris invalidées pour ace2, d’autant plus que la disparition d’ACE2 les prive d’angiotensine 1-7, peptide vasodilatateur. Peut-être est-ce lié à la faible augmentation de la concentration plasmatique d’angiotensine II ou bien, là encore, à une question de fond génétique ou d’effet tissulaire prédominant ? Un élément de réponse pourrait venir de l’examen du coeur des différentes souches de souris. Bien qu’ACE et l’angiotensine II jouent un rôle essentiel dans le développement de l’hypertrophie cardiaque des animaux hypertendus, les souris dont le gène ace a été invalidé ont un phénotype cardiaque normal. Il est donc surprenant d’observer cette cardiopathie dilatée sans hypertrophie compensatrice dans un contexte de production accrue d’angiotensine II au niveau plasmatique, rénal mais aussi cardiaque.
Malgré ces incohérences, les auteurs semblent convaincus du rôle causal de l’angiotensine II dans la cardiopathie. L’expression tissulaire d’ACE2 pourrait expliquer cette apparente contradiction. En effet, ACE2 est exprimée dans les cellules endothéliales de la circulation coronaire mais pas dans les myocytes cardiaques. La production accrue d’angiotensine II dans le seul compartiment vasculaire pourrait conduire à une vasoconstriction avec hypoperfusion, hypoxie et augmentation du stress oxydatif des myocytes qui, par ailleurs, ne seraient pas directement soumis aux effets hypertrophiques de l’angiotensine II. L’interprétation se complique quand la cardiopathie dilatée se développe car ce processus, en étirant les myocytes, stimule normalement la production d’angiotensine II par le myocyte cardiaque, production qui devrait normalement entraîner, de façon autocrine, une hypertrophie de ces cellules. Puisque tel ne semble pas être le cas, les souris devraient logiquement évoluer avec le temps vers l’insuffisance cardiaque congestive, conséquence d’une augmentation des contraintes ventriculaires sans possibilité d’hypertrophie compensatrice. Mais cela est une autre histoire… qui ne devrait pas tarder à paraître dans un prochain article.