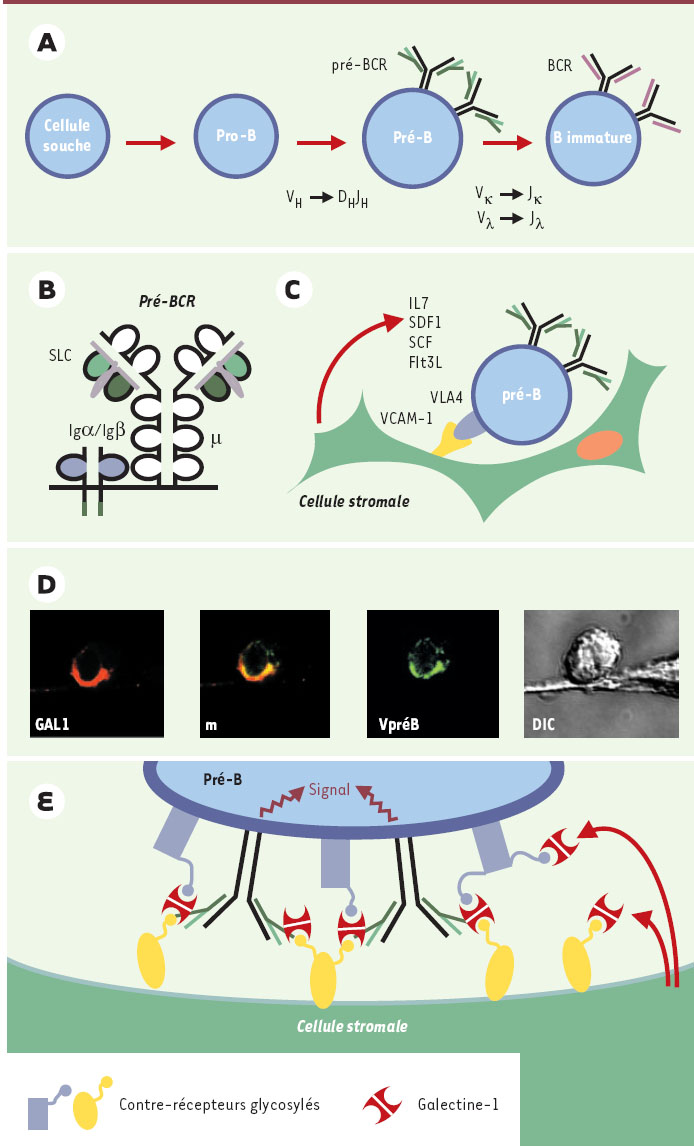
Le développement des lymphocytes B dans la moelle osseuse des mammifères est un processus très finement contrôlé, qui aboutit à la production d’une population de lymphocytes B immatures, diversifiés et tolérants aux antigènes du soi. La diversité qui caractérise l’ensemble de la population B se manifeste par l’existence d’une multitude de clones exprimant chacun un récepteur de l’antigène singulier. C’est la recombinaison des gènes codant pour les immunoglobulines et l’exclusion allélique qui, en assurant l’expression d’un récepteur pour l’antigène (BCR) unique à chaque cellule B, crée cette diversité. C’est au cours des différentes étapes du développement des cellules B que se fait le réarrangement séquentiel des gènes codant pour les chaînes des immunoglobulines (Ig), d’abord pour les chaînes lourdes µ, puis les chaînes légères κ et λ. Par ailleurs, la différenciation peut être suivie par l’expression de marqueurs de surface comme CD34, CD19, la chaîne lourde µ et la pseudochaîne légère (SLC, surrogate light chain) constituée de l’association des protéines λ-like et Vpré-B. De façon simplifiée, on reconnaît trois étapes majeures de la différenciation lymphoïde B (selon la combinaison des 4 marqueurs mentionnés cidessus) (Figure 1A): pro-B (CD34+ CD19+ SLC+ µ-), pré-B (CD34- CD19+ SLC+ µ+) et B immature (CD19+ µ+κ+ ou λ+). Chacune de ces étapes est en outre caractérisée par un profil d’expression génique et un spectre spécifique d’interactions avec l’environnement médullaire.
| Figure 1.
Expression et rôle du pré-BCR et de son ligand la galectine-1 au cours de la différenciation lymphoïde B. A. Les différentes étapes de la différenciation des lymphocytes B ont lieu dans la moelle osseuse chez l’adulte et sont caractérisées par le réarrangement séquentiel des gènes des immunoglobulines. Les réarrangements commencent au niveau des gènes codant pour la chaîne lourde H (DH-JH suivi de VH-DHJH) puis au niveau des locus codant pour la chaîne légère L, κ(Vκ-Jκ) puis λ(Vλ-Jλ). Les cellules pré-B et B immatures expriment respectivement les récepteurs pré-B (pré-BCR, en noir) et B (BCR). B. Le pré-BCR est formé de la surrogate light chain (SLC, en vert), composée des protéines λ-like et Vpré-B et de la chaîne lourde μ(en noir), associée aux molécules de transduction Igα/Igβ codées par les gènes CD79a et CD79b. C. Les cellules stromales de la moelle osseuse sont indispensables à la croissance, la maturation et la survie des précurseurs B. Elles établissent des contacts étroits avec les progéniteurs lymphoïdes par l’intermédiaire de molécules d’adhérence (VCAM/VLA4) et sécrètent des facteurs solubles (IL-7, SCF, Flt3L, SDF-1) qui sont délivrés aux précurseurs. D. Lorsque les cellules pré-B sont cultivées sur des lignées stromales, nous avons observé par microscopie confocale que le pré-BCR (révélé par un anticorps anti-Vpré-B, en vert) et la galectine-1 (révélé par un anticorps anti-GAL1, en rouge) sont tous deux re-localisés à la zone de contact entre les deux cellules participant à la formation d’une synapse. De plus, cette relocalisation s’accompagne de l’induction d’un signal de transduction à partir du pré-BCR. E. Nous proposons un modèle de l’organisation moléculaire de la synapse « développementale » qui s’établit entre la cellule pré-B et la cellule stromale. La galectine-1, sécrétée par la cellule stromale, est capturée par des contrerécepteurs présents à la surface des deux cellules ainsi que par les pré-BCR. La galectine-1 se comporte comme l’organisateur moléculaire d’un maillage qui rassemble les contre-récepteurs et les récepteurs pré-B. La formation de ce réseau est responsable de la re-localisation et du déclenchement de la signalisation des pré-BCR. |
Au stade pré-B, la SLC s’exprime à la surface des cellules accompagnée de la chaîne lourde µ, et associée aux molécules CD79a et CD79b qui assurent la transduction du signal par des motifs ITAM, et ce complexe moléculaire forme un récepteur fonctionnel, le pré-BCR (Figure 1B). L’étape d’association de la SLC avec la chaîne µ néosynthétisée constitue un point de contrôle essentiel de la constitution du pré-BCR et du développement B. En effet, chez l’homme et chez la souris, le pré-BCR est impliqué dans l’amplification de la population pré-B, dans la sélection du répertoire des chaînes µ, et il influence positivement l’expression transcriptionnelle des gènes des chaînes légères κ [ 1]. Le mécanisme physiologique par lequel le pré-BCR est activé in vivo était jusqu’à présent inconnu. Notre laboratoire vient de démontrer l’existence d’un ligand pour le récepteur pré-B qui est produit par l’environnement médullaire [ 2].
Les cellules « stromales » constituant l’environnement médullaire participent à la différenciation B en établissant des contacts directs avec les précurseurs B par l’intermédiaire de molécules d’adhérence comme VCAM-1 (vascular cell adhesion molécule) dont le récepteur sur le précurseur B est l’intégrine VLA-4 (ou α4β1, ou CD49dCD29) et en sécrétant des facteurs solubles comme l’interleukine-7, le SCF (stem cell factor), Flt3-L ou la chimiokine SDF-1 (stromal-derived factor 1, le ligand de CXRCR4), tous susceptibles de contrôler la croissance, la maturation et la survie des précurseurs B (Figure 1C). Or, nous avons démontré récemment que la SLC et des molécules pré-BCR humaines, produites sous forme soluble, étaient capables de se lier de façon spécifique à certaines de ces cellules stromales adhérentes, issues de plusieurs espèces et de plusieurs tissus, et dont certaines permettent la différenciation des précurseurs B en lymphocytes matures pré-B. En utilisant la SLC humaine recombinante comme sonde, nous avons isolé par biochimie préparative, et identifié par spectrométrie de masse, une molécule exprimée par les cellules stromales qui se lie au pré- BCR: la galectine-1 (GAL1). GAL1 est une S-lectine qui appartient à la famille des galectines, très conservée au cours de l’évolution. Les galectines possèdent une spécificité de liaison pour les β-galactosides et leurs domaines de reconnaissance des sucres sont très homologues. Nous avons établi que la SLC et GAL1 interagissent de façon directe, avec une constante d’affinité de 2.106 M-1. Cette interaction ne fait pas intervenir les sucres et implique un site de liaison sur GAL1 différent de la poche se liant aux sucres. GAL1 est une molécule soluble, son ancrage à la surface des cellules stromales se fait par l’intermédiaire de contre-récepteurs glycosylés, et la fixation de la SLC aux cellules stromales est dépendante de la présence de GAL1 ancrée à la membrane cellulaire. Lorsqu’on examine par microscopie confocale la localisation du pré-BCR et de GAL1 lors de l’interaction entre les cellules pré-B et des lignées stromales, on trouve une co-localisation des deux molécules au niveau de la zone de contact entre les deux cellules, entraînant la formation d’une synapse (Figure 1D). Comme le montre la Figure 1, la localisation du pré-BCR dans la synapse est toujours incluse dans celle de GAL1, suggérant que GAL1, outre sa liaison au pré-BCR, peut aussi interagir avec des contre-récepteurs présents à la surface des cellules pré-B. Enfin, nos résultats montrent que la formation de la synapse entre les cellules pré-B et stromale s’accompagne de la mise en route d’une activité intracellulaire de phosphorylation des tyrosines et d’un signal de transduction à partir du pré-BCR. Un modèle visualisant l’organisation moléculaire de la synapse, qui peut être qualifiée de « développementale », est présenté sur la Figure 1E.
La nature des contre-récepteurs de la galectine-1 qui sont impliqués dans l’établissement de la synapse entre les cellules pré-B et stromales reste à déterminer. Néanmoins, des contre-récepteurs de la galectine-1 ont déjà été identifiés dans d’autres systèmes biologiques: il s’agit de protéines de la matrice extracellulaire (laminine et fibronectine) ou de récepteurs de surface comme CD45, CD43, CD7, CD2, CD3 ou GM1. GAL1 participe à de nombreuses fonctions biologiques comme l’adhérence, la croissance et la mort cellulaires. GAL1 et ses contre-récepteurs se comportent comme de puissants régulateurs de l’homéostasie du système immunitaire [ 3], et ce sont les signaux délivrés par les différents contre-récepteurs qui déterminent la nature des réponses biologiques [ 4]. Les galectines induisent des effets contrastés sur la croissance cellulaire, et l’effet biologique observé - prolifération ou apoptose - dépend du type cellulaire et du statut d’activation cellulaire. Par exemple, il a été rapporté que GAL1 pouvait à la fois jouer un rôle d’inhibition de la prolifération sur les cellules T, et promouvoir la prolifération des cellules endothéliales vasculaires. Les galectines jouent aussi un rôle crucial dans les processus de transformation cellulaire et dans la formation des métastases.
Il nous reste à déterminer quel est le rôle physiologique de GAL1 sur les cellules pré- B. La propriété remarquable qu’a cette lectine d’organiser - à l’interface entre le précurseur B et la cellule stromale - un réseau de contre-récepteurs glycosylés dans lequel le pré-BCR est engagé et stimulé laisse présager un rôle fonctionnel déterminant d’une telle organisation in vivo. Compte tenu de la perte de la population pré-B chez les souris SLC−/− [ 5], la formation de la synapse entre les cellules pré-B et stromales pourrait être essentielle pour stimuler l’entrée en cycle des cellules pré-B et pour assurer la transition entre les grandes et les petites cellules pré-B, qui caractérise la différenciation lymphocytaire.