| |
| Med Sci (Paris). 2003 February; 19(2): 211–216. Published online 2003 February 15. doi: 10.1051/medsci/2003192211.Les inhibiteurs de farnésyl transférase : une cible peut en cacher une autre Julien Mazières,* Anne Pradines, and Gilles Favre Inserm U.563, Centre de Physiopathologie Toulouse Purpan, Département Innovation Thérapeutique et Oncologie Moléculaire, Institut Claudius Regaud, 20-24, rue du pont Saint-Pierre, 31052 Toulouse Cedex, France |
L’amélioration de la connaissance des processus moléculaires impliqués dans l’oncogenèse a permis l’identification de nouvelles cibles pour le traitement des cancers. Le gène ras, dont la mutation activatrice est retrouvée dans plus de 30 % des cancers humains, a fait l’objet d’une attention particulière. La protéine Ras est une GTPase monomérique qui doit être farnésylée pour exercer ses fonctions transformantes. Aussi, des inhibiteurs de farnésyl transférase (FTI) ont été développés afin d’inhiber l’activité de Ras via l’inhibition de la farnésylation. Les FTI inhibent effectivement la transformation cellulaire et la croissance tumorale dans de nombreux modèles murins et humains, avec peu d’effet sur la prolifération cellulaire normale. Après des résultats précliniques encourageants, les FTI sont actuellement dans une phase de développement clinique. Cependant, alors que leur place se précise en clinique, les bases biologiques de leur action antitumorale, et en particulier leur(s) cible(s) véritable(s), restent encore à définir. |
L’isoprénylation : une maturation post-traductionnelle nécessaire aux fonctions cellulaires des protéines L’isoprénylation est une modification post-traductionnelle des protéines par liaison covalente d’un lipide isoprénique, intermédiaire de la voie de biosynthèse du cholestérol [
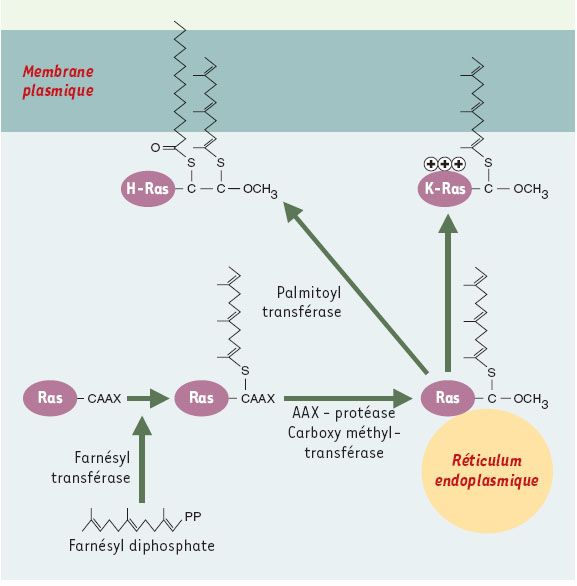
1]. L’isoprénylation concerne entre 0,5 % et 1 % des protéines cellulaires qui appartiennent pour la plupart à la famille des GTPases monomériques. L’isoprénylation est indispensable à la fonction cellulaire de ses protéines cibles dont elle permet l’ancrage membranaire et favorise les interactions protéine-protéine. Le radical isoprényl est fixé sur une cystéine localisée au sein d’un motif carboxy- terminal consensus, la boîte CAAX, où A est un acide aminé aliphatique (Figure 1). La nature de l’acide aminé X détermine le type d’isoprényl fixé sur la protéine. Si X est une leucine ou une isoleucine, la protéine est le substrat de la géranylgéranyl transférase I et la protéine est alors géranylgéranylée (chaîne à 20 atomes de carbone). Pour tout autre acide aminé, la protéine sera farnésylée (15 atomes de carbone) par la farnésyl transférase. Cependant, cette règle n’est pas absolue. En effet, les protéines Ki-Ras ou N-Ras, normalement farnésylées in vivo, peuvent devenir géranylgéranylées quand la farnésyl transférase est inhibée [
2]. De plus, nous avons montré que la protéine RhoB, malgré la présence de la leucine en carboxy-terminal du motif CAAX, peut être farnésylée et géranygéranylée in vivo [
3]. Il ne semble donc pas exister de loi stricte permettant de prédire la spécificité des isoprényl transférases pour les protéines. Après l’isoprénylation, les trois derniers acides aminés carboxy-terminaux sont éliminés et la cystéine farnésylée est carboxyméthylée. La maturation post-traductionnelle est parachevée, pour certaines protéines telle que H-Ras, par la palmitoylation de cystéines situées en amont de la cystéine isoprénylée.
 | Figure 1.
Maturation post-traductionnelle des protéines Ras. Les protéines Ras néosynthétisées sont farnésylées par la farnésyl transférase. Les trois acides aminés carboxy-terminaux sont ensuite éliminés par protéolyse et la cystéine farnésylée est carboxy-méthylée. Ces deux étapes ont lieu au niveau du réticulum endoplasmique. La protéine H-Ras subit alors une palmitoylation qui lui permet d’être localisée à la membrane plasmique. La protéine K-Ras, qui possède un domaine polybasique en position carboxy-terminale mais pas de site de palmitoylation, est adressée à la membrane plasmique sans autre modification. |
|
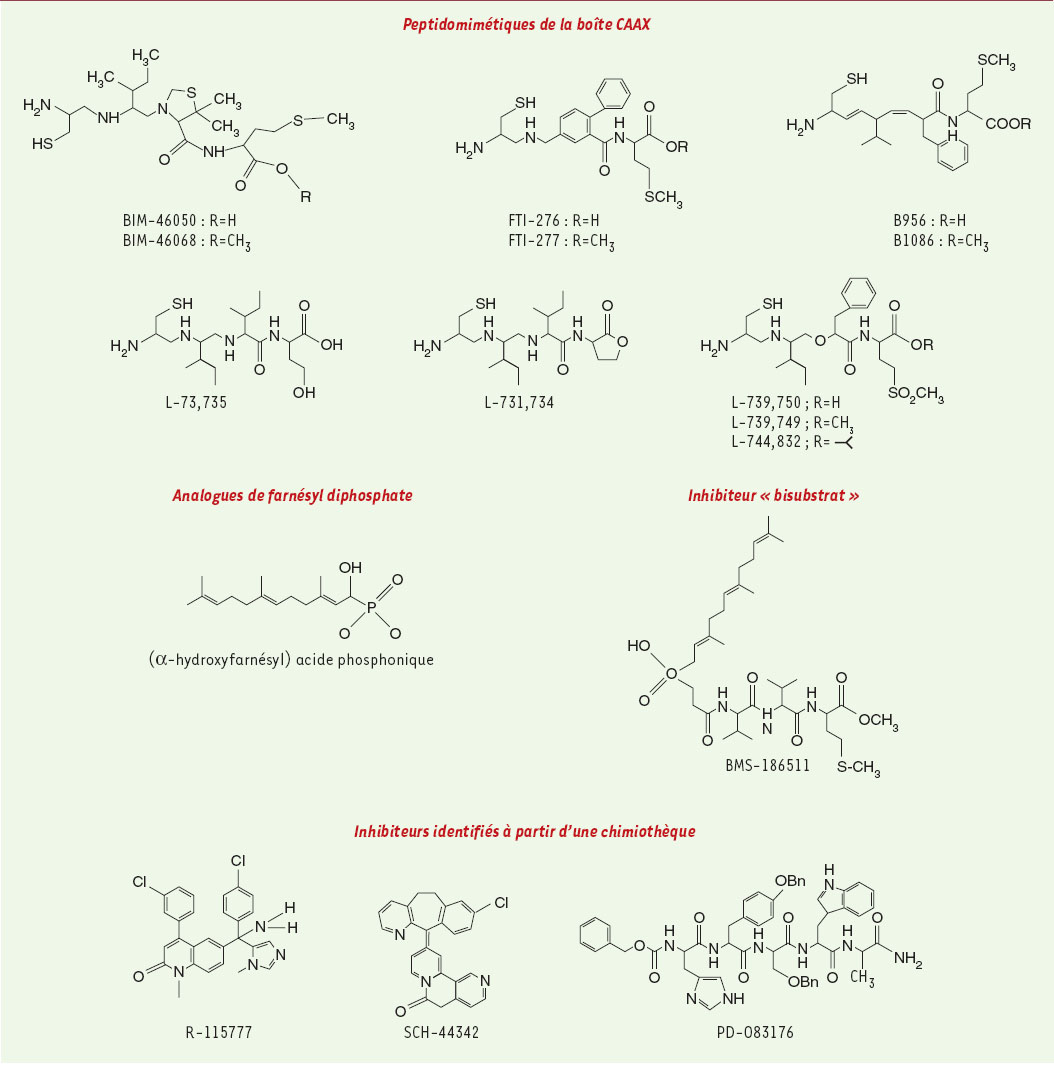
Les inhibiteurs de farnésyl transférase Le pouvoir transformant de l’oncogène ras étant dépendant de la farnésylation [
4], des inhibiteurs de la farnésyl transférase ont été recherchés en vue de développer des traitements spécifiques des tumeurs présentant des mutations de ras. Ces dernières années, de nombreux inhibiteurs compétitifs spécifiques de la farnésyl transférase in vitro ont été isolés, soit par criblage de produits naturels, soit par synthèse chimique de peptido-mimétiques du motif CAAX. Ces molécules préviennent la farnésylation de Ras in vivo (Figure 2). Des inhibiteurs compétitifs du farnésyl diphosphate, second substrat de la farnésyl transférase, ont également été décrits. L’effet inhibiteur des FTI sur la transformation induite par ras a été rapporté simultanément par deux équipes en 1993 [
5,
6]. Ces molécules inhibent la clonogénicité de fibroblastes murins transformés par l’oncogène ras mais n’ont aucun effet sur des cellules transformées par l’oncogène v-raf dont le pouvoir transformant est indépendant de l’isoprénylation.
 | Figure 2.
Structure de quelques inhibiteurs de farnésyl transférase.
|
En culture cellulaire, les FTI inhibent sélectivement la prolifération de cellules NIH-3T3 transformées par ras (NIH-3T3V12 Ras) ainsi que la phosphorylation, induite par l’expression de l’oncogène ras, des MAP-kinases ERK1 et ERK2. L’effet inhibiteur des FTI sur la prolifération tumorale est généralement attribué à un effet cytostatique. Dans la plupart des cas, les cellules sont bloquées dans le cycle cellulaire, soit en phase G1 soit en phase G2/M en fonction des lignées cellulaires considérées [
7,
8]. Cet effet est indépendant des mutations de p53. Dans certaines conditions, les FTI peuvent induire l’apoptose, notamment quand les cellules sont cultivées en l’absence d’ancrage ou en milieu dépourvu de sérum [
9]. Cette propriété pro-apoptotique des FTI pourrait être liée à l’activation cellulaire de la voie de la phospho-inositide 3 kinase-AKT (PI3K-AKT) [
10,
11].
In vivo chez la souris, les FTI inhibent la croissance de tumeurs constituées de cellules NIH-3T3 V12Ras [
12]. Cet effet anti-tumoral est corrélé à la prévention de la farnésylation de Ras. De même, les FTI ont été testés dans des modèles de souris trangéniques qui expriment l’oncogène ras sous le contrôle de promoteurs spécifiques de tissus tels que le promoteur du MMTV (mouse mammary tumor virus) [
13]. Ces souris développent des tumeurs spontanées des glandes salivaires et mammaires qui sont efficacement traitées par les FTI. Des résultats tout aussi probants ont été obtenus avec des souris qui possèdent de multiples altérations génétiques telles que des mutations activatrices de ras et de myc ou des souris dont le gène p53 a été invalidé et portant des mutations activatrices de ras [
14]. Pour tous ces modèles animaux, on observe une très faible toxicité des traitements laissant espérer un fort index thérapeutique. |
Ras n’est pas la seule cible des FTI Ces derniers résultats semblaient en faveur d’un effet inhibiteur des FTI spécifique de la transformation par ras. Cependant, de nombreux arguments expérimentaux ont battu en brèche cette hypothèse. Par exemple, la cinétique d’inversion du phénotype tumoral de cellules NIH-3T3 V12Ras par les FTI est bien plus rapide que la cinétique d’inhibition de la farnésylation de Ras [
15]. Par ailleurs, l’effet inhibiteur des FTI sur la prolifération cellulaire de tumeurs humaines in vitro et sur la croissance tumorale in vivo chez la souris s’exerce même en l’absence de mutation de ras [
16]. Enfin, les cellules tumorales possédant des mutations activatrices sur les gènes K-ras et N-ras sont sensibles aux FTI alors que ces protéines sont géranylgéranylées et donc toujours capables d’exercer leur fonction oncogénique [
17]. Toutes ces observations suggèrent que d’autres protéines farnésylées, différentes de Ras, doivent être responsables de l’effet anti-transformant des FTI. La caractérisation de ces protéines revêt une importance particulière puisqu’elle permettrait d’identifier de nouvelles voies de la transformation cellulaire. |
RhoB, cible potentielle des FTI Par plusieurs observations, la GTPase RhoB, qui peut être farnésylée ou géranygéranylée in vivo, apparaît comme une cible potentielle des FTI. Tout d’abord, la demi-vie courte de RhoB coïncide avec la cinétique rapide d’obtention des effets cellulaires des FTI [
18]. De plus, l’expression d’un mutant de RhoB, dont la fonction est devenue indépendante de sa prénylation, induit une résistance aux FTI [18]. Le fait que RhoB devienne géranylgéranylée quand la farnésyl transférase est inhibée a conduit l’équipe de G.C. Prendergast à formuler l’hypothèse « RhoB-FTI » [18,
19]. Selon cette hypothèse, c’est la disparition de la forme farnésylée de RhoB au profit de sa forme géranylgéranylée qui serait à l’origine de l’effet anti-transformant des FTI. Cela implique que les deux formes de RhoB aient des rôles cellulaires antagonistes: la forme farnésylée induirait la transformation alors que la forme géranylgéranylée l’inhiberait [19]. En faveur de cette hypothèse, on observe qu’une protéine chimérique RhoB-RhoA, exclusivement géranylgéranylée, a un rôle inhibiteur sur la transformation cellulaire [
20]. Afin d’étayer cette hypothèse, nous avons réalisé des mutants de RhoB dont la boîte CAAX ne peut qu’être soit farnésylée, soit géranylgéranylée. Nos résultats indiquent que la transformation de cellules murines NIH-3T3 induite par ras est renforcée par l’expression du mutant farnésylé de RhoB alors qu’elle est inhibée par l’expression du mutant géranygéranylé. Cependant, dans le cas de cellules tumorales humaines, RhoB ou ses différents mutants de prénylation (farnésyl ou géranylgéranyl), inhibent la prolifération cellulaire, la croissance dépendante de l’ancrage et la capacité d’induire des tumeurs chez la souris. RhoB aurait donc un rôle anti-transformant dans les cellules humaines, et ce quel que soit son mode de prénylation [
21]. Cet effet est dépendant de la voie PI3K/AKT et du facteur de transcription NF-κB. Ces résultats indiquent que les fonctions cellulaires des formes farnésylées ou géranylgéranylées de RhoB dépendent du type cellulaire. Ainsi, RhoB aurait un rôle inhibiteur de la transformation dans les cellules tumorales humaines, et ne pourrait donc pas être la cible de l’effet biologique des FTI. |
Premiers développements cliniques Il n’a fallu que cinq ans pour passer de la première description des FTI en 1993 à leur développement clinique en 1998. Trois grandes classes de FTI ont été développées: les inhibiteurs compétitifs de la boîte CAAX (L-731,735, L- 744,832, SCH-66336, R-115777), les inhibiteurs compétitifs du farnésylpyrophosphate (PD-169451, RPR-130401) et, enfin, les inhibiteurs bisubstrats (BMS-186511, BMS- 214662). Actuellement, quatre FTI font l’objet d’études cliniques: le R-115777 (Zarnestra®), le SCH-66336 (Serasar®), le L-778,123 et le BMS-214662. Au total, une vingtaine d’essais de phase I ont étudié les FTI en monothérapie ou en association et les résultats de ces essais ont été rapportés sous forme de publications ou de communications lors des derniers congrès de cancérologie. Seul le R-115777 a été analysé en essai de phase II [
22]. Le profil de toxicité associé aux FTI est d’un niveau acceptable: la toxicité hématologique, l’asthénie et des troubles digestifs sont les principaux effets secondaires mais il s’agit rarement de toxicité de grade IV. Une certaine toxicité cardiaque, sous la forme d’un élargissement de l’espace QT à l’électrocardiogramme, a été rapportée avec le L-778,123 [
23]. Les taux de réponse observés chez des patients porteurs de tumeurs solides prétraitées sont encourageants avec des réponses objectives dans des tumeurs bronchiques, pancréatiques et coliques [
24–
26]. Le R-115777 est également d’un grand intérêt dans le traitement des tumeurs mammaires (12 % de réponse partielle et 35 % de cas où la maladie est stabilisée à 3 mois) et dans les leucémies (10 % de réponse complète et 20 % de stabilisation à 3 mois) [22,
27]. On notera que ces deux derniers types de tumeurs présentent une faible incidence de mutations de l’oncogène ras, argument supplémentaire en faveur de l’existence d’autres cibles des FTI que Ras. Enfin, des résultats prometteurs sont obtenus avec l’association de FTI et de chimiothérapies conventionnelles telle que le SCH-66336 et la gemcitabine ou le BMS-214662 et le paclitaxel. Dans ce cas, une activité anti-tumorale associée à une toxicité modérée est obtenue chez des patients lourdement prétraités et parfois résistants à la chimiothérapie administrée seule [
28,
29]. Les FTI et, de manière plus générale, la plupart des nouvelles molécules qui ciblent les voies de signalisation sont actuellement évalués en phase I, comme des chimiothérapies conventionnelles, à la recherche de la dose maximale tolérée. Or, cette dose n’est pas obligatoirement corrélée à la dose réellement efficace pour ce type de traitement. La dose biologique efficace est probablement un meilleur marqueur et devrait être retenue pour les études de phase II. Néanmoins, les paramètres de mesure d’efficacité des FTI in vivo rapportés jusqu’à présent dans certaines études cliniques sont assez hétérogènes: inhibition de l’activité de la farnésyl transférase dans différents types cellulaires [27], inhibition, dépendante de la dose, de la prénylation de protéines telles que la protéine chaperon hDJ2 ou la prélamine A [
25,
30] ainsi que l’inhibition de la voie des MAP-kinases [27]. Or la relation entre l’efficacité clinique des FTI et l’efficacité biologique déterminée avec ces marqueurs reste à démontrer. |
Après trois ans de développement clinique, les FTI ont franchi avec succès les études de phase I en montrant leur innocuité et leur activité anti-tumorale. Leur avenir reste néanmoins soumis à l’identification d’un critère d’efficacité in vivo fiable et reproductible et à leur utilisation optimale dans la stratégie thérapeutique des cancers. L’utilisation des FTI dans des tumeurs très avancées et souvent pré-traitées est probablement inadéquate. En effet, les FTI sont des molécules cytostatiques, qui ont une plus grande efficacité dans des tumeurs peu évoluées, encore capables d’apoptose. Ils sont également efficaces pour prévenir la formation de tumeurs bronchiques murines induites par un carcinogène [
31]. Ces arguments, associés à la faible toxicité des FTI, sont en faveur de leur utilisation chez des patients porteurs de tumeurs peu développées ou pour contrôler la maladie résiduelle après un traitement initial (chirurgie ou chimiothérapie). Dans ce cas, l’administration de FTI devrait se faire en continu, au long cours, alors que les différents essais rapportés concernent une administration généralement discontinue et excédant rarement trois mois. De même, les paramètres d’efficacité clinique classiquement retenus, taux de réponse ou de survie à 1 an, ne peuvent rendre compte de manière précise de l’effet cytostatique ou préventif de la re-population tumorale et devraient être abandonnés au profit de paramètres plus adaptés comme la survie sans progression ou la survie à 5 ans. La perspective d’association d’un traitement ciblé sur les voies de transduction du signal à un traitement cytotoxique ou à une radiothérapie, en vue d’une potentialisation de l’effet anti-tumoral, est très séduisante. Des études in vitro et in vivo ont montré que l’association de FTI à des chimiothérapies conventionnelles peut avoir un effet additif ou même synergique. On peut citer comme exemple l’association des FTI, qui bloquent la formation du fuseau mitotique [
32], et des taxanes ou des épothilones, qui agissent sur les microtubules [
33]. Nous avons montré [
34] ainsi que l’équipe de W.G. McKenna [
35], que les FTI sensibilisent des cellules tumorales humaines résistantes aux radiations ionisantes, l’association FTIradiothérapie est donc une voie de recherche à explorer. Enfin, la voie de survie PI3K/AKT est impliquée de manière prépondérante dans l’effet des FTI [10, 11], observation qui devrait orienter les essais thérapeutiques vers l’association des FTI à des inhibiteurs de la voie PI3K mais aussi à des traitements hormonaux, dont on sait qu’ils agissent au moins partiellement en inhibant la voie de la PI3K dans les cancers du sein ou de la prostate. |
1. Zhang FL, Casey PJ. Protein prenylation: molecular mechanisms and functional consequences. Annu Rev Biochem 1996; 65: 241–69. 2. Whyte DB, Kirschmeier P, Hockenberry TN, et al. Kand N-Ras are geranylgeranylated in cells treated with farnesyl protein transferase inhibitors. J Biol Chem 1997; 272: 14459–64. 3. Baron R, Fourcade E, Lajoie-Mazenc I, et al. RhoB prenylation is driven by the three carboxylterminal amino acids of the protein: evidenced in vivo by an anti-farnesyl cysteine antibody. Proc Natl Acad Sci USA 2000; 97: 11626–31. 4. Hancock JF, Paterson H, Marshall CJ. A polybasic domain or palmitoylation is required in addition to the CAAX motif to localize p21ras to the plasma membrane. Cell 1990; 63: 133–9. 5. James GL, Goldstein JL, Brown MS, et al. Benzodiazepine peptidomimetics: potent inhibitors of Ras farnesylation in animal cells. Science 1993; 260: 1937–42. 6. Kohl NE, Mosser SD, Desolms SJ, et al. Selective inhibition of Ras-dependent transformation by a farnesyltransferase inhibitor. Science 1993; 260: 1934–7 7. Miquel K, Pradines A, Sun J, et al. GGTI-298 induces G0/G1 block and apoptosis whereas FTI-277 causes G2/M enrichment in A549 cells. Cancer Res 1997; 57: 1846–50. 8. Vogt A, Sun JZ, Qian YM, Hamilton AD, Sebti SM. The geranylgeranyltransferase-I inhibitor GGTI-298 arrests human tumor cells in G(0)/G(1) and induces p21(WAF1/CIP1/SDI1) in a p53-independent manner. J Biol Chem 1997; 272: 27224–9. 9. Lebowitz PF, Sakamuro D, Prendergast GC. Farnesyl transferase inhibitors induce apoptosis of Rastransformed cells denied substratum attachment. Cancer Res 1997; 57: 708–13. 10. Du W, Liu A, Prendergast GC. Activation of the PI3K-AKT pathway masks the proapoptotic effects of farnesyltransferase inhibitors. Cancer Res 1999; 59: 4208–12. 11. Jiang K, Coppola D, Crespo NC, et al. The phosphoinositide 3-OH kinase/AKT2 pathway as a critical target for farnesyltransferase inhibitor-induced apoptosis. Mol Cell Biol 2000; 20: 139–48. 12. Sun JZ, Qian YM, Hamilton AD, Sebti SM. Ras CAAX peptidomimetic FTI 276 selectively blocks tumor growth in nude mice of a human lung carcinoma with K-Ras mutation and p53 deletion. Cancer Res 1995; 55: 4243–7. 13. Kohl NE, Omer CA, Conner MW, et al. Inhibition of farnesyltransferase induces regression of mammary and salivary carcinomas in ras transgenic mice. Nat Med 1995; 1: 792–7. 14. Barrington RE, Subler MA, Rands E, et al. A farnesyltransferase inhibitor induces tumor regression in transgenic mice harboring multiple oncogenic mutations by mediating alterations in both cell cycle control and apoptosis. Mol Cell Biol 1998; 18: 85–92. 15. Prendergast GC, Davide JP, Desolms SJ, et al. Farnesyltransferase inhibition causes morphological reversion of ras-transformed cells by a complex mechanism that involves regulation of the actin cytoskeleton. Mol Cell Biol 1994; 14: 4193–202. 16. Sepp-Lorenzino L, Ma ZP, Bands E, et al. Peptidomimetic inhibitor of farnesyl protein transferase blocks the anchoragedependent and -independent growth of human tumor cell lines. Cancer Res 1995; 55: 5302–9. 17. Lerner EA, Zhang TT, Knowles DB, Qian Y, Hamilton AD, Sebti SM. Inhibition of the prenylation of K-Ras, but not H- or N-Ras, is highly resistant to CAAX peptidomimetics and requires both a farnesyltransferase and a geranylgeranyltransferase I inhibitors in human tumor cell lines. Oncogene 1997; 15: 1283–8. 18. Lebowitz PF, Davide JP, Prendergast GC. Evidence that farnesyltransferase inhibitors suppress ras transformation by interfering with rho activity. Mol Cell Biol 1995; 15: 6613–22. 19. Lebowitz PF, Prendergast GC. Non-Ras targets of farnesyltransferase inhibitors: focus on Rho. Oncogene 1998; 17: 1439–45. 20. Du W, Lebowitz PF, Prendergast GC. Cell growth inhibition by farnesyltransferase inhibitors is mediated by gain of geranylgeranylated RhoB. Mol Cell Biol 1999; 19: 1831–40. 21. Chen Z, Sun J, Pradines A, Favre G, Adnane J, Sebti SM. Both farnesylated and geranylgeranylated RhoB inhibit malignant transformation, induce apoptosis and suppress human tumor growth in nude mice. J Biol Chem 2000; 275: 17974–8. 22. Johnston SR, Ellis PA, Houston S, et al. A phase II study of the farnesyl transferase inhibitor R115777 in patients with advanced breast cancer. Proc Am Soc Clin Oncol 2000; 20: A318. 23. Rubin E, Abbruzzese JL, Morrison BW, et al. A phase I trial of the farnesyl transferase inhibitor L- 778123 on a 14 or 28-day dosing schedule. Proc Am Soc Clin Oncol 2000; 20: A689. 24. Schellens JHM, de Klerk G, Swart M, et al. Phase I and pharmacologic study with the novel farnesyl transferase inhibitor (FTI) R115777. Proc Am Soc Clin Oncol 2000; 20: A715. 25. Adjei AA, Erlichman C, Davis JN, et al. A phase I trial of the farnesyl transferase inhibitor SCH66336: evidence for biological and clinical activity. Cancer Res 2000; 60: 1871–7. 26. Ryan DP, Eder JP, Supko JG, et al. Phase I clinical trial of the farnesyl transferase inhibitor BMS-214662 in patients with advanced solid tumors. Proc Am Soc Clin Oncol 2000; 20: A720. 27. Lancet JE, Rosenblatt JD, Liesveld JL, et al. Use of farnesyl transferase inhibitor R115777 in relapsed or refractory acute leukemias: preliminary results of a phase I trial. Proc Am Soc Clin Oncol 2000; 20: A5B. 28. Hurwitz HI, Amado R, Prager D, et al. Phase I pharmacokinetic trial of the farnesyl transferase inhibitor SCH66336 plus gemcitabine in advanced cancers. Proc Am Soc Clin Oncol 2000; 20: A717. 29. Bailey HH, Marnocha R, Arzoomanian R, et al. Phase I trial of weekly paclitaxel and BMS214662 in patients with advanced solid tumors. Proc Am Soc Clin Oncol 2001; 21: A314. 30. Britten CD, Rowinsky E, Yao SL, et al. The farnesyl protein transferase (FPTase) inhibitor L-778123 in patients with solid cancers. Proc Am Soc Clin Oncol 1999; 19: A597. 31. Lantry LE, Zhang Z, Yao R, et al. Effect of farnesyltransferase inhibitor FTI-276 on established lung adenomas from A/J mice induced by 4- (methylnitrosamino)-1-(3- pyridyl)-1-butanone. Carcinogenesis 2000; 21: 113–6. 32. Crespo NC, Ohkanda J, Yen TJ, Hamilton AD, Sebti SM. The farnesyltransferase inhibitor, FTI-2153, blocks bipolar spindle formation and chromosome alignment and causes prometaphase accumulation during mitosis of human lung cancer cells. J Biol Chem 2001; 276: 16161–7. 33. Moasser MM, SeppLorenzino L, Kohl NE, et al. Farnesyl transferase inhibitors cause enhanced mitotic sensitivity to taxol and epothilones. Proc Natl Acad Sci USA 1998; 95: 1369–74. 34. Cohen-Jonathan E, Toulas C, Ader I, et al. The farnesyl transferase inhibitor FTI- 277 suppresses the 24kDa bFGF-induced radioresistance in HeLa cells expressing wild type Ras. Rad Res 1999; 152: 404–11. 35. Bernhard EJ, McKenna WG, Hamilton AD, et al. Inhibiting Ras prenylation increases the radiosensitivity of human tumor cell lines with activating mutations of ras oncogenes. Cancer Res 1998; 58: 1754–61. |