| |
| Med Sci (Paris). 2003 February; 19(2): 217–222. Published online 2003 February 15. doi: 10.1051/medsci/2003192217.Les lymphocytes : comment ça « Vav »? Céline Charvet and Marcel Deckert* Inserm U.343, Interactions cellulaires en immunologie et immunopathologie, Hôpital de l’Archet, Route de Saint-Antoine de Ginestière, BP 3079, 06202 Nice Cedex 3, France |
Les protéines de la famille Vav constituent un groupe d’oncoprotéines qui catalysent l’échange nucléotidique sur les petites GTPases de la famille Rho, permettant ainsi l’activation de ces régulateurs essentiels du remodelage du cytosquelette d’actine [
1]. Dans le système lymphoïde, ce processus joue un rôle fondamental dans tous les aspects de la vie des lymphocytes, depuis leur maturation et leur dissémination au sein de l’organisme, jusqu’à leur activation par un antigène et leurs fonctions régulatrices lors de la réponse immunitaire. Il n’est donc pas surprenant que les travaux effectués ces dernières années sur les protéines Vav éclairent leur rôle central dans le système hématopoïétique, et notamment dans la régulation de l’homéostasie des réponses lymphocytaires. |
Structure des protéines Vav Depuis l’identification de Vav1 en 1989 [
2] (Vav, 6e lettre de l’alphabet hébraïque correspondait au 6e oncogène isolé dans ce laboratoire), deux autres protéines fortement homologues ont été isolées chez l’homme et chez les rongeurs, Vav2 en 1996 [
3] et plus récemment Vav3 [
4]. Cependant, alors que l’expression de Vav1 est restreinte aux cellules hématopoïétiques, l’expression de Vav2 et de Vav3 est ubiquitaire. De plus, une forme tronquée de Vav (Vav-T), dont le rôle reste à éclaircir, a été isolée dans les spermatocytes de souris. Cette famille a également des représentants chez les invertébrés C. elegans et D. melanogaster, indiquant une fonction suffisamment importante pour être conservée dans la plupart des organismes multicellulaires (Figure 1) [
5]. Les protéines Vav sont composées de domaines structuraux homologues impliqués dans la stabilisation des interactions protéine-protéine et protéine- lipide, associés à un domaine enzymatique DH (Dbl homology) catalysant l’échange du nucléotide sur les petites GTPases de la famille Rho/Rac/Cdc42 et leur activation (→) [5,
6]. Ce domaine DH, suivi d’un domaine PH (pleckstrin homology) se liant aux phospho-inositides membranaires, constitue la caractéristique d’un groupe de protéines dont l’oncogène Dbl est le prototype (→→). Les protéines Vav possèdent aussi un domaine SH2 (Src-homology 2), impliqué dans l’association avec des protéines phosphorylées sur tyrosine, entouré de deux domaines SH3 (Src-homology 3) qui reconnaissent des motifs conservés riche en proline. Un autre domaine amino-terminal, le domaine CH (calponin homology), dont la délétion partielle entraîne l’activation oncogénique des protéines Vav, joue un rôle important bien que mal caractérisé.
(→) m/s 1997, n° 5, p. 629
(→→) m/s 1993, n° 7, p. 1039
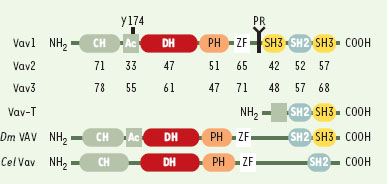
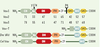 | Figure 1.
Structure des protéines Vav. Les protéines Vav sont constituées d’un domaine d’homologie à la calponine (CH), une région acide (Ac), des domaines d’homologie à Dbl (DH), possédant l’activité d’échange GDP/GTP, et à la pleckstrine (PH), une région riche en cystéine (zinc finger, ZF), une région riche en proline (PR), un domaine SH2 (Src-homology 2), et deux domaines SH3. Les pourcentages d’homologie entre Vav1, Vav2 et Vav3 sont identiques. Vav-T est une forme tronquée de Vav, isolée dans les spermatocytes de souris. Les orthologues des protéines Vav chez les invertébrés Drosophila melanogaster (Dm Vav) et Caenorhabditis elegans (Cel Vav) sont représentés. |
|
Régulation de l’activité des protéines Vav Parmi les nombreux facteurs d’échange nucléotidique (GEF) identifiés à ce jour, les protéines Vav sont les seules dont l’activité catalytique est réglée par phosphorylation sur tyrosine et qui possède un domaine SH2 [5,
7]. Ces caractéristiques leur attribuent une place priviligiée dans la signalisation des récepteurs couplés aux protéines tyrosine kinases (PTK). Les protéines Vav sont phosphorylées sur tyrosine en réponse à la stimulation des récepteurs de l’antigène des cellules T et B (TCR et BCR), des récepteurs de la portion Fc des immunoglobulines, des récepteurs de cytokines, comme l’interleukine- 2 (IL-2), l’IL-3, mais aussi des ligands co-stimulateurs CD28 dans les cellules T et CD19 dans les cellules B. Mais les protéines Vav sont également activées par des récepteurs à activité tyrosine kinase (récepteurs des facteurs de croissance), par des intégrines, et par des récepteurs couplés aux protéines G hétérotrimériques. De fait, il existe une grande variété de stimulus extracellulaires entraînant une phosphorylation des protéines Vav. Dans le cas des récepteurs de l’antigène dépourvus d’activité PTK intrinsèque, la phosphorylation des protéines Vav est assurée par les PTK cytoplasmiques des familles Src et Syk associées à ces récepteurs [5, 6]. La résolution de la structure cristalline du domaine DH de Vav1 a permis de comprendre comment l’activité des protéines Vav est réglée par phosphorylation [
8]. Au cours de l’activation cellulaire, la phosphorylation de Vav1 par les kinases des familles Src et Syk, et sa liaison avec les phospho-inositides membranaires produits par la phosphatidylinositol-3 kinase (PI-3K), induisent un changement conformationnel de la protéine qui permet son interaction avec les GTPases de la famille Rho et leur activation (Figure 2). Le domaine PH, dont la fonction normale est de se lier à certains phospholipides membranaires [
9,
10], pourrait jouer un rôle potentialisateur de l’activité des protéines Vav. Cependant, l’activation de Vav par liaison aux phospho-inositides membranaires n’est pas clairement établie et certaines publications récentes définissent une hiérarchie dans laquelle la voie PI-3K est activée en aval ou en parallèle des protéines Vav et de leurs substrats [
11,
12]. À côté de cette régulation de l’activité catalytique d’échange, la région carboxy-terminale comprenant les domaines SH3-SH2-SH3 joue un rôle adaptateur essentiel en recrutant des molécules de signalisation participant à la régulation de l’activité de Vav. Ces modes de régulation semblent également communs à Vav2 et à Vav3 [4,
13]..
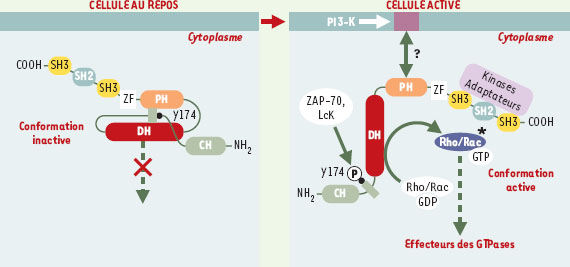
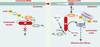 | Figure 2.
Régulation de l’activité des protéines Vav. Dans la cellule au repos, Vav1 se trouve dans une conformation inactive dans laquelle la queue amino-terminale se replie entre les domaines DH et PH masquant ainsi l’activité d’échange GDP/GTP et bloquant la phosphorylation de la tyrosine 174 (Y174). Dans la cellule activée, Vav1 se lie via son domaine PH aux phospholipides membranaires phosphorylés par la PI3-K (phosphatidylinositol-3 kinase) et se déplie dans sa conformation active. La phosphorylation de Vav1 sur sa tyrosine 174 entraîne l’augmentation de l’activité enzymatique de son domaine DH (Dbl homology) et favorise l’échange de GDP en GTP sur les petites GTPases de la famille Rho/Rac, qui participent à l’activation cellulaire par l’intermédiaire de leurs effecteurs. Notons que la région adaptatrice comprenant les domaines SH3-SH2-SH3 peut modifier l’activité des protéines Vav en recrutant des protéines de signalisation. |
|
L’importance des protéines Vav dans les réponses lymphocytaires a été confirmée par des études génétiques chez la souris. L’invalidation du gène vav1 se traduit par une forte réduction de la cellularité thymique, associée à des défauts importants de la prolifération des cellules T immatures dans le thymus en réponse à l’antigène (sélection positive) [
14] et à la délétion des clones auto-réactifs (sélection négative) [
15]. Ces souris présentent également un nombre réduit de lymphocytes T matures dans la rate et les ganglions lymphatiques, et ces lymphocytes ne répondent pas à la stimulation antigénique, en terme de production d’IL-2 [
16] ou d’activité cytotoxique anti-virale [
17]. À l’opposé, les défauts dans le compartiment B de ces animaux sont légers avec la perte des lymphocytes B1 péritonéaux et un défaut partiel d’activation des lymphocytes B matures par l’antigène, suggérant une compensation des fonctions de Vav1 par d’autres protéines dans le compartiment B. L’invalidation du gène vav2 chez la souris a confirmé cette hypothèse. En effet, la seule mutation du gène vav2 se traduit par un défaut partiel dans la formation des centres germinatifs et la commutation isotypique des immunoglobulines. En revanche, la double mutation des gènes vav1 et vav2 produit une immunodéficience grave chez la souris, avec une lymphopénie T et B très sévère, associée à un défaut fonctionnel du reliquat de lymphocytes T et B qui sont incapables d’être activés par leurs récepteurs de l’antigène [
18,
19]. La fonction biologique de Vav3 reste quant à elle encore inconnue, mais des études récentes suggèrent un rôle régulateur de la cytokinèse dans des fibroblastes [4], ainsi qu’une implication dans l’activation par le BCR de la voie PI-3K dans les cellules B de poulet [12]. |
Les défauts fonctionnels décrits ci-dessus trouvent leurs bases biochimiques dans la formation incomplète des complexes de signalisation associés au TCR et au BCR (Figure 3). Des études sur les modèles animaux et par surexpression des protéines Vav dans des cellules lymphoïdes ont permis d’identifier certains de leurs partenaires dans la signalisation des récepteurs de l’antigène et certaines réponses cellulaires auxquelles elles participent. Par exemple, dans la cellule T activée, Vav1 peut s’associer via son domaine SH2 à la protéine adaptatrice SLP-76 et à la kinase ZAP-70 (zeta-associated protein of 70 kDa), alors que dans la cellule B activée, Vav1 et Vav2 peuvent s’associer à la protéine adaptatrice Blnk (B cell linker protein) et à la kinase Syk. De plus, les protéines Vav peuvent s’associer via leurs domaines SH3 à d’autres molécules comme l’adaptateur Grb2 (growth factor receptor bound protein 2) qui est couplé à la voie mitogénique Ras [5]. Cette organisation moléculaire minimale (et très simplifiée) permet de coupler le TCR et le BCR aux GTPases des familles Rho et Ras, qui contrôlent l’architecture et la croissance des cellules lymphoïdes. En l’absence de Vav1, les lymphocytes T présentent une activation réduite des GTPases Rac et Cdc42, des flux calciques et des MAP (mitogen-activated protein) kinases Erk1/2 (extracellular signal-regulated kinase), en réponse à l’antigène. Cela s’accompagne d’un défaut de réorganisation de l’actine et de la formation de la synapse immunologique entre le lymphocyte T et la cellule présentatrice de l’antigène [
20]. Les lymphocytes B n’exprimant ni Vav1 ni Vav2 présentent quant à eux une activation réduite des flux calciques en réponse à l’antigène [18, 19].
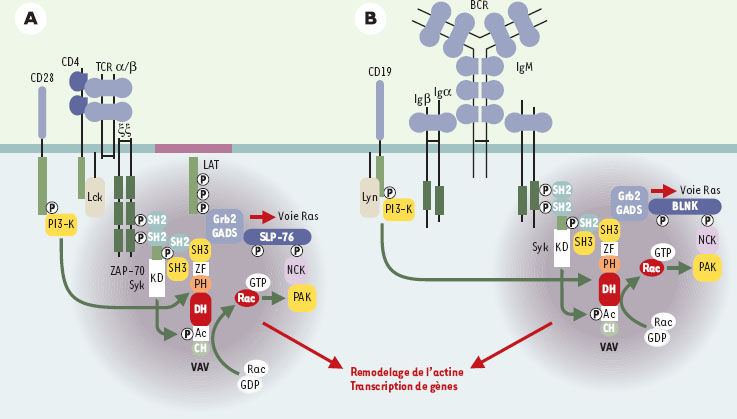
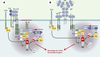 | Figure 3.
Réseaux moléculaires associés au TCR et au BCR. La stimulation par l’antigène du TCR (A) ou du BCR (B), et leurs co-récepteurs respectifs conduit au recrutement de Vav1 et/ou Vav2 à la membrane plasmique par son domaine PH via l’activation de la PI-3K (phosphatidylinositol-3 kinase). La phosphorylation de Vav1/2 augmente son activité enzymatique entraînant l’activation des petites GTPases. La formation d’un réseau moléculaire minimal comprenant Vav1/2, et des molécules adaptatrices ou possédant une activité kinase, conditionne la polymérisation de l’actine et la réorganisation du cytosquelette. GADS: Grb2-related adaptor downstream of Shc; KD: kinase domain; SLP-76: SH2 domain containing leukocyte-specific protein of 76 kDa; BLNK: B cell linker protein; LAT: linker for activated T-cell; ZAP-70: zeta-associated protein of 70 kDa; PAK: p21-activated kinase; CH: calponin homology; PH: pleckstrin homology; DH: Dbl homology; ZF: zinc finger. |
Les protéines Vav ont également un rôle essentiel dans la régulation de l’activité de facteurs nucléaires qui sont la cible de ces voies de signalisation (Figure 4). Par exemple, Vav1 est nécessaire à l’activation des facteurs de transcription NFAT (nuclear factor of activated T cells), NFκB (nuclear factor kappa B) et AP-1 (activating protein-1) qui contrôlent de nombreux gènes de cytokines [5,
21]. Les protéines Vav activent également le facteur de transcription SRF (serum responsive factor) qui règle l’expression du gène cfos, un des composants du complexe AP-1 [
22]. Il faut noter que le contexte cellulaire a un impact majeur sur la nature des réponses cellulaires réglées par les protéines Vav. Ainsi, dans le lymphocyte B, mais pas dans le lymphocyte T, Vav2 active le facteur de transcription NFAT [
23,
24]. Il faut également noter que les activations tissulaires spécifiques reflètent la prédominance d’une isoforme par rapport à une autre. Il reste à déterminer comment, dans chaque type cellulaire, sont coordonnées les activités de ces facteurs nucléaires pour déclencher l’expression des multiples protéines (récepteurs membranaires, chimiokines, cytokines, protéines du cycle cellulaire…), nécessaires à la maturation, à l’homéostasie et aux activités immunorégulatrices des cellules lymphoïdes.
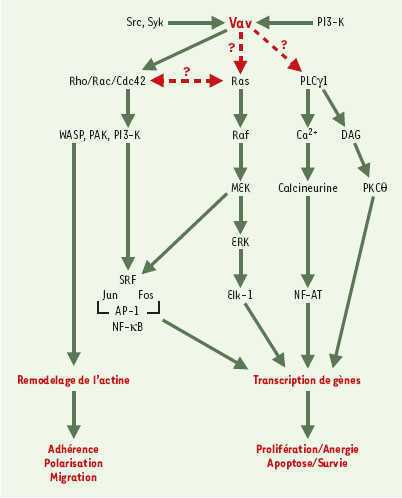
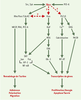 | Figure 4.
Voies de signalisation activées par les protéines Vav. Vav joue un role central dans la signalisation lymphocytaire, en participant à l’activation de plusieurs voies de signalisation, comme la voie Ras, la voie Rho/Rac/Cdc42 ou encore la voie PLCγ1 (phospholipase C γ1), aboutissant à la réorganisation du cytosquelette d’actine et à la transcription de gènes réglant des processus physiologiques indispensables à l’établissement de la réponse immunitaire. DAG: diacylglycérol; WASP: Wiskott-Aldrich syndrome protein; PAK: p21-activated protein kinase. |
|
Un rôle des protéines Vav en physiopathologie? Compte tenu de l’importance des réponses biologiques dans lesquelles sont impliquées les protéines Vav, il n’est pas étonnant de les trouver associées à certaines situations physiopathologiques. Par exemple, Vav1 est activée par la protéine Nef du VIH, et pourrait donc jouer un rôle important au cours de l’infection par ce virus [
25]. L’activité de Vav1 est également liée à la capacité tumorigénique du virus HTLV-1 [
26] et Vav1 peut s’associer à Bcr-Abl, une oncoprotéine impliquée dans le processus leucémogène. Il faut rappeler que Vav1 a été initialement identifiée par sa capacité de transformer des fibroblastes en culture et que des formes oncogéniques de Vav2 et de Vav3 ont été également isolées. Cependant, il est intéressant de noter que jusqu’à présent aucune forme oncogénique des protéines Vav n’a pu être isolée dans des tumeurs humaines spontanées, lymphoïdes ou autres. Enfin, des études chez la souris suggèrent un rôle des protéines Vav dans les maladies auto-immunes, même si ce rôle reste à démontrer chez l’homme. Dans un modèle de souris développant une auto-immunité spontanée, une hyperphosphorylation de Vav1 et de Vav2 est observée [
27,
28]. Cette hyperphosphorylation de Vav1 est normalement observée lors de la co-stimulation de la cellule T par la molécule CD28, un processus nécessaire à l’activation optimale du lymphocyte T au cours de la réponse immunitaire, et à l’établissement de la tolérance périphérique. Dans ce modèle murin d’auto-immunité, les lymphocytes T sont pleinement activés par l’antigène en l’absence de co-stimulation, expliquant l’hyperphosphorylation des protéines Vav, l’amplification des réponses lymphocytaires et l’auto-immunité spontanée chez ces souris. Il reste cependant à déterminer si un tel phénomène peut exister dans des maladies autoimmunes chez l’homme. À l’inverse, et étant donné le phénotype immunodéficient des souris n’exprimant pas Vav1 et Vav2, il serait intéressant de rechercher des altérations de l’expression de ces protéines dans certaines immunodéficiences humaines. |
Toutes les connaissances acquises sur les protéines Vav dans la biologie des cellules lymphoïdes montrent que ces molécules jouent un rôle central en couplant les récepteurs de l’antigène des cellules T et B aux voies de signalisation contrôlées par les GTPases de la famille Rho. Cependant, il est aussi clair que Vav1, Vav2 et Vav3 possèdent chacune des fonctions bien spécifiques qu’il convient de préciser. L’impact des protéines Vav sur la transcription de gènes est, de plus, largement influencé par le contexte cellulaire. Ces différences peuvent avoir plusieurs origines distinctes et non exclusives. Elles peuvent provenir des spécificités différentes pour les membres de la famille Rho qui ont été observées in vitro, et qui demandent à être confirmées in vivo. Outre leur activité de facteur d’échange, les protéines Vav se comportent comme des adaptateurs moléculaires qui peuvent interagir avec de nombreux partenaires protéiques. Il convient donc de déterminer s’il existe une combinaison de partenaires propre à chaque membre de la famille Vav, associée à une distribution spatiale spécifique et à une fonction précise. Il reste enfin à déterminer le rôle exact des protéines Vav dans la signalisation d’autres récepteurs couplés aux GTPases de la famille Rho comme les intégrines et les récepteurs des chimiokines qui règlent l’adhérence et la circulation des cellules lymphoïdes. La disponibilité de modèles cellulaires et animaux laisse augurer des progrès rapides dans l’identification des gènes cibles de Vav1, Vav2 et Vav3, et des partenaires protéiques qui leur sont associés. Toutes ces hypothèses ouvrent des perspectives excitantes pour la compréhension des mécanismes dépendant de l’actine contrôlant l’homéostasie du système lymphoïde et les maladies qui lui sont associées. |
Nous remercions M. Ticchioni, I. Foucault, I. Alberti (Inserm U.343), S. Tartare-Deckert (Inserm U.385), P. Auberger (Inserm U.526), ainsi que la Fondation pour la Recherche Médicale, l’Association pour la Recherche sur le Cancer et le Ministère de la Recherche.
|
1. Bar-Sagi D, Hall A. Ras and Rho GTPases: a family reunion. Cell 2000; 103: 227–38. 2. Katzav S, Martin-Zanca D, Barbacid M. Vav, a novel human oncogene derived from a locus ubiquitously expressed in hematopoietic cells. EMBO J 1989; 8: 2283–90. 3. Schuebel KE, Bustelo XR, Nielsen DA, et al. Isolation and characterization of murine vav2, a member of the vav family of protooncogenes. Oncogene 1996; 13: 363–71. 4. Movilla N, Bustelo XR. Biological and regulatory properties of Vav-3, a new member of the Vav family of oncoproteins. Mol Cell Biol 1999; 19: 7870–85. 5. Bustelo XR. Regulatory and signaling properties of the Vav family. Mol Cell Biol 2000; 20: 1461–77. 6. Collins TL, Deckert M, Altman A. Views on Vav. Immunol Today 1997; 18: 221–5. 7. Crespo P, Schuebel KE, Ostrom AA, Gutkind JS, Bustelo XR. Phosphotyrosinedependent activation of Rac-1 GDP/GTP exchange by the vav proto-oncogene product. Nature 1997; 385: 169–72. 8. Aghazadeh B, Lowry WE, Huang XY, Rosen, MK. Structural basis for relief of autoinhibition of the Dbl homology domain of protooncogene Vav by tyrosine phosphorylation. Cell 2000; 102: 625–33. 9. Han J, Luby-Phelps K, Das B, et al. Role of substrates and products of PI 3- kinase in regulating activation of Rac-related guanosine triphosphatases by Vav. Science 1998; 279: 558–60. 10. Das B, Shu X, Day GJ, et al. Control of intramolecular interactions between the pleckstrin homology and Dbl homology domains of Vav and Sos1 regulates Rac binding. J Biol Chem 2000; 275: 15074–81. 11. Djouder N, Schmidt G, Frings M, Cavalie A, Thelen M, Aktories K. Rac and phosphatidylinositol 3- kinase regulate the protein kinase B in Fc epsilon RI signaling in RBL 2H3 mast cells. J Immunol 2001; 166: 1627–34. 12. Inabe K, Ishiai M, Scharenberg AM, Freshney N, Downward J, Kurosaki T. Vav3 modulates B cell receptor responses by regulating phosphoinositide 3-kinase activation. J Exp Med 2002; 195: 189–200. 13. Schuebel KE, Movilla N, Rosa JL, Bustelo XR. Phosphorylationdependent and constitutive activation of Rho proteins by wild-type and oncogenic Vav-2. EMBO J 1998; 17: 6608–21. 14. Fischer KD, Zmuldzinas A, Gardner S, Barbacid M, Bernstein A, Guidos C. Defective T-cell receptor signalling and positive selection of Vav-deficient CD4+ CD8+ thymocytes. Nature 1995; 374: 474–7. 15. Kong YY, Fischer KD, Bachmann MF, et al. Vav regulates peptide-specific apoptosis in thymocytes. J Exp Med 1998; 188: 2099–111. 16. Costello PS, Walters AE, Mee PJ, et al. The Rhofamily GTP exchange factor Vav is a critical transducer of T cell receptor signals to the calcium, ERK, and NFkappaB pathways. Proc Natl Acad Sci USA 1999; 96: 3035–40. 17. Penninger JM, Fischer KD, Sasaki T, et al. The oncogene product Vav is a crucial regulator of primary cytotoxic T cell responses but has no apparent role in CD28-mediated costimulation. Eur J Immunol 1999; 29: 1709–18. 18. Dood GM, Bell SE, Vigorito E, et al. Signal transduction through Vav-2 participates in humoral immune responses and B cell maturation. Nat Immunol 2001; 2: 542–7. 19. Tedford K, Nitschke L, Girkontaite I, et al. Compensation between Vav-1 and Vav-2 in B cell development and antigen receptor signaling. Nat Immunol 2001; 2: 548–55. 20. Krawczyk C, Penninger JM. Molecular motors involved in T cell receptor clusterings. J Leuk Biol 2001; 69: 317–30. 21. Kaminuma O, Deckert M, Elly C, Liu YC, Altman A. Vav-Rac1-mediated activation of the c-Jun Nterminal kinase/c-Jun/AP- 1 pathway plays a major role in stimulation of the distal NFAT site in the interleukin-2 gene promoter. Mol Cell Biol 2001; 21: 3126–36. 22. Charvet C, Auberger P, Tartare-Deckert S, Bernard A, Deckert M. Vav1 couples T cell receptor to serum response factor-dependent transcription via a MEKdependent pathway. J Biol Chem 2002; 277: 15376–84. 23. Doody GM, Billadeau DD, Clayton E. Vav-2 controls NFAT-dependent transcription in B- but not T-lymphocytes. EMBO J 2000; 19: 6173–84. 24. Tartare-Deckert S, Monthouel MN, Charvet C, et al. Vav2 activates c-fos serum response element and CD69 expression, but negatively regulates NF-AT and IL-2 gene activation in T lymphocyte. J Biol Chem 2001; 276: 20849–57. 25. Fackler OT, Lu X, Frost JA, et al. p21-activated kinase 1 plays a critical role in cellular activation by Nef. Mol Cell Biol 2000; 20: 2619–27. 26. Mahana W, Zhao TM., Teller R, Robinson MA, Kindt TJ. Genes in the pX region of human T cell leukemia virus I influence Vav phosphorylation in T cells. Proc Natl Acad Sci USA 1998; 95: 1782–7. 27. Chiang YJ, Kole HK, Brown K, et al. Cbl-b regulates the CD28 dependence of Tcell activation. Nature 2000; 403: 216–20. 28. Krawczyk C, Bachmaier K, Sasaki T, et al. Cbl-b is a negative regulator of receptor clustering and raft aggregation in T cells. Immunity 2000; 13: 463–73. |