| |
| Med Sci (Paris). 2003 March; 19(3): 278–281. Published online 2003 March 15. doi: 10.1051/medsci/2003193278.Les vagues calciques entre cellules gliales : une voie alternative de transmission d’informations Christian Giaume,1* Laurent Venance,1 and Thomas Höfer2 1Inserm U.114, Collège de France, 11, place Marcelin Berthelot, 75005 Paris, France 2Theoretische Biophysik, Humbold-Universität Berlin, 10115 Berlin, Allemagne MeSH keywords: Astrocytes, Calcium, Canaux calciques, Communication cellulaire, Membrane cellulaire, Humains, Transduction du signal |
La possibilité de suivre la signalisation calcique en temps réel, par des techniques d’imagerie associées à des sondes fluorescentes, a beaucoup contribué à la compréhension du rôle des astrocytes, la population de cellules gliales majoritaire du système nerveux central. En effet, la mesure des variations de la concentration du calcium intracellulaire démontre que les astrocytes, cellules non excitables, sont non seulement capables de recevoir et d’intégrer des informations provenant des neurones, mais également de communiquer entre eux et avec d’autre types cellulaires, en particulier les neurones ou les cellules endothéliales [
1,
2]. Ainsi, l’augmentation de la concentration de calcium intracellulaire induite par la stimulation d’un astrocyte se propage dans plusieurs dizaines d’astrocytes voisins. Alors que les premières descriptions de ces « vagues calciques » intercellulaires avaient été faites in vitro à partir des cultures primaires d’astrocytes et des co-cultures de neurones et d’astrocytes, leur existence a été récemment démontrée dans des préparations de rétine intacte et sur des coupes de cerveau [
3,
4]. La connaissance détaillée des mécanismes de déclenchement et de propagation de ces vagues calciques intercellulaires, ainsi que leur modélisation, constituent une étape indispensable à la compréhension du rôle de ce phénomène dans la physiopathologie du système nerveux central. |
Mécanismes cellulaires impliqués dans le déclenchement et la propagation des vagues calciques Les vagues calciques intercellulaires ont été décrites dans une grande variété de types cellulaires issus de différents tissus (foie, coeur, épithéliums, système nerveux). Dans les astrocytes, les stimulations mécaniques ou électriques d’une seule cellule induisent des vagues calciques qui se propagent de manière concentrique sur plusieurs centaines de micromètres. En revanche, des applications focales de neurotransmetteurs déclenchent des vagues qui suivent des circuits préférentiels n’impliquant pas nécessairement la totalité des astrocytes [
5]. Par ailleurs, dans des tranches d’hippocampe, la stimulation d’afférences neuronales est capable d’induire la propagation de vagues calciques dans les astrocytes [
6]. Ces observations indiquent qu’un certain degré de spécificité dans la signalisation calcique intercellulaire intervient et qu’elle peut être déclenchée par l’activité des neurones. Dans toutes ces études, la vitesse de propagation des vagues est de l’ordre de 15 à 30 µm/s, ce qui en fait un mode de signalisation de cinétique « lente » comparé à la propagation d’un influx nerveux (> 1 m/s), mais du même ordre de grandeur que la propagation de signaux calciques intracellulaires le long des dendrites des neurones (60 à 90 µm/s) [
7]. Il est désormais admis qu’en dépit du terme de « vagues calciques », il s’agit en fait de vagues d’inositol triphosphate (IP3) provoquant de proche en proche, dans la même cellule ou dans deux cellules adjacentes, des augmentations de la concentration intracellulaire de calcium. En effet, le rayon de diffusion moyen de l’IP3 dans le cytoplasme est supérieur à celui des ions calcium libres [
8]. Les cellules gliales, et plus particulièrement les astrocytes, sont caractérisées par une forte expression des protéines des canaux intercellulaires qui constituent les jonctions communicantes (gap junctions), permettant la formation d’un réseau de type syncytial, dynamique et modulable [
9]. La perméabilité à l’IP3 de ces canaux jonctionnels et la réduction de l’étendue des vagues calciques en présence d’inhibiteurs de la communication jonctionnelle indiquent que ces jonctions communicantes sont impliquées dans la propagation des vagues calciques [5]. Cependant, un autre mécanisme de communication intercellulaire existe qui permet la propagation de vagues calciques entre les astrocytes même lorsqu’ils sont séparés par une zone dépourvue de cellules [9]. C’est l’ATP qui joue ce rôle de messager extracellulaire, comme l’atteste la visualisation en temps réel, par bioluminescence, de la libération de cette molécule dans l’espace extracellulaire [
10]. Selon les préparations étudiées et les modes de déclenchement de l’augmentation de la concentration intracellulaire de calcium, on observe soit la coexistence de ces deux voies (IP3 et ATP), soit la prédominance de l’une sur l’autre. Par ailleurs, l’augmentation de la concentration de calcium intracellulaire dans les astrocytes peut provoquer la libération de glutamate, qui ne participerait pas directement au mécanisme de propagation des vagues calciques entre les astrocytes, mais pourrait agir sur l’activité neuronale [1]. Ainsi, la signalisation calcique apparaît comme un mécanisme complexe faisant intervenir plusieurs modalités d’interaction cellulaire: l’IP3 (au niveau intracellulaire) et l’ATP (au niveau extracellulaire) seraient impliqués dans la signalisation entre les astrocytes eux-mêmes, alors que le glutamate serait impliqué dans la signalisation entre les astrocytes et les neurones. |
Modélisation du mécanisme de propagation intercellulaire La propagation des vagues calciques ne peut être attribuée seulement à une diffusion passive au travers des canaux des jonctions communicantes ou à la libération d’un facteur extracellulaire à partir de la seule cellule stimulée. L’existence d’un phénomène complètement régénératif est également exclue puisque les vagues ne se propagent pas indéfiniment. Récemment, à partir de données expérimentales obtenues à partir de cultures d’astrocytes de striatum de rat, un modèle mathématique a été élaboré qui permet de rendre compte des étapes intra- et intercellulaire impliquées dans l’induction et la propagation des vagues calciques après blocage par des inhibiteurs des jonctions communicantes [5,
11]. Les étapes considérées sont : (1) la production d’IP3 dans la cellule stimulée; (2) sa diffusion intercellulaire au travers des canaux jonctionnels; (3) la libération de calcium par l’IP3 à partir des réserves intracellulaires du réticulum endoplasmique ; et (4) l’activation, par le calcium ainsi libéré, de la phospholipase C de type δ (PLCδ), dont l’activité dépendante du calcium produit à nouveau de l’IP3 qui va à son tour diffuser dans les cellules voisines via les jonctions communicantes (Figure 1). Cette séquence d’événements est reproduite jusqu’à ce que la quantité d’IP3 disponible ne soit plus suffisante (en raison du nombre croissant de cellules réceptrices) pour élever la concentration de calcium intracellulaire au niveau requis pour l’activation de la PLCδ dans les cellules réceptrices [11]. Le modèle mathématique proposé est donc principalement fondé sur la diffusion d’IP3 au travers des jonctions communicantes et l’activation de proche en proche de la PLCδ Ainsi, dans le phénomène de propagation des vagues calciques, la PLCδ agirait comme le moteur, l’IP3 et le calcium comme le carburant, et les jonctions communicantes et les stocks calciques intracellulaires comme des freins, c’est-à-dire des éléments limitants et régulateurs. L’intérêt principal de ce modèle est de pouvoir rendre compte d’un mécanisme intercellulaire semi-régénératif caractérisé par une propagation limitée des vagues calciques dans l’espace. En introduisant dans ce système une hétérogénéité de distribution des jonctions communicantes, il est possible de produire, à partir du modèle proposé, une propagation asymétrique des vagues calciques semblable aux circuits préférentiels n’impliquant que certaines cellules, telles qu’ils ont été observés expérimentalement [5]. Enfin, ce modèle pourrait également rendre compte de la composante extracellulaire de la vague de propagation. Dans ce cas, l’activation de récepteurs purinergiques de type métabotropique couplés à des systèmes de transduction, notamment la PLC de type β, qui provoque une augmentation de la concentration du calcium intracellulaire, induirait la libération de l’ATP dans le milieu extracellulaire. Néanmoins, un tel modèle suppose que la libération d’ATP serait directement liée à l’augmentation de la concentration de calcium intracellulaire, une étape qui reste à démontrer expérimentalement. L’intérêt du modèle proposé est qu’il permet de réaliser de la pharmacologie in silico afin de vérifier l’impact de chacun des éléments et des étapes impliqués (enzymes, transporteurs, pompes, récepteurs, canaux ioniques, stocks intracellulaires de calcium…) dans la propagation de cette signalisation calcique intercellulaire [11].
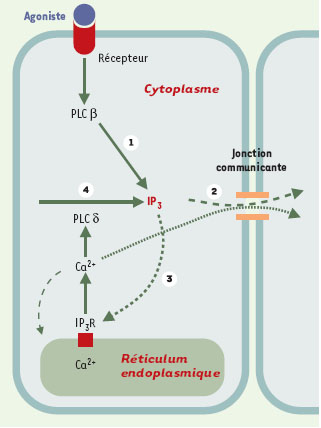
 | Figure 1.
Schéma des étapes dynamiques intra- et intercellulaires intervenant dans le modèle de propagation des vagues calciques intercellulaires. La cellule de gauche représente l’astrocyte à partir duquel est initiée la vague calcique, celle de droite un astrocyte dans lequel se propage la vague. (1) Un agoniste active des récepteurs membranaires couplés à la PLCβ (phospholipase Cβ) dont l’activité produit de l’IP 3 (inositol triphosphate); (2) une partie de l’IP 3 diffuse à travers les jonctions communicantes dans la cellule voisine, tandis que l’autre partie active des récepteurs de l’IP 3 (IP 3R) situés sur le réticulum endoplasmique qui libérent du calcium à partir de ces stocks intracellulaires; (3) et (4) cette augmentation de calcium active la PLCδ qui produit à son tour de l’IP 3 qui va passer dans les cellules voisines par les jonctions communicantes (d’après [ 11]). PLC: phospholipase C; IP 3: inositol triphosphate. |
|
Rôles des vagues calciques inter-astrocytaires Les rôles potentiels des vagues calciques intercellulaires sont sans doute multiples et dépendent des situations physiopathologiques dans lesquelles les cellules sont impliquées. Au niveau des astrocytes eux-mêmes, une augmentation importante de la concentration de calcium intracellulaire lors du « passage » d’une vague calcique pourrait avoir des répercussions sur leur physiologie, aussi bien à court terme, par exemple par activation transitoire des canaux ioniques dépendant du calcium, qu’à long terme, des élévations répétées de la concentration de calcium intracellulaire conduisant éventuellement à l’activation transcriptionnelle de gènes spécifiques. La propagation des vagues calciques dans les astrocytes constituerait un élément essentiel pour la communication entre réseaux neuronaux et gliaux, que le contact intercellulaire soit direct ou indirect. En effet, il a été démontré que l’activité neuronale induit des réponses calciques dans les astrocytes et qu’à l’inverse, des augmentations de la concentration de calcium intracellulaire dans les astrocytes provoquent des modifications d’activité des neurones [1]. Ces interactions réciproques peuvent, bien entendu, s’envisager à l’échelle d’un neurone et d’un astrocyte, mais la démonstration de l’existence de vagues calciques intercellulaires permet désormais de les proposer dans un contexte plus large (Figure 2). Ainsi l’induction d’une vague calcique par un groupe de neurones conduirait à l’activation d’un autre groupe de neurones indépendants du premier, à distance, via les réseaux astrocytaires. Ces interactions font sans doute intervenir plusieurs des mécanismes intercellulaires cités plus haut, une telle diversité permettant d’envisager l’existence d’une spécificité et d’une plasticité dans les interactions entre les deux types de réseaux.
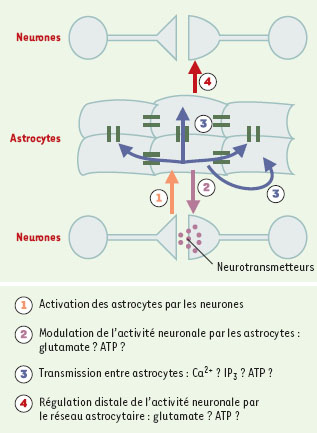
 | Figure 2.
Représentation schématique des différentes modalités d’interaction entre les neurones et le réseau astrocytaire.
|
Les vagues calciques observées en culture ou sur des sections de tissus impliquent la participation de plusieurs dizaines d’astrocytes. Aussi in vivo, dans un contexte plus intégré, il est probable que le nombre de neurones affectés par ces vagues leur soit proportionnel. De plus, du fait des relations étroites qui existent entre les astrocytes et les capillaires cérébraux, on peut envisager que les cellules endothéliales sont également concernées par ce mode de communication. Par conséquent, cette modalité de signalisation inter-astrocytaire pourrait concerner les interactions liées à l’activité neuronale, mais également d’autres fonctions attribuées aux astrocytes et aux cellules endothéliales comme l’homéostasie extracellulaire ou le fonctionnement de la barrière hémato-encéphalique. Par ailleurs, il existe déjà des pistes suggérant leur implication (cause ou conséquence?) dans plusieurs situations pathologiques comme les décharges épileptiques ou la « dépression envahissante » (spreading depression), qui correspond à la propagation d’une dépolarisation suivie d’une suppression de l’activité neuronale observée lors d’une ischémie ou d’une lésion traumatique [
12]. La compréhension de la régulation de l’étendue des vagues calciques dans les astrocytes s’avère donc cruciale pour la définition du rôle de ces cellules gliales. Dans ce contexte, l’identification des étapes intra- et intercellulaires et la modélisation du mécanisme de propagation permettront de mieux définir la contribution de la glie dans le fonctionnement du cerveau, que ce soit dans des conditions normales ou pathologiques. En effet, grâce au modèle proposé, il est désormais possible de simuler des altérations de chacune des étapes clés de ce processus et d’observer leur incidence sur le comportement général d’un réseau astrocytaire. |
1. Haydon PJ. Glia: listening and talking to neurons. Nat Rev Neurosci 2001; 2: 185–93. 2. Zonta M, Angulo MC, Gobbo S, et al. Neuron-toastrocyte signaling is central to the dynamic control of brain microcirculation. Nat Neurosci 2003; 6 : 43–50. 3. Newman EA, Zahs KR. Calcium waves in retinal glial cells. Science 1997; 275: 844–7. 4. Schipke CG, Boucsein C, Ohlemeyer C, et al. Astrocyte Ca2+ waves trigger responses in microglial cells in brain slices. FASEB J 2002; 16: 255–7. 5. Venance L, Stella N, Glowinski J, Giaume C. Mechanism of initiation and propagation of receptorinduced intercellular calcium signaling in cultured rat astrocytes. J Neurosci 1997; 17: 1981–92. 6. Dani JW, Chernjavsky A, Smith SJ. Neuronal activity triggers calcium waves in hippocampal astrocytes networks. Neuron 1992; 8: 429–40. 7. Nakamura T, Lasser-Ross N, Nakamura K, Ross WN. Spatial segregation and interaction of calcium signalling mechanisms in rat hippocampal CA1 pyramidal neurons. J Physiol (Lond) 2002; 543: 465–80. 8. Allbritton NL, Meyer T, Stryer L. Range of messenger action of calcium ion and inositol 1,4,5-trisphosphate. Science 1992; 258: 1812–5. 9. Giaume C, McCarthy KD. Control of junctional communication in astrocytic networks. Trends Neurosci 1996; 19: 83–104. 10. Hassinger TD, Guthrie PB, Atkinson PB, et al. An extracellular component in propagation of astrocytic calcium waves. Proc Natl Acad Sci USA 1996; 93: 13268–73. 11. Höfer T, Venance L, Giaume C. Control and plasticity of intercellular calcium waves in astrocytes: a modeling approach. J Neurosci 2002; 22: 4850–9. 12. Charles A, Giaume C. Intercellular calcium waves in astrocytes: underlying mechanisms and functional significance. In: Volterra A, Haydon P, Magistretti P, eds. Tripartite synapses: synaptic transmission in glia. New York: Oxford University Press, 2002 : 110–26. |