| |
| Med Sci (Paris). 2003 March; 19(3): 358–363. Published online 2003 March 15. doi: 10.1051/medsci/2003193358.Les protéines Rho : leur rôle dans les neurones Céline Ménager* and Kozo Kaibuchi Department of Cell Pharmacology, Nagoya University Graduate School of Medicine, 65 Tsurumai, Showa-ku, Nagoya, Aichi 466-8550, Japon |
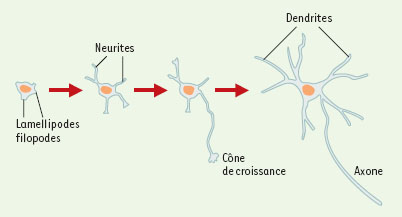
L’établissement de la polarité neuronale (Figure 1), qui se traduit par la formation de prolongements différenciés, est lié à des modifications du cytosquelette constitué d’actine, de microtubules et de filaments intermédiaires. Dans le neurone, la colchicine, inhibiteur de la polymérisation des microtubules, empêche l’élongation de l’axone et des dendrites, alors que la cytochalasine D, agent dépolymérisant l’actine, supprime la motilité du cône de croissance et entraîne une élongation des neurites. Ces résultats montrent l’importance dans les neurites en développement, de la polymérisation des microtubules et des réarrangements rapides des filaments d’actine intervenant au niveau des filopodes et des lamellipodes des cônes de croissance.
 | Figure 1.
Établissement de la polarité neuronale in vitro. Dans les neurones en culture, immédiatement après l’attachement au substrat, on observe la formation de lamellipodes puis l’apparition des prolongements non différenciés, les neurites. L’un de ces neurites, le futur axone, va croître plus rapidement: le neurone acquiert sa polarité. Le développement des dendrites et de l’axone se poursuit alors jusqu’à la maturité. |
La motilité du cône de croissance est également essentielle. En effet, pour être fonctionnel, un neurone doit établir des connexions avec des cellules cibles parfois très éloignées. Le cône de croissance, soumis à différents phénomènes d’attraction/répulsion (attraction de contact et chimio-attraction, répulsion de contact et chimiorépulsion [
1–
3]), pilote vers sa cible le neurite en extension, en alternant élongation et rétraction des filopodes et des lamellipodes. Des études réalisées in vitro sur des cellules fibroblastiques animales ont mis en évidence le rôle des protéines Rho dans la réorganisation du cytosquelette d’actine, notamment au cours de la formation de structures transitoires observées dans les processus d’adhérence et de migration cellulaire [
4,
5]. Plus récemment, des études menées in vivo et in vitro sur des neurones ont suggéré l’importance des protéines Rho dans la régulation de la croissance des neurites. |
Les protéines Rho appartiennent à la superfamille des petites GTPases Ras; les plus connues sont RhoA, Rac1 et Cdc42. De mode d’action identique aux protéines Ras, les protéines Rho existent sous deux formes distinctes, l’une active se liant au GTP et l’autre inactive se liant au GDP. Le changement de configuration est réglé, d’une part, par des protéines RhoGEF (guanine nucleotide exchange factor), qui sont des facteurs d’échange favorisant la dissociation du GDP et la liaison du GTP aux protéines Rho et, d’autre part, par des protéines GDI (GDP dissociation inhibitor) et RhoGAP (GTPases activating protein) qui favorisent le retour des protéines Rho à leur état inactif. Les différentes protéines Rho impliquées dans la réorganisation du cytosquelette d’actine ont largement été étudiées dans les fibroblastes: Cdc42 et Rac1 jouent respectivement un rôle dans la formation des filopodes et des lamellipodes, tandis que RhoA intervient essentiellement dans la formation des fibres de tension et des plaques d’adhérence [4, 5] (→). (→) m/s 2001, n° 8-9, p. 878
|
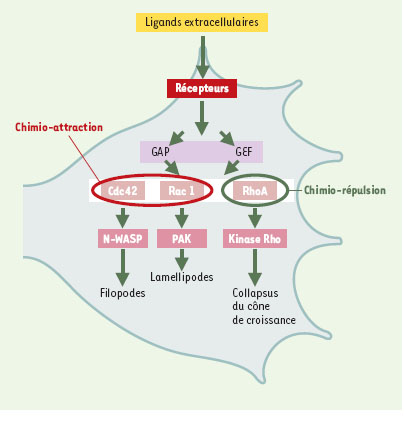
Les protéines Rho au niveau du cône de croissance Différents signaux extracellulaires agissent sur l’activation des protéines Rho. Les signaux attractifs activent Rac1 et Cdc42, avec pour conséquence une formation des filopodes et des lamellipodes, tandis que les signaux répulsifs, en activant RhoA, entraînent la rétraction de ces structures et vraisemblablement le collapsus (rétraction subite, avec perte de motilité) du cône de croissance (Figure 2).
 | Figure 2.
Voies de signalisation faisant intervenir les GTPases Rho dans la régulation de la mobilité du cône de croissance. Cdc42 et Rac1 sont sous le contrôle de signaux extracellulaires attractifs, tandis que RhoA est sous le contrôle de signaux répulsifs. L’association de ligands extracellulaires et de leurs récepteurs entraîne, via les protéines de régulation GEF (guanine nucleotide exchange factor) ou GAP (GTPaseactivating protein), l’activation ou l’inhibition des protéines Rho. L’activation de RhoA permet celle de la protéine Rho-kinase, provoquant le collapsus du cône de croissance qui peut éventuellement aboutir au phénomène d’évitement observé en présence d’agents chimiorépulsifs. À l’inverse, l’activation de Cdc42 et de Rac1 via celle de N-WASP (Wiskott-Aldrich syndrome protein) et PAK (serine-threonine kinase p21-activated kinase) induit la formation de filopodes et de lamellipodes qui vont autoriser la croissance axonale et le phénomène d’attraction en réponse à un signal attractif. |
In vivo, chez la drosophile, Caenorhabditis elegans ou bien encore chez la souris, l’expression des formes constitutivement actives ou dominantes négatives des protéines Rac1 et Cdc42 provoque des défauts du guidage axonal. De plus, il a récemment été montré que l’éphrine A5, un chimiorépulsif, entraîne le collapsus du cône de croissance via son activation de RhoA et son inhibition de Rac [
6]. Cette observation renforce l’hypothèse selon laquelle un signal répulsif extracellulaire que l’on sait impliqué dans le guidage axonal module directement l’activité des protéines Rho. |
Au niveau de l’axone et des dendrites L’effet des protéines Rho sur la croissance axonale dépend de leur nature: Cdc42 et Rac1 induisent la croissance des neurites, alors que RhoA l’inhibe. In vivo, chez la drosophile [
7] et chez la souris [
8], Rac1 est requise pour la croissance axonale, tandis que Cdc42 intervient au niveau de la migration neuronale et de la croissance des axones et des dendrites. Les formes dominantes négatives et constitutivement actives de Rac1 induisent d’une façon similaire une anomalie de croissance de l’axone durant son développement. L’une des explications possibles est que la forme GTP-Rac favorise la polymérisation de l’actine, comme le fait la forme constitutivement active, alors que GDP-Rac1, à qui correspond la forme dominante négative, favorise directement ou indirectement la dépolymérisation de l’actine. Puisque la croissance d’un axone nécessite une alternance entre polymérisation et dépolymérisation, en bloquant ce cycle par l’une ou l’autre forme de Rac1, la croissance axonale se trouverait bloquée. Des études réalisées in vivo sur des cellules de Purkinje de souris montrent que l’expression de la forme active de Rac1 induit un déficit des terminaisons pré-synaptiques, mais que l’arbre dendritique présente une taille normale et de nombreux embranchements [8]. L’effet des GTPases semble donc différer selon le type de compartiment neuronal. Les formes activées de Rac et de Cdc42 régleraient l’actine et favoriseraient la formation de filopodes et de lamellipodes dans le cône de croissance du futur axone, facilitant ainsi la croissance du neurite. Dans les autres cônes de croissance du même neurone, Rac et Cdc 42 resteraient dans un état inactif (liées au GDP), alors qu’il y aurait une concentration relativement forte en Rho activée (liée au GTP) qui inhiberait l’élongation des neurites. Il faut également noter que Rac1 est susceptible, dans certaines conditions, d’induire le collapsus des cônes de croissance [
9,
10]. En utilisant des molécules comme la collapsine-1 ou la sémaphorine-3, connues pour inhiber la croissance axo-nale en induisant le collapsus des cônes de croissance, Jin et al. ont montré, dans les neurites de DRG (dorsal root ganglia) de poussins, que RhoA et Rac1 modulaient la croissance des neurites et que l’activation de Rac1 était l’une des clés de la cascade d’événements conduisant au collapsus [9]. En effet, le collapsus du cône de croissance induit par la sémaphorine-3 est bloqué par l’expression de la forme inactive de Rac1 [9], et plus précisément par les acides aminés 17-32 de Rac1 [10]. L’expression de la forme dominante négative de RhoA et l’ajout de la toxine botulinique C3, inhibiteur de RhoA, induisent la croissance de neurites, voire la régénération de l’axone dans les neurones du système nerveux central. C’est le cas chez le rat: 2 semaines après lésion du nerf optique et traitement avec C3, de nombreux axones sont régénérés et traversent le site de lésion [
11]. Inversement, l’activation de RhoA par l’acide lysophosphatidique ou la thrombine provoque le collapsus des cônes de croissance et la rétraction des neurites. Le rôle de RhoA, Rac1 et Cdc42 dans l’élaboration de l’arbre dendritique a été étudié dans différents systèmes, in vivo comme in vitro. Même si les résultats obtenus sont parfois différents d’une étude à l’autre, ils suggèrent toutefois que Rac1 et Cdc42 favorisent la croissance des dendrites, alors que RhoA l’inhibe. De plus, Rac1 intervient au niveau du développement des épines dendritiques [8] et contribue à la plasticité neuronale en favorisant le remodelage dendritique, alors que RhoA l’inhibe. |
Effet des activateurs et des inhibiteurs de Rho Parmi les protéines RhoGEF, activatrices des protéines Rho, la plus étudiée dans le contexte du guidage axonal est certainement la protéine Trio (→). Les résultats d’études menées chez la drosophile et chez C. elegans suggèrent que Trio règle la croissance et le guidage axonal en activant Rac1 via son domaine GEF1 et limite le développement des dendrites en activant Rho via son domaine GEF2 [
12]. Une autre protéine GEF, Tiam1 (T-lymphoma invasion and metastasis inducing protein 1), activatrice de Rac1, a récemment été impliquée dans la formation et la polarisation de l’axone. La surexpression de cette protéine conduit à l’apparition de plusieurs neurites ressemblant à des axones, tandis que sa suppression entraîne une inhibition de la formation de l’axone [
13]. (→) m/s 2001, n° 12, p. 1316
Quelques études ont montré le rôle spécifique des protéines de régulation RhoGAP dans le contrôle de la croissance axonale. Brouns et al. [
14] ont ainsi étudié l’effet de p190 RhoGAP (Rho family GTPase-activating protein), régulatrice de RhoA: les souris déficientes pour ce facteur présentent des défauts au niveau du guidage axonal et de la fasciculation (tendance qu’ont les neurites en développement à croître le long de neurites préexistants). Dans les neuroblastes, la surexpression de p190 RhoGAP induit, quant à elle, la croissance des neurites, d’une façon qui dépend de la présence de laminine, protéine de la matrice extracellulaire. Le facteur p190 RhoGAP pourrait être un régulateur clé de RhoA, en réponse à l’adhérence des neurones à la matrice extracellulaire. |
Protéines Rho et effecteurs : effet sur le cytosquelette d’actine Les voies de signalisation par lesquelles les GTPases Rho exercent une régulation sur le cytosquelette d’actine ont été largement étudiées [
15]. L’un des effecteurs de Cdc42, N-WASP (Wiskott-Aldrich syndrome protein), essentiel pour la formation des filopodes induite par Cdc42 dans les fibroblastes, est particulièrement présent dans le système nerveux. N-WASP se lie au complexe Arp 2/3 (actin-related protein 2/3), stimulateur de la nucléation des filaments d’actine (→).
(→) m/s 1996, n° 10, p. 1173
Une autre voie de signalisation associant Rac1 et Cdc42 à la réorganisation de l’actine implique leur effecteur commun, la protéine PAK (serine-threonine kinase p21-activated kinase), dont l’activation s’effectue par l’intermédiaire de la liaison des formes GTP de Cdc42 ou Rac1 à son domaine CRIB (Cdc42/Racinteractive binding). Dans les neuroblastes, l’expression de la protéine PAK5, spécifique du cerveau, induit des prolongements semblables aux neurites, alors que l’expression de sa forme dominante négative inhibe leur croissance [
16]. Dans les photorécepteurs de drosophile, des mutations entraînant une perte de fonction de PAK1 provoquent des défauts dans le guidage axonal [
17,
18]. PAK possède plusieurs cibles, dont la LIM kinase (Lim-11, Isl-1, Mec-3 domains kinase) et la MLCK (myosin light chain kinase). La LIM kinase activée par PAK inhibe la cofiline par phosphorylation, réduisant ainsi le recyclage des filaments d’actine. Une inhibition globale de la cofiline aboutirait probablement à réduire la motilité, mais une inhibition locale peut être le moyen de redistribuer l’actine du cône de croissance. PAK agit également sur la MLCK en l’inhibant, ce qui résulte en une diminution de la phosphorylation de la chaîne légère de myosine et, par conséquent, en une diminution de la contractilité de l’actomyosine. Sachant que la phosphorylation de la myosine induit la rétraction des neurites [
19], PAK, via son effet inhibiteur sur la MLCK, est susceptible d’agir en inhibant la rétraction des neurites. La rétraction des neurites induite par RhoA pourrait être liée à une contraction du système cortical d’actomyosine. En accord avec cette hypothèse, l’action de RhoA sur la Rho-kinase permet l’activation de la myosine II, ce qui induit la rétraction des neurites [19]. Un autre substrat de la Rho-kinase est la protéine CRMP- 2 (collapsin response mediator protein-2) [
20], dont la surexpression induit la formation d’axones surnuméraires [
21], vraisemblablement via les microtubules. |
Protéines Rho et nerve growth factor (NGF) Les relations entre le NGF (nerve growth factor) et les protéines Rho ont été particulièrement étudiées dans les cellules PC12 dérivées d’un phéochromocytome murin, cellules qui ont la particularité d’émettre des neurites en présence de NGF. Yamaguchi et al. ont montré l’activation rapide de Rac1 et l’inhibition de l’activité de RhoA en réponse au NGF [
22]. L’expression de la forme constitutivement active de RhoA inhibe la formation de neurites [
23] et diminue l’activation de Rac1 en réponse au NGF [22]. L’expression de RhoA dominant négatif, au contraire, induit la formation de neurites et l’augmentation du nombre d’embranchements. Dans les neurones trigéminaux (assurant l’innervation sensorielle du visage et de la muqueuse buccale, ainsi que l’innervation motrice des muscles de la mastication), la forme dominante négative de Rac1, de même que la forme constitutivement active de RhoA, inhibent la croissance de l’axone induite par le NGF, tandis que l’expression de la forme active de Rac1 ou de la forme dominante négative de RhoA la stimule [
24]. Ces résultats montrent l’importance des protéines Rho dans la formation des neurites et dans la différenciation axonale en réponse au NGF, RhoA et Rac1 présentant des effets opposés. D’une manière générale, les données présentées ici soulignent le rôle des GTPases Rho dans la formation, le guidage et le développement des neurites. |
Protéines Rho et trafic membranaire La localisation de certaines des GTPases Rho telles que Cdc42 dans l’appareil de Golgi et Rho B aux niveaux endosomique et lysosomique suggère un rôle possible de ces protéines dans l’endocytose et l’exocytose [
25]. Peu de travaux ont été effectués dans les neurones. Toutefois, dans le cerveau de rat, les protéines Rac1, RhoA, RhoB et Cdc42 sont présentes dans les terminaisons pré-synaptiques. Rac1 est ainsi associée aux vésicules synaptiques, tandis qu’elle intervient dans l’exocytose dépendante du calcium [
26] dans les neurones de l’Aplysie. Dans les cellules PC12, RhoA, Rac1 et Cdc42 sont impliquées dans le phénomène de sécrétion induite par des stimulus [
27]. Ce rôle des GTPases Rho dans le trafic membranaire est en accord avec les hypothèses actuelles selon lesquelles les protéines Rho interviennent dans la régulation du cytosquelette d’actine [4, 5], qui contribue très certainement à la motilité des vésicules sécrétrices. |
Protéines Rho et maladies neurologiques/neurodégénératives Chez l’homme, les protéines Rho semblent jouer un rôle dans certaines maladies neurologiques telles que le retard mental lié à l’X. Ainsi, Billuart et al. [
28] ont identifié, chez des sujets présentant un retard mental lié à l’X, des mutations du gène de l’oligophrénine qui entraînent une perte de fonction de cette protéine RhoGAP. Il est probable que l’activation constitutive des protéines Rho par inhibition de l’hydrolyse du GTP affecte la migration cellulaire et la croissance axonale et dendritique. De façon similaire, des mutations du gène de la protéine PAK3, effecteur de Rac1 et Cdc42, sont associées au retard mental lié à l’X [
29], soutenant l’hypothèse d’une intervention des protéines Rho dans la physiopathologie de certaines affections neurologiques. Les protéines Rho semblent également intervenir dans les maladies neurodégénératives. Ainsi, dans la maladie d’Alzheimer, la protéine kinase PKN, effecteur direct de RhoA, jouerait un rôle dans la formation des NFT (neurofibrillary tangles) et dans la dégénérescence des neurones [
30]. Il a également été montré qu’une autre kinase, la glycogène synthétase kinase-3 (GSK-3), intervient dans la maladie d’Alzheimer ; or, son activité est augmentée au cours du collapsus des cônes de croissance induit par l’acide lysophosphatidique, phénomène qui, là encore, fait intervenir les protéines Rho. Ces études suggèrent l’intervention des protéines Rho dans le développement et le fonctionnement neuronal in vivo, chez l’homme. |
Les protéines Rho, qui sont d’importants régulateurs du cytosquelette d’actine, apparaissent également impliquées dans le développement neuronal, et plus particulièrement dans la régulation de la croissance axonale (guidage et élongation) et dendritique. D’autres études sont nécessaires pour mieux comprendre leur rôle. Plusieurs orientations peuvent être envisagées. Il semble, par exemple, utile d’approfondir les connaissances sur les voies de signalisation en amont et en aval des protéines Rho, les interactions éventuelles des protéines entre elles et l’ampleur du rôle des protéines Rho dans le développement neuronal, ainsi que dans la migration, le fonctionnement et la survie des neurones. Par ailleurs, élucider le mécanisme d’action des GTPases Rho dans les neurones pourrait conduire à des applications cliniques. Par exemple, de nombreux inhibiteurs de croissance bloquent le développement de l’axone après lésion de la moelle épinière ; l’inhibition de RhoA pourrait permettre une régénération de l’axone, comme le suggèrent les travaux de Lehmann et al. [11] menés in vivo sur le nerf optique. |
1. Tessier-Lavigne M, Goodman CS. The molecular biology of axon guidance. Science 1996; 274: 1123–33. 2. Skutella T, Nitsch R. New molecules for hippocampal development. Trends Neurosci 2001; 24: 107–13. 3. Song H, Poo M. The cell biology of neuronal navigation. Nat Cell Biol 2001; 3: E81–8. 4. Nobes CD, Hall A. Rho, Rac and cdc42 GTPases: regulators of actin structures, cell adhesion and motility. Biochem Soc Trans 1995; 23: 456–9. 5. Nobes CD, Hall A. Rho, Rac, and cdc42 GTPases regulate the assembly of multimolecular focal complexes associated with actin stress fibers, lamellipodia, and filopodia. Cell 1995; 81: 53–62. 6. Wahl S, Barth H, Ciossek T, Aktories K, Mueller BK. Ephrin-A5 induces collapse of growth cones by activating Rho and Rho kinase. J Cell Biol 2000; 149: 263–70. 7. Luo L, Liao YJ, Jan LY, Jan YN. Distinct morphogenetic functions of similar small GTPases: Drosophila Drac1 is involved in axonal outgrowth and myoblast fusion. Genes Dev 1994; 8: 1787–802. 8. Luo L, Hensch TK, Ackerman L, Barbel S, Jan LY, Jan YN. Differential effects of the Rac GTPase on Purkinje cell axons and dendritic trunks and spines. Nature 1996; 379: 837–40. 9. Jin Z, Strittmatter SM. Rac1 mediates collapsin-1- induced growth cone collapse. J Neurosci 1997; 17: 6256–63. 10. Vastrik I, Eickholt BJ, Walsh FS, Ridley A, Doherty P. Sema3A-induced growthcone collapse is mediated by Rac1 amino acids 17–32. Curr Biol 1999; 9: 991–8. 11. Lehmann M, Fournier A, Selles-Navarro I, et al. Inactivation of Rho signaling pathway promotes CNS axon regeneration. J Neurosci 1999; 19: 7537–47. 12. Dickson BJ. Rho GTPases in growth cone guidance. Curr Opin Neurobiol 2001; 11: 103–10. 13. Kunda P, Paglini G, Quiroga S, Kosik K, Caceres A. Evidence for the involvement of Tiam1 in axon formation. J Neurosci 2001; 21: 2361–72. 14. Brouns MR, Matheson SF, Settleman J. p190 RhoGAP is the principal Src substrate in brain and regulates axon outgrowth, guidance and fasciculation. Nat Cell Biol 2001; 3: 361–7. 15. Kaibuchi K, Kuroda S, Amano M. Regulation of the cytoskeleton and cell adhesion by the Rho family GTPases in mammalian cells. Annu Rev Biochem 1999; 68: 459–86. 16. Dan C, Nath N, Liberto M, Minden A. PAK5, a new brain-specific kinase, promotes neurite outgrowth in N1E-115 cells. Mol Cell Biol 2002; 22: 567–77. 17. Hing H, Xiao J, Harden N, Lim L, Zipursky SL. PAK functions downstream of Dock to regulate photoreceptor axon guidance in Drosophila. Cell 1999; 97: 853–63. 18. Newsome TP, Schmidt S, Dietzl G, et al. Trio combines with dock to regulate PAK activity during photoreceptor axon pathfinding in Drosophila. Cell 2000; 101: 283–94. 19. Amano M, Chihara K, Nakamura N, et al. Myosin II activation promotes neurite retraction during the action of Rho and Rho-kinase. Genes Cells 1998; 3: 177–88. 20. Arimura N, Inagaki N, Chihara K, et al. Phosphorylation of collapsin response mediator protein-2 by Rho-kinase. Evidence for two separate signaling pathways for growth cone collapse. J Biol Chem 2000; 275: 23973–80. 21. Inagaki N, Chihara K, Arimura N, et al. CRMP-2 induces axons in cultured hippocampal neurons. Nat Neurosci 2001; 4: 781–82. 22. Yamaguchi Y, Katoh H, Yasui H, Mori K, Negishi M. RhoA inhibits the nerve growth factor-induced Rac1 activation through Rhoassociated kinasedependent pathway. J Biol Chem 2001; 276: 18977–83. 23. Sebok A, Nusser N, Debreceni B, et al. Different roles for RhoA during neurite initiation, elongation, and regeneration in PC12 cells. J Neurochem 1999; 73: 949–60. 24. Ozdinler PH, Erzurumlu RS. Regulation of neurotrophininduced axonal responses via Rho GTPases. J Comp Neurol 2001; 438: 377–87. 25. Ridley AJ. Rho proteins: linking signaling with membrane trafficking. Traffic 2001; 2: 303–10. 26. Doussau F, Gasman S, Humeau Y, et al. A Rhorelated GTPase is involved in Ca2+-dependent neurotransmitter exocytosis. J Biol Chem 2000; 275: 7764–70. 27. Frantz C, Coppola T, Regazzi R. Involvement of Rho GTPases and their effectors in the secretory process of PC12 cells. Exp Cell Res 2002; 273: 119–26. 28. Billuart P, Bienvenu T, Ronce N, et al. Oligophrenin-1 encodes a rhoGAP protein involved in X-linked mental retardation. Nature 1998; 392: 923–6. 29. Allen KM, Gleeson JG, Bagrodia S, et al. PAK3 mutation in nonsyndromic Xlinked mental retardation. Nat Genet 1998; 20:25–30. 30. Kawamata T, Taniguchi T, Mukai H, et al. A protein kinase, PKN, accumulates in Alzheimer neurofibrillary tangles and associated endoplasmic reticulumderived vesicles and phosphorylates tau protein. J Neurosci 1998; 18: 7402–10. |