| |
| Med Sci (Paris). 2003 March; 19(3): 364–367. Published online 2003 March 15. doi: 10.1051/medsci/2003193364.Les pinces optiques en biologie et en médecine Catherine Coirault,* Jean-Claude Pourny, Francine Lambert, and Yves Lecarpentier Inserm-Laboratoire d’Optique Appliquée- Ensta-École Polytechnique, Centre de l’Yvette, 91761 Palaiseau Cedex, France |
De la physique des comètes à celle du nanomonde La lumière exerce sur les objets une force appelée pression de radiation. Déjà au XVIIe siècle, Kepler avait déduit que le soleil exerçait une pression sur les particules échappées d’une comète, pression qui provoquait la fuite des particules dans la direction opposée à la position du soleil. Ce n’est qu’avec l’avènement du LASER (light amplification by stimulated emission of radiation), source de lumière cohérente, intense et monochromatique, que l’on a pu envisager l’application de cette force à des objets terrestres microscopiques. Dans les années 1970, A. Ashkin a mis en évidence les déviations d’une bille éclairée par un faisceau laser [
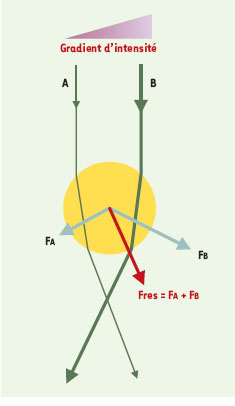
1]. Quelle est la nature physique de la pression de radiation? Une bille de petite taille et transparente réfracte la lumière. Un rayon lumineux traversant cette bille change de direction à son entrée et à sa sortie, ce qui modifie aussi la direction de sa quantité de mouvement photonique (p = h/λ pour un photon, où h est la constante de Planck et λ la longueur d’onde de la lumière). Cette variation de quantité de mouvement est compensée par une force qui s’applique à la bille (Figure 1). Si la bille est placée dans un champ lumineux d’intensité uniforme, les forces produites s’annulent et la bille reste immobile. Si la bille est placée dans un gradient d’intensité lumineuse, la résultante des forces qu’elle subit est une force de rappel qui l’entraîne vers une position stable au centre du faisceau et à proximité du foyer du faisceau (Figure 1). Le déplacement du faisceau lumineux modifie l’équilibre des forces exercées sur la bille, et cette dernière est instantanément déplacée avec le faisceau [1]. La pince optique permet ainsi de maintenir et de déplacer, sans aucun lien matériel, un objet de taille microscopique.
 | Figure 1.
Principe physique de la manipulation optique d’un objet microscopique. Le schema décrit la force optique s’appliquant sur une sphère dans un gradient d’intensité lumineuse. Une bille de taille microscopique (en jaune) est placée dans un faisceau à fort gradient d’intensité lumineuse. Les rayons lumineux incidents (A et B) qui traversent la bille changent de direction à leur entrée et à leur sortie. Les modifications de quantité de mouvement qui en résultent produisent des forces optiques (FA et FB) d’autant plus grandes que l’intensité lumineuse est forte (FB > FA). La force résultante qui s’exerce sur la bille (Fres =FA +FB) tend à attirer la bille dans la direction où la lumière est la plus intense. |
Les lasers utilisés pour produire une pince optique sont des lasers continus de faible puissance (0,1 à 1 Watt). Le choix de la longueur d’onde, comprise entre 950 et 1060 nm, permet de minimiser l’absorption lumineuse par la préparation biologique et donc de limiter les risques de détériorations thermiques ou photochimiques. La force produite par de tels faisceaux laser varie de 0,5 à 50 picoNewtons (pN). |
Domaines potentiels d’application des pinces optiques Ces domaines concernent principalement la manipulation de cellules, l’analyse des propriétés élastiques des matériaux biologiques et la fonction des moteurs moléculaires. Manipulation de cellules et mesure de leurs propriétés motrices Les pinces optiques ont été utilisées pour capturer, sélectionner et déplacer de nombreux types cellulaires ou organismes unicellulaires: bactéries, virus, spermatozoïdes, globules rouges, cellules rétiniennes en culture [ 1]. La sélection et la mise en contact de cellules photosensibles avec des cellules neuronales a permis d’étudier le développement des contacts intercellulaires et la régénération de synapses entre ces deux types cellulaires [
2]. La manipulation optique de cellules mobiles comme les spermatozoïdes pour la mesure de leurs forces de propulsion flagellaire et d’échappement au piège optique constitue un outil diagnostique de certaines stérilités [
3]. L’association pinces et ciseaux optiques pour sélectionner, déplacer et injecter un spermatozoïde directement dans l’ovule a également été proposée [
4]. Analyse des propriétés élastiques des matériaux biologiques En assurant un contrôle précis des forces exercées sur les membranes, les pinces optiques ont contribué à une meilleure connaissance de leurs propriétés visco-élastiques [
5]. Ainsi, les pinces optiques ont permis d’étudier l’élasticité de la membrane du globule rouge et de mieux comprendre comment l’absence ou l’anomalie de certaines proteins membranaires pouvait entraîner une deformation persistante du globule rouge susceptible de favoriser sa destruction prématurée [
6]. Les propriétés visco-élastiques de protéines ou de certains domaines peptidiques ont également été étudiées. Deux microbilles étant fixées à la protéine, la distance et la force exercée sur la molécule sont très précisément contrôlées par les pinces optiques. Ainsi, les relations force-extension de la titine ont été déterminées [
7].Des modifications des propriétés visco-élastiques de cette protéine altèrent les propriétés visco-élastiques du muscle et peuvent contribuer à diminuer la performance dans certaines pathologies musculaires ou cardiaques [
8]. La flexibilité et la résistance à la torsion de brin d’ADN ont également été mesurées, en raison de l’importance de ces propriétés dans la transcription du génome [
9]. Analyse de la fonction des moteurs moléculaires De nombreux moteurs moléculaires, parmi lesquels les kinésines et les myosines, se déplacent de façon linéaire par rapport à une protéine substrat (microtubules ou filaments d’actine). D’autres moteurs, comme ceux des flagelles d’ Escherichia coli ou l’ATP synthase, sont responsables de mouvements de type rotatif. Tous transforment de l’énergie chimique (ATP ou gradient de protons) en énergie mécanique (production d’une force et d’un déplacement). Durant la dernière décennie, l’intégration des résultats de mécanique moléculaire, de génétique et d’études ultrastructurales a donné lieu à de remarquables progrès concernant le fonctionnement des moteurs moléculaires. L’intérêt suscité par les pinces optiques est lié aux possibilitiés d’étude de la fonction des moteurs moléculaires en configuration de molécule unique [
10,
11]. Les kinésines Les kinésines se lient et se déplacent le long de microtubules [
12]. Elles participent à des fonctions aussi vitales pour la cellule que le transport des vésicules et des organites, l’organisation du faisceau mitotique ou la mobilité des chromosomes. Ce sont des molécules dimériques, chaque monomère comprenant un domaine moteur (ou tête), avec un site de fixation de l’ATP et un site de fixation du microtubule, une longue hélice αet un domaine carboxy- terminal. L’une des caractéristiques de la kinésine conventionnelle est la processivité: pendant plus de 50 % du cycle d’interaction, l’une des têtes est attachée au microtubule. Le dispositif utilisé pour mesurer la force et le déplacement élémentaire (ou « pas ») de la kinésine est schématisé sur la partie gauche de la Figure 2 [
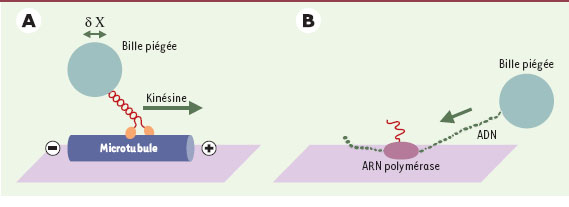
13]. Une bille piégée dans un faisceau lumineux est recouverte de quelques molécules de kinésine et mise en contact avec un microtubule. La pince optique se comportant mécaniquement comme un ressort linéaire, le déplacement de la bille par rapport au centre du piège est proportionnel à la force produite par la molécule de kinésine. Une pince de faible rigidité (≈ 0,02 pN/nm) est utilisée lorsque l’on veut mesurer le déplacement élémentaire de la kinésine à charge nulle. La force maximale est mesurée en utilisant une pince optique plus rigide.
 | Figure 2.
Schéma de la pince optique permettant l’étude d’un moteur moléculaire tel que la kinésine ou l’ARN polymérase II. A. La kinésine, un dimère comportant deux domaines moteurs globulaires (en orange) et une longue hélice α (en rouge) se lie et se déplace de façon processive le long de microtubules (en bleu). La manipulation par une pince optique et l’analyse des déplacements d’une bille fixée sur l’hélice α de la kinésine permettent de mesurer la force et le déplacement produits par une molécule de kinésine. B. L’ARN polymérase II fixée à la surface d’une lamelle induit la transcription de l’ADN (en vert) en ARN messager (en rouge). L’énergie de chaque cycle d’interaction entre l’enzyme et son substrat est fournie par l’hydrolyse d’une molécule d’ATP. La kinésine et l’ARN polymérase effectuent un grand nombre de déplacement élémentaire avant de se dissocier de leur substrat. Chaque déplacement élémentaire (ou pas) du moteur moléculaire (indiqué par δX) est transmis à la bille piégée dans la pince optique. |
Le pas élémentaire de la kinésine est de 8 nanomètres (nm), ce qui correspond à la distance entre deux monomères successifs de tubuline. Chaque kinésine exécute une centaine de pas élémentaires à une vitesse maximale proche de 800 nm/s avant de se détacher. La force maximale développée est de 5-7 pN. Chaque pas élémentaire est associé à l’hydrolyse d’une molécule d’ATP. On pense actuellement que les deux têtes de la molécule agissent de façon coordonnée, la fixation et l’hydrolyse de l’ATP sur l’une des têtes favorisant le départ de l’ADP de l’autre tête. Ainsi, le mouvement de la kinésine sur le microtubule implique que l’une au moins des têtes de la molécule demeure attachée au microtubule. L’ARN polymérase L’ARN polymérase II est un moteur moléculaire processif qui se fixe à l’ADN pour induire sa transcription en ARN messager [
14]. Pour étudier le déplacement et la force de ce moteur, l’ARN polymérase, fixée sur une surface, est mise en contact avec un brin d’ADN à l’extrémité duquel est fixée une bille piégée par le faisceau laser (partie droite de la Figure 2). Au cours de la transcription, le déplacement du brin d’ADN par l’ARN polymérase II se traduit par le déplacement de la bille vers la surface. La force maximale produite par le moteur est proche de 25 pN. La myosine II, moteur musculaire La contraction musculaire est liée à l’interaction de la myosine musculaire, ou myosine II, avec un filament d’actine. La famille des myosines comprend par ailleurs 16 classes de myosine impliquées dans le transport de vésicules, la division cellulaire ou les mouvements cellulaires [
15]. La myosine II et la kinésine présentent de nombreuses analogies de fonctionnement. Ces deux moteurs utilisent l’ATP comme source d’énergie chimique. Leur pas élémentaire résulte d’une modification conformationnelle minime d’une partie de la molécule amplifiée par un bras de levier. L’interaction avec leur substrat est caractérisée par un cycle complexe au cours duquel le moteur moléculaire est alternativement lié puis détaché [
16,
17]. Cependant, contrairement à la kinésine conventionnelle, la myosine est détachée de l’actine pendant la plus grande partie de son cycle d’interaction: la myosine II n’est donc pas une enzyme processive. Le déplacement du filament d’actine induit par la fixation de chaque molécule de myosine est équivalent au pas élémentaire de la myosine. Ces caractéristiques associées à la brièveté de la durée de l’interaction imposent un dispositif expérimental particulier comportant une double pince optique [
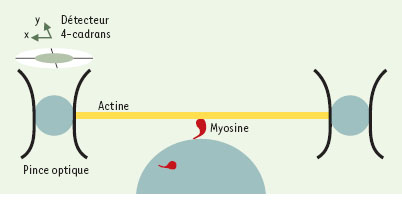
18]. Une bille est collée à chaque extrémité d’un filament d’actine (Figure 3). Le faisceau laser est envoyé alternativement sur chacune des deux billes, à fréquence suffisamment rapide, afin de créer une double pince optique. Une troisième bille de verre tapissée de quelques molécules de myosine est placée juste audessous du filament d’actine, de telle sorte que la myosine puisse se fixer sur l’actine. Lors de la bascule de la tête de la myosine, le déplacement et la force produits par la myosine sont transmis aux billes piégées et mesurés grâce à des détecteurs à 4 cadrans (photodiodes). L’utilisation des pinces optiques a permis de comparer les propriétés des myosines de muscles lisse, squelettique ou cardiaque. Le déplacement élémentaire de ces différentes myosines varie de 4 à 10 nm et la force élémentaire est de 3 à 6 pN. Dans le muscle lisse, cependant, les durées du déplacement et de la force exercée par la molécule de myosine sur la pince optique sont d’environ un ordre de grandeur plus grand que dans le muscle squelettique, et une bascule supplémentaire de la tête de la myosine, contemporaine du départ de l’ADP, a été observée. La caractérisation fonctionnelle des anomalies moléculaires de l’actine et de la myosine ouvre des perspectives pour la compréhension et le traitement des myopathies génétiques et acquises [
19]. Dans notre laboratoire, nous utilisons la technique des pinces optiques pour mesurer, à l’échelon moléculaire, les cinétiques et la force des ponts actinemyosine des muscles normaux et pathologiques. Cette analyse moléculaire fonctionnelle a pour objectif principal de mieux comprendre la physiopathologie des myopathies et des cardiopathies dont l’enjeu médical et en santé publique est très important. 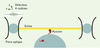 | Figure 3.
La mesure du déplacement et de la force élémentaire produit par une molécule unique de myosine musculaire nécessite un dispositif expérimental particulier comportant une double pince optique. Deux billes fixées aux extrémités d’un filament d’actine permettent sa manipulation optique. Lors de son interaction avec l’actine, la tête de la myosine bascule, produisant un déplacement élémentaire du filament d’actine et donc des billes de 4-10 nm en fonction de l’origine tissulaire de la myosine. De même, la force maximale produite varie de 3 à 6 pN. Après la bascule, la fixation d’une molécule d’ATP sur la tête de la myosine induit le détachement du pont actine-myosine. L’interaction de la myosine musculaire avec l’actine est un phénomène rapide: l’analyse du déplacement des billes et de la force produite lors de l’interaction actine-myosine nécessitent des systèmes rapides de détection (détecteurs à 4 cadrans basé sur un système de photodiodes). |
|
Depuis quelques années, le développement d’outils permettant la manipulation de cellules et de molécules d’intérêt biologique a ouvert des voies de recherche nouvelles. Les techniques de nanomanipulation par les pinces optiques ont rendu possible la mesure en temps réel des forces et contraintes exercées ou produites par des structures moléculaires. Face aux enjeux de la post-génomique, le champ d’application croissant de ces nouvelles biotechnologies rend compte de la nécessité d’appréhender non seulement la structure mais également la fonction des protéines. |
1. Ashkin A. Optical trapping and manipulation of neutral particles using lasers. Proc Natl Acad Sci USA 1997; 94: 4853–60. 2. Townes-Anderson E, St Jules RS, Sherry DM, Lichtenberg J, Hassanain M. Micromanipulation of retinal neurons by optical tweezers. Mol Vision 1998; 4: 12. http://www.molvis.org/molvi s/v4/p12
3. Konig K, Svaasand L, Liu Y, et al. Determination of motility forces of human spermatozoa using an 800 nm optical trap. Cell Mol Biol 1996; 422: 501–9 4. Schütze K, Clement- Sengewald A, Ashkin A. Zona drilling and sperm insertion with combined laser microbeam and optical tweezers. Fertil Steril 1994; 61: 783–6. 5. Kuo SC. Using optics to measure biological forces and mechanics. Traffic 2001; 11: 757–63. 6. Sleep J, Wilson D, Simmons R, Gratzer W. Elasticity of the red cell membrane and its relation to hemolytic disorders: an optical tweezers study. Biophys J 1999; 77: 3085–95. 7. Kellermayer MS, Smith SB, Bustamante C, Granzier HL. Mechanical fatigue in repetitively stretched single molecules of titin. Biophys J 2001; 80: 852–63. 8. Coirault C, Samuel JL, Chemla D, et al. Increased compliance in diaphragm muscle of the cardiomyopathic syrian hamster. J Appl Physiol 1998; 85: 1762–9. 9. Bustamante C, Smith SB, Liphardt J, Smith D. Singlemolecule studies of DNA mechanics. Curr Opin Struct Biol 2000; 10: 279–85. 10. Bustamante C, Macosko JC, Wuite GJL. Grabbing the cat by the tail: manipulating molecules one by one. Nat Rev Mol Cell Biol 2000; 1: 130–6. 11. Mehta AD, Rief M, Spudich JA, Smith DA, Simmons RM. Single-molecule biomechanics with optical methods. Science 1999; 283: 1689–95. 12. Woehlke G, Schliwa M. Walking on two heads: the many talents of kinesin. Nat Rev Mol Cell Biol 2000; 1:50–8. 13. Block SM, Goldstein LS, Schnapp B. Bead movement by single kinesin molecules studied with optical tweezers. Nature 1990; 348: 348–52. 14. Gelles J, Landick R. RNA polymerase as a molecular motor. Cell 1998; 93: 13–6. 15. Sellers JR. Myosins: a diverse superfamily. Biochim Biophys Acta 2000; 1496: 3–22. 16. Huxley AF. Cross-bridge action: present views, propects, and unknowns. J Biomech 2000; 33: 1189–95. 17. Spudich JA. The myosin swinging cross-bridge model. Nat Rev Mol Cell Biol 2001; 2: 387–92. 18. Knight AE, Veigel C, Chambers C, Molloy JE. Analysis of single-molecule mechanical recordings: application to acto-myosin interactions. Prog Biophys Mol Biol 2001; 77: 45–72. 19. Coirault C, Lambert F, Pourny JC, Lecarpentier Y. Velocity of actomyosin sliding in vitro is reduced in dystrophic mouse diaphragm. Am J Respir Crit Care Med 2002; 165: 250–3. |