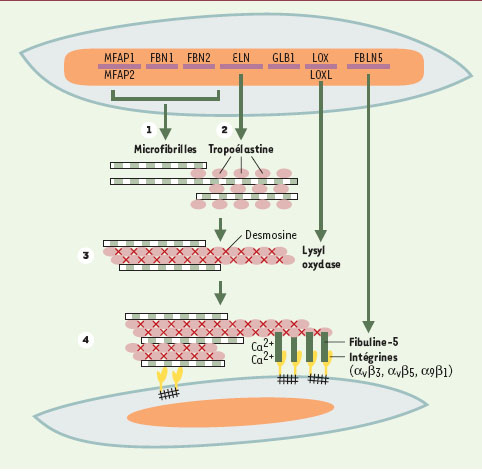
Ce sont les fibres élastiques qui confèrent la propriété d’élasticité aux organes qui les contiennent (artères, poumons, peau, cartilages élastiques). L’analyse par les techniques biochimiques des différentes protéines ou glycoprotéines qui constituent ces fibres n’a jamais été complète du fait de leur totale insolubilité dans le cas de l’élastine, ou quasiinsolubilité pour les glycoprotéines de structure qui lui sont associées. Depuis 1987, les techniques de biologie moléculaire et d’invalidation de gènes chez la souris ont permis la caractérisation et l’étude structurale des différentes protéines et glycoprotéines composant les fibres élastiques (tropoélastine, fibrillines 1 et 2, MAGP [microfibrillar- associated glycoproteins]). La synthèse des fibres élastiques commence au 3e-4e mois de développement et se poursuit durant la phase de croissance de l’individu. La fibrillogenèse débute par la synthèse des glycoprotéines de structure comme les fibrillines (Figure 1, étape 1) qui s’organisent dans l’espace extracellulaire et constituent une charpente sur laquelle se déposent les molécules de tropoélastine, précurseurs solubles de l’élastine (Figure 1, étape 2) (→). Les dernières étapes de la formation des fibres élastiques sont la désamination oxydative des lysines de la tropoélastine, catalysée par une lysyl oxydase, et la formation d’acides aminés de pontage comme les desmosines, formées à partir de quatre résidus lysine (Figure 1, étape 3). La formation des acides aminés de pontage rend l’élastine insoluble, résistante à l’hydrolyse par la plupart des enzymes et surtout fonctionnelle en lui conférant ses propriétés d’élasticité [ 1]. Plusieurs maladies connues sont des élastinopathies dues à l’altération ou à la suppression de l’une des protéines constitutives des fibres élastiques. Chez la plupart des patients atteints du syndrome de Marfan, on détecte une mutation dans le gène de la fibrilline-1 [ 2]. La sténose supravalvulaire aortique est associée à l’hémizygotie fonctionnelle du gène de l’élastine, le syndrome de Williams est dû à la délétion complète d’un allèle du gène de l’élastine [ 3, 4], et des mutations à l’extrémité 3’ du gène de l’élastine ont été décrites chez les patients souffrant de cutis laxa (forme autosomique dominante) [ 5].
(→) m/s 1996, n° 10, p. 1077 et 2001, n° 3, p. 327
| Figure 1.
Organisation des fibres élastiques au niveau moléculaire. La synthèse des fibres élastiques commence par la synthèse et l’organisation, dans l’espace extracellulaire, des glycoprotéines de structure, fibrillines et microfibrillar-associated glycoproteins, produits des gènes FBN 1, FBN 2, MFAP 1 et MFAP2 (étape 1). Ces glycoprotéines de structure constituent une charpente sur laquelle se déposent les molécules de tropoélastine, molécules qui sont « chaperonées » par le variant court (S-Gal) de la β-galactosidase au cours de leur transit intracellulaire et de leur sécrétion (étape 2). Dans l’espace extracellulaire, les molécules de tropoélastine sont liées les unes aux autres lors de la formation des acides aminés de pontage, formation catalysée par une lysyl oxydase (LOX) ou une « lysyl oxydase-like » (LOXL-1 à 4) (étape 3). La liaison des fibres élastiques aux cellules via la fibuline- 5 induit l’organisation optimale des fibres élastiques dans les tissus (étape 4). |
Deux articles publiés récemment [ 6, 7] décrivent une nouvelle élastinopathie résultant de l’invalidation du gène codant pour la fibuline-5 chez la souris. Cette protéine, préalablement dénommée EVEC (embryonic vasculature-expressed epidermal growth factor-like repeats containing protein) [ 8] ou DANCE (developmental arteries and neural crest epidermal growth factor-like protein) [ 9], a initialement été séquencée à partir de banques d’ADNc. Les premiers travaux démontraient que la fibuline-5 est fortement exprimée au cours de l’organogenèse des artères (embryons de souris de 11,5 à 16,5 jours), n’est plus exprimée dans les artères adultes, mais est détectable dans les plaques d’athéroclérose et dans la néo-intima qui se développe après angioplastie au ballonnet [8, 9]. La fibuline-5 est une molécule de liaison entre les fibres élastiques et les cellules. L’invalidation du gène codant pour la fibuline-5 induit une élastinopathie qui altère tous les tissus qui contiennent des fibres élastiques, même s’ils en contiennent peu. Les phénotypes observés correspondent à des maladies humaines connues: le cutis laxa au niveau de la peau, l’emphysème au niveau des poumons et l’élongation et la tortuosité des artères, maladies génétiques ou acquises au cours du vieillissement liées à la déficience ou à la dégradation d’un composant des fibres élastiques.
En fait, l’absence de fibuline-5 altère l’organogenèse des tissus élastiques en modifiant l’organisation tridimensionnelle des cellules dans la matrice extracellulaire qui les entoure. Le rôle des fibres élastiques dans l’organogenèse avait déjà été démontré par l’invalidation du gène codant pour l’élastine. Cette invalidation induit une prolifération non contrôlée des cellules musculaires lisses des artères, allant jusqu’à l’occlusion complète des artères, cause du décès des souris 2,5 jours après leur naissance [ 10]. Les souris dont le gène de la fibuline-5 a été invalidé survivent jusqu’à l’âge de 6 mois mais tous les tissus élastiques sont altérés. La fibuline-5 interagit exclusivement avec l’élastine au sein des fibres élastiques, et avec les intégrines αvβ3, αvβ5, α9β1 à la surface des cellules (Figure 1, étape 4). La liaison élastinefibuline- 5 est dépendante du calcium. L’interaction entre la fibuline-5 et les intégrines αVβ3 et αVβ5 est inhibée par le peptide GRGDSP alors que l’interaction fibuline-5-intégrine α9β1 ne l’est pas. La mise en évidence du rôle de la fibuline-5 dans l’interaction élastine-intégrines est importante car les intégrines jouent un rôle-clé dans le réarrangement des protéines structurales du cytosquelette via les adhérences focales et la définition du profil d’expression des cellules [ 11]. Cette interaction fibres élastiques-cellules détermine en retour une organisation optimale des fibres élastiques dans l’espace extracellulaire (Figure 1, étape 4 et Figure 2).
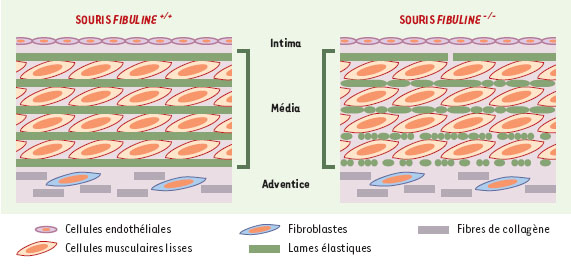
| Figure 2.
Organisation des fibres élastiques au niveau tissulaire (aorte) chez les souris fibuline-5+/+et les souris fibuline-5−/−. Les fibres élastiques des artères s’organisent en lames entre lesquelles s’alignent les cellules musculaires lisses. Chez les souris dont le gène codant pour la fibuline-5 a été invalidé, les lames élastiques sont altérées; la fragmentation des lames élastiques est plus intense du coté adventiciel que du coté intimal. |
L’interaction fibres élastiques-cellules avait déjà été visualisée [ 12] et la fibuline- 5 n’est pas la seule protéine qui intervient dans cette interaction [ 13, 14]. Ces deux articles concordants et complémentaires apportent toutefois des données nouvelles et un niveau de complexité supplémentaire dans la connaissance de l’organogenèse des tissus élastiques. De plus, ils démontrent, comme dans le cas des souris dont le gène de l’élastine a été invalidé, que, outre leur fonction d’élasticité, les fibres élastiques jouent un rôle dans l’organogenèse des tissus qui les contiennent.