Neuro-anatomie fonctionnelle de la préhension Les actes moteurs visuellement guidés reposent en grande partie sur l’intégrité du cortex pariétal. Cette idée remonte au début du XXe siècle, et a été confirmée par les premiers travaux expérimentaux réalisés chez l’animal et par les études cliniques menées chez l’homme. Cependant, les voies anatomiques par lesquelles s’exprime cette fonction pariétale n’ont été découvertes que récemment [
3,
4], et l’on commence à comprendre les propriétés neuronales qui la sous-tendent. On sait maintenant que les aires visuelles et associatives du cortex pariétal sont le lien anatomique privilégié entre les aires des commandes motrices (le cortex prémoteur) et le cortex visuel, notamment la voie dorsale [
5]. Une revue exhaustive de la neuro-anatomie fonctionnelle de la préhension a été publiée dans un chapitre récent [
6]. On se limitera ici à un bref aperçu de l’organisation anatomique du cortex moteur et de ses connexions avec le cortex pariétal, tout en mettant l’accent sur les aspects fonctionnels. Organisation anatomique des cortex moteur et pariétal Le cortex moteur occupe, chez le singe, l’étendue corticale située entre le sillon central et le sillon arqué. Il a été subdivisé, outre la distinction entre le cortex moteur primaire (M1, ou aire 4 de Brodmann) et le cortex prémoteur (aire 6), en une douzaine d’aires, selon des critères d’architecture et de connectivité, et en fonction d’effets de lésions ou encore de propriétés neuronales. Retenons pour ce chapitre les principales subdivisions du cortex prémoteur situé sur la surface latérale de l’hémisphère cérébral (Figure 1A): on distingue les cortex prémoteurs dorsal (PMd) et ventral (PMv), l’aire motrice supplémentaire (SMA), qui continue sur la surface médiane de l’hémisphère, l’aire oculomotrice (FEF) et l’aire oculomotrice supplémentaire (SEF). D’autres aires prémotrices se trouvent sur la surface médiane de l’hémisphère, occupant le gyrus et le sillon cingulaires. Des subdivisions plus fines ont été identifiées dans certaines de ces aires. Ainsi, on fait généralement la distinction entre les régions antérieures, ou rostrales (PMdr, PMvr et pré-SMA), et les régions postérieures, ou caudales (PMdc, PMvc et SMA propre). Ces différentes aires ont un rôle spécifique dans la motricité des membres et du corps (la musculature squelettique), à l’exception des aires FEF et SEF qui font partie du réseau de structures impliquées dans la motricité oculaire. Les aires PMd et PMv sont les principales aires impliquées dans les transformations visuo-motrices directes, la SMA étant plutôt impliquée dans les mouvements dits « autoproduits » ( self initiated) [
7].  | Figure 1.
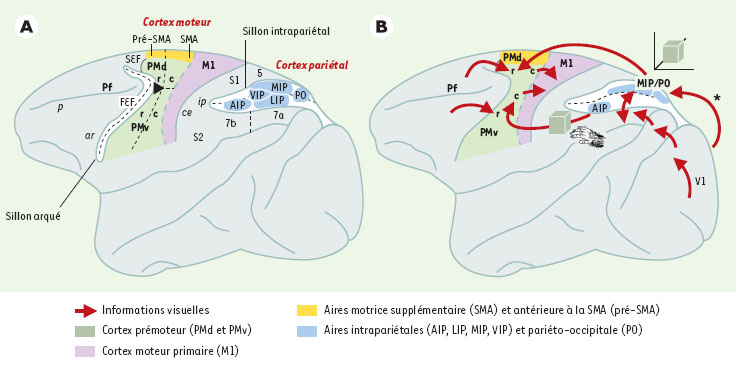
A. Principales subdivisions du cortex moteur et du cortex pariétal illustrées sur une vue latérale du cerveau de singe. Les sillons intrapariétal ( ip) et arqué ( ar) ont été ouverts pour exposer les aires qu’ils abritent; leur fond est indiqué par la ligne en pointillés. Les noms abrégés des sillons sont en italique ( ce : sillon central; p : sillon principal). Pf: cortex préfrontal; PMd et PMv, cortex prémoteur dorsal et ventral, respectivement. Les lettre « r » et « c » se réfèrent aux sous-divisions rostrales et caudales de ces aires. SMA: aire motrice supplémentaire; pré-SMA: aire antérieure à la SMA; FEF et SEF: aires oculomotrice et oculomotrice supplémentaire, respectivement; M1: cortex moteur primaire; AIP, LIP, MIP et VIP: aires intrapariétales antérieure, latérale, médiane et ventrale, respectivement; PO, aire pariéto-occipitale. S1 et S2: aires somesthésiques; 5, 7a et 7b: subdivisions des lobules pariétaux. B. Voies de cheminement de l’information visuelle aux aires de commandes motrices. L’information visuelle peut parvenir au cortex prémoteur soit directement par le biais du cortex pariétal, lui-même connecté au cortex visuel (l’astérisque indique que la projection vient de la surface médiane du cortex visuel [V1], représentant la vision périphérique), soit indirectement par le cortex préfrontal, qui reçoit les projections des deux voies visuelles, dorsale et ventrale [ 6]. Les voies pariéto-prémotrices s’organisent en deux composantes: l’une spécialisée dans le codage spatial (qui est schématisé par le cube vert dans un espace tridimensionnel), et l’autre codant pour les caractéristiques tridimensionnelles de l’objet et pour sa manipulation (objet et main). |
L’organisation du cortex pariétal a, elle aussi, connu un morcellement complexe, grâce à de nombreux travaux anatomiques et physiologiques. De nombreuses aires ont ainsi été identifiées dans le sillon intrapariétal qui sépare les deux lobules supérieur et inférieur et, de ce fait, leur dénomination inclut presque toujours les lettres I et P, auxquelles s’ajoute la position dans le sillon: l’aire AIP est située dans la partie antérieure, LIP sur la berge latérale, MIP sur la berge médiane et VIP (V pour ventral) au fond du sillon. Enfin, l’aire PO (également appelée V6/V6A) est située à la jonction entre les lobes pariétal et occipital, sur la berge antérieure du sillon pariéto-occipital. Le rôle fonctionnel de chacune de ces aires fait actuellement l’objet de nombreuses études. Nous reviendrons sur celles qui sont pertinentes dans le cadre de cet article. Les voies de cheminement de l’information visuelle aux aires des commandes motrices Le schéma classique selon lequel l’information visuelle ne parvient au cortex prémoteur que par des voies indirectes impliquant le cortex préfrontal [
8] a considérablement évolué ces dix dernières années, grâce notamment à l’avènement de nouveaux traceurs anatomiques, mais aussi à d’importants progrès dans les connaissances de l’organisation fonctionnelle du cortex visuel, du cortex pariétal et de leurs interconnexions. L’identification de nouvelles aires visuelles dans le cortex pariétal, dont certaines sont situées dans le lobule pariétal supérieur considéré « aveugle », et de leurs connexions avec le cortex frontal a conduit à un nouveau schéma d’organisation des voies visuo-motrices. En fait, contrairement aux premières études anatomiques, les aires pariétales sont la principale source d’informations visuelles envoyées au cortex prémoteur. Ce dernier est en effet la cible de projections directes d’aires pariétales, elles-mêmes directement connectées au cortex visuel (V1) (Figure 1B). On peut alors identifier deux composantes dans la voie visuelle dorsale: une composante dirigée vers le lobule pariétal supérieur (aires MIP et PO), et spécialisée dans la localisation spatiale, l’autre se terminant dans le lobule pariétal inférieur (aire AIP), et davantage liée au traitement des formes des objets et à leur manipulation. L’aire AIP se caractérise par la présence de neurones codant pour les formes tridimensionnelles des objets, ainsi que leur manipulation [
9]. Chez l’homme, il existe aussi une distinction fonctionnelle entre les lobules pariétaux supérieur et inférieur, fondée sur des corrélations anatomocliniques: l’ataxie optique, que l’on peut résumer en un déficit de localisation spatiale [
10], est associée aux atteintes du lobule pariétal supérieur, alors que la négligence (c’est-à-dire un déficit de l’attention vers les stimulus présentés du côté opposé à la lésion) et les déficits dans la manipulation d’objets sont souvent corrélés aux atteintes du lobule pariétal inférieur [
11], qui semble par ailleurs contenir une aire homologue de l’aire AIP du singe [
12]. La séparation des fonctions au niveau du cortex pariétal se maintient jusque dans le cortex prémoteur. En effet, on a pu identifier deux voies de connexions pariéto-prémotrices plus ou moins parallèles, qui collaboreraient au guidage des gestes de préhension [4]. L’une part des régions pariétales médianes (notamment l’aire MIP) pour atteindre le cortex prémoteur dorsal (PMd), l’autre est issue des régions latérales du cortex pariétal (incluant l’aire AIP) et se termine dans le cortex prémoteur ventral (PMv). Ainsi, alors que la région du cortex prémoteur commandant les muscles du bras (PMd) reçoit les projections en provenance d’aires codant pour la localisation spatiale des objets, celle commandant les muscles de la main (PMv) reçoit ses informations d’aires pariétales impliquées dans le codage des paramètres intrinsèques des objets. La question est maintenant de savoir comment les neurones du cortex prémoteur codent pour les mouvements. Un geste simple, saisir une tasse de thé par exemple, fait appel à plusieurs processus: des mécanismes internes complexes font naître chez le sujet le désir de saisir la tasse, ce qui oriente son attention vers elle afin de la sélectionner parmi la multitude d’objets qui stimulent la rétine. Bien souvent, s’ensuit une saccade oculaire qui oriente le regard sur l’objet, avant le mouvement de la main lui-même. Ce dernier nécessite la coordination de plusieurs canaux, notamment celui qui permet le codage de la destination finale de la main en utilisant l’information visuelle spatiale (canal de transport de la main) et celui qui transforme les informations visuelles relatives aux propriétés intrinsèques de l’objet en mouvements précis des doigts (canal de saisie). Le tout intervient dans un laps de quelques centaines de millisecondes et, sans une décomposition artificielle de la tâche, il est difficile de faire la part des choses quand on observe l’activité des neurones. Nous allons nous concentrer sur la dissociation entre l’attention, un processus de sélection des informations sensorielles, et la préparation de l’action, qui est l’ensemble des transformations visuo-motrices qui précèdent l’exécution du mouvement vers un but. Les mécanismes du codage des paramètres du mouvement ont été traités par ailleurs [6]. |
Attention et préparation motrice dans le cortex frontal L’attention et la préparation motrice (on parlera d’intention par commodité) sont des processus intimement liés, car on comprend aisément que l’attention doit nécessairement être orientée ver l’objet de l’action, sans quoi la performance est mauvaise (« Fais attention à ce que tu fais »!). Les protocoles expérimentaux de laboratoire doivent donc les dissocier pour en identifier les corrélats respectifs au niveau de l’activité neuronale. Nous allons passer en revue les données obtenues chez le singe et chez l’homme, à l’aide d’un protocole similaire, en neurophysiologie et en IRM fonctionnelle. Neurophysiologie chez le singe Les neurologues du début du siècle dernier avaient déjà constaté que les lésions des régions frontales situées en avant du cortex moteur primaire (M1) induisaient des déficits subtils, difficiles à catégoriser en sensoriels ou moteurs. L’idée était née alors que cette région jouait un rôle dans des processus complexes de préparation motrice, d’où le nom de « cortex prémoteur » qui remonte à Fulton (1935). Avec l’avènement de la neurophysiologie chez l’animal vigile, les premières études neurophysiologiques des années 1980 ont confirmé cette idée en observant que les neurones de cette région déchargent pendant la préparation motrice [
13,
14]. La question s’est posée ensuite de savoir quelle information est contenue dans cette décharge, qui peut tout aussi bien coder de manière prospective pour l’action, comme de manière rétrospective pour les stimulus qui en sont la cause, ou les deux à la fois. Mais avant de résoudre ce difficile débat, il convient d’abord de savoir si l’activité dite « préparatoire » reflète la préparation motrice (comprenant le codage du stimulus) ou l’attention spatiale [
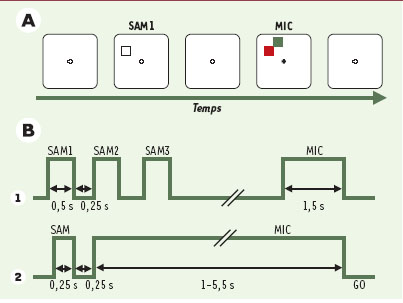
15]. Dans une série d’études, nous avons utilisé une tâche complexe à l’origine mise au point dans un double objectif [8]. Le premier était de dissocier les activités neuronales liées à l’attention et/ou à la mémoire spatiale de celles codant pour la préparation motrice; le second était de distinguer, au sein de l’activité préparatoire, le codage des paramètres du mouvement de celui des stimulus instruisant le mouvement. C’est le premier aspect de la tâche qui nous concerne dans cet article, car il présente une situation unique ayant permis d’identifier des subdivisions fines au sein du cortex prémoteur et la spécificité de ce dernier par rapport au cortex préfrontal. Différentes catégories d’essais ont donc été conçues, afin de comparer les réponses de chaque neurone pour un même stimulus qui oriente l’attention de l’animal dans une partie de l’essai, ou guide la préparation motrice dans une autre partie. Les enregistrements des neurones ont été effectués sur des animaux entraînés et connaissant parfaitement la tâche. Dans ce protocole, le singe est assis face à un écran d’ordinateur sur lequel sont présentés les stimulus visuels (Figure 2), avec trois touches métalliques alignées devant lui, à portée de sa main. Une touche centrale permet de déclencher les essais et constitue le point de départ de tous les mouvements du bras. Deux touches latérales, équidistantes de la touche centrale, une à droite et une à gauche, constituent les cibles des mouvements. La tête de l’animal est immobile, et il a été conditionné à fixer du regard un point lumineux pendant la tâche. Il n’y a donc pas d’interférence possible par les mouvements oculaires. Un essai débute lorsque le singe pose sa patte sur la touche centrale et oriente son regard vers le point de fixation central. Puis un carré lumineux (rouge ou vert) est présenté pendant une courte durée (0,5 s) à l’une des 8 positions de l’écran. Ce stimulus indique au singe l’endroit auquel il doit s’attendre à recevoir une instruction motrice plus tard dans l’essai; sa couleur est aléatoire et ne permet pas de prédire la direction du mouvement. Ce premier stimulus est appelé SAM (spatial attention and/or memory stimulus). À ce stade de l’essai, la direction du mouvement n’étant pas connue, toute variation de l’activité neuronale est interprétée comme liée à l’attention et/ou à la mémoire spatiale. Passé un délai de 0,5 à 1,5 s, un autre carré (rouge ou vert) de même taille apparaît à l’endroit indiqué par SAM. C’est ce stimulus qui indique au singe dans quelle direction il doit effectuer son mouvement du bras: vers la touche de gauche si le stimulus est rouge, vers la touche de droite s’il est vert. Ce deuxième stimulus est appelé MIC (motor instructional cue). Le stimulus MIC reste allumé pendant une durée variant de 1 à 3 s, et le singe doit attendre son extinction (signal GO) avant d’exécuter sa réponse. Ce délai imposé entre l’apparition du stimulus qui guide le mouvement et son exécution permet de mettre en évidence l’activité liée à la préparation motrice. 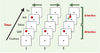 | Figure 2.
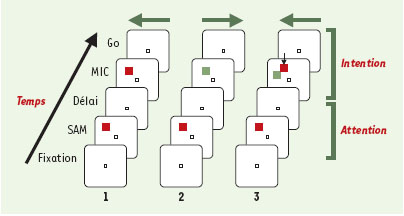
Protocole expérimental (SAM-MIC) permettant de dissocier l’activité liée à l’attention de l’activité pour codant pour la préparation motrice. Chaque colonne diagonale illustre un exemple d’essai parmi 56 types d’essais possibles. Chaque essai débute par la fixation oculaire d’un point lumineux central, puis par la présentation d’un indice attentionnel SAM (spatial attention and/or memory stimulus) (carré rouge dans ces exemples, mais il peut être vert dans d’autres essais). Après un délai, un autre carré apparaît à l’endroit de l’indice attentionnel, seul (essais 1 et 2) ou accompagné (essai 3) d’un autre carré en position adjacente. Le carré correspondant à l’emplacement du SAM instruit le sujet quant à la réponse motrice à donner: appuyer sur la touche droite s’il est vert, sur la touche gauche quand c’est rouge (la direction du mouvement est indiquée par les flèches horizontales). Dans l’essai 3, la petite flèche verticale indique le carré qui instruit le mouvement. |
Attention versus intention dans le cortex frontal Il a été possible, à l’aide de ce protocole expérimental, d’observer que certains neurones déchargent en relation avec des indices attentionnels, d’autres avec les instructions motrices, d’autres encore avec les deux [ 15]. De façon attendue, la grande majorité des neurones du cortex prémoteur (environ 70 % d’un échantillon de 37 neurones) déchargent de préférence pendant la préparation motrice, alors qu’ils restent silencieux pendant la phase d’attention. Preuve supplémentaire que cette aire code pour la préparation du mouvement, au sens strict du terme, ces neurones ne déchargent pas de la même façon selon que le mouvement amène la main sur la touche de droite ou celle de gauche. Par exemple, le neurone illustré sur la Figure 3 est silencieux lorsque le singe est attentif, et s’active fortement dès lors que l’instruction motrice est donnée de préparer un mouvement à droite (Figure 3A). Ce neurone code donc pour le mouvement à droite; un autre neurone s’activerait plutôt avec le mouvement à gauche. La situation est différente dans le cortex préfrontal où, inversement au cortex prémoteur, la majorité des neurones étudiés (69 % d’un échantillon de 33 neurones) déchargent en relation avec les indices attentionnels, et peu ou pas du tout pendant la préparation motrice (Figure 4). Ces résultats viennent renforcer l’idée que le cortex préfrontal code pour des processus complexes du comportement (organisation spatiale et temporelle du comportement, mémoire de travail, codage du contexte…), alors que le cortex prémoteur participe au codage des paramètres cinématiques du mouvement, ici sa direction dans l’espace.  | Figure 3.
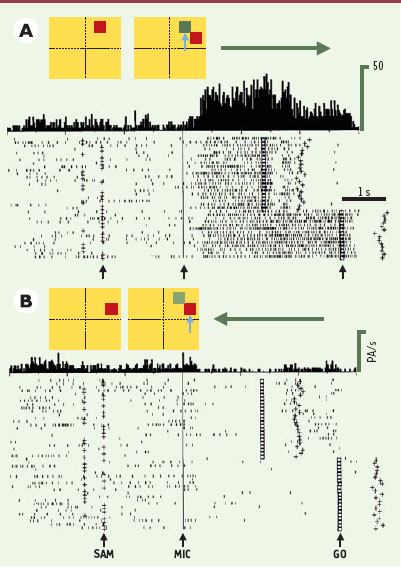
Exemple d’activité d’un neurone du cortex prémoteur codant pour la préparation motrice. La figure illustre l’activité d’un neurone (représentée par les petits points) du cortex prémoteur enregistrée pendant plusieurs essais (une ligne de points correspond à un essai), selon la direction de la réponse motrice indiquée par la flèche horizontale (A, à droite; B, à gauche). Deux panneaux schématisent la configuration des stimulus présentés: un carré rouge apparaît comme indice attentionnel (SAM), puis deux carrés comme instruction motrice (MIC). La flèche verticale bleue montre le carré, situé au même endroit que l’indice SAM, qui doit guider la réponse motrice. Les essais sont alignés sur l’apparition du stimulus MIC, et les histogrammes montrent l’activité cumulée pour chaque type d’essais (PA/s, potentiels d’action par seconde). Les petites croix, avant MIC, indiquent le moment d’apparition de l’indice SAM et les petits carrés après MIC montrent l’extinction de MIC (signal GO). Les croix situées après le GO indiquent la fin de la réponse motrice. On peut noter que le neurone ne répond pas à l’indice attentionnel, s’active pendant la préparation du mouvement à droite et s’inhibe pendant celle du mouvement à gauche. Pour d’autres neurones, ce serait la situation inverse (inhibition pendant la préparation du mouvement à droite et décharge pour le mouvement à gauche), ou une situation plus ambiguë (une décharge plus forte pour une direction que pour l’autre). L’activité globale de la population neuronale active déterminera la direction du mouvement. |
 | Figure 4.
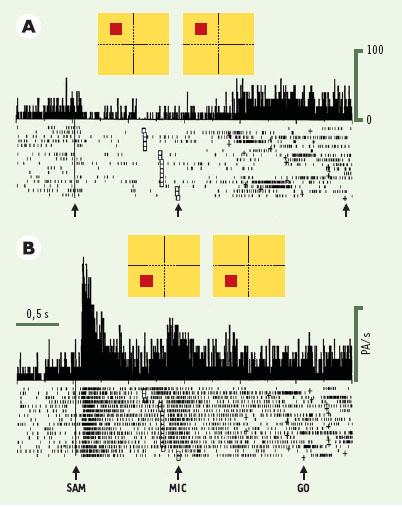
Exemple de neurone du cortex préfrontal dont l’activité est liée à l’attention. Les essais sont regroupés ici selon que l’indice attentionnel est en haut (A) ou en bas (B) de l’hémichamp visuel gauche. L’activité est alignée sur l’apparition de l’indice attentionnel (SAM). Dans le cortex préfrontal, on note que le neurone décharge en relation avec les indices attentionnels, et peu ou pas du tout pendant la préparation motrice (il décharge toutefois en relation avec l’exécution du mouvement). Noter que le neurone décharge de manière importante quand l’attention est dirigée vers le bas, alors qu’il est inhibé lorsqu’elle est orientée vers le haut. Là aussi, tous les neurones ne présentent pas le même profil de décharge, et l’on observe une grande variabilité des réponses neuronales. |
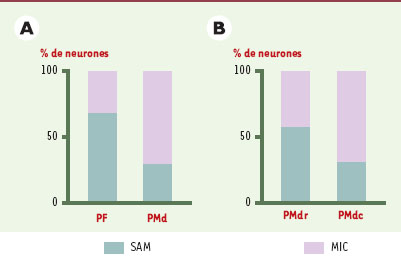
Il est cependant intéressant de noter qu’une proportion non négligeable des neurones prémoteurs s’active en relation avec les indices attentionnels, et qu’inversement certains neurones du cortex préfrontal sont impliqués dans la préparation du mouvement. D’autres aspects du protocole ont permis de déterminer que l’activité préparatoire du cortex préfrontal reflète en fait très souvent le stimulus instructeur, et non pas le mouvement lui-même, alors que, dans le cortex prémoteur, la décharge neuronale est fortement corrélée à la direction du mouvement, indépendamment des stimulus qui l’instruisent. Du cortex préfrontal au cortex moteur : un gradient fonctionnel Une analyse précise de la distribution des propriétés neuronales au sein du cortex prémoteur (Figure 5) montre que cette aire, loin d’être homogène, code des processus différents selon que l’on considère la région antérieure, proche du cortex préfrontal, ou la région postérieure, voisine du cortex moteur. En effet, la conclusion tirée des première études, selon laquelle les neurones liés à l’attention sont rares dans le cortex moteur, doit être nuancée car le résultat dépend de la région enregistrée. Dans la région antérieure (PMdr), une forte proportion de neurones s’activent en relation avec l’attention (21 neurones sur 34), alors qu’ils sont peu nombreux dans la région postérieure (PMdc, 16 neurones sur 42). Ce résultat est compatible avec des données anatomiques montrant que l’aire PMdr entretient des connexions réciproques avec le cortex préfrontal et ne projette pas sur la moelle épinière [ 8]. Qui plus est, cette région reçoit les plus fortes projections venant des aires pariétales visuelles. La région PMdc, elle, n’est pas connectée au cortex préfrontal mais au cortex moteur primaire (M1), et envoie des fibres vers la moelle épinière. Ce schéma fonctionnel est également confirmé par les études de microstimulation intracorticale qui montrent que l’application d’un faible courant électrique dans PMdc, ou dans M1, aboutit à des mouvements de parties du corps opposées au côté stimulé, alors que la stimulation de PMdr, comme celle du cortex préfrontal, n’évoque pas de mouvement. L’ensemble de ces données convergent sur l’idée d’un gradient anatomo-fonctionnel entre le cortex préfrontal et le cortex moteur, le long duquel on assiste à une transformation du contenu de l’activité neuronale: les aspects les plus cognitifs sont traités dans le cortex préfrontal, les aspects les plus moteurs dans le cortex moteur primaire, et les niveaux intermédiaires entre les deux, dans le cortex prémoteur. Ce dernier assurerait la continuité des transformations entre les niveaux de traitement, permettant ainsi au cortex préfrontal d’influencer le comportement moteur.
 | Figure 5.
Répartition des neurones liés à l’attention (SAM) ou à l’intention (MIC) dans les cortex préfrontal et prémoteur. A. Comparaison entre le cortex préfrontal (PF) et le cortex prémoteur (PMd). B. Au sein du contexte prémoteur, comparaison entre la région rostrale (PMdr, proche du cortex préfrontal) et la région caudale (PMdc, proche du cortex moteur). Les échantillons de neurones ont été obtenus à partir de deux études différentes. |
En résumé, des neurones qui déchargent en relation avec l’attention ou avec la préparation motrice existent aussi bien dans le cortex préfrontal que dans le cortex prémoteur, entre autres structures du cerveau. Ce qui différencie ces deux régions sont, d’une part, les proportions de neurones liés à ces deux processus, et, d’autre part, la spécificité de l’activité dite « préparatoire ». Celle-ci reflète des processus de sélection sensorielle dans le cortex préfrontal, et de sélection de l’action dans le cortex prémoteur. L’utilisation du protocole SAM/MIC a permis, outre ces conclusions, de distinguer deux régions dans le cortex prémoteur du singe: la région antérieure, dont la fonction s’apparente à celle du cortex préfrontal, et la région postérieure, dont la fonction est motrice. Il restait à démontrer que cette organisation fonctionnelle était applicable chez l’homme. Neuro-imagerie par IRM fonctionnelle chez l’homme Des études d’imagerie ont montré que le cortex prémoteur du cerveau humain est actif dans les tâches de préparation motrice, mais également pendant des tâches de mémoire de travail ou d’attention(→). Il est difficile, lorsque ces tâches sont exécutées par des groupes de sujets différents, de savoir si les activations liées à ces différentes tâches se recouvrent dans le cortex prémoteur ou si, au contraire, elles activent des régions fonctionnellement différentes. Pour pallier cette difficulté, nous avons adapté à l’homme le protocole SAM/MIC utilisé chez le singe, et fait exécuter les deux tâches (attention et intention) au même groupe de sujets. Il a alors été possible de superposer les activations liées aux deux tâches, et de découvrir qu’elles impliquent des régions différentes du cortex prémoteur. Les détails de cette étude ont été publiés récemment [
16] (Figure 6). Dix sujets volontaires, tous droitiers, ont participé à l’étude. Ils se sont exercés aux deux tâches avant le passage à l’IRM, ce qui a permis d’homogénéiser le niveau de performance d’un sujet à l’autre. Une manette à deux boutons, l’un sous l’index, l’autre sous le majeur, permet au sujet de donner sa réponse, et les stimulus sont présentés sur un écran: une croix de fixation, un carré blanc comme indice attentionnel (SAM), et des carrés rouge ou vert servant d’instruction motrice (MIC). Le protocole incluait quatre blocs expérimentaux: un bloc « attention », un bloc « intention » et leurs témoins respectifs. La soustraction de l’activation témoin de la tâche permet d’identifier l’activité spécifique.
(→) m/s 1999, n° 4, p. 457
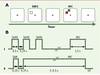 | Figure 6.
Protocole expérimental SAM/MIC utilisé en IRMf chez l’homme. A. Séquence typique des stimulus. B. Décours temporel des stimulus. (1) Lors de la tâche d’attention: les sujets fixent la croix de fixation pendant les blocs d’essais, pendant qu’un carré blanc est présenté 4, 8 ou 12 fois à différentes positions de l’écran, avec un délai de 250 ms entre deux présentations. Ils doivent « faire attention » à ces stimulus, car le dernier permettait de savoir s’il faut répondre avec l’index ou avec le majeur. En effet, après la dernière présentation de SAM, deux carrés (rouge et vert) apparaissent simultanément, l’un des deux étant exactement à l’endroit indiqué par le dernier SAM. Si ce carré est rouge, la bonne réponse est d’appuyer avec l’index, s’il est vert avec le majeur. Un bloc d’essais témoins permet de soustraire toute activité liée aux stimulus, à la fixation et aux réponses motrices. L’activation restante après cette soustraction devrait représenter l’activation spécifique à l’attention et/ou la mémoire spatiale. (2) Lors de la tâche d’intention, l’accent est mis sur la préparation motrice. Comme chez le singe, un seul stimulus SAM est présenté, indiquant l’endroit futur du stimulus MIC. Ce dernier est présenté pour une période de 1 à 5,5 s pendant laquelle les sujets attendent le signal d’exécution de la réponse (GO), qui est donné par l’extinction de MIC. Là aussi, un bloc d’essais témoins permet de soustraire toute activité non pertinente pour ne laisser que l’activation spécifique à la préparation motrice (d’après [ 16]). |
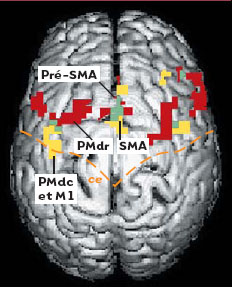
Une activation spécifique du cortex prémoteur latéral Les données obtenues à partir de l’étude de dix sujets sont présentées sur la Figure 7. Il apparaît que les deux tâches (attention et intention) activent le gyrus frontal médian des deux hémisphères, ainsi que le cortex prémoteur médian (SMA et pré- SMA). L’attention active en outre la région du sillon frontal supérieur et une grande étendue du cortex pariétal (non montrée sur la Figure 7). Ces données confirment les résultats des nombreuses études d’imagerie cérébrale, et permettent en outre de pouvoir observer le degré de ségrégation, ou de convergence, des réseaux activés par l’attention et de ceux activés par la préparation motrice. On découvre alors que, au sein du cortex prémoteur latéral (situé sur la surface externe du cerveau), notamment ipsilatéral à la main utilisée par les sujets (c’est-à-dire dans l’hémisphère situé du même côté que la main utilisée), les deux tâches n’impliquent pas les mêmes régions. À l’image des données neurophysiologiques obtenues chez le singe, l’attention active la partie antérieure (coordonnées de Talairach: X=-20, Y=1, Z=49), alors que l’intention active davantage la région postérieure chevauchant l’aire M1 (aire de Brodmann 6/4; coordonnées de Talairach: X=-33, Y=-7, Z=49). Il existe donc une spécialisation fonctionnelle au sein du cortex prémoteur dorsal du cerveau humain, similaire à celle observée chez le singe. 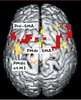 | Figure 7.
Activation cérébrale chez l’homme lors de tâches d’attention et d’intention. Vue dorsale d’un cerveau humain montrant l’activation cérébrale en IRMf chez un groupe de dix sujets. Seule l’activation frontale est montrée. L’activation est en rouge pendant la tâche d’attention, en jaune pendant la tâche d’intention, et les zones de recouvrement sont en vert. SMA: aire motrice supplémentaire; pré-SMA: aire antérieure à la SMA; ce : sillon central; PMd: cortex prémoteur dorsal; « r » et « c » se réfèrent aux sous-divisions rostrales et caudales de cette aire; M1: cortex moteur primaire; ce: sillon central. |
|