Toute lésion de l’organisme quelle qu’en soit l’origine (brûlure, coupure, fracture, infection bactérienne, intervention chirurgicale…) s’accompagne d’une réaction de défense non spécifique: le développement de l’inflammation. La douleur, un des quatre points « cardinaux » de la réaction inflammatoire, résulte de l’interaction de l’activation du système immunitaire avec celle des systèmes nerveux périphériques sensoriel et végétatif, par l’intermédiaire des médiateurs chimiques de l’inflammation, en particulier le NGF (nerve growth factor).
Au cours de l’inflammation, une hypersensibilité à la douleur, et particulièrement à la chaleur, se développe. Deux processus hypothétiques pourraient l’expliquer: d’une part une sensibilisation périphérique, c’est-à-dire une augmentation de la réponse des nocicepteurs associés aux terminaisons périphériques des neurones sensoriels dans les tissus enflammés; d’autre part une sensibilisation centrale, c’est-à-dire une augmentation de la réponse des neurones nociceptifs post-synaptiques de la corne dorsale de la moelle épinière (CDME).
Dans ce contexte, le rôle joué par le récepteur TRPV1, sensible à la chaleur nociceptive et exprimé par les terminaisons nerveuses périphériques des fibres nociceptives, est particulièrement intéressant. Ce récepteur a toute une histoire: il a d’abord été décrit comme un récepteur susceptible de lier la capsaïcine, composé lipophile à l’origine de la saveur piquante (chaude!) des extraits du piment, le récepteur vanilloïde VR1.
Ce récepteur est le premier récepteur moléculaire caractérisé qui capte les variations d’une grandeur physique, la chaleur : c’est un récepteur-canal ionique activé par la chaleur nociceptive (seuil de réponse à 44 °C), spécifique pour les cations, qui peut également être activé par les protons. Cette remarque est doublement importante: une acidose extracellulaire se développe dans les tissus enflammés, et le seuil d’activation à la chaleur du récepteur VR1 peut être diminué par les protons, jusqu’à atteindre un seuil non nociceptif (par exemple 34 °C) en milieu acide.
Depuis, d’autres récepteurs aux propriétés analogues ont été caractérisés et rassemblés dans la famille des récepteurs TRP (transient receptor potential), récepteurs-canaux sélectifs pour les cations. La plupart des membres de la famille sont thermosensibles: TRPM8 est activé par des faibles températures (< 22 °C) et par le menthol; TRPV1, ex- VR1, par la chaleur nociceptive (> 43 °C) et la capsaïcine; TRPV2 par des températures supérieures à 52 °C; TRPV3 par des températures physiologiques non nociceptives entre 22 °C et 40 °C. Enfin, un dernier membre de la famille, TRPV4, est, lui, sensible à l’osmolarité extracellulaire.
Parmi les molécules mises en jeu au cours de la cascade inflammatoire, le NGF joue un rôle central: caractérisé initialement pour son rôle au cours de l’ontogenèse du système nerveux périphérique, particulièrement pour le développement des fibres nociceptives de petit diamètre, il se révèle un véritable médiateur de l’inflammation. En effet, l’interleukine 1 (IL-1) libérée par les macrophages au niveau du foyer inflammatoire stimule la synthèse du NGF par les fibroblastes et les kératinocytes. Le NGF a deux effets: un effet à court terme de sensibilisation périphérique en agissant directement sur les terminaisons périphériques des nocicepteurs, avec pour résultat une hypersensibilité à la chaleur; un effet à long terme sur l’expression génique des neurones sensoriels primaires du ganglion de la racine dorsale (GRD). Le couple que forme le NGF et son récepteur spécifique de haute affinité TrkA, exprimé par les terminaisons des fibres nociceptives, est internalisé dans des vésicules endosomales recouvertes de clathrine et transporté de façon rétrograde jusqu’au corps cellulaire dans le GRD par les systèmes microtubulaires de l’axone. Il y activera l’expression de gènes codant par exemple pour des neuropeptides comme la substance P et le CGRP (calcitonin generelated peptide), des canaux ioniques et des récepteurs de protéines.
Le groupe de Clifford Woolf s’intéresse aux processus à l’origine de l’hypersensibilité à la douleur associée à l’inflammation et vient d’identifier le rôle d’une voie de signalisation intracellulaire, le système p38 MAPK, dans l’hypersensibilisation à la chaleur développée au cours de l’inflammation [ 1]. Ce groupe avait précédemment mis en évidence, dans les neurones nociceptifs des couches superficielles de la CDME, le rôle de l’activation des kinases de type ERK (extracellular signal-regulated kinases) dans la genèse de l’hypersensibilité à la douleur inflammatoire par l’intermédiaire de la régulation transcriptionnelle de gènes tels que ceux de la pro-dynorphine et du récepteur NK1 de la substance P [ 2, 3].
Dans l’étude publiée dans Neuron [1], en réponse à une inflammation périphérique, p38 MAPK est phosphorylée et activée dans les corps cellulaires des neurones du GRD et ce de façon prolongée pendant sept jours. Cette augmentation de la phosphorylation de p38 MAPK prédomine dans les corps cellulaires des neurones de petit diamètre du GRD, ceux qui sont associés aux fibres C nociceptives non myélinisées; de plus elle est sélective, et ne concerne pas la CDME où la forme phosphorylée de p38 MAPK n’est présente que dans des cellules non neuronales et en petite quantité (Figure 1).
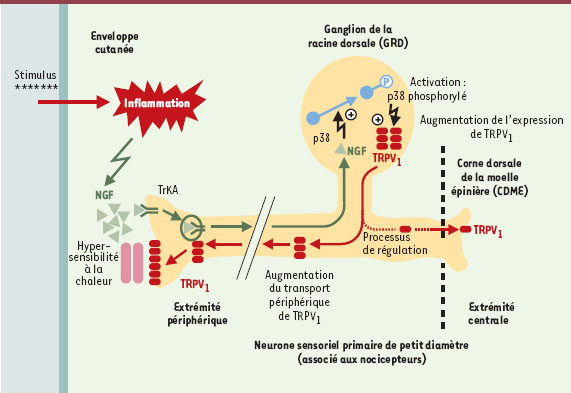
| Figure 1.
Représentation schématique du rôle exercé par le NGF au cours de l’inflammation sur la phosphorylation de p38 MAPK dans la régulation de la synthèse de TRPV1 au niveau traductionnel. Le stimulus inflammatoire entraîne l’activation de TrkA par la fixation de son ligand NGF, puis son transport dans les ganglions de la racine dorsale où il entraîne l’activation/phosphorylation de p38. p38 phosphorylé agit sur la traduction de TRPV1, dont l’essentiel est transporté en sens inverse dans la terminaison périphérique des fibres nociceptives et très peu vers l’extrémité centrale. L’augmentation de la synthèse de TRPV1 et son transport préférentiel sont à l’origine de l’augmentation de la sensibilité à la chaleur caractéristique de la douleur inflammatoire. |
Or il y a un lien chronologique dans le GRD entre la phosphorylation de p38 MAPK et l’augmentation, 48 heures après l’inflammation, de la quantité de protéine TRPV1 ainsi que de la proportion de neurones exprimant ce récepteur. Surtout, le lien direct est établi par l’injection d’un inhibiteur spécifique de p38 MAPK qui inhibe ces deux paramètres. D’un point de vue mécanistique, l’augmentation de la synthèse de TRPV1 au cours de l’inflammation ne résulte pas d’un processus transcriptionnel, mais d’une régulation traductionnelle. L’injection d’un inhibiteur de p38 MAPK affecte également le transport antérograde massif de TRPV1 le long du nerf sciatique, du GRD vers les terminaisons périphériques de la peau, et faiblement le long des racines dorsales, du GRD vers les terminaisons centrales des couches périphériques de la CDME.
Le NGF, troisième partenaire, est également impliqué. L’administration d’un anticorps anti-NGF au cours de l’inflammation diminue la phosphorylation de p38 MAPK, l’augmentation de TRPV1 et l’hypersensibilité à la chaleur. À l’inverse, une injection intrathécale de NGF augmente, dans le GRD, la quantité de protéine TRPV1 (mais pas les quantités de transcrits) ainsi que la phosphorylation de p38 MAPK. L’administration simultanée d’un inhibiteur spécifique de p38 MAPK avec le NGF diminue significativement l’augmentation de TRPV1.
Tous ces résultats permettent de proposer un modèle de l’hyperalgésie à la chaleur au cours de l’inflammation, reposant sur la phosphorylation de p38 MAPK dans le neurone sensoriel primaire: le complexe NGF-TrkA, activé en périphérie, une fois parvenu dans les corps cellulaires des neurones du GRD, active p38 MAPK qui a son tour contrôle l’augmentation de la traduction et le transport de TRPV1 vers les terminaisons périphériques des nocicepteurs où il contribue à l’hypersensibilité à la chaleur. Cet effet est limité aux neurones de petit diamètre du GRD associés aux nocicepteurs. Ces données identifient aussi un autre point de contrôle: celui qui intervient au point de branchement de l’axone dans le GRD et engage TRPV1 vers une destination périphérique (terminaisons périphériques cutanées) plus que centrale (neurones sensoriels primaires).
On est donc en présence d’une forme nouvelle de régulation de la fonction sensorielle neuronale: un changement (phosphorylation de p38 MAPK) déclenché par un signal spécifique (l’inflammation) restreint à un sous-ensemble particulier de neurones périphériques (les neurones nociceptifs), est relié à l’hyperalgésie inflammatoire strictement thermique, par une augmentation de la quantité de transducteurs sensibles à la chaleur (récepteurs TRPV1) présents dans les terminaisons périphériques. Soulignons que ce processus, affectant la traduction de TRPV1 sans affecter sa transcription, échappe à toute méthode de détection reposant sur la régulation différentielle de l’expression de gènes, comme les puces à ADN