L’athérosclérose est un processus physiopathologique multifactoriel, qui fait intervenir des facteurs de risque génétiques et environnementaux. Elle pose un problème majeur de santé publique, puisque les pathologies par athérosclérose représentent aujourd’hui la première cause de mortalité et de morbidité dans les pays industrialisés [ 1]. La corrélation négative entre la concentration plasmatique des lipoprotéines de haute densité (HDL) et l’incidence des maladies cardiovasculaires est connue depuis plus de 25 ans [ 2], les HDL constituant actuellement le seul facteur protecteur connu vis-à-vis de l’infarctus du myocarde. Cela est classiquement attribué à leur capacité d’épurer les cellules des tissus périphériques de leur excès de cholestérol pour ramener celui-ci au foie, permettant ainsi son élimination via les voies biliaires et réduisant de ce fait l’importance des lésions athéroscléreuses. Ce «transport retour» est la seule voie stricto sensu d’élimination du cholestérol. Son importance physiologique a été à l’origine de nombreuses études focalisées sur l’identification de récepteurs hépatocytaires de surface pour les HDL qui pourraient contrôler le transport-retour de cholestérol.
En raison de la grande hétérogénéité des HDL plasmatiques, les mécanismes régissant les interactions HDL-hépatocytes sont encore peu connus, mais font vraisemblablement intervenir l’apolipoprotéine AI (apoA-I), protéine majoritaire des HDL. Bien que plusieurs protéines de liaison des HDL aux hépatocytes aient déjà été décrites et leurs gènes clonés, leur rôle physiologique reste souvent indéterminé [ 3, 4]. Ainsi, à l’heure actuelle, seule la protéine SR-BI (scavenger receptor class B type I) est clairement impliquée dans la capture des esters de cholestérol des HDL par le foie et les tissus producteurs de stéroïdes chez les rongeurs [ 5, 6]; l’importance physiologique de son homologue humain n’est toutefois pas établie. Plus récemment, le rôle majeur d’une protéine de la famille des ATP-binding cassette, ABCA-1, dans l’efflux de phospholipides et de cholestérol des cellules périphériques, et en particulier des macrophages, a été révélé. Le déficit en ABCA-1 est responsable de la maladie de Tangier qui se caractérise notamment par une quasi-absence de HDL circulantes, exposant les patients à un risque accru de développement de maladies cardiovasculaires. L’existence d’une liaison directe de l’apoA-I sur la protéine ABCA-1 a été suggérée, mais reste un sujet de controverses [ 7, 8]. De manière intéressante, ABCA-1 semble abondamment exprimée au niveau du foie, mais les souris déficientes en ABCA-1 (Abca1−/− ), ne présentent aucune modification dans la sécrétion biliaire de cholestérol, de sels biliaires et de phospholipides en comparaison des souris témoins (Abca1+/+ ) [ 9]. Ainsi, un certain nombre de protéines candidates potentiellement impliquées dans l’interaction des HDL avec les cellules hépatiques sont apparues, mais leur importance physiologique, chez l’homme notamment, reste à établir. Par ailleurs, on peut concevoir qu’à côté de ces protéines contrôlant les mouvements du cholestérol, intervienne(nt) un (des) récepteur(s) spécifique(s) de l’apoA-I (coopérant avec ces différentes protéines).
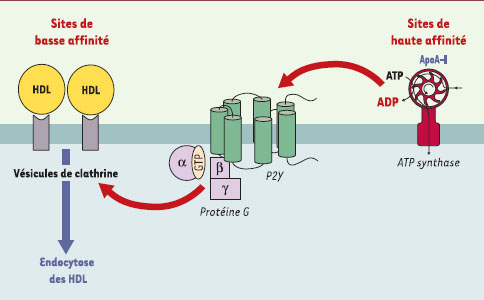
C’est dans ce contexte que nous venons de purifier et de caractériser un récepteur de haute affinité pour l’apoA-I, situé à la surface des hépatocytes [ 10]. Ce récepteur a été identifié comme étant la chaîneβ de l’ATP synthase, un complexe protéique majeur du feuillet interne de la mitochondrie. Sa localisation à la surface des hépatocytes humains a été confirmée par différentes approches expérimentales (microscopie confocale, cytofluorométrie…). Sa présence est associée à une activité ATP hydrolase à la surface cellulaire, suggérant que l’enzyme entière pourrait y être présente. Par ailleurs, nous avons observé que l’apoA-I stimule fortement l’endocytose des HDL. Or, cette endocytose apparaît strictement dépendante de l’ADP produit après stimulation de l’ATP synthase de surface par l’apoA-I. Ainsi, un nouveau rôle a été démontré pour une ATP synthase/ hydrolase ectopique, capable de moduler les niveaux extracellulaires d’ADP et contrôlée par une apolipoprotéine plasmatique majeure, l’apoA-I. Pour évaluer l’implication physiologique de ces observations, des expériences ont été réalisées sur des foies de rat perfusés : un inhibiteur spécifique de l’activité hydrolase de l’ATP synthase, l’IF1, induit une diminution importante de l’internalisation des HDL par le foie, ce qui semble indiquer que, au moins chez les rongeurs, l’ATP synthase de surface est impliquée dans l’endocytose des HDL.
Ces travaux ont permis de démontrer que l’endocytose hépatique des HDL est contrôlée, dès le niveau membranaire, par l’activité ATP hydrolase de l’ATP synthase de surface, en amont de récepteurs purinergiques qui vont prendre ensuite le relais dans cette cascade de régulation de l’endocytose des HDL (Figure 1). L’ensemble de cette nouvelle voie métabolique ajoute un élément important, sorte de «chaînon manquant», à la compréhension des mécanismes contrôlant la dynamique du transport-retour du cholestérol et susceptibles de devenir, dans un proche avenir, des cibles pharmacologiques de choix pour la modulation de l’homéostasie du cholestérol.
La présence de l’ATP synthase au niveau de la membrane plasmique a déjà été rapportée dans des cellules endothéliales humaines [ 11, 12], où elle serait un récepteur de l’angiostatine, suggérant son implication dans l’angiogenèse. L’ATP synthase a également été localisée à la surface de certaines lignées tumorales lymphocytaires[ 13], pouvant ainsi constituer un marqueur de tumorigénicité.
Mais la présence inattendue, à la surface de plusieurs types cellulaires, de l’ATP synthase pose maintenant la question des mécanismes permettant cette localisation membranaire, et laisse entrevoir que les mitochondries pourraient jouer un rôle nouveau, insoupçonné à ce jour. Par ailleurs, elle relance la question des rôles physiologiques de l’apoA-I, protéine abondante dans le plasma et qui, comme ligand de cette ATP synthase membranaire, pourrait intervenir dans divers processus physiopathologiques tels que l’athérosclérose ou l’angiogenèse.