II. Épidémiologie
2013
| ANALYSE |
12-
Maladie de Parkinson1
 ). Elle est liée à la perte progressive des neurones dopaminergiques d’une structure mésencéphalique impliquée dans la régulation de l’activité des noyaux gris centraux, la substantia nigra pars compacta, qui joue un rôle important dans le contrôle de la motricité. Cette perte neuronale est caractérisée par la présence d’inclusions neuronales typiques (corps de Lewy).
). Elle est liée à la perte progressive des neurones dopaminergiques d’une structure mésencéphalique impliquée dans la régulation de l’activité des noyaux gris centraux, la substantia nigra pars compacta, qui joue un rôle important dans le contrôle de la motricité. Cette perte neuronale est caractérisée par la présence d’inclusions neuronales typiques (corps de Lewy).Diagnostic, traitement médical et évolution
 ). Certains peuvent apparaître au cours de l’évolution de la maladie (par exemple, déclin cognitif), tandis que d’autres (par exemple, anosmie, constipation, troubles de l’humeur ou du sommeil paradoxal) peuvent être présents d’emblée voire des années avant l’apparition des signes moteurs (Savica et coll., 2010
). Certains peuvent apparaître au cours de l’évolution de la maladie (par exemple, déclin cognitif), tandis que d’autres (par exemple, anosmie, constipation, troubles de l’humeur ou du sommeil paradoxal) peuvent être présents d’emblée voire des années avant l’apparition des signes moteurs (Savica et coll., 2010 ).
).Diagnostic
 ). Ainsi, aucun examen complémentaire ne permet d’établir le diagnostic avec certitude en dehors de l’examen anatomopathologique du cerveau. De nombreuses études tentent d’identifier des biomarqueurs : si certains résultats comme le dosage d’oligomères de l’α-synucléine dans le liquide céphalo-rachidien semblent prometteurs (Tokuda et coll., 2010
). Ainsi, aucun examen complémentaire ne permet d’établir le diagnostic avec certitude en dehors de l’examen anatomopathologique du cerveau. De nombreuses études tentent d’identifier des biomarqueurs : si certains résultats comme le dosage d’oligomères de l’α-synucléine dans le liquide céphalo-rachidien semblent prometteurs (Tokuda et coll., 2010 ), leur utilisation comme test diagnostique est débattue (Ballard et Jones, 2010
), leur utilisation comme test diagnostique est débattue (Ballard et Jones, 2010 ).
).Traitement médical et prise en charge
 ). Une prévalence plus élevée de 4,0 pour 1 000, avec 14 200 affiliés en ALD pour maladie de Parkinson, était estimée en France métropolitaine au 31 décembre 2007 par la Mutualité Sociale Agricole (MSA, 2011
). Une prévalence plus élevée de 4,0 pour 1 000, avec 14 200 affiliés en ALD pour maladie de Parkinson, était estimée en France métropolitaine au 31 décembre 2007 par la Mutualité Sociale Agricole (MSA, 2011 ). Cette prévalence plus élevée est expliquée, au moins en partie, par l’âge plus élevé de la population couverte par la MSA (Moisan et coll., 2011
). Cette prévalence plus élevée est expliquée, au moins en partie, par l’âge plus élevé de la population couverte par la MSA (Moisan et coll., 2011 ). Il est à noter que tous les patients traités pour maladie de Parkinson ne sont pas en ALD et qu’il n’est pas possible d’estimer la fréquence de la maladie de manière précise uniquement à partir de ces sources.
). Il est à noter que tous les patients traités pour maladie de Parkinson ne sont pas en ALD et qu’il n’est pas possible d’estimer la fréquence de la maladie de manière précise uniquement à partir de ces sources.Évolution et histoire naturelle
 ; Hawkes, 2008
; Hawkes, 2008 ). Plus récemment, des études de cohorte ont montré que certains symptômes pré-moteurs (anosmie, constipation, troubles du sommeil paradoxal) traduisant une atteinte d’autres structures (respectivement : bulbe olfactif, tube digestif, locus coeruleus) peuvent exister 20 ans avant l’apparition des signes moteurs (Hawkes, 2008
). Plus récemment, des études de cohorte ont montré que certains symptômes pré-moteurs (anosmie, constipation, troubles du sommeil paradoxal) traduisant une atteinte d’autres structures (respectivement : bulbe olfactif, tube digestif, locus coeruleus) peuvent exister 20 ans avant l’apparition des signes moteurs (Hawkes, 2008 ; Savica et coll., 2010
; Savica et coll., 2010 ). Des études anatomopathologiques montrent également que les corps de Lewy peuvent être présents dans d’autres structures, en particulier le système nerveux autonome digestif (Braak et coll., 2006
). Des études anatomopathologiques montrent également que les corps de Lewy peuvent être présents dans d’autres structures, en particulier le système nerveux autonome digestif (Braak et coll., 2006 ; Minguez-Castellanos et coll., 2007
; Minguez-Castellanos et coll., 2007 ). Ces résultats soulignent la difficulté qu’il y a à définir une fenêtre de susceptibilité (cf. paragraphe « Difficultés méthodologiques »).
). Ces résultats soulignent la difficulté qu’il y a à définir une fenêtre de susceptibilité (cf. paragraphe « Difficultés méthodologiques »). ; Herlofson et coll., 2004
; Herlofson et coll., 2004 ). Les principales caractéristiques cliniques associées à une plus grande mortalité incluent la sévérité des symptômes moteurs (D’Amelio et coll., 2006
). Les principales caractéristiques cliniques associées à une plus grande mortalité incluent la sévérité des symptômes moteurs (D’Amelio et coll., 2006 ) et la présence d’une démence (Herlofson et coll., 2004
) et la présence d’une démence (Herlofson et coll., 2004 ).
).Incidence et prévalence
 ; von Campenhausen et coll., 2005
; von Campenhausen et coll., 2005 ). Le risque vie entière de maladie de Parkinson a été estimé comme étant approximativement de 2,0 % chez les hommes et 1,3 % chez les femmes, après prise en compte de la différence d’espérance de vie entre les deux sexes (Elbaz et coll., 2002
). Le risque vie entière de maladie de Parkinson a été estimé comme étant approximativement de 2,0 % chez les hommes et 1,3 % chez les femmes, après prise en compte de la différence d’espérance de vie entre les deux sexes (Elbaz et coll., 2002 ).
). ). Elle augmente avec l’âge et elle est comprise entre 1 000 et 1 500 pour 100 000 personnes après 60 ans.
). Elle augmente avec l’âge et elle est comprise entre 1 000 et 1 500 pour 100 000 personnes après 60 ans. ), avec une prévalence de l’ordre de 1 à 10 pour 100 000 personnes (Nath et coll., 2001
), avec une prévalence de l’ordre de 1 à 10 pour 100 000 personnes (Nath et coll., 2001 ).
). ). En revanche, une méta-analyse de six études retrouve une prévalence plus faible en Afrique qu’en Europe ou en Amérique du nord (Okubadejo et coll., 2006
). En revanche, une méta-analyse de six études retrouve une prévalence plus faible en Afrique qu’en Europe ou en Amérique du nord (Okubadejo et coll., 2006 ). D’après une revue d’études menées en Asie, la prévalence de la maladie de Parkinson serait légèrement plus faible que dans les pays occidentaux (Muangpaisan et coll., 2009
). D’après une revue d’études menées en Asie, la prévalence de la maladie de Parkinson serait légèrement plus faible que dans les pays occidentaux (Muangpaisan et coll., 2009 ), même si certaines études retrouvent des estimations similaires (Zhang et coll., 2005
), même si certaines études retrouvent des estimations similaires (Zhang et coll., 2005 ). Toutefois, il est difficile de savoir si ces différences sont dues à des facteurs d’ordre méthodologique (cf. « Difficultés méthodologiques ») ou environnementaux ou si elles reflètent des différences entre les populations (espérance de vie). Une étude en porte-à-porte menée dans le Mississipi (États-Unis) chez des Noirs américains et des Caucasiens et au Nigeria, et employant la même méthodologie ne retrouvait pas de différence importante de prévalence entre les deux groupes ethniques du Mississipi (341/100 000 après 40 ans), tandis qu’au Nigéria la prévalence était plus faible (67/100 000 après 40 ans) (Schoenberg et coll., 1988
). Toutefois, il est difficile de savoir si ces différences sont dues à des facteurs d’ordre méthodologique (cf. « Difficultés méthodologiques ») ou environnementaux ou si elles reflètent des différences entre les populations (espérance de vie). Une étude en porte-à-porte menée dans le Mississipi (États-Unis) chez des Noirs américains et des Caucasiens et au Nigeria, et employant la même méthodologie ne retrouvait pas de différence importante de prévalence entre les deux groupes ethniques du Mississipi (341/100 000 après 40 ans), tandis qu’au Nigéria la prévalence était plus faible (67/100 000 après 40 ans) (Schoenberg et coll., 1988 ). Les auteurs interprétaient ces résultats comme étant en faveur du rôle de facteurs environnementaux dans la maladie de Parkinson.
). Les auteurs interprétaient ces résultats comme étant en faveur du rôle de facteurs environnementaux dans la maladie de Parkinson. ). Une étude a néanmoins montré la stabilité de l’incidence de la maladie de Parkinson sur une courte période (1976-1990) dans une petite région (comté d’Olmsted) de l’État du Minnesota (Rocca et coll., 2001
). Une étude a néanmoins montré la stabilité de l’incidence de la maladie de Parkinson sur une courte période (1976-1990) dans une petite région (comté d’Olmsted) de l’État du Minnesota (Rocca et coll., 2001 ) où il existe une agriculture principalement céréalière. Il semble donc que dans cette région du nord des États-Unis, aucun facteur de risque environnemental de la maladie de Parkinson ne soit intervenu au cours de cette courte période. En revanche, une étude finlandaise indique une augmentation de l’incidence de la maladie de Parkinson entre 1971 et 1992 chez les hommes (14,9/100 000 personnes-années en 1971 et 21,5/100 000 personnes-années en 1992) tandis que l’incidence a diminué chez les femmes (16,1/100 000 personnes-années en 1971 et 11,0/100 000 personnes-années en 1992) (Kuopio et coll., 1999a
) où il existe une agriculture principalement céréalière. Il semble donc que dans cette région du nord des États-Unis, aucun facteur de risque environnemental de la maladie de Parkinson ne soit intervenu au cours de cette courte période. En revanche, une étude finlandaise indique une augmentation de l’incidence de la maladie de Parkinson entre 1971 et 1992 chez les hommes (14,9/100 000 personnes-années en 1971 et 21,5/100 000 personnes-années en 1992) tandis que l’incidence a diminué chez les femmes (16,1/100 000 personnes-années en 1971 et 11,0/100 000 personnes-années en 1992) (Kuopio et coll., 1999a ).
). ). Dans cette même région, l’incidence de la maladie de Parkinson a été estimée dans l’étude Paquid (Perez et coll., 2010
). Dans cette même région, l’incidence de la maladie de Parkinson a été estimée dans l’étude Paquid (Perez et coll., 2010 ) ; après 15 ans de suivi, 68 cas incidents de maladie de Parkinson ont été identifiés chez les participants âgés de plus de 65 ans à l’inclusion correspondant à une incidence de 263/100 000 personnes-années, similaire à celle observée dans d’autres pays européens. Une autre étude réalisée en 2000 à partir des données de remboursement de l’Assurance Maladie, incluant les bénéficiaires du régime général âgés de 65 ans et plus, rapporte une prévalence de la maladie de Parkinson de 1 250 pour 100 000 personnes (Bertin et coll., 2005
) ; après 15 ans de suivi, 68 cas incidents de maladie de Parkinson ont été identifiés chez les participants âgés de plus de 65 ans à l’inclusion correspondant à une incidence de 263/100 000 personnes-années, similaire à celle observée dans d’autres pays européens. Une autre étude réalisée en 2000 à partir des données de remboursement de l’Assurance Maladie, incluant les bénéficiaires du régime général âgés de 65 ans et plus, rapporte une prévalence de la maladie de Parkinson de 1 250 pour 100 000 personnes (Bertin et coll., 2005 ). À l’aide d’un modèle prédictif établi à partir des remboursements des médicaments antiparkinsoniens sur un an (2007) des affiliés à la Mutualité Sociale Agricole dans 5 départements français et validé sur un sous-ensemble de cette population (cf. partie « Difficultés méthodologiques »), une étude récente a estimé une prévalence standardisée sur la population française de 2007 de 293 pour 100 000 ; elle était de 1 525 pour 100 000 après 65 ans (Moisan et coll., 2011b
). À l’aide d’un modèle prédictif établi à partir des remboursements des médicaments antiparkinsoniens sur un an (2007) des affiliés à la Mutualité Sociale Agricole dans 5 départements français et validé sur un sous-ensemble de cette population (cf. partie « Difficultés méthodologiques »), une étude récente a estimé une prévalence standardisée sur la population française de 2007 de 293 pour 100 000 ; elle était de 1 525 pour 100 000 après 65 ans (Moisan et coll., 2011b ).
).Étiologie et facteurs de risque
 ).
). ; Wirdefeldt et coll., 2004
; Wirdefeldt et coll., 2004 et 2011b
et 2011b ). Elles suggèrent que la composante génétique ne joue pas un rôle majeur dans la maladie de Parkinson sauf pour les cas à début précoce chez qui elle joue un rôle plus important. Par exemple, dans une étude américaine, parmi 16 paires de jumeaux dont la maladie de Parkinson avait commencé avant 50 ans pour au moins l’un d’entre eux, la concordance était de 100 % pour les jumeaux monozygotes (4 paires) contre 17 % chez les jumeaux dizygotes (12 paires) (Tanner et coll., 1999
). Elles suggèrent que la composante génétique ne joue pas un rôle majeur dans la maladie de Parkinson sauf pour les cas à début précoce chez qui elle joue un rôle plus important. Par exemple, dans une étude américaine, parmi 16 paires de jumeaux dont la maladie de Parkinson avait commencé avant 50 ans pour au moins l’un d’entre eux, la concordance était de 100 % pour les jumeaux monozygotes (4 paires) contre 17 % chez les jumeaux dizygotes (12 paires) (Tanner et coll., 1999 ). De même, les études d’agrégation familiale montrent que le risque de maladie de Parkinson chez les apparentés de patients parkinsoniens est plus élevé lorsque la maladie a débuté à un âge précoce (Thacker et Ascherio, 2008
). De même, les études d’agrégation familiale montrent que le risque de maladie de Parkinson chez les apparentés de patients parkinsoniens est plus élevé lorsque la maladie a débuté à un âge précoce (Thacker et Ascherio, 2008 ).
). ). Elles ne concernent qu’une minorité de patients et ont souvent des caractéristiques particulières, notamment un âge de début précoce (Hardy, 2010
). Elles ne concernent qu’une minorité de patients et ont souvent des caractéristiques particulières, notamment un âge de début précoce (Hardy, 2010 ; Wirdefeldt et coll., 2011a
; Wirdefeldt et coll., 2011a ). En plus de ces formes mendéliennes, plusieurs gènes de susceptibilité sont incriminés dans les formes sporadiques avec des odds ratio (OR) compris approximativement entre 0,7 et 3,02
.
). En plus de ces formes mendéliennes, plusieurs gènes de susceptibilité sont incriminés dans les formes sporadiques avec des odds ratio (OR) compris approximativement entre 0,7 et 3,02
. ). À cette date, le groupe d’experts avait retenu un niveau de preuve « suffisant » uniquement pour le tabagisme et la consommation de café.
). À cette date, le groupe d’experts avait retenu un niveau de preuve « suffisant » uniquement pour le tabagisme et la consommation de café. ). Une étude plus récente réalisée à partir des données individuelles de huit études cas-témoins et de trois études de cohorte conduites aux États-Unis retrouve également une association inverse entre le tabagisme et la maladie de Parkinson (Ritz et coll., 2007
). Une étude plus récente réalisée à partir des données individuelles de huit études cas-témoins et de trois études de cohorte conduites aux États-Unis retrouve également une association inverse entre le tabagisme et la maladie de Parkinson (Ritz et coll., 2007 ). Cette association existe aussi bien chez les hommes que chez les femmes (Ritz et coll., 2007
). Cette association existe aussi bien chez les hommes que chez les femmes (Ritz et coll., 2007 ; Chen et coll., 2010
; Chen et coll., 2010 ). Plusieurs études rapportent une relation dose-effet en fonction du nombre de paquets-années ou du nombre d’années de tabagisme (Hernan et coll., 2002
). Plusieurs études rapportent une relation dose-effet en fonction du nombre de paquets-années ou du nombre d’années de tabagisme (Hernan et coll., 2002 ; Ritz et coll., 2007
; Ritz et coll., 2007 ). Plus récemment, une étude de cohorte a cherché à distinguer le rôle respectif de la durée et de l’intensité du tabagisme. Dans cette étude, la durée du tabagisme semblait plus déterminante que l’intensité (Chen et coll., 2010
). Plus récemment, une étude de cohorte a cherché à distinguer le rôle respectif de la durée et de l’intensité du tabagisme. Dans cette étude, la durée du tabagisme semblait plus déterminante que l’intensité (Chen et coll., 2010 ).
). ). Une seule étude cas-témoins s’est intéressée au rôle du tabagisme passif, qui est moins susceptible d’être affecté par des facteurs génétiques, la personnalité ou d’autres comportements. Cette étude retrouvait une association inverse à la limite de la significativité entre la maladie de Parkinson et le fait de vivre ou de travailler avec des fumeurs (Mellick et coll., 2006
). Une seule étude cas-témoins s’est intéressée au rôle du tabagisme passif, qui est moins susceptible d’être affecté par des facteurs génétiques, la personnalité ou d’autres comportements. Cette étude retrouvait une association inverse à la limite de la significativité entre la maladie de Parkinson et le fait de vivre ou de travailler avec des fumeurs (Mellick et coll., 2006 ).
). ). D’autres auteurs ont évoqué les propriétés antioxydantes de la nicotine (Ross et Petrovitch, 2001
). D’autres auteurs ont évoqué les propriétés antioxydantes de la nicotine (Ross et Petrovitch, 2001 ). Une étude a montré que parmi cinq composés de la fumée de cigarette (anabasine, cotinine, hydroquinone, nicotine et nornicotine), la nicotine et l’hydroquinone entraînent une inhibition marquée de l’agrégation de l’α-synucléine (Hong et coll., 2009
). Une étude a montré que parmi cinq composés de la fumée de cigarette (anabasine, cotinine, hydroquinone, nicotine et nornicotine), la nicotine et l’hydroquinone entraînent une inhibition marquée de l’agrégation de l’α-synucléine (Hong et coll., 2009 ). Cependant, les études toxicologiques sur le tabagisme restent difficiles puisque la fumée de cigarette comprend plus de 4 000 molécules différentes.
). Cependant, les études toxicologiques sur le tabagisme restent difficiles puisque la fumée de cigarette comprend plus de 4 000 molécules différentes. ). Une méta-analyse de huit études cas-témoins et de quatre études de cohorte sur la relation entre la consommation de café et la maladie de Parkinson retrouve une diminution du risque de maladie de Parkinson de 30 % (OR=0,69 ; IC 95 % [0,59-0,80]) parmi les buveurs de café par rapport à ceux n’en consommant pas (Hernan et coll., 2002
). Une méta-analyse de huit études cas-témoins et de quatre études de cohorte sur la relation entre la consommation de café et la maladie de Parkinson retrouve une diminution du risque de maladie de Parkinson de 30 % (OR=0,69 ; IC 95 % [0,59-0,80]) parmi les buveurs de café par rapport à ceux n’en consommant pas (Hernan et coll., 2002 ). Cette relation est indépendante du tabagisme et la diminution de risque est d’autant plus importante que le nombre de tasses de café consommées par jour augmente.
). Cette relation est indépendante du tabagisme et la diminution de risque est d’autant plus importante que le nombre de tasses de café consommées par jour augmente. ). Il existe une relation dose-effet avec un risque d’autant plus faible que la consommation de caféine est élevée. Cette association n’est pas expliquée par le tabagisme puisque la majorité des études ont pris en compte le tabagisme. L’association entre la consommation de caféine et la maladie de Parkinson a également été observée parmi les participants ne consommant pas de café et pour qui les sources de caféine étaient principalement le thé et le cola (Ross et coll., 2000
). Il existe une relation dose-effet avec un risque d’autant plus faible que la consommation de caféine est élevée. Cette association n’est pas expliquée par le tabagisme puisque la majorité des études ont pris en compte le tabagisme. L’association entre la consommation de caféine et la maladie de Parkinson a également été observée parmi les participants ne consommant pas de café et pour qui les sources de caféine étaient principalement le thé et le cola (Ross et coll., 2000 ). Quelques études ont évalué séparément le rôle du café avec et sans caféine et aucune association entre la maladie de Parkinson et la consommation de café décaféiné n’est observée (Ascherio et coll., 2001
). Quelques études ont évalué séparément le rôle du café avec et sans caféine et aucune association entre la maladie de Parkinson et la consommation de café décaféiné n’est observée (Ascherio et coll., 2001 ; Paganini-Hill, 2001
; Paganini-Hill, 2001 ). De même, une étude chinoise retrouve une association entre le thé noir contenant de la caféine et la maladie de Parkinson, tandis qu’il n’existait pas de relation avec le thé vert qui ne contient pas de caféine (Tan et coll., 2008
). De même, une étude chinoise retrouve une association entre le thé noir contenant de la caféine et la maladie de Parkinson, tandis qu’il n’existait pas de relation avec le thé vert qui ne contient pas de caféine (Tan et coll., 2008 ). Ainsi, parmi toutes les molécules contenues dans le café, la caféine semble être celle qui pourrait expliquer le mieux la relation entre la consommation de café et la maladie de Parkinson.
). Ainsi, parmi toutes les molécules contenues dans le café, la caféine semble être celle qui pourrait expliquer le mieux la relation entre la consommation de café et la maladie de Parkinson.Difficultés méthodologiques des études épidémiologiques
Critères diagnostiques et méthodes pour identifier les patients parkinsoniens
 ; Newman et coll., 2009a
; Newman et coll., 2009a ). L’examen anatomopathologique des patients montre les bonnes performances du diagnostic établi par des neurologues (valeur prédictive positive=90 %) (Hughes et coll., 2001
). L’examen anatomopathologique des patients montre les bonnes performances du diagnostic établi par des neurologues (valeur prédictive positive=90 %) (Hughes et coll., 2001 ), en particulier si le neurologue est spécialisé dans les mouvements anormaux (valeur prédictive positive=98 %) (Hughes et coll., 2002
), en particulier si le neurologue est spécialisé dans les mouvements anormaux (valeur prédictive positive=98 %) (Hughes et coll., 2002 ). Toutefois, ces études ont été réalisées dans des centres spécialisés dans la prise en charge des patients parkinsoniens et il est probable que ces résultats ne puissent être généralisés à la population générale. Les estimations de la fréquence de la maladie de Parkinson varient selon les critères diagnostiques retenus et leur stringence (de Rijk et coll., 1997a
). Toutefois, ces études ont été réalisées dans des centres spécialisés dans la prise en charge des patients parkinsoniens et il est probable que ces résultats ne puissent être généralisés à la population générale. Les estimations de la fréquence de la maladie de Parkinson varient selon les critères diagnostiques retenus et leur stringence (de Rijk et coll., 1997a ; Bower et coll., 2000
; Bower et coll., 2000 ). Par ailleurs, les études épidémiologiques qui reposent sur un diagnostic déclaré ou sur des codes issus de bases administratives sans validation ultérieure comportent un plus important risque d’erreur de classement.
). Par ailleurs, les études épidémiologiques qui reposent sur un diagnostic déclaré ou sur des codes issus de bases administratives sans validation ultérieure comportent un plus important risque d’erreur de classement. ), les certificats de décès (Mylne et coll., 2009
), les certificats de décès (Mylne et coll., 2009 ), les services hospitaliers, les registres (Strickland et Bertoni, 2004
), les services hospitaliers, les registres (Strickland et Bertoni, 2004 ), les bases de données administratives (Errea et coll., 1999
), les bases de données administratives (Errea et coll., 1999 ) ou la consommation de médicaments antiparkinsoniens. Ces différentes méthodes peuvent avoir un impact important sur les résultats obtenus.
) ou la consommation de médicaments antiparkinsoniens. Ces différentes méthodes peuvent avoir un impact important sur les résultats obtenus. ; Beyer et coll., 2001
; Beyer et coll., 2001 ) ; des études comparables ne sont pas disponibles en France. Les études qui reposent sur des cas identifiés dans des services hospitaliers comportent un risque de biais de sélection puisqu’elles concernent des patients souvent plus jeunes avec une plus grande fréquence d’antécédents familiaux et qui ne sont donc pas représentatifs de l’ensemble des patients parkinsoniens. Quelques études scandinaves reposent sur des causes d’hospitalisation mais la maladie de Parkinson n’est pas fréquemment la cause principale d’hospitalisation, en particulier pendant les premières années d’évolution d’où une sous-estimation du nombre de patients et une surévaluation de l’âge de diagnostic.
) ; des études comparables ne sont pas disponibles en France. Les études qui reposent sur des cas identifiés dans des services hospitaliers comportent un risque de biais de sélection puisqu’elles concernent des patients souvent plus jeunes avec une plus grande fréquence d’antécédents familiaux et qui ne sont donc pas représentatifs de l’ensemble des patients parkinsoniens. Quelques études scandinaves reposent sur des causes d’hospitalisation mais la maladie de Parkinson n’est pas fréquemment la cause principale d’hospitalisation, en particulier pendant les premières années d’évolution d’où une sous-estimation du nombre de patients et une surévaluation de l’âge de diagnostic. et 1985
et 1985 ; Aquilonius et Hartvig, 1986
; Aquilonius et Hartvig, 1986 ; Menniti-Ippolito et coll., 1995
; Menniti-Ippolito et coll., 1995 ; Chio et coll., 1998
; Chio et coll., 1998 ; van de Vijver et coll., 2001
; van de Vijver et coll., 2001 ; Lai et coll., 2003
; Lai et coll., 2003 ; Yesavage et coll., 2004
; Yesavage et coll., 2004 ; Brandt-Christensen et coll., 2006
; Brandt-Christensen et coll., 2006 ; Newman et coll., 2009a
; Newman et coll., 2009a ; Szumski et Cheng, 2009
; Szumski et Cheng, 2009 ; Masalha et coll., 2010
; Masalha et coll., 2010 ). Une étude réalisée dans cinq départements français parmi les affiliés de la Mutualité Sociale Agricole a montré que cette approche avait une sensibilité et une spécificité correctes, en particulier après prise en compte de l’ensemble des médicaments, de leur dose et de la régularité des prescriptions (Moisan et coll., 2011a
). Une étude réalisée dans cinq départements français parmi les affiliés de la Mutualité Sociale Agricole a montré que cette approche avait une sensibilité et une spécificité correctes, en particulier après prise en compte de l’ensemble des médicaments, de leur dose et de la régularité des prescriptions (Moisan et coll., 2011a ).
).Méthodes utilisées pour caractériser les expositions
 ). Or, la perte de poids est associée avec une libération d’organochlorés stockés dans le tissu adipeux ce qui peut conduire à modifier la concentration plasmatique de ces marqueurs. Il est donc nécessaire de disposer d’études avec un délai suffisamment long entre la mesure initiale et la détection des cas incidents.
). Or, la perte de poids est associée avec une libération d’organochlorés stockés dans le tissu adipeux ce qui peut conduire à modifier la concentration plasmatique de ces marqueurs. Il est donc nécessaire de disposer d’études avec un délai suffisamment long entre la mesure initiale et la détection des cas incidents. ). L’existence d’une période pré-symptomatique (cf. paragraphe « Évolution et histoire naturelle ») suggère que les expositions dans les années précédant le début de maladie ne jouent pas un rôle dans sa survenue. Bien que la durée de cette période pré-symptomatique ne soit pas connue avec précision, il est habituel dans les études épidémiologiques d’exclure de l’analyse les expositions survenant dans les trois à sept ans avant le début de la maladie. Les études plus récentes qui ont identifié des symptômes pré-moteurs jusqu’à 20 ans avant l’apparition des signes moteurs suggèrent qu’il existe déjà probablement à la date de leur survenue un ou des facteurs de risque. Toutefois, une grande partie des personnes qui présentent ces signes pré-moteurs ne développent pas la maladie de Parkinson et il est peut-être trop simpliste de supposer qu’il existe une évolution linéaire depuis leur survenue jusqu’à l’apparition de la maladie. Il est par exemple possible d’envisager une évolution par paliers au cours desquels d’autres facteurs de risque se surajoutent tout au long de la vie (Savica et coll., 2010
). L’existence d’une période pré-symptomatique (cf. paragraphe « Évolution et histoire naturelle ») suggère que les expositions dans les années précédant le début de maladie ne jouent pas un rôle dans sa survenue. Bien que la durée de cette période pré-symptomatique ne soit pas connue avec précision, il est habituel dans les études épidémiologiques d’exclure de l’analyse les expositions survenant dans les trois à sept ans avant le début de la maladie. Les études plus récentes qui ont identifié des symptômes pré-moteurs jusqu’à 20 ans avant l’apparition des signes moteurs suggèrent qu’il existe déjà probablement à la date de leur survenue un ou des facteurs de risque. Toutefois, une grande partie des personnes qui présentent ces signes pré-moteurs ne développent pas la maladie de Parkinson et il est peut-être trop simpliste de supposer qu’il existe une évolution linéaire depuis leur survenue jusqu’à l’apparition de la maladie. Il est par exemple possible d’envisager une évolution par paliers au cours desquels d’autres facteurs de risque se surajoutent tout au long de la vie (Savica et coll., 2010 ).
).Exposition professionnelle aux pesticides et maladie de Parkinson
 ). Le MPTP est métabolisé en 1-méthyle-4-phénylpyridinium (MPP+), un inhibiteur de la chaîne respiratoire mitochondriale possédant des propriétés neurotoxiques sur les cellules dopaminergiques (cf. chapitre « Mécanismes d’action neurotoxique des pesticides »). Cette molécule a une structure chimique proche de celle du paraquat. Commercialisé depuis les années 1960, le paraquat est un herbicide non sélectif qui a été très largement utilisé dans le monde. Son utilisation est interdite dans les pays membres de l’Union Européenne depuis 2007, mais il est encore utilisé dans certains pays en voie de développement. C’est donc cette observation accidentelle et la similarité entre les deux molécules qui ont motivé les études sur le rôle de l’exposition aux pesticides dans la maladie de Parkinson.
). Le MPTP est métabolisé en 1-méthyle-4-phénylpyridinium (MPP+), un inhibiteur de la chaîne respiratoire mitochondriale possédant des propriétés neurotoxiques sur les cellules dopaminergiques (cf. chapitre « Mécanismes d’action neurotoxique des pesticides »). Cette molécule a une structure chimique proche de celle du paraquat. Commercialisé depuis les années 1960, le paraquat est un herbicide non sélectif qui a été très largement utilisé dans le monde. Son utilisation est interdite dans les pays membres de l’Union Européenne depuis 2007, mais il est encore utilisé dans certains pays en voie de développement. C’est donc cette observation accidentelle et la similarité entre les deux molécules qui ont motivé les études sur le rôle de l’exposition aux pesticides dans la maladie de Parkinson. ). Une seconde revue commandée par le Department for Environment, Food, and Rural Affairs anglais a été publiée en 2006 (Brown et coll., 2006
). Une seconde revue commandée par le Department for Environment, Food, and Rural Affairs anglais a été publiée en 2006 (Brown et coll., 2006 ). Une troisième a été réalisée par un groupe d’experts qui ont classé les expositions suivant les niveaux de preuve de l’Institute of Medicineà partir de la litttérature scientifique disponible jusqu’en 2007 (Bronstein et coll., 2009
). Une troisième a été réalisée par un groupe d’experts qui ont classé les expositions suivant les niveaux de preuve de l’Institute of Medicineà partir de la litttérature scientifique disponible jusqu’en 2007 (Bronstein et coll., 2009 ). Une quatrième plus récente, portant sur l’ensemble des caractéristiques épidémiologiques de la maladie de Parkinson et financée par un fabricant de pesticides, Syngenta Crop Protection, consacre plusieurs paragraphes au rôle des pesticides et présente des tableaux résumant les résultats des études sur cette exposition (Wirdefeldt et coll., 2011
). Une quatrième plus récente, portant sur l’ensemble des caractéristiques épidémiologiques de la maladie de Parkinson et financée par un fabricant de pesticides, Syngenta Crop Protection, consacre plusieurs paragraphes au rôle des pesticides et présente des tableaux résumant les résultats des études sur cette exposition (Wirdefeldt et coll., 2011 ). Une revue financée par Syngenta Crop Protection s’est intéressée exclusivement aux études épidémiologiques portant sur le paraquat et la roténone (Mandel et coll., 2012
). Une revue financée par Syngenta Crop Protection s’est intéressée exclusivement aux études épidémiologiques portant sur le paraquat et la roténone (Mandel et coll., 2012 ), tandis qu’une autre rapporte les études épidémiologiques et toxicologiques impliquant le paraquat (Berry et coll., 2010
), tandis qu’une autre rapporte les études épidémiologiques et toxicologiques impliquant le paraquat (Berry et coll., 2010 ). Une revue publiée en 2012 rassemble les études parues entre 2000 et 2011 portant aussi bien sur les expositions professionnelles qu’environnementales (Freire et Koifman, 2012
). Une revue publiée en 2012 rassemble les études parues entre 2000 et 2011 portant aussi bien sur les expositions professionnelles qu’environnementales (Freire et Koifman, 2012 ) ; deux autres revues sur ce même sujet sont disponibles (Dick, 2006
) ; deux autres revues sur ce même sujet sont disponibles (Dick, 2006 ; Moisan et Elbaz, 2011
; Moisan et Elbaz, 2011 ). Enfin, une revue a traité exclusivement les mécanismes toxicologiques évoqués pour expliquer la relation entre la maladie de Parkinson et l’exposition aux pesticides (Hatcher et coll., 2008
). Enfin, une revue a traité exclusivement les mécanismes toxicologiques évoqués pour expliquer la relation entre la maladie de Parkinson et l’exposition aux pesticides (Hatcher et coll., 2008 ). Globalement, ces revues concluent à l’existence d’un lien générique (c’est-à-dire pour l’exposition aux pesticides dans leur ensemble) entre la maladie de Parkinson et l’exposition aux pesticides avec des difficultés pour étudier le rôle de produits plus spécifiques, mais certaines d’entre elles concluent à l’absence d’arguments suffisants pour conclure à une relation causale et non expliquée par des biais (Li et coll., 2005
). Globalement, ces revues concluent à l’existence d’un lien générique (c’est-à-dire pour l’exposition aux pesticides dans leur ensemble) entre la maladie de Parkinson et l’exposition aux pesticides avec des difficultés pour étudier le rôle de produits plus spécifiques, mais certaines d’entre elles concluent à l’absence d’arguments suffisants pour conclure à une relation causale et non expliquée par des biais (Li et coll., 2005 ; Bronstein et coll., 2009
; Bronstein et coll., 2009 ; Wirdefeldt et coll., 2011
; Wirdefeldt et coll., 2011 ). Au total, ces revues recommandent la poursuite d’études avec en particulier une meilleure évaluation de l’exposition. La revue sur le paraquat et la roténone souligne la difficulté d’étudier le rôle de substances spécifiques et d’aboutir à une conclusion sur le rôle de ces deux substances à partir des seules études épidémiologiques (Mandel et coll., 2012
). Au total, ces revues recommandent la poursuite d’études avec en particulier une meilleure évaluation de l’exposition. La revue sur le paraquat et la roténone souligne la difficulté d’étudier le rôle de substances spécifiques et d’aboutir à une conclusion sur le rôle de ces deux substances à partir des seules études épidémiologiques (Mandel et coll., 2012 ).
). ). Elle rapportait un odds ratio de 1,94 (IC 95 % [1,49-2,53]) mais elle retrouvait une hétérogénéité importante entre les études. Une méta-analyse publiée en 2012 a porté uniquement sur les études de cohorte sur le rôle de l’exposition aux pesticides et de métiers impliquant une exposition aux pesticides (agriculteurs, jardiniers) (Van Maele-Fabry et coll., 2012
). Elle rapportait un odds ratio de 1,94 (IC 95 % [1,49-2,53]) mais elle retrouvait une hétérogénéité importante entre les études. Une méta-analyse publiée en 2012 a porté uniquement sur les études de cohorte sur le rôle de l’exposition aux pesticides et de métiers impliquant une exposition aux pesticides (agriculteurs, jardiniers) (Van Maele-Fabry et coll., 2012 ). Elle a identifié 12 études publiées entre 1985 et 2011 et concluait à une association (risque relatif=1,28 ; IC 95 % [1,03-1,59]) malgré l’existence d’une hétérogénéité importante entre les études (cf. paragraphe « Études de cohorte »). Une autre méta-analyse publiée en 2012 a inclus 46 études (39 études cas-témoins, 4 études de cohorte, 3 études transversales) réalisées jusqu’en novembre 2010 ; le tableau 12.I
). Elle a identifié 12 études publiées entre 1985 et 2011 et concluait à une association (risque relatif=1,28 ; IC 95 % [1,03-1,59]) malgré l’existence d’une hétérogénéité importante entre les études (cf. paragraphe « Études de cohorte »). Une autre méta-analyse publiée en 2012 a inclus 46 études (39 études cas-témoins, 4 études de cohorte, 3 études transversales) réalisées jusqu’en novembre 2010 ; le tableau 12.I présentent les caractéristiques des études incluses dans la méta-analyse est disponible en fin de chapitre (d’après Van der Mark et coll., 2012
présentent les caractéristiques des études incluses dans la méta-analyse est disponible en fin de chapitre (d’après Van der Mark et coll., 2012 ). La plupart des études incluses dans cette méta-analyse portait sur la maladie de Parkinson, mais trois études concernaient les syndromes parkinsoniens (Engel et coll., 2001
). La plupart des études incluses dans cette méta-analyse portait sur la maladie de Parkinson, mais trois études concernaient les syndromes parkinsoniens (Engel et coll., 2001 ; Duzcan et coll., 2003
; Duzcan et coll., 2003 ; Tanner et coll., 2009
; Tanner et coll., 2009 ) : l’article de Engel et coll. (2001
) : l’article de Engel et coll. (2001 ) n’a pas été pris en compte dans l’expertise car les critères utilisés pour définir les cas ont conduit à en identifier un grand nombre dont la plupart n’avaient pas la maladie de Parkinson, tandis que qu’on été pris en compte les publications de Duzcan et coll. (2003
) n’a pas été pris en compte dans l’expertise car les critères utilisés pour définir les cas ont conduit à en identifier un grand nombre dont la plupart n’avaient pas la maladie de Parkinson, tandis que qu’on été pris en compte les publications de Duzcan et coll. (2003 ) et de Tanner et coll. (2009
) et de Tanner et coll. (2009 ) car d’après les renseignements fournis pas les auteurs la plupart des cas avaient une maladie de Parkinson. Parmi les 46 études de la méta-analyse de van der Mark et coll. (2012
) car d’après les renseignements fournis pas les auteurs la plupart des cas avaient une maladie de Parkinson. Parmi les 46 études de la méta-analyse de van der Mark et coll. (2012 ), 40 portaient sur les pesticides sans distinction, tandis que 15 portaient sur les herbicides, 15 sur les insecticides et 9 sur les fongicides. Dans cette étude, un travail important a été réalisé pour identifier les sources potentielles d’hétérogénéité entre les études. C’est donc principalement cette méta-analyse qui sera décrite dans les paragraphes suivants tout en apportant des éléments de discussion complémentaires sur certains points précis ou sur des études qu’il a semblé intéressant d’individualiser.
), 40 portaient sur les pesticides sans distinction, tandis que 15 portaient sur les herbicides, 15 sur les insecticides et 9 sur les fongicides. Dans cette étude, un travail important a été réalisé pour identifier les sources potentielles d’hétérogénéité entre les études. C’est donc principalement cette méta-analyse qui sera décrite dans les paragraphes suivants tout en apportant des éléments de discussion complémentaires sur certains points précis ou sur des études qu’il a semblé intéressant d’individualiser.
Tableau 12.I Caractéristiques des études mesurant l’association entre maladie de Parkinson et l’exposition aux pesticides (partiellement adapté de Van der Mark et coll., 2012 )
)
|
Référence
Pays |
Type d’étude
|
Cas
|
Témoins
|
Méthode d’évaluation
de l’exposition |
Ajustements
|
Remarques
|
|---|---|---|---|---|---|---|
|
Cas-Témoinsc
1c : Étude cas-témoins avec témoins d’autres sources ou d’une combinaison d’autres sources |
35 patients MP
65-87 ans |
105 appariés sur âge/sexe
|
SR-E/N
Occ/Non-Occ P |
—
|
—
|
|
|
Cas-Témoinsd
2d : Étude cas-témoins avec témoins de population |
57 patients MP
|
122 appariés sur âge
|
SR-E/N
Occ uniq. P, paraquat |
—
| ||
|
Cas-Témoinsb
3b : Étude cas-témoins avec témoins hospitaliers |
150 patients MP
39-87 ans Âge moyen: 66 ans |
150 appariés sur âge/sexe
|
SR-E/N
Occ uniq. P |
—
|
OR calculés à partir des données présentées
|
|
|
Cas-Témoinsc
|
106 patients MP
Âge non renseigné |
106 époux
|
SR-R
Occ/Non-Occ P |
—
|
OR calculés à partir des données présentées
|
|
|
Cas-Témoinsd
|
42 patients MP
Âge non renseigné |
84 appariés sur âge/sexe
|
SR-R
Occ/Non-Occ P |
Âge, sexe
|
—
|
|
|
Cas-Témoinsb
|
38 patients MP
Âge moyen: 70 ans |
38 appariés sur âge/sexe
|
SR-E/N
Occ/Non-Occ P |
—
|
OR calculés à partir des données présentées
|
|
|
Cas-Témoinsc
|
80 patients MP, diagnostiqués après l’âge de 60 ans
Âge non renseigné |
80 appariés sur âge/sexe/race/centre participant
|
SR-E/N
Non-Occ uniq. H, I |
—
|
—
|
|
|
Cas-Témoinsb
|
128 patients MP
Âge moyen : 66,8 ans |
256 appariés sur âge/sexe
|
SR-R
Occ/Non-Occ P |
—
|
OR calculés à partir des données présentées
|
|
|
Cas-Témoinsd
|
130 patients MP
36-97 ans Âge moyen : 68,5 ans Participation : 88 % |
260 appariés sur âge/sexe
Participation : 76 % |
SR-E/N
Occ uniq. P, H, I, F |
—
|
OR herbicides ajustés sur histoire familiale de maladie de Parkinson et traumatisme crânien
|
|
|
Cas-Témoinsc
|
63 patients MP
Âge moyen : patients urbains, 69,3 ans ; patients ruraux patients, 69,0 ans |
75 avec âge moyen similaire
|
SR-R
Occ/Non-Occ P |
Âge < 65 ans ; homme ; mode de vie ; origine ethnique ; histoire familiale ; consommation de produits frais ; historique familial de traumatisme crânien, dépression ou infection SNC
|
—
|
|
|
Cas-Témoinsc
|
63 patients MP, diagnostiqués avant l’âge de 51 ans
35-72 ans Âge moyen : 49 ans Participation : 69 % |
68, appariement de fréquence sur âge/sexe/année de diagnostic
Participation : 41 % |
SR-R
Occ/Non-Occ H, I, F |
Âge, sexe, race, âge au diagnostic, éducation, histoire familiale
|
IC 95 % calculés à partir des ORs et des p-values
F-OR n’est pas ajusté |
|
|
Cas-Témoinsb
|
74 patients MP
Âge moyen : 68,4 ans |
148 appariés sur âge/sexe
|
SR-R
Occ/Non-Occ P |
—
|
OR calculés à partir des chiffres présentés
|
|
|
Cas-Témoinsd
|
142 patients MP
Âge moyen : 70,4 ans |
124 témoins âgés de 45-80 ans
Participation : 61 % |
SR-E/N
Occ uniq. P, H, I, F |
—
|
Les résultats présentés ont été poolés pour les homes et les femmes
Un 2nd groupe témoin composé de témoins hospitaliers n’a pas été utilisé dans cette méta-analyse |
|
|
Cas-Témoinsd
|
87 patients MP
|
2070 témoins
|
SR-E/N
Occ uniq. P |
Age, sexe
|
—
|
|
|
Cas-Témoinsd
|
379 patients MP < 66 ans
Âge moyen : 56,2 ans Participation : 71 % |
379 appariés sur âge/sexe
|
SR-E/N
Occ/Non-Occ H, I |
Tabac, éducation
|
Les résultats présentés pour les catégories d’exposition ont été poolés.
Un 2nd groupe témoin composé de témoins de voisinage n’a pas été utilisé dans cette méta-analyse. |
|
|
Cas-Témoinsb
|
120 patients MP
37-91 ans Âge moyen : 63,1 ans |
240 appariés sur âge/sexe
|
SR-R
Occ/Non-Occ P |
—
|
—
|
|
|
Cas-Témoinsb
|
100 patients MP
Âge moyen : 66,6 ans |
200 témoins, âge et sexe similaires
|
JT
Occ/Non-Occ P |
—
|
Certaines activités de loisir ont été prises en compte dans l’exposition
|
|
|
Cas-Témoinsb
|
215 patients MP
< 60 ans : 13,5 % 60-69 ans : 33,5 % 70-79 ans : 33,5 % ≥ 80 ans : 19,5 % |
313 appariés sur âge/sexe/hôpital
|
SR-E/N
Occ uniq. P |
Tabac ; histoire familiale ; vie rurale ; boire l’eau du puits ; agriculture ; consommation de thé, fruits, légumes, vitamines, suppléments d’huile de foie de morue
|
Différence importante entre OR des analyses ajustées et non ajustées
OR non ajustés=1,80 ; IC 95 % [0,90-3,58] |
|
|
Cas-Témoinsc
|
224 patients MP
Âge moyen : 70,3 ans |
310 appariés sur âge/sexe/origine ethnique/lieu de residence/site de recueil
|
SR-R
Occ uniq. P |
—
|
—
|
|
|
Cas-Témoinsd
|
144 patients MP,
≥ 50 ans 50-59 ans : 9,0 % 60-69 ans : 30,6 % 70-79 ans : 46,5 % ≥ 80 ans : 13,9 % Participation : 81 % |
464, appariement de fréquence sur âge/sexe/race
Participation : 65 % |
SR-E/N
Occ uniq., et Non-Occ uniq. H, I, F |
Âge, sexe, race, tabac
|
—
|
|
|
Cas-Témoinsb
|
92 patients MP
55-78 ans Âge moyen : 70,6 ans |
110 appariés sur âge/sexe
|
SR-R
Occ/Non-Occ P |
—
|
—
|
|
|
Cas-Témoinsd
|
113 patients MP
40-75 ans Âge moyen : 63,9 ans Participation : 90 % |
263 de la même catégorie d’âge
Participation : 82 % |
SR-E/N
Occ uniq. P, I |
Tabac, alcool, café, consommation de viande rôtie/bouillie, charpentiers, ébénistes
|
Seuls les résultats pour les hommes sont présentés
I-OR n’est pas ajusté. |
|
|
Cas-Témoinsd
|
123 patients MP
Âge moyen : 69,3 ans |
246 appariés sur âge/sexe/lieu de résidence
|
SR-E/N
Occ uniq P, H, DDT |
—
| ||
|
Cas-Témoinsb
|
140 patients MP
|
147 témoins
|
SR-E/N
Occ/Non-Occ P, H |
Année de naissance, sexe
|
—
|
|
|
Cas-Témoinsb
|
140 patients MP
Âge moyen : 71,1 ans |
280 appariés sur âge/sexe
|
SR-E/N
Occ/Non-Occ P |
—
|
OR calculés à partir des chiffres présentés
|
|
|
Cas-Témoinsb
|
93 patients MP
Âge non renseigné |
93 appariés sur âge/sexe
|
SR-E/N
Occ/Non-Occ P |
Tabac, pays de naissance, ulcère de l’estomac, travail dans la construction ou dans industrie de mécanique
|
—
|
|
|
Transversale
|
65 patients atteints de syndrome parkinsonien
Âge non renseigné |
310 parmi les 1 300 hommes ayant participé à une étude de cohorte
|
SR-E/N
Occ uniq. P, H, I, F |
Âge, tabac
|
Étude menée chez les homes uniquement
|
|
|
Cas-Témoinsb
|
377 patients MP
24-86 ans Âge moyen : 56,8 ans Participation : 100 % |
377 appariés sur âge
Participation : 100 % |
SR-E/N
Occ/Non-Occ H, I |
—
|
ORs calculés à partir des chiffres présentés
|
|
|
Cas-Témoinsb
|
136 patients MP
Âge moyen : 70,0 ans |
272 appariés sur âge/sexe
|
SR-E/N
Occ/Non-Occ P |
—
|
Tabac
|
|
|
Cohorte
|
99 patients MP après 30 ans de suivi
Âge médian au diagnostic : 73,7 ans 54-89 ans |
Référence : 7 986 hommes japonais à Hawaii
|
SR-R
Occ/Non-Occ P |
—
|
RR calculés à partir des chiffres d’incidence présentés
|
|
|
Cas-Témoinsd
|
36 patients atteints de syndrome parkinsonien
< 50 ans 50-59 ans : 11,1 % 60-69 ans : 30,6 % 70-79 ans : 47,2 % ≥ 80 ans : 11,1 % |
108 appariés sur âge/sexe
|
SR-R
Occ/Non-Occ P |
—
|
—
|
|
|
Transversale
|
113 patients MP
Âge moyen : 78,1 ans |
Étude parmi 4 496 personnes âgées sélectionnées aléatoirement
|
SR-E/N
Occ uniq. P |
Âge, sexe, éducation, tabac
|
Avoir une licence d’utilisation de pesticide a été utilisé comme proxy pour l’usage de pesticides
|
|
|
Cas-Témoinsd
|
84 patients MP,
> 69 ans Âge moyen : 75,6 ans |
252 appariés sur âge/sexe
|
JT
Occ uniq. P |
Âge, sexe, tabac, éducation
|
—
|
|
|
Cohorte
|
24 patients MP après 5 ans de suivi
Âge non renseigné |
Référence : 1 507 personnes, âgées de 65 ans et +, habitant dans la même région que les cas
|
JT
Occ uniq. P |
Tabac, éducation
|
Les résultats présentés pour les hommes et les femmes ont été poolés
|
|
|
Cas-Témoinsd
|
114 patients MP
|
205 appariés sur âge/sexe/lieu de résidence
|
SR-E/N
Occ/Non-Occ P, H |
Age, sexe, tabac, thé, alcool, eau de puits, métier d’agriculteur, traumatisme crânien, solvants
|
—
|
|
|
Cas-Témoinsd
|
190 patients MP
Âge moyen : 63,9 ans |
190 appariés sur âge/sexe/facteurs socioculturels
|
SR-E/N
Occ/Non-Occ P |
—
|
ORs calculés à partir des chiffres présentés
|
|
|
Cas-Témoinsd
|
102 patients MP
|
133 appariés sur âge/origine ethnique
|
SR-E/N
Occ uniq P |
Statut marital, tabac, habitat rural, MP familiale, tremblement essentiel familial, traumatisme crânien, employé de verger, utilisation domestique de pesticides
|
—
|
|
|
Cas-Témoinsd
|
149 patients MP
41-97 ans Âge moyen : 70,0 années Participation : 76 % |
129 appariés sur âge/sexe
Participation : 66 % |
SR-E/N
Occ/Non-Occ P, H, I |
Âge, sexe
|
Résultats aussi pour une exposition professionnelle uniquement (agriculture)
|
|
|
Cohorte
|
413 patients MP après 9 ans de suivi
Âge moyen à l’apparition: 70 ans |
Référence : 184 190 personnes
|
SR-R
Occ/Non-Occ P |
Âge, sexe, tabac, café, NSAIDs, education, activité physique
|
—
|
|
|
Cohorte
|
78 patients MP après 5 ans de suivi
≤ 50 ans : 9 % 51-60 ans : 40 % 61-70 ans : 41 % > 70 ans : 10 % |
Référence : 84 738 personnes qui ont demandé une licence pour l’utilisation de pesticides ainsi que leurs épouses
|
SR-E/N
Occ/Non-Occ P |
Âge, État, applicateur ou épouse
|
—
|
|
|
Cas-Témoinsc
|
767 patients MP
Âge moyen : 69,8 ans Participation : 77 % |
1 989 appariés sur âge/sexe/pays
Participation : 59 % |
SR-E/N (+ JT)
Occ/Non-Occ P |
Âge, sexe, pays, tabac, histoire familiale, n’avoir jamais perdu connaissance
|
—
|
|
|
Cas-Témoinsb
|
153 patients MP
Âge moyen : 71,7 ans |
155 appariés sur âge/sexe/lieu de naissance
|
SR-R
Occ uniq. P |
Âge, sexe, tabac
|
—
|
|
|
Cas-Témoinsc
|
833 patients MP
32-91 ans Âge médian : 67,7 ans |
361 appariés sur âge/sexe/région et 472 frères et sœurs
|
SR-R
Occ/Non-Occ P, H, I, F |
Âge, sexe
|
—
|
|
|
Cas-Témoinsc
|
319 patients MP
29-94 ans Âge moyen : 65,6 ans |
296 membres de famille et époux
|
SR-E/N
Occ/Non-Occ P, H, I |
Âge, sexe, tabac, consommation de caféine
|
—
|
|
|
Cas-Témoinsd
|
79 patients MP
Âge moyen : 74,4 years |
154 appariés sur âge/sexe
|
SR-E/N
Occ uniq. P |
Tabac
|
Les OR sont présentés uniquement chez les hommes car il n’y a pas de femmes exposées dans l’étude.
|
|
|
Cas-Témoinsd
|
224 patients MP < 76 ans
Âge médian : 69,0 ans Participation : 83 % |
557 appariés sur âge/sexe/région
Participation : 75 % |
SR-E/N
Occ uniq., et Non-Occ uniq. P, H, I, F |
Tabac, Mini Mental State Examination score
|
Les I-OR, H-OR, et F-OR présentés pour les hommes et les femmes ont été poolés.
L’OR pour Non-Occ uniq. n’est pas ajusté. |
|
|
Cas-Témoinsc
|
519 patients atteints de syndrome parkinsonien
30-88 ans Âge médian : 65 ans |
511, appariement de fréquence sur âge/sexe/lieu
|
SR-E/N
Occ uniq. P |
Âge, sexe, origine ethnique, tabac, alcool, caféine, blessure à la tête
|
—
|
|
|
Cas-Témoinsb
|
110 patients MP
Âge moyen : 60,8 ans Participation : 100 % |
220 appariés sur âge/sexe/vie en milieu urbain ou rural
Participation : 100 % |
SR-E/N
Occ/Non-Occ P, H, I, F |
I-OR est ajusté pour jardinage, vie en milieu rural, boire l’eau du puits ou de source, exposition aux colorants ou au naphte, travail dans le secteur tertiaire
|
OR, H-OR et F-OR calculés à partir des chiffres présentés
|
|
|
Cas-Témoinsb
|
404 patients MP
29-88 ans Âge médian : 69 ans Participation : 70 % |
526, appariement de fréquence sur âge/sexe
Participation : 60 % |
SR-E/N
Occ uniq., et Non-Occ uniq. P, H, I, F |
Âge, origine ethnique, tabac
|
Les résultats présentés pour tous les pesticides ont été poolés pour les hommes et les femmes
Seuls les résultats pour les hommes sont présentés pour les sous-groupes pour Occ uniq. |
|
|
Cas-Témoinsd
|
351 patients MP
60 ans : 22 % > 60 ans : 78 % |
363 témoins de la même region
|
SR-E/N (+ JT)
Occ uniq. P |
Âge, sexe, origine ethnique, tabac, éducation, comté
|
—
|
|
|
Cas-Témoinsd
|
403 patients MP
|
405 appariés sur âge/sexe/région
|
SR-E/N (+ JT)
hygiéniste industriel Occ uniq P, H, I, F, OP, OC, DDT |
Sexe, année de naissance, tabac
|
—
|
|
|
Cas-Témoinsb
|
345 patients MP
|
370 appariés sur âge/sexe
|
SR-E/N
Occ/Non-Occ P, I |
—
|
—
|
|
|
Cohorte
|
204 hommes MP
|
Référence : 14169 hommes
|
Occ uniq (+ JT)
P |
Age, éducation, tabac
|
Registre de jumeaux
|
a Études non incluses dans la méta-analyse de van der Mark et coll. (2012  )
)
b Étude cas-témoins avec témoins hospitaliers ;
c Étude cas-témoins avec témoins d’autres sources ou d’une combinaison d’autres sources;
d Étude cas-témoins avec témoins de population
F : Fongicides ; I : Insecticides ; JT : Intitulé de la profession (job title) ; MP : Maladie de Parkinson ; Non-occ uniq. : Uniquement l’exposition non professionnelle incluse dans le groupe exposé (only nonoccupational exposure included in the exposed group) ; NSAIDs : NonSteroidal Anti-Inflammatory Drugs ; Occ uniq. : Uniquement l’exposition professionnelle incluse dans le groupe exposé (only occupational exposure included in the exposed group) ; Occ/Non-Occ : Exposition non professionnelle incluse dans le groupe exposé (non occupational exposure included in the exposed group) ; OC : organochloré ; OP : organophosphoré ; P : Pesticides ; SNC : Système nerveux central ; SR-E/N : Auto-rapporté oui/non ; SR-R : Auto-rapporté régulier
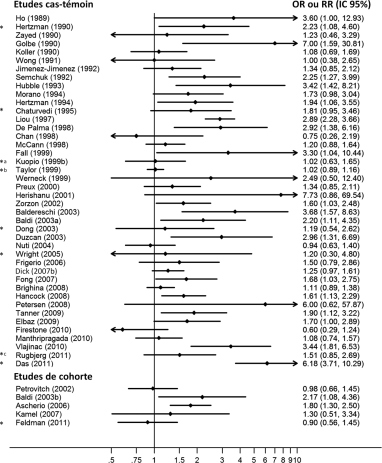
 et les figures 12.1
et les figures 12.1 et 12.2
et 12.2 (voir en fin de chapitre) synthétisent respectivement les caractéristiques et les principaux résultats de toutes les études sur la relation entre la maladie de Parkinson et l’exposition aux pesticides, dans l’ensemble et par grande famille, dont la très grande majorité sont incluses dans la méta-analyse de van der Mark et coll. (2012
(voir en fin de chapitre) synthétisent respectivement les caractéristiques et les principaux résultats de toutes les études sur la relation entre la maladie de Parkinson et l’exposition aux pesticides, dans l’ensemble et par grande famille, dont la très grande majorité sont incluses dans la méta-analyse de van der Mark et coll. (2012 ). Un certain nombre d’études n’ont pas été identifiées par cette méta-analyse ou n’ont pas été incluses car publiées après 2010 ; elles sont indiquées par un astérisque. Lorsque des odds ratio ou des risques relatifs n’étaient pas disponibles, ils ont été calculés à partir des effectifs disponibles dans les publications. Lorsque des odds ratio ou des risques relatifs ajustés étaient disponibles, ils ont été inclus préférentiellement. L’étude de Dhillon et coll. (2008
). Un certain nombre d’études n’ont pas été identifiées par cette méta-analyse ou n’ont pas été incluses car publiées après 2010 ; elles sont indiquées par un astérisque. Lorsque des odds ratio ou des risques relatifs n’étaient pas disponibles, ils ont été calculés à partir des effectifs disponibles dans les publications. Lorsque des odds ratio ou des risques relatifs ajustés étaient disponibles, ils ont été inclus préférentiellement. L’étude de Dhillon et coll. (2008 ) n’a pas été incluse car les expositions prises en compte sont celles survenues dans l’année précédant l’interrogatoire et, compte tenu de l’inclusion de cas prévalents, elles ne peuvent donc jouer un rôle étiologique. L’étude de Tanner et coll. (2011
) n’a pas été incluse car les expositions prises en compte sont celles survenues dans l’année précédant l’interrogatoire et, compte tenu de l’inclusion de cas prévalents, elles ne peuvent donc jouer un rôle étiologique. L’étude de Tanner et coll. (2011 ) dans l’AHS, n’est pas présentée dans les figures car elle ne fournit pas d’estimation de l’odds ratio pour l’exposition aux pesticides, aux fongicides, aux herbicides ou aux insecticides, mais seulement pour des produits particuliers. Enfin, les résultats de quelques études dont les participants ont été inclus dans plusieurs publications sont présentés.
) dans l’AHS, n’est pas présentée dans les figures car elle ne fournit pas d’estimation de l’odds ratio pour l’exposition aux pesticides, aux fongicides, aux herbicides ou aux insecticides, mais seulement pour des produits particuliers. Enfin, les résultats de quelques études dont les participants ont été inclus dans plusieurs publications sont présentés. | Figure 12.1 Odds ratio (études cas-témoins) et risques relatifs (études de cohorte) mesurant l’association entre la maladie de Parkinson et l’exposition aux pesticides |
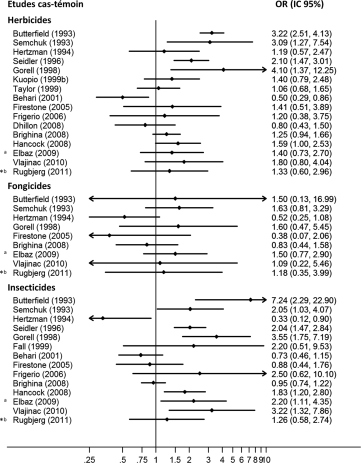
 | Figure 12.2 Odds ratio (études cas-témoins) mesurant l’association entre la maladie de Parkinson et l’exposition aux herbicides, insecticides et fongicides |
 ). Au Nebraska (États-Unis), une étude reposant sur des données de mortalité et la consommation de médicaments antiparkinsoniens et des données d’utilisation de pesticides par comté, retrouvait une association entre les ventes d’antiparkinsoniens et différentes activités agricoles comme l’utilisation d’engrais, l’utilisation de pesticides pour désherber ou d’insectides pour le foin (Strickland et coll., 1996
). Au Nebraska (États-Unis), une étude reposant sur des données de mortalité et la consommation de médicaments antiparkinsoniens et des données d’utilisation de pesticides par comté, retrouvait une association entre les ventes d’antiparkinsoniens et différentes activités agricoles comme l’utilisation d’engrais, l’utilisation de pesticides pour désherber ou d’insectides pour le foin (Strickland et coll., 1996 ). En Californie, la mortalité liée à la maladie de Parkinson entre 1984 et 1994 était plus élevée dans les régions caractérisées par une forte utilisation de pesticides et une proportion élevée de surface traitée par insecticides (Ritz et Yu, 2000
). En Californie, la mortalité liée à la maladie de Parkinson entre 1984 et 1994 était plus élevée dans les régions caractérisées par une forte utilisation de pesticides et une proportion élevée de surface traitée par insecticides (Ritz et Yu, 2000 ). Dans cinq départements français en 2007, la prévalence de la maladie de Parkinson parmi les affiliés à la Mutualité sociale agricole (MSA) était environ 1,2 fois plus élevée dans les cantons caractérisés par une forte densité en arbres fruitiers et cultures permanentes d’après les données du recensement agricole de 1988 (Moisan et coll., 2011b
). Dans cinq départements français en 2007, la prévalence de la maladie de Parkinson parmi les affiliés à la Mutualité sociale agricole (MSA) était environ 1,2 fois plus élevée dans les cantons caractérisés par une forte densité en arbres fruitiers et cultures permanentes d’après les données du recensement agricole de 1988 (Moisan et coll., 2011b ). À partir des ventes de pesticides (2001) et des hospitalisations entre 1998 et 2005, après ajustement sur l’âge et le sexe, une étude dans le sud de l’Espagne ne retrouvait pas de différence de prévalence en fonction de l’utilisation de pesticides, mais la méthode d’identification des patients rend difficile l’interprétation de cette étude (Parron et coll., 2012
). À partir des ventes de pesticides (2001) et des hospitalisations entre 1998 et 2005, après ajustement sur l’âge et le sexe, une étude dans le sud de l’Espagne ne retrouvait pas de différence de prévalence en fonction de l’utilisation de pesticides, mais la méthode d’identification des patients rend difficile l’interprétation de cette étude (Parron et coll., 2012 ).
). ), les résultats sont analysés dans les paragraphes suivants pour l’exposition aux pesticides considérés dans leur ensemble, puis en fonction des familles d’utilisation (herbicides, insecticides, fongicides) et de quelques substances actives plus précises ; un paragraphe indépendant est consacré à l’Agricultural Health Study.
), les résultats sont analysés dans les paragraphes suivants pour l’exposition aux pesticides considérés dans leur ensemble, puis en fonction des familles d’utilisation (herbicides, insecticides, fongicides) et de quelques substances actives plus précises ; un paragraphe indépendant est consacré à l’Agricultural Health Study.Exposition aux pesticides (sans distinction)
Méta-analyse (Van der Mark et coll. 2012) et études complémentaires
 et b
et b ; Dick et coll., 2007b
; Dick et coll., 2007b ) ou l’expertise individuelle des questionnaires d’exposition par des experts (Elbaz et coll., 2009
) ou l’expertise individuelle des questionnaires d’exposition par des experts (Elbaz et coll., 2009 ; Rugbjerg et coll., 2011
; Rugbjerg et coll., 2011 ). Dans un peu plus de la moitié des études, l’exposition professionnelle et non-professionnelle n’étaient pas distinguées, tandis que d’autres portaient exclusivement sur l’exposition professionnelle. De plus, la grande majorité de ces études n’ont pas porté sur des populations agricoles et le nombre de sujets exposés était généralement faible.
). Dans un peu plus de la moitié des études, l’exposition professionnelle et non-professionnelle n’étaient pas distinguées, tandis que d’autres portaient exclusivement sur l’exposition professionnelle. De plus, la grande majorité de ces études n’ont pas porté sur des populations agricoles et le nombre de sujets exposés était généralement faible. ) a estimé que le risque de maladie de Parkinson était 1,62 (IC 95 % [1,40-1,88]) fois plus élevé chez les personnes exposées aux pesticides au cours de leur vie (van der Mark et coll., 2012
) a estimé que le risque de maladie de Parkinson était 1,62 (IC 95 % [1,40-1,88]) fois plus élevé chez les personnes exposées aux pesticides au cours de leur vie (van der Mark et coll., 2012 ). Il existait toutefois une hétérogénéité importante entre les études (I²=63,7 % ; p<0,001). Cette hétérogénéité ne semblait pas liée au type d’exposition puisqu’il n’y avait pas de différence importante entre les études regroupant l’exposition professionnelle et non-professionnelle (OR=1,69 ; IC 95 % [1,38-2,06]) et celles portant uniquement sur l’exposition professionnelle (OR=1,52 ; IC 95 % [1,23-1,89]). L’origine des témoins (hospitaliers, population générale, autres) dans les études cas-témoins, la région d’étude (Amérique du Nord, Europe, autre) ou la prise en compte de facteurs de confusion (analyses multivariées) n’expliquaient pas non plus l’hétérogénéité. Plusieurs études ont notamment pris en compte le tabagisme et/ou la consommation de café et ont retrouvé des associations indépendamment de ces facteurs (Petrovitch et coll., 2002
). Il existait toutefois une hétérogénéité importante entre les études (I²=63,7 % ; p<0,001). Cette hétérogénéité ne semblait pas liée au type d’exposition puisqu’il n’y avait pas de différence importante entre les études regroupant l’exposition professionnelle et non-professionnelle (OR=1,69 ; IC 95 % [1,38-2,06]) et celles portant uniquement sur l’exposition professionnelle (OR=1,52 ; IC 95 % [1,23-1,89]). L’origine des témoins (hospitaliers, population générale, autres) dans les études cas-témoins, la région d’étude (Amérique du Nord, Europe, autre) ou la prise en compte de facteurs de confusion (analyses multivariées) n’expliquaient pas non plus l’hétérogénéité. Plusieurs études ont notamment pris en compte le tabagisme et/ou la consommation de café et ont retrouvé des associations indépendamment de ces facteurs (Petrovitch et coll., 2002 ; Baldi et coll., 2003a
; Baldi et coll., 2003a ; Ascherio et coll., 2006
; Ascherio et coll., 2006 ; Kamel et coll., 2007
; Kamel et coll., 2007 ; Dick et coll., 2007b
; Dick et coll., 2007b ; Elbaz et coll., 2009
; Elbaz et coll., 2009 ). L’oddsratio était de 1,67 (IC 95 % [1,43-1,96]) pour les études cas-témoins tandis qu’il était un peu plus faible, quoique non significativement différent mais fondé sur 4 études seulement, pour les études de cohorte (RR=1,39 ; IC 95 % [0,92-2,10]). Le seul facteur qui semblait expliquer une partie de l’hétérogénéité entre les études était la méthode d’évaluation de l’exposition ; l’odds ratio était de 1,50 (IC 95 % [1,26-1,78]) pour les études avec une définition binaire (oui/non) de l’exposition auto-déclarée tandis qu’il était de 1,71 (IC 95 % [1,30-2,25]) pour les études sur l’exposition fréquente aux pesticides (auto-déclarée), et de 2,50 (IC 95 % [1,54-4,05]) pour trois études qui avaient défini l’exposition à partir du codage des métiers et dont les résultats ne dépendaient donc pas des déclarations des participants. Toutefois, ces différences n’étaient pas significatives, en partie à cause du faible nombre d’études avec une méthode d’évaluation plus précise. Ces résultats sont donc en faveur d’une association générique entre l’exposition aux pesticides et la maladie de Parkinson. L’absence de différence en fonction de la prise en compte ou pas de l’exposition non-professionnelle suggère que l’exposition non-professionnelle est également associée à la maladie de Parkinson, ou que, plus vraisemblablement, l’exposition professionnelle représente la principale source d’exposition dans les études qui n’ont pas fait la distinction entre les deux types d’exposition. Les différences des résultats en fonction du type de méthode d’évaluation de l’exposition suggèrent que les méthodes les moins précises pourraient conduire à un biais de classement non-différentiel et qu’il s’agit de l’un des aspects qui pourrait être amélioré dans des études futures.
). L’oddsratio était de 1,67 (IC 95 % [1,43-1,96]) pour les études cas-témoins tandis qu’il était un peu plus faible, quoique non significativement différent mais fondé sur 4 études seulement, pour les études de cohorte (RR=1,39 ; IC 95 % [0,92-2,10]). Le seul facteur qui semblait expliquer une partie de l’hétérogénéité entre les études était la méthode d’évaluation de l’exposition ; l’odds ratio était de 1,50 (IC 95 % [1,26-1,78]) pour les études avec une définition binaire (oui/non) de l’exposition auto-déclarée tandis qu’il était de 1,71 (IC 95 % [1,30-2,25]) pour les études sur l’exposition fréquente aux pesticides (auto-déclarée), et de 2,50 (IC 95 % [1,54-4,05]) pour trois études qui avaient défini l’exposition à partir du codage des métiers et dont les résultats ne dépendaient donc pas des déclarations des participants. Toutefois, ces différences n’étaient pas significatives, en partie à cause du faible nombre d’études avec une méthode d’évaluation plus précise. Ces résultats sont donc en faveur d’une association générique entre l’exposition aux pesticides et la maladie de Parkinson. L’absence de différence en fonction de la prise en compte ou pas de l’exposition non-professionnelle suggère que l’exposition non-professionnelle est également associée à la maladie de Parkinson, ou que, plus vraisemblablement, l’exposition professionnelle représente la principale source d’exposition dans les études qui n’ont pas fait la distinction entre les deux types d’exposition. Les différences des résultats en fonction du type de méthode d’évaluation de l’exposition suggèrent que les méthodes les moins précises pourraient conduire à un biais de classement non-différentiel et qu’il s’agit de l’un des aspects qui pourrait être amélioré dans des études futures. ). Dans cette étude, les odds ratio diminuaient lorsque l’exposition était définie par un expert par rapport à une exposition auto-rapportée, sauf pour les expositions liées à l’épandage. À noter que le taux d’acceptation de participation dans cette étude était relativement faible (32 % chez les témoins et 51 % chez les cas).
). Dans cette étude, les odds ratio diminuaient lorsque l’exposition était définie par un expert par rapport à une exposition auto-rapportée, sauf pour les expositions liées à l’épandage. À noter que le taux d’acceptation de participation dans cette étude était relativement faible (32 % chez les témoins et 51 % chez les cas). ), les auteurs ont également réalisé des graphiques en entonnoir et les tests statistiques correspondants (test d’Egger) qui suggèrent que pour les pesticides (p=0,057) les études de plus petite taille estimaient les odds ratios les plus importants ce qui, d’après les auteurs, pourrait contribuer à surestimer les associations ; les tests correspondants étaient de p=0,338 pour les herbicides, p=0,208 pour les insecticides et de p=0,680 pour les fongicides.
), les auteurs ont également réalisé des graphiques en entonnoir et les tests statistiques correspondants (test d’Egger) qui suggèrent que pour les pesticides (p=0,057) les études de plus petite taille estimaient les odds ratios les plus importants ce qui, d’après les auteurs, pourrait contribuer à surestimer les associations ; les tests correspondants étaient de p=0,338 pour les herbicides, p=0,208 pour les insecticides et de p=0,680 pour les fongicides. ). Bien qu’aucune association avec la maladie de Parkinson ne soit retrouvée quand on considère l’ensemble des sujets exposés par rapport aux non exposés, une association est observée pour les participants dont les intensités d’exposition annuelle aux pesticides sont les plus élevées (OR=1,39 ; IC 95 % [1,02-1,89]).
). Bien qu’aucune association avec la maladie de Parkinson ne soit retrouvée quand on considère l’ensemble des sujets exposés par rapport aux non exposés, une association est observée pour les participants dont les intensités d’exposition annuelle aux pesticides sont les plus élevées (OR=1,39 ; IC 95 % [1,02-1,89]). ).
).Études de cohorte
 ; Baldi et coll., 2003b
; Baldi et coll., 2003b ; Ascherio et coll., 2006
; Ascherio et coll., 2006 ; Kamel et coll., 2007
; Kamel et coll., 2007 ; Feldman et coll., 2011
; Feldman et coll., 2011 ). Les quatre premières ont été incluses dans la méta-analyse de van der Mark et coll. (2012
). Les quatre premières ont été incluses dans la méta-analyse de van der Mark et coll. (2012 ) qui a estimé un risque relatif de 1,39 (IC 95 % [0,92-2,10]) ; la dernière étude n’a pas été prise en compte car publiée en 2011. Les principaux résultats de ces études sont résumés ci-dessous. Parmi ces études, n’ont pas été inclus les cohortes ayant identifié les cas de maladie de Parkinson à partir des certificats de décès (Hofmann et coll., 2006
) qui a estimé un risque relatif de 1,39 (IC 95 % [0,92-2,10]) ; la dernière étude n’a pas été prise en compte car publiée en 2011. Les principaux résultats de ces études sont résumés ci-dessous. Parmi ces études, n’ont pas été inclus les cohortes ayant identifié les cas de maladie de Parkinson à partir des certificats de décès (Hofmann et coll., 2006 ; Tomenson et coll., 2011
; Tomenson et coll., 2011 ), celles qui disposaient uniquement de l’information sur le métier agricole et non sur l’exposition aux pesticides (Tuchsen et Jensen, 2000
), celles qui disposaient uniquement de l’information sur le métier agricole et non sur l’exposition aux pesticides (Tuchsen et Jensen, 2000 ; Li et coll., 2009
; Li et coll., 2009 ; Kenborg et coll., 2011
; Kenborg et coll., 2011 ) ou celles qui n’ont pas distingué les cas de maladie de Parkinson des syndromes parkinsoniens (Engel et coll., 2001
) ou celles qui n’ont pas distingué les cas de maladie de Parkinson des syndromes parkinsoniens (Engel et coll., 2001 ) ; ces études ont en revanche été prises en compte dans la méta-analyse de van Maele-Fabry et coll. (2012
) ; ces études ont en revanche été prises en compte dans la méta-analyse de van Maele-Fabry et coll. (2012 ).
). ). L’incidence de la maladie de Parkinson augmentait significativement avec le nombre d’années de travail dans une plantation ; le risque était près de deux fois plus élevé pour les hommes ayant travaillé plus de 20 ans dans une plantation par rapport à ceux n’y ayant pas travaillé. L’exposition aux pesticides a été évaluée 6 ans après le début de l’étude (entre 1971 et 1974). L’incidence de la maladie de Parkinson était 1,6 fois plus élevée chez les participants exposés pendant plus de trois ans aux pesticides par rapport aux non exposés, mais cette relation n’était pas statistiquement significative (p=0,10) et il n’existait pas de relation dose-effet en fonction du nombre d’années d’exposition (Petrovitch et coll., 2002
). L’incidence de la maladie de Parkinson augmentait significativement avec le nombre d’années de travail dans une plantation ; le risque était près de deux fois plus élevé pour les hommes ayant travaillé plus de 20 ans dans une plantation par rapport à ceux n’y ayant pas travaillé. L’exposition aux pesticides a été évaluée 6 ans après le début de l’étude (entre 1971 et 1974). L’incidence de la maladie de Parkinson était 1,6 fois plus élevée chez les participants exposés pendant plus de trois ans aux pesticides par rapport aux non exposés, mais cette relation n’était pas statistiquement significative (p=0,10) et il n’existait pas de relation dose-effet en fonction du nombre d’années d’exposition (Petrovitch et coll., 2002 ).
). ), tandis qu’aucune association n’était retrouvée chez les femmes (RR=1,0 ; IC 95 % [0,2-4,8]), après ajustement sur l’âge, le niveau d’éducation et le tabagisme. Cette différence pourrait être expliquée par une faible fréquence de l’utilisation professionnelle de pesticides et/ou une exposition de nature différente chez les femmes.
), tandis qu’aucune association n’était retrouvée chez les femmes (RR=1,0 ; IC 95 % [0,2-4,8]), après ajustement sur l’âge, le niveau d’éducation et le tabagisme. Cette différence pourrait être expliquée par une faible fréquence de l’utilisation professionnelle de pesticides et/ou une exposition de nature différente chez les femmes. ).
). ). En revanche, elle mettait en évidence une relation entre le risque de maladie de Parkinson incidente et le nombre de jours passés à utiliser des pesticides (préparation et application) avec un risque 2,3 (IC 95 % [1,2-4,5]) fois plus élevé de maladie de Parkinson pour les participants ayant passé le plus grand nombre de jours à utiliser des pesticides. Aucune relation n’était observée pour les cas prévalents.
). En revanche, elle mettait en évidence une relation entre le risque de maladie de Parkinson incidente et le nombre de jours passés à utiliser des pesticides (préparation et application) avec un risque 2,3 (IC 95 % [1,2-4,5]) fois plus élevé de maladie de Parkinson pour les participants ayant passé le plus grand nombre de jours à utiliser des pesticides. Aucune relation n’était observée pour les cas prévalents. ). Toutefois, cette étude présente plusieurs limites : historique professionnel incomplet, évaluation de l’exposition aux pesticides reposant sur la profession exercée vers l’âge de 35 ans qui n’était pas disponible pour environ 25 % des participants, et le diagnostic de maladie de Parkinson défini principalement à partir du codage des causes de décès et d’hospitalisation, alors que la valeur prédictive positive du diagnostic de maladie de Parkinson dans ces bases est de l’ordre de 70 % (Feldman et coll, 2012
). Toutefois, cette étude présente plusieurs limites : historique professionnel incomplet, évaluation de l’exposition aux pesticides reposant sur la profession exercée vers l’âge de 35 ans qui n’était pas disponible pour environ 25 % des participants, et le diagnostic de maladie de Parkinson défini principalement à partir du codage des causes de décès et d’hospitalisation, alors que la valeur prédictive positive du diagnostic de maladie de Parkinson dans ces bases est de l’ordre de 70 % (Feldman et coll, 2012 ).
). , le risque de maladie de Parkinson était 1,62 (IC 95 % [1,40-1,88]) fois plus élevé chez les personnes exposées aux pesticides au cours de leur vie. L’odds ratio n’est pas significativement différent entre les études cas-témoins et les études de cohorte. Si l’évaluation de l’exposition est effectuée à partir du codage des métiers (elle est donc indépendante des déclarations des participants), l’odds ratio atteint 2,50 (IC 95 % [1,54-4,05]) pour trois études.
, le risque de maladie de Parkinson était 1,62 (IC 95 % [1,40-1,88]) fois plus élevé chez les personnes exposées aux pesticides au cours de leur vie. L’odds ratio n’est pas significativement différent entre les études cas-témoins et les études de cohorte. Si l’évaluation de l’exposition est effectuée à partir du codage des métiers (elle est donc indépendante des déclarations des participants), l’odds ratio atteint 2,50 (IC 95 % [1,54-4,05]) pour trois études.Exposition aux herbicides
 ; van der Mark et coll., 2012
; van der Mark et coll., 2012 ). Les études les plus anciennes ont porté sur le rôle des herbicides. La méta-analyse de van der Mark et coll. (2012
). Les études les plus anciennes ont porté sur le rôle des herbicides. La méta-analyse de van der Mark et coll. (2012 ) estime un risque de maladie de Parkinson associé à l’exposition aux herbicides de 1,40 (IC 95 % [1,08-1,81]) (van der Mark et coll., 2012
) estime un risque de maladie de Parkinson associé à l’exposition aux herbicides de 1,40 (IC 95 % [1,08-1,81]) (van der Mark et coll., 2012 ). Une étude a été exclue des calculs de cette méta-analyse, car elle rapportait un odds ratio pour l’augmentation d’une année d’exposition aux herbicides (Taylor et coll., 1999
). Une étude a été exclue des calculs de cette méta-analyse, car elle rapportait un odds ratio pour l’augmentation d’une année d’exposition aux herbicides (Taylor et coll., 1999 ), tandis que les autres études avaient généralement considéré des expositions cumulées sur l’ensemble de la vie. Il est important de noter que l’exposition à d’autres pesticides, comme les insecticides, n’était pas prise en compte dans certaines de ces études.
), tandis que les autres études avaient généralement considéré des expositions cumulées sur l’ensemble de la vie. Il est important de noter que l’exposition à d’autres pesticides, comme les insecticides, n’était pas prise en compte dans certaines de ces études. ; Tanner et coll., 2011
; Tanner et coll., 2011 ), notamment pour de longues périodes d’exposition (≥20 ans) (Liou et coll., 1997
), notamment pour de longues périodes d’exposition (≥20 ans) (Liou et coll., 1997 ). Quatre autres études n’ont pas retrouvé d’association avec cette substance (Hertzman et coll., 1994
). Quatre autres études n’ont pas retrouvé d’association avec cette substance (Hertzman et coll., 1994 ; Tanner et coll., 2009
; Tanner et coll., 2009 ; Elbaz et coll., 2009
; Elbaz et coll., 2009 ; Firestone et coll., 2010
; Firestone et coll., 2010 ).
). ). Toutefois, parmi les 23 participants (16 cas, 7 témoins) exposés à cette substance, plusieurs étaient également exposés à d’autres pesticides (paraquat, perméthrine) qui étaient associés, mais non significativement, à la maladie de Parkinson. Deux autres études ne mettent pas en évidence d’association avec le 2,4-D (Elbaz et coll., 2009
). Toutefois, parmi les 23 participants (16 cas, 7 témoins) exposés à cette substance, plusieurs étaient également exposés à d’autres pesticides (paraquat, perméthrine) qui étaient associés, mais non significativement, à la maladie de Parkinson. Deux autres études ne mettent pas en évidence d’association avec le 2,4-D (Elbaz et coll., 2009 ; Tanner et coll., 2011
; Tanner et coll., 2011 ).
). ) on estime que le risque de maladie de Parkinson est 1,40 (IC 95 % [1,08-1,81]) fois plus élevé chez les personnes exposées aux herbicides. Deux études rapportent une association pour l’exposition au paraquat mais elle n’est pas confirmée dans quatre autres études
) on estime que le risque de maladie de Parkinson est 1,40 (IC 95 % [1,08-1,81]) fois plus élevé chez les personnes exposées aux herbicides. Deux études rapportent une association pour l’exposition au paraquat mais elle n’est pas confirmée dans quatre autres étudesExposition aux insecticides
 ) a estimé un odds ratio de 1,50 (IC 95 % [1,07-2,11]) (van der Mark et coll., 2012
) a estimé un odds ratio de 1,50 (IC 95 % [1,07-2,11]) (van der Mark et coll., 2012 ).
).Organochlorés
 ; Hancock et coll., 2008
; Hancock et coll., 2008 ; Elbaz et coll., 2009
; Elbaz et coll., 2009 ). En Allemagne, 380 cas de maladie de Parkinson hospitaliers ont été appariés à 379 témoins de voisinage et à 376 témoins régionaux (Seidler et coll., 1996
). En Allemagne, 380 cas de maladie de Parkinson hospitaliers ont été appariés à 379 témoins de voisinage et à 376 témoins régionaux (Seidler et coll., 1996 ). L’exposition aux pesticides résidentielle et professionnelle était déclarée par les participants ; ils étaient également interrogés sur une liste de produits. Il n’existait pas d’association entre la maladie de Parkinson et le métier d’agriculteur, mais il existait une association avec l’exposition aux herbicides et insecticides plus marquée pour les comparaisons des cas aux témoins régionaux ; il existait également une association significative avec les organochlorés, mais sans relation dose-effet en fonction du nombre d’années d’exposition, qui reposait sur un petit nombre de cas (7) et de témoins (5 de voisinage, 2 régionaux) exposés. Aux États-Unis, une étude a comparé 319 cas à 296 témoins recrutés parmi la fratrie, les parents et les conjoints des cas ; l’exposition aux pesticides professionnelle ou résidentielle était rapportée par les participants (Hancock et coll., 2008
). L’exposition aux pesticides résidentielle et professionnelle était déclarée par les participants ; ils étaient également interrogés sur une liste de produits. Il n’existait pas d’association entre la maladie de Parkinson et le métier d’agriculteur, mais il existait une association avec l’exposition aux herbicides et insecticides plus marquée pour les comparaisons des cas aux témoins régionaux ; il existait également une association significative avec les organochlorés, mais sans relation dose-effet en fonction du nombre d’années d’exposition, qui reposait sur un petit nombre de cas (7) et de témoins (5 de voisinage, 2 régionaux) exposés. Aux États-Unis, une étude a comparé 319 cas à 296 témoins recrutés parmi la fratrie, les parents et les conjoints des cas ; l’exposition aux pesticides professionnelle ou résidentielle était rapportée par les participants (Hancock et coll., 2008 ). L’odds ratio pour l’exposition aux pesticides dans leur ensemble était de 1,8 (IC 95 % [1,2-2,7]) tandis qu’il était de 2,0 (IC 95 % [1,1-3,6]) pour les organochlorés (13 % des cas et 7 % des témoins exposés) et 1,9 (IC 95 % [1,1-3,3]) pour les organophosphorés (17 % des cas et 10 % des témoins exposés), ce qui témoigne de la difficulté à distinguer les associations avec ces deux familles. Dans l’étude cas-témoins menée en France (Elbaz et coll., 2009
). L’odds ratio pour l’exposition aux pesticides dans leur ensemble était de 1,8 (IC 95 % [1,2-2,7]) tandis qu’il était de 2,0 (IC 95 % [1,1-3,6]) pour les organochlorés (13 % des cas et 7 % des témoins exposés) et 1,9 (IC 95 % [1,1-3,3]) pour les organophosphorés (17 % des cas et 10 % des témoins exposés), ce qui témoigne de la difficulté à distinguer les associations avec ces deux familles. Dans l’étude cas-témoins menée en France (Elbaz et coll., 2009 ), auprès d’affiliés de la MSA, il existait, chez les hommes, une association entre la maladie de Parkinson et l’utilisation des insecticides, en particulier les organochlorés (45 % des cas et 36 % des témoins exposés) avec un odds ratio de 1,9 ; IC 95 % [1,1-3,5]. Cette association était caractérisée par une relation dose-effet avec un risque d’autant plus important que le nombre d’années d’utilisation d’organochlorés était élevé.
), auprès d’affiliés de la MSA, il existait, chez les hommes, une association entre la maladie de Parkinson et l’utilisation des insecticides, en particulier les organochlorés (45 % des cas et 36 % des témoins exposés) avec un odds ratio de 1,9 ; IC 95 % [1,1-3,5]. Cette association était caractérisée par une relation dose-effet avec un risque d’autant plus important que le nombre d’années d’utilisation d’organochlorés était élevé. ). Dans une deuxième analyse des données de l’AHS réalisée en 2011 à partir de 110 cas prévalents, il n’existait pas d’association pour le DDT et l’aldrine, tandis que l’odds ratio était de 1,6 (IC 95 % [0,7-3,3]) pour la dieldrine en considérant l’ensemble des sujets, de 1,8 (IC 95 % [0,8-4,0]) chez les hommes et de 2,5 (IC 95 % [0,9-6,8]) pour ceux exposés le plus longtemps (Tanner et coll., 2011
). Dans une deuxième analyse des données de l’AHS réalisée en 2011 à partir de 110 cas prévalents, il n’existait pas d’association pour le DDT et l’aldrine, tandis que l’odds ratio était de 1,6 (IC 95 % [0,7-3,3]) pour la dieldrine en considérant l’ensemble des sujets, de 1,8 (IC 95 % [0,8-4,0]) chez les hommes et de 2,5 (IC 95 % [0,9-6,8]) pour ceux exposés le plus longtemps (Tanner et coll., 2011 ). En Finlande, il n’existait pas d’association entre la maladie de Parkinson et l’utilisation de DDT (OR=1,04 ; IC 95 % [0,68-1,60]), mais le contexte d’exposition n’était pas précisé (Kuopio et coll., 1999b
). En Finlande, il n’existait pas d’association entre la maladie de Parkinson et l’utilisation de DDT (OR=1,04 ; IC 95 % [0,68-1,60]), mais le contexte d’exposition n’était pas précisé (Kuopio et coll., 1999b ). Dans une étude canadienne, après confirmation de l’exposition par un hygiéniste, l’odds ratio associé aux organochlorés était de 0,62 (IC 95 % [0,19-2,00]) mais seuls 6 cas et 6 témoins étaient exposés (Rugbjerg et coll., 2011
). Dans une étude canadienne, après confirmation de l’exposition par un hygiéniste, l’odds ratio associé aux organochlorés était de 0,62 (IC 95 % [0,19-2,00]) mais seuls 6 cas et 6 témoins étaient exposés (Rugbjerg et coll., 2011 ).
). ). Les mêmes auteurs ont confirmé ces résultats sur un échantillon de plus grande taille (149 cas, 134 témoins) : l’augmentation d’un ng de β-HCH /mg de cholestérol était associée à un odds ratio de 1,03 (IC 95 % [1,00-1,07]) (Richardson et coll., 2011
). Les mêmes auteurs ont confirmé ces résultats sur un échantillon de plus grande taille (149 cas, 134 témoins) : l’augmentation d’un ng de β-HCH /mg de cholestérol était associée à un odds ratio de 1,03 (IC 95 % [1,00-1,07]) (Richardson et coll., 2011 ). Une association avec la concentration de β-HCH a également été rapportée aux îles Féroé parmi 79 cas et 154 témoins (Petersen et coll., 2008
). Une association avec la concentration de β-HCH a également été rapportée aux îles Féroé parmi 79 cas et 154 témoins (Petersen et coll., 2008 ). Dans une étude post-mortem, une quantité plus importante de dieldrine et de lindane (β-HCH) a été détectée dans la substance noire de 10 patients parkinsoniens que dans celle des témoins ou des patients atteints de maladie d’Alzheimer, tandis qu’il n’y avait pas de différence significative pour d’autres polluants persistants (p,p’-DDE ou l’hexachlorobenzène, HCB) (Corrigan et coll., 2000
). Dans une étude post-mortem, une quantité plus importante de dieldrine et de lindane (β-HCH) a été détectée dans la substance noire de 10 patients parkinsoniens que dans celle des témoins ou des patients atteints de maladie d’Alzheimer, tandis qu’il n’y avait pas de différence significative pour d’autres polluants persistants (p,p’-DDE ou l’hexachlorobenzène, HCB) (Corrigan et coll., 2000 ). Deux autres études ont retrouvé des concentrations plus importantes de dieldrine dans le cerveau de patients parkinsoniens par rapport à des témoins (Fleming et coll., 1994
). Deux autres études ont retrouvé des concentrations plus importantes de dieldrine dans le cerveau de patients parkinsoniens par rapport à des témoins (Fleming et coll., 1994 ; Corrigan et coll., 1998
; Corrigan et coll., 1998 ) ou des patients atteints de maladie d’Alzheimer (Fleming et coll., 1994
) ou des patients atteints de maladie d’Alzheimer (Fleming et coll., 1994 ). Rappelons que dans toutes ces études, les niveaux mesurés peuvent être le marqueur de l’exposition à l’ensemble des pesticides, puisqu’il s’agit de la seule famille qui peut être mesurée des années après l’exposition (Hatcher et coll., 2008
). Rappelons que dans toutes ces études, les niveaux mesurés peuvent être le marqueur de l’exposition à l’ensemble des pesticides, puisqu’il s’agit de la seule famille qui peut être mesurée des années après l’exposition (Hatcher et coll., 2008 ). Il est à noter qu’aucune de ces études, en particulier celles réalisées à partir de dosages plasmatiques, n’a pris en compte la perte de poids des patients parkinsoniens comme facteur de confusion potentiel, or le relargage dans la circulation des organochlorés accumulés dans la graisse lié à l’amaigrissement pourrait conduire à surestimer les différences entre cas et témoins.
). Il est à noter qu’aucune de ces études, en particulier celles réalisées à partir de dosages plasmatiques, n’a pris en compte la perte de poids des patients parkinsoniens comme facteur de confusion potentiel, or le relargage dans la circulation des organochlorés accumulés dans la graisse lié à l’amaigrissement pourrait conduire à surestimer les différences entre cas et témoins. ). L’odds ratio associé à l’augmentation d’une étendue inter-quartile (28,2 ng/g de lipides) de la dieldrine était à la limite de la significativité dans l’ensemble (OR=1,28 ; IC 95 % [0,97-1,69]), mais il augmentait chez les non-fumeurs (OR=1,95 ; IC 95 % [1,26-3,02]), (ce que les auteurs interprétaient comme un possible biais de confusion résiduel lié au tabac), chez les patients dont l’âge de début de la maladie de Parkinson était supérieur à 66 ans (OR=1,69 ; IC 95 % [1,19-2,39], et qui étaient aussi non-fumeurs (OR=2,55 ; IC 95 % [1,48-4,39]). Les auteurs précisaient qu’en Finlande à cette période, l’exposition aux organochlorés était essentiellement d’origine non agricole (utilisation domestique, dans les entrepôts et dans les refuges pour animaux).
). L’odds ratio associé à l’augmentation d’une étendue inter-quartile (28,2 ng/g de lipides) de la dieldrine était à la limite de la significativité dans l’ensemble (OR=1,28 ; IC 95 % [0,97-1,69]), mais il augmentait chez les non-fumeurs (OR=1,95 ; IC 95 % [1,26-3,02]), (ce que les auteurs interprétaient comme un possible biais de confusion résiduel lié au tabac), chez les patients dont l’âge de début de la maladie de Parkinson était supérieur à 66 ans (OR=1,69 ; IC 95 % [1,19-2,39], et qui étaient aussi non-fumeurs (OR=2,55 ; IC 95 % [1,48-4,39]). Les auteurs précisaient qu’en Finlande à cette période, l’exposition aux organochlorés était essentiellement d’origine non agricole (utilisation domestique, dans les entrepôts et dans les refuges pour animaux). ; Hancock et coll., 2008
; Hancock et coll., 2008 ; Elbaz et coll., 2009
; Elbaz et coll., 2009 ). Toutefois, il est souvent difficile de distinguer l’effet de l’exposition aux organochlorés de celui de l’exposition aux organophosphorés car, compte tenu des longues périodes d’exposition, il est fréquent que les mêmes travailleurs aient été exposés aux deux types de pesticides.
). Toutefois, il est souvent difficile de distinguer l’effet de l’exposition aux organochlorés de celui de l’exposition aux organophosphorés car, compte tenu des longues périodes d’exposition, il est fréquent que les mêmes travailleurs aient été exposés aux deux types de pesticides. ) a estimé un odds ratio de 1,50 (IC 95 % [1,07-2,11]) pour les insecticides. Parmi les insecticides, plusieurs études retrouvent des arguments en faveur d’une association avec les insecticides organochlorés. L’étude cas-témoins menée en France auprès d’affiliés de la MSA, rapporte un odds ratio de 1,9 (IC 95 % [1,1-3,5]) pour cette famille de produits. Le risque était d’autant plus important que le nombre d’années d’utilisation d’organochlorés était élevé.
) a estimé un odds ratio de 1,50 (IC 95 % [1,07-2,11]) pour les insecticides. Parmi les insecticides, plusieurs études retrouvent des arguments en faveur d’une association avec les insecticides organochlorés. L’étude cas-témoins menée en France auprès d’affiliés de la MSA, rapporte un odds ratio de 1,9 (IC 95 % [1,1-3,5]) pour cette famille de produits. Le risque était d’autant plus important que le nombre d’années d’utilisation d’organochlorés était élevé.Exposition aux fongicides
 ) (OR=0,99 ; IC 95 % [0,71-1,40]). Bien que l’étude conduite parmi les affiliés de la MSA retrouvait chez les hommes une association entre la maladie de Parkinson et les dithiocarbamates, cette association ne persistait pas après prise en compte de l’exposition à d’autres pesticides (Elbaz et coll., 2009
) (OR=0,99 ; IC 95 % [0,71-1,40]). Bien que l’étude conduite parmi les affiliés de la MSA retrouvait chez les hommes une association entre la maladie de Parkinson et les dithiocarbamates, cette association ne persistait pas après prise en compte de l’exposition à d’autres pesticides (Elbaz et coll., 2009 ).
). ).
).Exposition aux matières actives dans l’Agricultural Health Study
 ), les auteurs avaient identifié, à partir d’un diagnostic auto-déclaré de maladie de Parkinson, 83 cas prévalents à l’inclusion (1993-1997) et 78 cas incidents à la fin du suivi (1999-2003). Leur diagnostic n’avait pas été validé par un examen neurologique standardisé. L’exposition des cas a été comparée à celle des participants sans maladie de Parkinson (79 557 à l’inclusion et 55 931 à la fin du suivi). Il existait un risque augmenté de maladie de Parkinson incidente pour les participants qui avaient utilisé des pesticides le plus longtemps, tandis qu’il n’existait aucune association pour les cas prévalents (cf. paragraphe « Exposition aux pesticides (sans distinction »). Les auteurs étudiaient également l’exposition à 43 pesticides spécifiques avec au moins 4 cas exposés et retrouvaient des oddsratio considérés comme élevés (≥1,4) pour certains produits, mais avec des différences entre les cas prévalents (pendiméthaline, paraquat, cyanazine) et incidents (dicamba, trifuralin, 2,4,5-T, butylate, lindane, phorate, chlorothalonil, benomyl) sans explication évidente. Le nombre de cas et témoins exposés était toutefois relativement faible dans chacun des groupes, ce qui pourrait contribuer à expliquer des résultats peu robustes pour les analyses par type de pesticides. Cette étude est la seule à avoir utilisé dans le cadre de la maladie de Parkinson un modèle de régression logistique hiérarchique. Il s’agit d’une méthode statistique permettant d’inclure dans le même modèle de nombreuses variables, en particulier lorsqu’elles sont corrélées (Momoli et coll., 2010
), les auteurs avaient identifié, à partir d’un diagnostic auto-déclaré de maladie de Parkinson, 83 cas prévalents à l’inclusion (1993-1997) et 78 cas incidents à la fin du suivi (1999-2003). Leur diagnostic n’avait pas été validé par un examen neurologique standardisé. L’exposition des cas a été comparée à celle des participants sans maladie de Parkinson (79 557 à l’inclusion et 55 931 à la fin du suivi). Il existait un risque augmenté de maladie de Parkinson incidente pour les participants qui avaient utilisé des pesticides le plus longtemps, tandis qu’il n’existait aucune association pour les cas prévalents (cf. paragraphe « Exposition aux pesticides (sans distinction »). Les auteurs étudiaient également l’exposition à 43 pesticides spécifiques avec au moins 4 cas exposés et retrouvaient des oddsratio considérés comme élevés (≥1,4) pour certains produits, mais avec des différences entre les cas prévalents (pendiméthaline, paraquat, cyanazine) et incidents (dicamba, trifuralin, 2,4,5-T, butylate, lindane, phorate, chlorothalonil, benomyl) sans explication évidente. Le nombre de cas et témoins exposés était toutefois relativement faible dans chacun des groupes, ce qui pourrait contribuer à expliquer des résultats peu robustes pour les analyses par type de pesticides. Cette étude est la seule à avoir utilisé dans le cadre de la maladie de Parkinson un modèle de régression logistique hiérarchique. Il s’agit d’une méthode statistique permettant d’inclure dans le même modèle de nombreuses variables, en particulier lorsqu’elles sont corrélées (Momoli et coll., 2010 ). L’intérêt de cette approche dans le cadre des études sur les pesticides mériterait d’être étudié plus en détail.
). L’intérêt de cette approche dans le cadre des études sur les pesticides mériterait d’être étudié plus en détail. ). Dans cette étude, le diagnostic auto-déclaré de maladie de Parkinson a été confirmé par un neurologue et 110 cas prévalents de maladie de Parkinson ont été identifiés et appariés à 358 témoins. Un risque 2,0 (IC 95 % [1,2-3,6]) fois plus élevé de maladie de Parkinson est observé chez les personnes exposées à un pesticide induisant un stress oxydant et un risque 1,7 (IC 95 % [1,0-2,8]) fois plus élevé chez celles ayant utilisé un pesticide inhibant le complexe I mitochondrial. De plus, dans chacun de ces deux groupes, une association avec un pesticide spécifique a été observée, le paraquat (OR=2,5 ; IC 95 % [1,4-4,7]) et la roténone (OR=2,5 ; IC 95 % [1,3-4,7]) respectivement. Il existait une relation dose-effet en fonction du nombre de jours cumulés pour le paraquat mais pas pour la roténone. La roténone est un insecticide dérivé de substances naturelles, autorisé en France pour certaines cultures jusqu’en 2011 et aussi utilisé en agriculture biologique et pour des usages domestiques et le jardinage. Peu d’études épidémiologiques disposent de données sur la relation entre l’exposition à la roténone et la maladie de Parkinson et leurs résultats sont difficiles à interpréter en raison du petit nombre de sujets exposés (Kamel et coll., 2007
). Dans cette étude, le diagnostic auto-déclaré de maladie de Parkinson a été confirmé par un neurologue et 110 cas prévalents de maladie de Parkinson ont été identifiés et appariés à 358 témoins. Un risque 2,0 (IC 95 % [1,2-3,6]) fois plus élevé de maladie de Parkinson est observé chez les personnes exposées à un pesticide induisant un stress oxydant et un risque 1,7 (IC 95 % [1,0-2,8]) fois plus élevé chez celles ayant utilisé un pesticide inhibant le complexe I mitochondrial. De plus, dans chacun de ces deux groupes, une association avec un pesticide spécifique a été observée, le paraquat (OR=2,5 ; IC 95 % [1,4-4,7]) et la roténone (OR=2,5 ; IC 95 % [1,3-4,7]) respectivement. Il existait une relation dose-effet en fonction du nombre de jours cumulés pour le paraquat mais pas pour la roténone. La roténone est un insecticide dérivé de substances naturelles, autorisé en France pour certaines cultures jusqu’en 2011 et aussi utilisé en agriculture biologique et pour des usages domestiques et le jardinage. Peu d’études épidémiologiques disposent de données sur la relation entre l’exposition à la roténone et la maladie de Parkinson et leurs résultats sont difficiles à interpréter en raison du petit nombre de sujets exposés (Kamel et coll., 2007 ; Dhillon et coll., 2008
; Dhillon et coll., 2008 ; Tanner et coll., 2009
; Tanner et coll., 2009 ). Par ailleurs, cette molécule a été utilisée pour créer un modèle animal de maladie de Parkinson (cf. chapitre « Mécanismes d’action neurotoxique des pesticides »).
). Par ailleurs, cette molécule a été utilisée pour créer un modèle animal de maladie de Parkinson (cf. chapitre « Mécanismes d’action neurotoxique des pesticides »).Exposition non professionnelle aux pesticides
 ). Une étude cas-témoins plus récente, également menée en Californie, a évalué l’exposition environnementale aux pesticides en combinant les lieux de résidence et de travail avec un registre d’utilisation de pesticides, grâce à des SIG (Système d’Information Géographique) (Costello et coll., 2009
). Une étude cas-témoins plus récente, également menée en Californie, a évalué l’exposition environnementale aux pesticides en combinant les lieux de résidence et de travail avec un registre d’utilisation de pesticides, grâce à des SIG (Système d’Information Géographique) (Costello et coll., 2009 ). La région de l’étude (Central Valley of California) est une région agricole et la majorité des traitements est réalisée par voie aérienne. L’exposition environnementale aux pesticides a été définie à partir de l’ensemble des traitements pesticides réalisés chaque année dans un rayon de 500 mètres autour du lieu d’habitation. Les participants exposés à la fois au paraquat et au manèbe (fongicide) avaient un risque 1,75 fois plus élevé de maladie de Parkinson par rapport aux participants non exposés, tandis qu’il n’existait pas d’association en cas d’exposition à un seul des deux produits. Les mêmes auteurs ont récemment rapporté une association entre la maladie de Parkinson et la co-exposition au paraquat, manèbe et zirame (fongicide dithiocarbamate pouvant inhiber une enzyme du complexe protéasome-ubiquitine), avec une association plus forte pour les expositions à proximité du lieu de travail que pour celles à proximité du domicile (Wang et coll., 2011
). La région de l’étude (Central Valley of California) est une région agricole et la majorité des traitements est réalisée par voie aérienne. L’exposition environnementale aux pesticides a été définie à partir de l’ensemble des traitements pesticides réalisés chaque année dans un rayon de 500 mètres autour du lieu d’habitation. Les participants exposés à la fois au paraquat et au manèbe (fongicide) avaient un risque 1,75 fois plus élevé de maladie de Parkinson par rapport aux participants non exposés, tandis qu’il n’existait pas d’association en cas d’exposition à un seul des deux produits. Les mêmes auteurs ont récemment rapporté une association entre la maladie de Parkinson et la co-exposition au paraquat, manèbe et zirame (fongicide dithiocarbamate pouvant inhiber une enzyme du complexe protéasome-ubiquitine), avec une association plus forte pour les expositions à proximité du lieu de travail que pour celles à proximité du domicile (Wang et coll., 2011 ). Ces résultats suggèrent la possibilité d’effets synergiques dans le cadre de la neurotoxicité liée aux pesticides.
). Ces résultats suggèrent la possibilité d’effets synergiques dans le cadre de la neurotoxicité liée aux pesticides. ). Les auteurs de cette étude évoquent la bioaccumulation de substances neurotoxiques, comme les polychlorobiphényles (PCB) chez la baleine, pour expliquer cette association. Le même phénomène pourrait être évoqué pour certains pesticides comme les organochlorés. Deux études de cohorte ont rapporté une augmentation du risque de maladie de Parkinson chez les hommes ayant une forte consommation de produits laitiers (Park et coll., 2005
). Les auteurs de cette étude évoquent la bioaccumulation de substances neurotoxiques, comme les polychlorobiphényles (PCB) chez la baleine, pour expliquer cette association. Le même phénomène pourrait être évoqué pour certains pesticides comme les organochlorés. Deux études de cohorte ont rapporté une augmentation du risque de maladie de Parkinson chez les hommes ayant une forte consommation de produits laitiers (Park et coll., 2005 ; Chen et coll., 2007
; Chen et coll., 2007 ). Parmi les hypothèses avancées, la contamination des produits laitiers par certains pesticides a été émise mais elle reste à confirmer.
). Parmi les hypothèses avancées, la contamination des produits laitiers par certains pesticides a été émise mais elle reste à confirmer.Autres variables liées à l’habitat rural ou au métier d’agriculteur
 ).
). ). Des études postérieures à cette méta-analyse retrouvent une association similaire (Elbaz et coll., 2009
). Des études postérieures à cette méta-analyse retrouvent une association similaire (Elbaz et coll., 2009 ; Tanner et coll., 2009
; Tanner et coll., 2009 ; Rugbjerg et coll., 2011
; Rugbjerg et coll., 2011 ). Certains travaux agricoles précis ont été associés à la maladie de Parkinson : les grandes cultures ou cultures céréalières (Semchuk et coll., 1992
). Certains travaux agricoles précis ont été associés à la maladie de Parkinson : les grandes cultures ou cultures céréalières (Semchuk et coll., 1992 ), l’élevage (Lee et coll., 2002
), l’élevage (Lee et coll., 2002 ; Vlajinac et coll., 2010
; Vlajinac et coll., 2010 ), l’horticulture (Tuchsen et Jensen, 2000
), l’horticulture (Tuchsen et Jensen, 2000 ) ou les cultures fruitières ou légumières (Hertzman et coll., 1990
) ou les cultures fruitières ou légumières (Hertzman et coll., 1990 ; Vlajinac et coll., 2010
; Vlajinac et coll., 2010 ). Dans une étude, le travail agricole et l’exposition aux pesticides étaient des facteurs de risque indépendants de maladie de Parkinson (Gorell et coll., 1998
). Dans une étude, le travail agricole et l’exposition aux pesticides étaient des facteurs de risque indépendants de maladie de Parkinson (Gorell et coll., 1998 ), tandis que dans une autre, l’association entre la maladie de Parkinson et le métier agricole était expliquée par l’exposition professionnelle aux pesticides (Liou et coll., 1997
), tandis que dans une autre, l’association entre la maladie de Parkinson et le métier agricole était expliquée par l’exposition professionnelle aux pesticides (Liou et coll., 1997 ) et, qu’à l’inverse, dans une étude canadienne, la relation entre la maladie de Parkinson et l’exposition aux pesticides diminuait après ajustement sur le métier d’agriculteur qui lui restait significativement associé à la maladie (Rugbjerg et coll., 2011
) et, qu’à l’inverse, dans une étude canadienne, la relation entre la maladie de Parkinson et l’exposition aux pesticides diminuait après ajustement sur le métier d’agriculteur qui lui restait significativement associé à la maladie (Rugbjerg et coll., 2011 ) ; les auteurs de cette étude interprétaient ce résultat comme en faveur du rôle d’un facteur présent dans le milieu agricole et distinct des pesticides.
) ; les auteurs de cette étude interprétaient ce résultat comme en faveur du rôle d’un facteur présent dans le milieu agricole et distinct des pesticides. ). Une étude cas-témoins conduite en Californie a identifié les puits potentiellement contaminés par des pesticides après des applications agricoles à l’aide d’un SIG et a retrouvé une association avec la maladie de Parkinson, indépendante de l’exposition environnementale ou professionnelle aux pesticides (Gatto et coll., 2009
). Une étude cas-témoins conduite en Californie a identifié les puits potentiellement contaminés par des pesticides après des applications agricoles à l’aide d’un SIG et a retrouvé une association avec la maladie de Parkinson, indépendante de l’exposition environnementale ou professionnelle aux pesticides (Gatto et coll., 2009 ).
). ), mais ce modèle n’a pas été répliqué de manière satisfaisante dans plusieurs autres laboratoires (Bove et coll., 2006
), mais ce modèle n’a pas été répliqué de manière satisfaisante dans plusieurs autres laboratoires (Bove et coll., 2006 ; Schapira et coll., 2006
; Schapira et coll., 2006 ; Kordower et coll., 2006
; Kordower et coll., 2006 ; Manning-Bog et coll., 2006
; Manning-Bog et coll., 2006 ; Zeng et coll., 2006
; Zeng et coll., 2006 ). Une étude plus récente suggère qu’une bactérie du sol (Streptomyces venezuelae) produit un métabolite pouvant perturber le fonctionnement du protéasome et entraînerait ainsi une perte des neurones dopaminergiques chez le nématode (Caenorhabditis elegans) (Caldwell et coll., 2009
). Une étude plus récente suggère qu’une bactérie du sol (Streptomyces venezuelae) produit un métabolite pouvant perturber le fonctionnement du protéasome et entraînerait ainsi une perte des neurones dopaminergiques chez le nématode (Caenorhabditis elegans) (Caldwell et coll., 2009 ). Ces résultats doivent être approfondis, en particulier par l’étude de la relation entre les caractéristiques agricoles, l’utilisation de pesticides et la présence de ces bactéries.
). Ces résultats doivent être approfondis, en particulier par l’étude de la relation entre les caractéristiques agricoles, l’utilisation de pesticides et la présence de ces bactéries.Interactions gène-environnement
 ). En effet, des polymorphismes de certains gènes pourraient expliquer une susceptibilité particulière aux facteurs environnementaux (interaction gène-environnement), d’autant plus qu’un grand nombre de protéines intervient dans le métabolisme et le transport des pesticides (Hodgson, 2001
). En effet, des polymorphismes de certains gènes pourraient expliquer une susceptibilité particulière aux facteurs environnementaux (interaction gène-environnement), d’autant plus qu’un grand nombre de protéines intervient dans le métabolisme et le transport des pesticides (Hodgson, 2001 et 2003
et 2003 ).
). ; Elbaz et coll., 2004
; Elbaz et coll., 2004 ; Manthripragada et coll., 2010
; Manthripragada et coll., 2010 ; Dutheil et coll., 2010
; Dutheil et coll., 2010 ). Toutefois, ces résultats n’ont pas toujours été répliqués (Dick et coll., 2007
). Toutefois, ces résultats n’ont pas toujours été répliqués (Dick et coll., 2007
 ). Le séquençage du génome humain et le développement des études pangénomiques rendent maintenant possibles des études à plus large échelle. Même si celles-ci présentent un certain nombre de difficultés méthodologiques, elles permettront d’aborder la question des interactions gène-environnement dans le futur. Au-delà de l’intérêt des résultats de ces études pour la compréhension des mécanismes impliqués dans la cause de la maladie de Parkinson, ces approches posent néanmoins des questions éthiques qui nécessitent d’être discutées (Kaye et coll., 2010
). Le séquençage du génome humain et le développement des études pangénomiques rendent maintenant possibles des études à plus large échelle. Même si celles-ci présentent un certain nombre de difficultés méthodologiques, elles permettront d’aborder la question des interactions gène-environnement dans le futur. Au-delà de l’intérêt des résultats de ces études pour la compréhension des mécanismes impliqués dans la cause de la maladie de Parkinson, ces approches posent néanmoins des questions éthiques qui nécessitent d’être discutées (Kaye et coll., 2010 ).
).Bibliographie
























































































































































































→ Aller vers SYNTHESE