III. Toxicologie
2013
22-
Mécanismes d’action des pesticides dans les hémopathies
L’hématopoïèse est un ensemble de processus qui concourent à la production journalière de millions de cellules sanguines aussi différentes dans leur morphologie que dans leurs fonctions. L’hématopoïèse démarre dans le sac vitellin après 6 à 8 semaines de gestation, puis dans le foie fœtal, la rate et la moelle osseuse, seul compartiment hématopoïétique chez l’homme adulte. Chez l’adulte, l’hématopoïèse résulte d’une différenciation progressive et multiple à partir d’un nombre restreint de cellules souches capables d’auto-renouvellement. La première étape conduit à la formation de progéniteurs (capables de constituer in vitro des colonies de cellules morphologiquement identifiables) à l’origine des précurseurs et des cellules matures qui rejoindront le compartiment sanguin.
Mécanismes moléculaires de régulation de l’hématopoïèse
Le devenir des cellules souches hématopoïétiques (CSH) vers l’auto-renouvellement ou la différenciation est contrôlé par une interaction complexe entre les mécanismes moléculaires intrinsèques et des signaux extrinsèques de l’environnement comme les chimiokines, les molécules d’adhésion et certaines cytokines, les facteurs de croissance hématopoïétiques (FCH). La caractéristique commune des FCHs est leur capacité à activer des récepteurs membranaires entraînant leur dimérisation, puis l’activation des voies de transduction du signal, auxquelles participent des protéines kinases. Ces dernières vont conduire à la mobilisation de facteurs de transcription, puis à l’activation de l’expression de gènes spécifiques.
Les FCH, synthétisés par de nombreuses cellules, peuvent exercer plusieurs fonctions par l’intermédiaire d’un même récepteur dans différents types cellulaires, et une même fonction peut être exercée par plusieurs FCHs. Parmi les différents types de FCHs, les plus connus intervenant lors des premières étapes de l’hématopoïèse sont le c-kit ligand ou SCF (Stem Cell Factor), les interleukines, les CSF (Colony Stimulating Factors). Il existe aussi des régulateurs négatifs de l’hématopoïèse comme le TGFa ou b (Transforming Growth Factor).
Plusieurs facteurs de transcription (Ets, Gfi, GATA-2, c-myb…) sont impliqués dans l’auto-renouvellement des CSH, leur survie, leur prolifération, et le maintien de leur pool, les STAT
(Signal Transducers and Activators of Transcription) régulant positivement l’auto-renouvellement. L’engagement des CSH et des progéniteurs vers la différenciation lymphoïde ou myéloïde est contrôlé par un réseau de facteurs de transcription. La balance entre les niveaux d’expression des différents facteurs de transcription conditionne la voie de différenciation vers laquelle les cellules vont s’engager. On distingue les facteurs intervenant dans la différenciation de toutes les lignées et ceux spécifiques de lignées comme GATA-1 et PU.1 impliqués dans la différenciation des lymphocytes B et des macrophages par exemple (Arinobu et coll., 2007

). L’expression de certains facteurs de transcription pourrait être modulée par des modifications épigénétiques.
Les voies de signalisation impliquées dans la régulation de l’auto-renouvellement sont les voies Notch, Wnt/β-caténine et BMP (Bone Morphogenetic proteins). Les principales voies de transduction du signal impliquées dans la croissance et la différenciation des cellules hématopoïétiques sont la voie des MAP kinases (Mitogen-Activated Protein Kinase), la voie de la PI3K/AKT (Phosphatidyl Inositol 3-Kinase/AKT), la voie JAK/STAT (Janus Kinase/Signal Transducer and Activator of Transcription) et la voie NFkB (Nuclear Factor kappa B). La transmission du signal se fait par des cascades de phosphorylation de protéines kinases qui vont activer les facteurs impliqués dans la régulation de la survie et de la prolifération. Des phosphatases contrôlent ces activités kinases comme PTEN (gène suppresseur de tumeur) qui régule négativement la voie PI3K/AKT.
Mécanismes moléculaires impliqués dans les pathologies hématopoïétiques
Sous-types de pathologies
Les hémopathies sont des groupes hétérogènes de pathologies originaires de la moelle osseuse (leucémie) ou d’un tissu ou cellule lymphoïde (lymphomes, myélomes). Elles peuvent être classées selon différents critères : par exemple le site où se développe la maladie ou/et la lignée impliquée (lymphoïde, myéloïde) mais également selon le caractère chronique ou aigu de la maladie. Par ordre d’incidence décroissante on note : les lymphomes hodgkinien et non hodgkinien (LH, LNH) ; les myélomes (proliférations malignes de plasmocytes) ; et les leucémies issues des lignées lymphoïde ou myéloïde (aiguës et chroniques).
Lymphomes
Les lymphomes sont des tumeurs du système lymphatique (Cuenca et coll., 2008

). Ils sont constitués par les lymphocytes des ganglions, de la rate, des amygdales et ceux présents dans tous les organes (en particulier la moelle osseuse, l’intestin, les glandes…). Les lymphomes non hodgkiniens (LNH) résultent des proliférations de cellules tumorales issues des lymphocytes B (type le plus courant), T (CD4, CD8 ou Tγδ) ou NK, et bloquées à un stade de différenciation plus ou moins précoce. Ils forment un groupe diversifié de plus de 30 types différents. La classification des LNH la plus utilisée actuellement est celle publiée récemment par l’OMS (Swerdlow et coll., 2008

). On classe également les LNH selon leur développement (lymphomes indolents avec développement lent, et lymphomes agressifs) et selon leur évolution probable. La maladie de Hodgkin ou lymphome de Hodgkin est un type de lymphome caractérisé par la présence de grosses cellules atypiques, les cellules de Reed-Sternberg.
Myélomes
Le myélome multiple ou maladie de Kahler est une infiltration plasmocytaire maligne de la moelle osseuse. Elle s’accompagne, en général de la sécrétion d’une immunoglobuline monoclonale complète (chaînes lourdes et légères) ou bien seulement d’une chaîne légère et de manifestations osseuses cliniques ou radiologiques. Rare avant 40 ans, il ne concerne jamais l’enfant.
Leucémies myéloïdes
Les leucémies myéloïdes concernent la transformation et la prolifération de précurseurs hématopoïétiques des lignées myéloïdes (granulocytique et monocytaire).
Les leucémies myéloïdes chroniques proviennent d’une prolifération sans blocage de la différenciation, de la cellule souche hématopoïétique et de la lignée granuleuse.
Les leucémies myéloblastiques aiguës (81 % des malades ont plus de 20 ans) sont caractérisées par une expansion clonale de cellules immatures dont la différenciation est bloquée à un stade précoce et qui sont incapables de maturation terminale.
Leucémies lymphoïdes
Les leucémies aiguës lymphoblastiques (LAL), très fréquentes chez l’enfant, sont de plusieurs sous-types en fonction des différents réarrangements chromosomiques. Elles sont issues de la prolifération de cellules lymphoïdes bloquées à un stade précoce (lymphoblaste) (75 % des cas de leucémie chez l’enfant, pic entre 2 et 5 ans).
La leucémie lymphoïde chronique (LLC), caractérisée par la prolifération de lymphocytes est la leucémie la plus fréquente, touchant de façon préférentielle les personnes âgées de plus de 50 ans avec une évolution lente. En dehors de quelques cas familiaux, on ne connaît pas de facteurs favorisant le déclenchement de la maladie qu’ils soient environnementaux, génétiques ou infectieux.
Étiologie
L’étiologie des pathologies hématopoïétiques est encore assez mal connue. Plusieurs hypothèses sont proposées.
Ainsi une immunodéficience peut être à l’origine de certaines pathologies hématopoïétiques notamment des lymphomes (LNH et AIDS/HIV) (Grulich et coll., 2005

). Une perturbation des interleukines IL-4 et IL-10 est associée au risque de LNH (Lan et coll., 2006

; Rothman et coll., 2006

; Purdue et coll., 2007

).
Certaines infections virales sont également suspectées (LLC et virus Epstein-Barr…) (De Sanjosé et coll., 2007

), ainsi que des facteurs génétiques (LH, LNH) (Rudant et coll., 2007

; Wang et coll., 2007

), mais aussi l’exposition aux radiations, à la chimiothérapie, au benzène, au pétrole, aux polluants.
Outre les déficits immunitaires et les infections, d’autres dérèglements du système immunitaire sont de plus en plus reconnus comme étant liés au risque de LNH. Les maladies auto-immunes (l’arthrite rhumatoïde, le lupus érythémateux disséminé, le syndrome de Sjögren, le psoriasis et la maladie cœliaque) seraient associées à un risque accru de LNH. Aujourd’hui, les mécanismes sous-jacents restent mal identifiés.
Mécanismes moléculaires
Les pathologies hématopoïétiques sont caractérisées par des translocations, des mutations et des fusions de gènes.
Pour les leucémies myéloïdes chroniques, dans 95 % des cas, il est observé une translocation réciproque entre les chromosomes 22 et 9, ce qui conduit à l’expression constitutive d’une nouvelle protéine à activité tyrosine kinase « bcr-abl » activant de nombreuses voies de signalisation (ras, STAT, PI3K et myc).
Pour les leucémies lymphoïdes chroniques, dans 50 % à 80 % des cas on retrouve des anomalies chromosomiques dont les plus fréquentes sont une délétion du bras long du chromosome 13 (délétion 13q) et la trisomie du chromosome 12. Certaines anomalies concernent des délétions des chromosomes 11 et 17 (17q avec perte du gène suppresseur de tumeur p53) et des anomalies du bras long du chromosome 11 (11q23).
Les mécanismes moléculaires impliqués dans les leucémies aiguës sont les suivants :
• translocation chromosomique et fusion de gènes : entre un gène actif et un proto-oncogène (par exemple : fusion d’un gène des immunoglobulines et de c-myc dans la leucémie aiguë lymphoblastique (type Burkitt)). Environ 300 translocations récurrentes ont été recensées ;
• mutations de récepteurs membranaires aux cytokines (FLT3, cKIT), de petites protéines G (cRas), de gènes suppresseurs de tumeurs (Rb), de protéines kinases (AKT) et facteurs de transcription (GATA-1) (Harigae, 2006

; Kim et coll., 2008

; Reinhardt et coll., 2012

) ;
• défaut de GSTt-1 (glutathion transférase thêta-1) et activité plus importante du cytochrome P450 2E1 (CYP2E1) dans 30 % des syndromes myélodysplasiques – SMD – (cellule souche anormale) qui peuvent se transformer en leucémie aiguë myéloïde (LAM).
Pour les leucémies myéloblastiques aiguës, la transformation leucémique résulte de l’accumulation de mutations au niveau de proto-oncogènes (ras) ou de récepteurs membranaires aux cytokines (FLT3) ou de gènes suppresseurs de tumeurs (Rb).
Le myélome multiple est la conséquence de plusieurs événements oncogéniques concernant la lignée lymphocytaire B : translocation chromosomique (11 ; 14), translocation (4 ; 14), dysrégulation des gènes
c-myc,
N-ras et
K-ras,
Rb. Au cours de la progression de la maladie, on assiste fréquemment à une translocation (16 ; 14), et la mutation du gène suppresseur de tumeur p 53
1
http://fmc.med.univ‑tours.fr/Pages/Hemato/Cours/myelome.html [lien obsolète]
.
Certaines anomalies génétiques ont été reconnues comme caractéristiques d’entités spécifiques de LNH – lymphomes folliculaires et translocation (14 ; 18), lymphomes du manteau et translocation (11 ; 14) – et ont contribué de ce fait à l’élaboration de la classification des LNH acceptée actuellement comme référence par tous les anatomopathologistes et cliniciens (Thieblemont et Salles, 2005

).
Mécanismes d’action des pesticides dans les pathologies hématopoïétiques
Afin d’apporter des arguments scientifiques sur la plausibilité d’une relation entre pesticides et santé, en particulier en ce qui concerne les pathologies hématopoïétiques, les recherches bibliographiques ont été focalisées sur les études relatives à l’impact des pesticides in vivo ou in vitro sur :
• les voies de signalisation clé de la régulation de l’hématopoïèse normale : AKT/PI3K/NFkB/MAPK/JAK/STAT ; et celles affectées au cours des pathologies hématopoïétiques (RAS/Stat/PI3K/Myc/Rb/AKT/BLc2/caspase) ;
• les cytokines (IL-2, -3, -4, -6, -7, -5 et -11) et facteurs de croissance (GM-CSF), les récepteurs (FLT3, cKIT), et les facteurs de transcription (CEBPA, GATA-1, PU.1; spi-1) impliqués dans la régulation de l’hématopoïèse normale ;
• les dommages de l’ADN (présence de micronoyaux, d’adduits, de coupures) pouvant conduire à des réarrangements et/ou des aberrations chromosomiques, des mutations, des translocations et des fusions de gènes ;
• le stress oxydant qui pourrait être l’origine des perturbations des voies de signalisation citées ci-dessus (AKT) ou des dommages à l’ADN.
De plus, il est établi que les fluctuations contrôlées des taux de radicaux libres gouverneraient au moins en partie les capacités d’auto-renouvellement, de différenciation et de prolifération des cellules hématopoïétiques (Hole et coll., 2012

). Toute perturbation de cet équilibre oxydo-réducteur pouvant conduire à une insuffisance des propriétés de la moelle osseuse en lien avec des dommages à l’ADN et l’altération du cycle cellulaire des progéniteurs hématopoïétiques. Ces dérèglements peuvent être à l’origine de pathologies hématopoïétiques (Ghaffari et coll., 2008

; Iuchi et coll., 2010

).
Organochlorés
Lindane
La majorité des études sur les mécanismes d’action des organochlorés (environ 30 études), concerne le lindane ou g-HCH.
Ce composé ainsi que le pentachlorophénol, l’hexachlorophénol exercent
in vitro un effet toxique sur les cellules hématopoïétiques : ils peuvent perturber la différenciation hématopoïétique, bloquer ou retarder la mitose des progéniteurs hématopoïétiques (Parent-Massin et coll., 1993

; Henschler et coll., 2001

; Van den Heuvel et coll., 2001

).
Chez les rats traités avec 10 mg/kg de lindane (Mediratta et coll., 2008

), on observe une diminution de l’immunité humorale ainsi qu’une immunotoxicité dépendante de l’induction d’un stress oxydant. Les souris nourries pendant 1 mois avec de l’aliment contenant 12 µg, 120 µg ou 1,2 mg/kg de lindane ont leur réponse immunitaire perturbée (Meera et coll., 1992

). Un autre organochloré, l’heptachlore, exerce un effet immunosuppresseur chez les rats exposés au cours du développement embryonnaire (Smialowicz, 2002

). Chez la truite arc en ciel, l’injection de lindane à 10 mg/kg pendant 1 mois entraîne une lymphopénie (Dunier et coll., 1995

). De même, ce composé modifie l’expression à différents degrés de gènes liés au système immunitaire dans les leucocytes de poisson (daurade) : IL-1b, TNFa, MHCIa, MHCIIa, Mx, TLR9, IgML and TCRa (Cuesta et coll., 2008

).
In vitro, ces composés exercent un effet pro-apoptotique sur des cellules immunitaires en culture (splénocytes, thymocytes, lignée HL-60) (Kang et coll., 1998

; Olgun et coll., 2004

; Battaglia et coll., 2010

).
Seth et coll. (2005

) ont observé chez des personnes empoisonnées au lindane une élévation du taux sérique de cytokines (IL-2, IL-4, TNFa). L’étude de Colt et coll. (2009

) suggère qu’une corrélation entre le risque de LNH et l’exposition aux organochlorés est plausible chez les personnes portant certains variants de gènes de cytokines ou interleukines comme IFN, IL-4 IL-10 ou IL-8.
La génotoxicité du lindane semble dépendre du modèle cellulaire testé ou du tissu cible (Pool-Zobel et coll., 1994

; Tisch et coll., 2005

). Le lindane exerce un effet pro-oxydant ; cette propriété démontrée
in vivo et
in vitro dans divers modèles cellulaires s’exercerait
via la production accrue d’espèces radicalaires et/ou l’augmentation de taux de GSH (glutathion réduit).
In vitro, ces effets sont observés à la dose de 25 µM (Sharma et coll., 2010

) ;
in vivo, une dose de 40 mg/kg pendant 24 heures induit chez le rat un stress oxydant mis en évidence par la présence de glutathion oxydé dans les sécrétions biliaires et d’une réponse inflammatoire au niveau hépatique (Junge et coll., 2001

). Une exposition prolongée des animaux (4 semaines) à 30 mg/kg de lindane entraîne une peroxydation lipidique ainsi qu’une modification des défenses anti-oxydantes (Ahmed et coll., 2008

). Des doses plus faibles (5 mg/kg) entraînent une perturbation du statut oxydoréducteur chez l’animal avec une augmentation des TBARS (
Thiobarbituric Acid Reactive Substances), sous-produits des peroxydations lipidiques dans le foie et le plasma dès les premières heures de traitement (Radosavjevic et coll., 2009

).
Selon les modèles cellulaires, le lindane est soit inhibiteur, soit inducteur de l’apoptose. Dans les cultures primaires d’hépatocytes, il inhibe,
via son pouvoir pro-oxydant et l’activation des PKCs, l’apoptose hépatocytaire spontanée (inhibition des caspases-3, -9, induction de Bcl-xL/Bcl-2, répression de Bax), données pouvant expliquer son pouvoir pro-carcinogène. L’ensemble de ces modifications moléculaires s’accompagne d’une perturbation des processus d’autophagie pouvant favoriser un processus de cancérisation (Zucchini-Pascal et coll., 2009

). Mais, il est aussi un inducteur de l’apoptose dans d’autres modèles cellulaires en culture : les splénocytes de souris (Battaglia et coll., 2010

) et aussi
in vivo chez l’animal (La Sala et coll., 2009

; Saradha et coll., 2009

). Le lindane exerce des effets spécifiques sur certaines protéines de la signalisation cellulaire (ERK1, MAP kinase, TPP2, caspase, P53) (Hatakeyama et coll., 2003

; Mograbi et coll., 2003

; Ledirac et coll., 2005

) ; il perturbe aussi les jonctions intercellulaires comme les «
GAP Junctions » qui jouent un rôle critique dans la régulation de la prolifération cellulaire (Yamasaki, 1996

; Trosko et Ruch, 2002

). En effet, l’exposition des lignées murines de cellules de Sertoli à 50 µM de lindane induit une accumulation intracellulaire de connexine, évènement qui peut être rapproché de la transformation néoplasique (Mograbi et coll., 2003

). Certains auteurs montrent que le lindane est capable à des doses élevées (50 µM) d’induire dans les cellules tumorales, la translocation nucléaire d’une enzyme (tripetidylpeptidase II) ce qui entraîne une augmentation des processus apoptotiques via l’expression augmentée de p53 et l’activation de certaines caspases (Preta et coll., 2010

).
En résumé, le lindane exerce une toxicité sur les cellules hématopoïétiques in vitro qui est cohérente avec les perturbations du système immunitaire observées in vivo. Le lindane est un agent pro-apoptotique qui perturbe le statut oxydo-réducteur intracellulaire et/ou active des voies de signalisation qui contrôlent la croissance et la différenciation. Certains effets observés en particulier chez l’Homme comme la perturbation du système immunitaire, sont en faveur de la plausibilité d’une relation entre l’exposition chronique à ce composé et l’apparition de pathologies hématopoïétiques.
Heptachlore
L’heptachlore n’apparaît pas comme un composé génotoxique dans les hépatocytes de rat en culture (Okoumassoun et coll., 2003

). Cependant, Telang et coll. (1982

) ont montré que ce composé inhibait les communications intercellulaires à l’instar des promoteurs de tumeurs connus et suggèrent un mécanisme d’action épigénétique. En revanche, l’exposition de cellules lymphoblastiques humaines TK6 à des doses d’heptachlore allant de 1 à 20 µM entraîne une augmentation de dommages à l’ADN (test des comètes) (Prado et coll., 2009

). L’exposition de cellules leucocytaires polymorphonucléées humaines pendant 40 min à de faibles doses d’heptachlore (0,01 à 10 nM induits des cassures d’ADN mesurées par la méthode Tunnel (Cassidy et coll., 2005

). Ce composé aurait un potentiel mutagène dans les lymphomes de souris tk+/- (McGregor et coll., 1988

).
Une étude rapporte un potentiel pro-oxydant de l’heptachlore (Bayoumi et coll., 2000

) à des concentrations assez élevées dans les cellules CHO.
L’heptachlore modifie certains éléments clés de la transduction des signaux comme :
• les récepteurs à activité tyrosine kinase dans les hépatomes de rats (Hansen et coll., 2001

) ;
• l’activité kinasique globale de fractions particulaires (PKA) dans les villosités placentaires humaines (Magnarelli et coll., 2009

) ;
• l’activité des MAP kinases, PKC et Raf MEK dans les cellules Hacat (Ledirac et coll., 2005

) ;
• l’activité de la PKC dans le foie chez la souris exposée à de l’heptachlore epoxide (Hansen et coll., 2001

) ;
• une entrée de calcium dans les hépatomes de souris (Hansen et coll., 2006

).
Dans des lignées lymphocytaires, l’heptachlore apparaît comme un agent capable de moduler certaines voies de signalisation corrélées à la croissance cellulaire (activation de la voie MAP kinase) (Chuang et Chuang, 1998

) et l’apoptose (diminution de l’expression de p53) (Rought et coll., 1998

).
Des études rapportent un effet immunomodulateur de l’heptachlore. Il diminue la capacité des cellules NK à lyser les cellules tumorales (Beach et coll., 2006

) ; exerce un effet mitogénique sur les cellules mononuclées périphériques de singe et stimule la sécrétion d’IL-2 (Chuang et coll., 1992

) et certaines fonctions immunitaires comme le chimiotactisme des leucocytes (Chuang et Chuang, 1998

; Chuang et coll., 1999

). Dans les lymphocytes humains (CEMx174), l’heptachlore présente des effets différentiels selon la dose : à faible concentration il supprime l’activation d’une protéase apoptotique alors qu’il l’augmente à forte concentration (Rought et coll., 2000

). L’heptachlore exerce un effet immunosuppresseur chez les rats exposés au cours du développement embryonnaire (Smialowicz, 2002

). L’étude de Colt et coll. (2009

) suggère qu’une interaction entre gène et environnement (gène immunité/exposition aux organochlorés) est plausible dans les cas de LNH.
En résumé, l’heptachlore perturbe l’immunité. Si son effet génotoxique n’est pas prouvé dans tous les modèles cellulaires, il semble en revanche moduler certaines voies de signalisation impliquées dans la régulation de la prolifération et de la survie cellulaire. Il n’existe pas d’étude concernant son impact sur l’hématopoïèse. Il est difficile en se basant sur la bibliographie actuelle, d’émettre une hypothèse quant à son implication dans le développement des leucémies ou dans l’initiation ou la promotion du processus de cancérogenèse.
Chlordane
Le chlordane peut affecter l’hématopoïèse. Il n’induit pas d’aberrations nucléaires ni de micronoyaux dans la moelle osseuse de souris exposées à 1/8, 1/16 ou 1/32 de la LD50 (Schop et coll., 1990

), mais il perturbe la prolifération et la différenciation. La moelle osseuse de souris femelles nées de mères traitées avec des doses de 0 à 8 mg/kg/j de chlordane durant la gestation, présente chez les animaux âgés de 6 semaines, une diminution de la capacité de différenciation vers la lignée granulomonocytaire (Blyler et coll., 1994

). Cet effet est déjà visible chez le fœtus (Barnett et coll., 1990

). Le chlordane tout comme le lindane ou le DDT sont des composés associés à l’aplasie de la moelle osseuse (Mencoboni et coll., 1992

).
In vitro, le chlordane exerce un effet immunosuppresseur (Johnson et coll., 1986

et 1987

) et affecte les capacités tumorigènes des macrophages (Theus et coll., 1992

). Comme l’heptachlore, il diminue la capacité des cellules NK à lyser les cellules tumorales (Beach et coll., 2006

) et inhibe le chimiotactisme de cellules immunitaires (Miyagi et coll., 1998

). L’exposition de neutrophiles humains au chlordane (24 heures, de 0,1 à 50 µg/ml) induit un stress oxydant
via l’activation de la PKC ainsi que la phagocytose sans modifier les propriétés de chimiotactisme ou apoptotique des cellules. Il est classé par les auteurs parmi les composés pro-inflammatoires (Gauthier et coll., 2001

). L’effet pro-oxydant du chlordane est confirmé
in vivo par les études de Bagchi et coll. (1995

et 1996

) et Hassoun et coll. (1993

). Le chlordane ne présente pas de propriétés génotoxiques et apparaît agir par un mécanisme épigénétique (Whysner et coll., 1998

).
In vivo, le chlordane est un immunomodulateur. Il stimule le système immunitaire. Les dérivés tels que le nonachlore cis et trans apparaissent très immunotoxiques (Tryphonas et coll., 2003

). L’exposition cutanée au chlordane diminue chez la souris l’hypersensibilité aux allergènes (Blaylock et coll., 1995

) et une exposition
in utero augmente la résistance à l’infection au virus de l’influenza (Barnett et coll., 1995).
Contrairement à l’heptachlore, il n’y a pas de données sur l’effet du chlordane sur les voies de signalisation. Ce composé peut inhiber les «
gap junctions » dans différents modèles cellulaires (Rivedal et coll., 2001

). Il active la transcription du gène codant pour le récepteur à l’acide rétinoïque (RAR)
via les éléments de réponse RARE (présents dans les régions ADN régulatrices du gène) (Lemaire et coll., 2005

). Il faut noter que l’acide rétinoïque intervient
via RAR alpha dans la différenciation ostéoblastique et granulocytique.
En résumé, le chlordane non génotoxique, présente des propriétés d’immunosuppresseur et diminue la capacité des cellules NK à lyser les cellules tumorales in vitro. Le chlordane tout comme le lindane ou le DDT est un composé associé à l’aplasie de la moelle osseuse ce qui renforce la conviction d’un lien entre l’exposition à ce composé et l’apparition de certaines pathologies hématopoïétiques. Certains arguments mécanistiques sont cependant à approfondir comme l’activation de la synthèse du récepteur à l’acide rétinoïque
Toxaphène
Le toxaphène a été classé comme cancérogène chez l’animal (Reuber, 1979

) et mutagène (Hooper et coll., 1979

) mais ces données sont aujourd’hui controversées (Bartos et coll., 2005

). Le toxaphène serait un agent de faible activité mutagénique et génotoxique qui exercerait ses propriétés
via des mécanismes indirects par exemple en interférant avec les enzymes de réparation de l’ADN (Schrader et coll., 1998

). La dose journalière tolérable (DJT) est de 0,2 mg/kg/jour. Le toxaphène apparaît comme un agent immunosuppresseur chez la souris et le singe (Allen et coll., 1983

; Tryphonas et coll., 2000

). Chez les singes, l’ingestion de 1 mg/kg/jour pendant un an induit divers troubles incluant une inflammation ainsi qu’une augmentation de l’activité hépatique microsomiale (Bryce et coll., 2001

), mais ne semble pas affecter l’hématopoïèse. Le toxaphène, bien que l’un des moins puissants des organochlorés, inhibe
in vitro les propriétés chimio-attractantes des interleukines vis-à-vis des leucocytes (monocyte et neutrophile de singe) (Miyagi et coll., 1998

). Selon Lavastre et coll. (2002

), le toxaphène est un puissant stimulateur des neutrophiles et induit dans ces cellules une production accrue de DRO secondaire à l’activation de la protéine kinase C ou de certaines tyrosine kinases. Le toxaphène induit l’apoptose des neutrophiles
via l’induction d’un stress oxydant. Des concentrations de toxaphène de 0,1 à 50 µg/ml n’induisent pas la nécrose des neutrophiles humains incubés 24 heures
in vitro (Gauthier et coll., 2001

).
En résumé, les propriétés génotoxiques et mutagènes du toxaphène sont controversées. Ce composé semble affecter le système immunitaire en activant les neutrophiles et la production d’un stress oxydant par ces cellules. Il n’existe pas de données dans la littérature sur un impact du toxaphène sur les voies de signalisation liée à la croissance et la survie cellulaire. L’absence de données complètes sur le mécanisme d’action du toxaphène ne nous permet pas de comprendre comment l’exposition à ce composé pourrait être liée à l’apparition de cancers hématopoïétiques. Cependant, son effet immunosuppresseur pourrait être à l’origine des évènements qui conduisent au développement des lymphomes.
Dieldrine
Aucune étude à notre connaissance n’a été réalisée dans un modèle hématopoïétique. Les propriétés de la dieldrine sur le statut oxydoréducteur, la signalisation et les voies apoptotiques ont été essentiellement décrites dans les cellules neuronales. Ces données servent de support pour démontrer les propriétés pro-oxydantes, les effets sur la signalisation et l’apoptose.
La toxicité de cet organochloré vis-à-vis des cellules neuronales est liée à son effet antagoniste sur les récepteurs GABA-A (Briz et coll., 2011

). La neurotoxicité de la dieldrine serait également liée à sa capacité à induire un stress oxydant (Kannan et coll., 2000

; Chun et coll., 2001

; Kitazawa et coll., 2001

). Le pré-traitement avec un anti-oxydant inhibe en général la neurotoxicité
in vitro de ce composé (Cho et coll., 2008

; Park et coll., 2008

; Sharma et coll., 2010

). La dieldrine à une dose de 10 µM inhibe la communication cellulaire
via les jonctions serrées en agissant sur l’activation des voies ERK1/2 dans les cellules astrogliales de rat (Sidorova et Matesic, 2008

).
La dieldrine induit des dommages à l’ADN liés à sa capacité pro-oxydante (Cicchetti et Argentin, 2003

) dans les cultures primaires de fibroblastes de poumon de souris. En revanche, en utilisant d’autres tests de génotoxicité sur la drosophile, Osaba et coll. (1999

) n’ont pas trouvé d’effet génotoxique lié à l’exposition à la dieldrine.
La dieldrine stimule les processus apoptotiques dans les modèles neuronaux à la fois
in vitro et
in vivo (Kitazawa et coll., 2001

et 2003

; Kanthasamy et coll., 2003

, 2005 et 2008

). Ces processus impliquent à la fois des voies de signalisation (activation de kinases : PKC, Fyn) (Saminathan et coll., 2011

) ou des processus nucléaires (modification de la chromatine notamment hyperacétylation) (Song et coll., 2010

). Toutefois, la dieldrine peut produire un effet opposé dans d’autres modèles cellulaires : par exemple, dans des cellules tumorales mammaires, la dieldrine à 10 µM augmente la résistance des cellules à l’apoptose (anoikis
2
Les cellules épithéliales dépendent, pour réprimer leur autodestruction, de molécules exprimées à la surface de leurs cellules voisines et de la matrice extracellulaire auxquelles elles adhèrent, et qui les activent en engageant leurs intégrines de surface. Tout détachement de leur point d’ancrage provoque un phénomène d’apoptose, nommé anoïkis, un terme grec qui signifie « sans domicile » (m/s 2005, n° 2, p. 119).
)
via une augmentation de l’expression de la tyrosine kinase B (Cameron et Foster, 2008

). Ces différences pourraient être liées à l’expression ou à la fonctionnalité de certaines voies de transduction en fonction du modèle cellulaire utilisé. Martyniuk et coll. (2010

) observent la multiplicité des voies de signalisation qui sont touchées dans l’hypothalamus de poisson après une exposition à la dieldrine (2,5 mg/kg dans l’alimentation) et relient les voies affectées à différentes pathologies. L’exposition à la dieldrine dans certains modèles cellulaires conduit également à une altération de l’activité du protéasome résultant en une accumulation de protéines dégradées (Sun et coll., 2005

). Les produits des gènes régulés par la dieldrine sont localisés dans de nombreux compartiments cellulaires.
La dieldrine affecte l’expression et l’activité de certaines voies de signalisation. La dieldrine active la voie AKT et ERK2 dans les cellules neuronales primaires, effet lié à son interaction avec les récepteurs aux œstrogènes (beta ou alpha selon les modèles cellulaires testés) (Briz et coll., 2011

).
La dieldrine est un perturbateur endocrinien. De faibles concentrations de dieldrine (<1 nM) induisent
in vitro une dégranulation dans les mastocytes (humain et murins) de façon biphasique (courbe en U)
in vitro. L’impact de la dieldrine sur la dégranulation est dépendant en partie des récepteurs alpha aux œstrogènes (Tarraf et coll., 2003

). La combinaison de faibles doses d’œstrogène endogènes et environnementales conduit à un effet additif sur la dégranulation des mastocytes (Narita et coll., 2007

). Par ailleurs, de faibles doses de dieldrine (1 nM et 1 pM) dans les explants de testicules de fœtus humain conduisent à une diminution de la sécrétion de testostérone ainsi que des dérégulations pouvant affecter le développement des organes reproducteurs et la fertilité (Fowler et coll., 2007

).
La dieldrine apparaît comme un composé immuno-modulateur et l’exposition à ce composé pourrait être à l’origine de troubles immunitaires de type allergie ou asthme. Des études menées par Pelletier et coll. (2001

) montrent que la dieldrine est un composant pro-inflammatoire (production IL-8, production d’anions superoxydes dans les neutrophiles humains).
En résumé, la dieldrine est un composé pro-oxydant et pro-inflammatoire qui peut affecter le système immunitaire. La dieldrine perturbe aussi plusieurs voies de signalisation (AKT, ERK2) dont certaines impliquées dans l’apoptose. Ces propriétés peuvent être à l’origine d’évènements pouvant conduire au développement de cancers hématopoïétiques bien qu’il n’existe aucune étude concernant l’impact de ce composé sur l’hématopoïèse.
DDT
Le DDT (dichlorodiphenyltrichloroéthane) possède des propriétés génotoxiques dans les lymphocytes humains traités pendant 48 heures avec 25 µg/l (Garaj-Vrhovac et coll., 2008

) et dans un modèle de mollusques aquatiques traités avec de très faibles doses 0,1 à 10 µg/ml (Binelli et coll., 2008

). De même, l’exposition d’animaux pendant 5 mois (8 heures par jour et 6 jours par semaine) à une dose de 7 mg/m
3 dans l’air ambiant entraîne une génotoxicité dans les lymphocytes et les cellules mammaires (Canales-Aguirre et coll., 2011

). Dans les lymphocytes humains de donneurs différents (Ennaceur et coll., 2008

), le DDE métabolite du DDT induit des dommages à l’ADN à des concentrations élevées (80 mM). La génotoxicité du DDT a été mise en évidence par la présence de micronoyaux dans les fibroblastes de Béluga (10 à 15 µg/ml), mais celle-ci disparaît lorsque le pesticide est ajouté, en présence de la fraction métabolique S9
3
La fraction intracellulaire S9 (surnageant d’homogénat de foie, 9 000g) constitue un système d’essai utile pour l’étude du métabolisme des substances faisant appel à la fois aux enzymes microsomales et cytosoliques.
(Gauthier et coll., 1999

). En revanche, Wu et coll. n’ont pas observé d’augmentation de la fréquence de micronoyaux dans les lignées cellulaires HepG2 exposées pendant 24 heures au DDT entre 18 et 60 mM (Wu et coll., 2003

).
Le DDT est un xéno-œstrogène, il active, à de faibles concentrations, les récepteurs aux œstrogènes dans des modèles de lignées cellulaires (Hela-ER) et chez le poisson-zèbre (Lemaire et coll., 2006

; Cosnefroy et coll., 2012

). Outre les récepteurs aux œstrogènes, le DDT a d’autres cibles intracellulaires comme la protéine kinase p38, le TNFa, le TGF b, les caspases, ou le proto-oncogène erb2 (Buchmann et coll., 1999

; Tessier et Matsumura, 2001

; Frigo et coll., 2005

). D’autres voies de signalisation peuvent être impliquées dans le mécanisme d’action du DDT. Ainsi, de faibles doses de DTT (0,01, 0,1 et 1 µM) stimulent la prolifération des lignées de cellules cancéreuses mammaires (Han et coll., 2010

) en lien avec une augmentation de l’expression de l’aromatase, enzyme chargée de la transformation de certains précurseurs androgéniques (diandrostènedione, testostérone) en œstrogène dans les tissus mammaires. Cet effet sur l’aromatase serait induit par une production augmentée de prostaglandines, consécutive à une activation transcriptionnelle du gène
cox2. Ces effets sont associés à la voie de signalisation dépendante de l’AMP cyclique et protéine kinase A, et des enzymes de type PI3K, p38 et AKT, enzymes clés dans la régulation de la prolifération et de la survie cellulaire. Les éléments de réponse à l’AMP cyclique et l’AP-1 sont impliqués dans l’impact du DDT sur les macrophages murins (Han et coll., 2008

)
via l’activation de la protéine P38 (Bratton et coll., 2009

). La modulation de l’activité de la protéine kinase A par le DDT a été confirmée sur les cellules placentaires (10 µM, Magnarelli et coll., 2009

).
L’exposition d’animaux pré-pubertaires au DDE (20 à 100 mg/kg), principal métabolite du DDT, entraîne un stress oxydant ainsi qu’une activation de l’apoptose dans les testicules par la voie de signalisation fas/FasL (Shi et coll., 2009

et 2010

). Des études menées dans les populations d’enfants au sud de Mexico (Perez-Maldonado et coll., 2006, 2011

) montrent une corrélation entre les taux élevés de DDT (et DDE) et l’induction de l’apoptose dans les cellules sanguines mononuclées périphériques. Une relation est également observée avec les dommages à l’ADN. Dans les cultures primaires de cellules de Sertoli, le DDE (de 30 à 70 µM) induit un stress oxydant qui conduit à une activation de la protéine kinase p38 et des voies de l’apoptose (Song et coll., 2011

). Harada et coll. (2003

) montrent qu’une exposition au DDT (50 à 500 ppm pendant 4 semaines) chez le rat entraîne un stress oxydant qui pourrait être un élément clé de l’hépatocarcinogenèse.
Le DDT exerce des propriétés immunotoxiques chez la souris et augmente la susceptibilité aux pathogènes intracellulaires comme
Mycobacterium leprae (Nunez et coll., 2002

). Le DDT à faibles doses (2,5 µg/ml) inhibe
in vitro l’activité des macrophages J774A.1 (production de NO
., O
2., TNFa et iNO synthase) et induit une cytotoxicité (Nunez et coll., 2002

). Le DDT module certains composants du système immunitaire, comme la production d’IL-2, jouant un rôle important dans la réponse immunitaire adaptative (Ndebele et coll., 2004

). Dans une population professionnellement exposée, les taux sériques de DDT ou de son métabolite le DDE sont corrélés avec une diminution du taux sérique de cytokines de type IL-2 et l’augmentation de cytokines de type IL-4 (Daniel et coll., 2002

). Le DDT peut affecter la réponse des lymphocytes T et des cellules NK.
In vitro, le DDT, comme d’autres organochlorés, diminue, à faible dose (10 µM), la capacité des cellules NK humaines à lyser les cellules tumorales, en diminuant les taux de cytokines qui modulent leur activité cytotoxique (Beach et Whalen, 2006

). Dans une étude de population (Schaalan et coll., 2012

), les auteurs montrent que les taux d’organochlorés (dont le DDT) dans le lait maternel sont associés à une augmentation de l’incidence de saignements chez l’enfant ainsi qu’à une diminution de la sécrétion de cytokines de type TNFa et IL-10, soulignant une immunotoxicité des organochlorés présents dans le lait maternel. L’effet immunosuppresseur du DDT pourrait être lié à la fois à son effet sur la structure du macrophage (condensation de l’hétérochromatine, perte des pseudopodes, vacuolisation du cytoplasme) et sur ses fonctions (production de TNFa, d’oxyde nitrique) (Kim et coll., 2004

; Dutta et coll., 2008

). De plus, la présence de DDT dans le sérum humain entraîne une surproduction de certains composants du complément (C3b, C3d et C3a) et une diminution de son activité lytique (Dutta et coll., 2008

). Dans les monocytes humains, le DDE à faibles concentrations (10 µg/ml) induit une réponse pro-inflammatoire ; à plus fortes doses (80 µg/ml), le statut inflammatoire s’accompagne d’une activation des voies extrinsèques et intrinsèques de l’apoptose (Alegria-Torres, 2009

).
Chez les souris transgéniques exprimant constitutivement le CYP3A4, l’exposition par voie orale au DDT à faibles doses (1 mg/kg) entraîne une augmentation de l’expression de ce gène
via l’activation de PXR (Medina-Diaz et coll., 2007

). De plus fortes doses de DDT conduisent à un effet opposé. Il est connu que ce composé induit la production de cytokines pro-inflammatoires (Kim et coll., 2004

) dans les macrophages (effet hormétique : effet inverse observé entre faibles et fortes doses). La production de cytokines, induite après exposition au DDT, pourrait alors diminuer l’expression de PXR et conduire à une moindre activation des cytochromes P450 (Medina-Diaz et coll., 2007

). L’interaction du DDT avec les cytochromes impliqués dans la détoxication de nombreux médicaments peut ainsi interférer avec leur efficacité. Cet effet hormétique a été observé pour le DDT dans l’hépatocarcinogenèse (activé par les faibles doses et inhibé par les fortes doses) (Shutoh et coll., 2010). L’exposition de rats à de très faibles doses de DDT (0,06 mg/kg/j) pendant 4 semaines conduit à de faibles taux de stress oxydant dans l’hypothalamus, associés à une méthylation de l’ADN incomplète et à une régulation transcriptionnelle négative de certains gènes (Shutoh et coll., 2010).
En résumé, le DDT et son métabolite, le DDE, sont génotoxiques. L’effet génotoxique est retrouvé dans plusieurs modèles cellulaires et en particulier dans les lymphocytes humains. Le DDE peut également avoir un effet génotoxique de manière indirecte en provoquant un stress oxydant. Le DDT, xéno-œstrogène, perturbe différentes voies de signalisation et augmente l’expression de l’aromatase. Comme d’autres organochlorés, le DDT, en modifiant les taux de cytokines (IL-2, IL-4), altère in vitro la capacité des cellules NK humaines à lyser les cellules tumorales.
Phénoxy herbicides (2,4-D, MCPA, dicamba)
Une étude réalisée par Linnainmaa (1984

) montre que le 2,4-D (acide 2,4-dichlorophénoxyacétique) et le MCPA (acide 4-chloro-2-méthylphénoxyacétique) n’induisent pas de dommages à l’ADN dans les lymphocytes périphériques chez l’animal après administration par voie intra-gastrique (100 mg/kg pendant deux semaines) ou
in vitro dans les cellules CHO (exposition une heure à 10 µM). Une administration orale chez l’animal de 2,4-D à une dose élevée (LD16) exerce un effet immuno-suppresseur (Imel’baeva et coll., 2000

). Le dicamba (acide 3,6-dichloro-2-méthoxybenzoique) et son produit commercial aux doses de 200 µg/ml (environ 1M) induisent une génotoxicité dans les lymphocytes humains en culture (Filkowski et coll., 2003

).
Le phénoxyherbicide 2,4,5-T (acide 2,4,5-trichlorophénoxyacétique) et son métabolite 2,4,5-TCP (à 100 ppm) entraînent
in vitro un stress oxydant dans les érythrocytes humains mis en évidence par une diminution de l’activité des enzymes impliquées dans la régulation du stress oxydant (superoxyde dismutase – SOD – et catalase) et une diminution des taux d’ATP (Bukowska, 2004

).
Chez des souris, l’exposition par gavage au MCPA à 40 ppm pendant 18 mois suivie par un retour à une alimentation contrôle pendant 12 mois conduit à l’apparition de leucémies et à la présence d’infiltrations néoplasiques dans le foie (Takagi, 1990

). Il existe très peu d’études concernant l’impact des phénoxyherbicides au niveau cellulaire et moléculaire.
En résumé, il est impossible d’apporter des arguments en faveur ou non d’une relation de causalité entre l’exposition aux phénoxy herbicides et l’apparition de pathologies hématopoïétiques.
Hydrocarbures halogénés (DBCP)
En 1989, certains auteurs (Teramoto et Shirasu, 1989

) montrent que le DBCP (1,2-dibromo-3-chloropropane), un nématocide, induit des aberrations chromosomiques dans les cellules de la moelle osseuse, des mutations dominantes létales chez les rats
germ-free. En revanche, cet effet ne serait pas reproductible chez la souris (Generoso et coll., 1985

). Le DBCP (5 mg/kg) induit des cassures simples brins d’ADN dans le foie et les reins des rats traités, 20 min et 4 h après une injection intra-péritonéale (Brunborg et coll., 1996

). Une dose de 10 mg entraîne l’apparition de dommages à l’ADN dans tous les organes excepté la moelle osseuse et le colon. Des doses plus importantes (40 mg/kg) induisent des cassures simples brins dans la moelle osseuse et le colon (Brunborg et coll., 1996

). Les dommages à l’ADN ont été observés dans les hépatocytes isolés de rat à de faibles concentrations (5 à 10 µM) (Soderlund et coll., 1991

). Chez le rat, le DBCP (4 doses de 87 mg/kg) pendant 4 jours induit l’apoptose dans les cellules de Sertoli, ce qui conduit à une perte de leur capacité de différenciation (Meistrich et coll., 2003

). L’effet pro-apoptotique du DBCP a été montré sur d’autres types cellulaires (HL-60, LLCPK1) à des doses élevées allant de 30 à 300 µM (Wiger et coll., 1998

). Le DBCP apparaît clairement comme un agent tumorigène dans différentes espèces quelle que soit la voie d’exposition (Clark et Snedeker, 2005

). Son effet mutagène est montré dans différentes études (Ryu et coll., 2002

; Clark et Snedeker, 2005

).
En résumé, aucune étude concernant son impact sur l’hématopoïèse ou sur des voies de signalisation impliquées dans la régulation de la croissance et la différenciation des cellules hématopoïétiques n’est disponible. Aucune étude n’a été décrite concernant le potentiel immunotoxique du DBCP.
Organophosphorés
La propriété la plus connue des organophosphorés (OP) est leur toxicité cholinergique (Costa, 2006

). Les OP inhibent l’acétylcholine estérase, enzyme qui hydrolyse l’acétylcholine, neurotransmetteur majoritaire du système nerveux central et périphérique. L’inhibition de cette enzyme entraîne une accumulation d’acétylcholine dans les synapses, ce qui a des conséquences graves sur la transmission synaptique.
Chlorpyrifos, malathion, parathion, paraoxon, diazinon
Les OP, et notamment le chlorpyrifos pour lequel il existe une littérature abondante, sont capables d’affecter le système immunitaire
via d’autres cibles cellulaires et moléculaires. Une large documentation est disponible sur les propriétés immunotoxiques de ces composés (Gallichio et coll., 1987

; Parent-Massin et coll., 1993

; Nakadai et coll., 2006

). Les personnes exposées au chlorpyrifos à la maison ou au travail présentent des changements de plusieurs paramètres immunologiques (Thrasher et coll., 2002

). La capacité des organophosphorés à perturber l’immunité résulterait d’effets sur des cibles cellulaires précises régulant le processus d’immunité au niveau de :
• la production d’interleukine ;
• la prolifération des lymphocytes T ;
• la modification des profils de sécrétion des cytokines ;
• l’inhibition de l’activité cytolytique des cellules NK via l’induction de l’apoptose.
Les OP (chlorpyrifos, malathion et parathion) sont capables de modifier l’hématopoïèse myéloïde ou de perturber la différenciation de cellules hématopoïétiques en culture après exposition expérimentale de l’animal par gavage (Li et coll., 2007

et 2009

). Les composés organophosphorés sont des composés pro-oxydants capables d’induire
in vivo une augmentation de la peroxydation lipidique, d’induire la production d’espèces radicalaires, de perturber le fonctionnement mitochondrial, de diminuer l’activité des enzymes impliquées dans la régulation du stress oxydant (Saulsbury et coll., 2009

; Ambali et coll., 2010

; Gupta et coll., 2010

; Mansour et Mossa, 2010

; Slotkin et Seidler, 2010

; Cole et coll., 2011

; Saxena et coll., 2011

). Certains auteurs ont observé des effets différents sur le statut oxydo-réducteur selon la dose (Mandal et Das, 2011

). Ainsi, chez le rat albinos exposé à des doses de 5 à 10 mg/kg, le taux de péroxydation lipidique est élevé et l’activité des enzymes anti-oxydantes est réduite ; le contraire est observé à plus forte dose (20 à 30 mg/kg). Des effets sur des cibles spécifiques contrôlant l’entrée de cystéine dans la cellule
via le transporteur cystine/glutamate ont été rapportés (Slotkin et coll., 2010

). Le chlorpyrifos est un agent pro-apoptotique, effet référencé dans diverses études
in vitro et
in vivo, en raison de son pouvoir pro-oxydant. L’activation de caspases (caspase 3) par le chlorpyrifos est controversée (Li et coll., 2007

et 2009

; Das et coll., 2008

; Saulsbury et coll., 2008

). Ce composé active les voies de type MAP kinase (ERK, p38 JNK) ce qui conduirait à l’induction de l’apoptose. Il régule l’expression de certains facteurs de transcription (SP1, AP-1) (Crumpton et coll., 2000

) et la voie de signalisation liée à l’AMP cyclique (adénylate cyclase, PDE et PKA) (Adigun et coll., 2010

). Des modulations de l’expression de cfos et de p53 dans certaines zones du cerveau après exposition expérimentale des animaux au chlorpyrifos ont aussi été observées (Dam et coll., 2003

).
Le chlorpyrifos, le diazinon, le paraoxon et le parathion sont capables d’induire des dommages à l’ADN (Hreljac coll., 2008

; Hreljac et Filipic, 2009

; Ukpebor et coll., 2011

). Des effets génotoxiques (micronoyaux, coupures simples et doubles brins, échanges de chromatides) sont observés
in vivo (larve de xénope, poisson, souris) (Amer et Fahmy, 1982

; Shadnia et coll., 2005

; Ali et coll., 2008

et 2009

; Rahman et coll., 2009

) et
in vitro (lymphocytes de sang périphérique humain, lignée cellulaire NK, hépatocytes de souris) (Muscarella et coll., 1984

; Vindas et coll., 2004

; Das et coll., 2006

; Li et coll., 2007

; Cui et coll., 2011

; Khanna et coll., 2011

). La génotoxicité des OP pourrait être liée à leur propriété pro-oxydante (Shadnia et coll., 2005

). Chez l’homme, le polymorphisme du gène codant pour l’enzyme paraoxonase I (PON1) impliquée dans la détoxication des OP est en relation avec l’activité génotoxique de ces composés (Singh et coll., 2011

). Le polymorphisme génétique de PON1 peut intervenir dans la susceptibilité au stress oxydant associé aux organophosphorés (Huen et coll., 2010

).
Fonofos et terbufos
Aucune étude relative à l’impact de ces composés sur la moelle osseuse, l’hématopoïèse, la signalisation cellulaire et l’immunité (interleukine/cytokine) n’a été répertoriée. Une étude concerne l’impact du terbufos sur le statut oxydo-réducteur. Elle montre l’existence d’une interaction entre le polymorphisme de gènes impliqués dans la régulation du stress oxydant et l’utilisation de terbufos chez les patients atteints de cancer de la prostate (Koutros et coll., 2011

). Trois études rapportent une génotoxicité de ces deux composés (Gentile et coll., 1982

; Wu et coll., 2011

; Barry et coll., 2012

). Un effet pro-apoptotique du terbufos a été démontré dans les cellules HepG2 (Wu et coll., 2011

) et les blastocytes (Greenlee et coll., 2004

). Du point de vue mécanistique les données bibliographiques sont très insuffisantes pour apporter une quelconque conclusion sur le mécanisme d’action de ces composés.
Malathion
Des effets génotoxiques et clastogéniques ont été observés dans la moelle osseuse après administration de malathion chez la souris et le rat (Hoda et coll., 1991

; Amer et coll., 2002

; Moore et coll., 2011

; Giri et coll., 2011

) à des doses de 2,5 à 80 mg/kg de poids corporel
via des injections intra-péritonéales (Amer et coll., 1996

; Moore et coll., 2011

; Giri et coll., 2011

), l’alimentation (Amer et coll., 2002

), l’intubation (0,1 % de la dose commercialisée ; Hoda et coll., 1991

) ou une application cutanée (Salvadori et coll., 1988

) ; dans ce dernier cas les doses appliquées étaient très élevée 500 à 2 000 mg/kg. En revanche, une autre étude chez le rat ne montre pas de dommage à l’ADN dans les cellules de la moelle osseuse suite à l’exposition au malathion 8 ppm dans l’eau de boisson (Degraeve et coll., 1984

). Reus et coll. (2008

) montrent que l’administration intra-péritonéale de malathion à des doses 100 fois supérieures à la DJA (100 et 150 mg/kg) chez le rat, pendant 1 ou 28 jours entraîne des dommages à l’ADN dans le sang périphérique et l’hippocampe (Reus et coll., 2008

).
Des aberrations chromosomiques et des échanges de chromatides sœurs ont été observés
in vitro. L’exposition de lymphocytes humains à des doses de 10 à 70 µg/ml (soit 33 µM) induit des dommages à l’ADN (Walter et coll., 1980

). Des résultats identiques ont été observés dans les leucocytes périphériques humains traités pendant 24 et 48 heures avec des doses de 66 nM à 66 µM (Balaji et coll., 1993

). Cependant, certains auteurs n’observent qu’un faible potentiel du malathion à induire des dommages à l’ADN dans les lymphocytes humains exposés 1 heure à des concentrations de 25, 75, et 200 µM (Blasiak et coll., 1999

) ou à des concentrations de 5 à 100 µg/ml (Titenko-Holland et coll., 1997

). Le métabolite du malathion, le malaoxon semble plus efficace dans ce modèle (Blasiak et coll., 1999

). En revanche, celui-ci n’exerce aucune activité génotoxique dans les cellules humaines placentaires contrairement à la molécule mère (Galantai et coll., 2011

). En 1993, Flessel et coll. (1993

) rapportent que les tests de génotoxicité sont positifs lorsqu’on utilise le malathion de grade technique ou commercial ou son métabolite mais que le malathion pur n’exerce qu’un très faible effet génotoxique. L’exposition de cellules de moelle osseuse de hamster au malathion à des doses DL50/2 /5 ou /10 n’induit que de faibles effets clastogéniques (Dzwonkowska et coll., 1986

).
In vitro, l’exposition de cellules de moelle osseuse humaine au malaoxon entraîne une diminution de la capacité de différenciation des progéniteurs vers la lignée érythrocytaire et granulo-monocytaire (1 nM à 0,1 µM) (Gallicchio et coll., 1987

).
À des doses non cholinergiques, les organophosphorés sont immunotoxiques. Le malathion peut modifier les propriétés des macrophages après une administration orale (Rodgers et coll., 1996

) et altérer
in vitro leur production de nitrite, de TNFα et la peroxydation des lipides (Ayub et coll., 2003

). L’exposition d’animaux par voie orale au malathion peut faire varier la réponse humorale (Banerjee et coll., 1998

; Johnson et coll., 2002

), cependant l’exposition par voie cutanée chez la souris ne modifie pas l’immunité (Relford et coll., 1989

).
Le malathion apparaît comme un composé pro-oxydant.
In vitro par exemple, l’effet génotoxique du malathion ou de son métabolite est associé à une induction de stress oxydant dans les cellules PC12 ou HepG2 (Moore et coll., 2010

; Lu et coll., 2012

).
L’administration
in vivo de malathion est associée à une augmentation de la peroxydation lipidique hépatique, des dommages oxydatifs (lipides, protéines, ADN) et des signaux pro-inflammatoires (Mostafalou et coll., 2011

; Aboul-Soud et coll., 2011

). L’exposition de rat au malathion à une dose équivalente à la DL50 entraîne au bout de 60 jours des dommages à l’ADN associés à une augmentation de la production d’oxygène radicalaire dans différents tissus (Ojha et coll., 2011

).
In vivo (Aboul-Soud et coll., 2011

) et
in vitro, le malathion apparaît comme un agent pro-apoptotique dans les splénocytes murins (Battaglia et coll., 2010

), dans les cellules mononuclées de sang périphérique (Ahmed et coll., 2009

), dans les fibroblastes (Masoud et coll., 2003

) et dans les cellules d’hépatocarcinome HepG2 (Moore et coll., 2010

).
En résumé, les organophosphorés dont le chlorpyrifos, sont des composés que l’on peut considérer comme génotoxiques et pro-oxydants. Les effets sont liés à l’activation de certaines voies de signalisation impliquées dans la régulation de la prolifération et de la survie cellulaire. Les propriétés immunotoxiques pourraient être à l’origine des pathologies hématopoïétiques observées chez les professionnels exposés à ce composé.
Glyphosate
Le glyphosate (N-(phosphonométhyl) glycine) est un agent pro-oxydant. Une adminisration par voie intra-péritonéale à la dose de 50 mg/kg, induit chez la souris, une peroxydation des lipides dans le foie et les reins ainsi que des dommages à l’ADN (Cavusoglu et coll., 2011

). Son activité pro-oxydante n’est pas forcément corrélée avec une atteinte à l’ADN, la génotoxicité du glyphosate semble controversée (pour une revue voir Williams et coll., 2000

). Une injection unique par voie intra-péritonéale de doses comparables voire plus faibles (25 mg/kg), induit chez la souris des cassures chromosomiques et des micronoyaux dans la moelle osseuse ainsi qu’une certaine cytotoxicité (Prasad et coll., 2009

). Le glyphosate aux doses de 1 à 7 mM est cytotoxique pour les cellules humaines (GM38 et HT1080) (Monroy et coll., 2005

). Dans d’autres modèles cellulaires, le glyphosate ne montre pas d’effet génotoxique (Li et Long, 1988

; Rank et coll., 1993

; Dimitrov et coll., 2006

). Ces effets controversés peuvent être dus aux tests utilisés (Alvarez-Moya et coll., 2011

). De plus, la génotoxicité observée dans certaines études
in vitro ou
in vivo correspond à des doses assez élevées (3 à 7 mM, 580 mg/ml -3,5 mM- et 400 mg/kg
respectivement dans les cellules HepG2, dans les lymphocytes humains et chez la souris) (Mana et coll., 2009

; Mladinic et coll., 2009

).
La formulation des produits contenant le glyphosate aurait plus d’effet toxique que la molécule isolée (Williams et coll., 2000

; Dimitrov et coll., 2006

; Heydens et coll., 2008

; Gasnier et coll., 2009

). Des effets génotoxiques de différentes formulations sont rapportés à des concentrations de formulation correspondant à des doses résiduelles de 120 nM de glyphosate seul. Le Round up, une des formulations la plus testée, exerce des effets génotoxiques dans les globules rouges de caïman après exposition de l’œuf (50 à 1 750 µg ou 10 µM/œuf) (Poletta et coll., 2009

). L’addition de Round up dans les cellules d’hépatome de rats à des doses allant de 1 à 10 mM induit des perturbations mitochondriales (membrane et activité de la chaîne respiratoire) et nucléaires suggérant une diminution de l’activité transcriptionnelle (Malatesta et coll., 2008

). Dans le même modèle cellulaire (Calvacante et coll., 2008

), le métabolite du glyphosate, l’acide aminoéthylphosphonique aurait un potentiel génotoxique dans la lignée cellulaire HepG2 exposées à 2,5 - 7,5 mM, pendant 4 heures ou dans les lymphocytes de souris après exposition
in vivo 48 heures aux doses de 200- 400 mg/kg.
Une étude conduite sur des lignées cellulaires HepG2 et MDA-MB-453-kb2 (issues de cancers du sein) montre que différentes formulations de glyphosate conduisent à des effets cytotoxiques, génotoxiques et perturbateurs endocriniens, même à faibles doses (Gasnier et coll., 2009

).
Les effets du glyphosate sur le système immunitaire ont été moins étudiés que celles du chlorpyrifos. Chez le poisson, ils apparaissent moins importants que ceux du chlorpyrifos (El-Gendy et coll., 1998

) Des effets immunosuppresseurs sont observés dans les cultures primaires de lymphocytes humains uniquement aux doses de 1 mM (Nakashima et coll., 2002

).
Le glyphosate ajouté à des concentrations de 1 à 10 mM entraîne un retard du cycle cellulaire au niveau de l’entrée en phase M, retard lié à une diminution globale de la synthèse protéique et un retard dans l’activation de la kinase dépendante des cyclines B (CDK1) (Marc et coll., 2002

).
En résumé, le glyphosate présente une activité pro-oxydante qui n’est pas forcément corrélée avec une atteinte à l’ADN. Le glyphosate induit chez la souris, des cassures chromosomiques et des micronoyaux dans la moelle osseuse ainsi qu’une certaine cytotoxicité. Cependant, la génotoxicité n’est pas retrouvée dans tous les systèmes cellulaires. Le métabolite du glyphosate, l’acide aminoéthylphosphonique aurait un potentiel génotoxique dans les lymphocytes de souris exposées in vivo.
Triazines (atrazine, simazine)
La plupart des études concernant la famille des triazines ont été réalisées sur l’atrazine et la simazine. La génotoxicité de l’atrazine est controversée (Gebel et coll., 1997

; Kligerman et coll., 2000

). En revanche, de nombreuses études démontrent un impact des triazines sur l’immunité et la myélopoïèse. L’exposition expérimentale des animaux à l’atrazine ou la simazine modifierait la réponse humorale et cellulaire, exercerait un effet immunosuppresseur, diminuerait les capacités cytotoxiques des cellules
Natural killer (NK), pourrait perturber la prolifération et la distribution des lymphocytes et la production de cytokines et diminuer la capacité de résistance de l’hôte au développement de mélanome dans le test de contaminations avec des cellules de mélanome B16F10 (Fournier et coll., 1992

; Rooney et coll., 2003

; Filipov et coll., 2005

; Karrow et coll., 2005

; Brodkin et coll., 2007

). Chez le poisson, l’administration d’atrazine au cours du développement embryonnaire (0,1 à 12,5 µg/l) pendant 3 jours conduit à une perturbation du système immunitaire avec une augmentation du recrutement des phagocytes et un impact sur l’expression de l’interleukine IL-1b (Jin et coll., 2010a

).
In vitro, l’atrazine diminue l’activité proliférative des blastes de souris en culture (0,05 µM à 5 µM) (Bocher et coll., 1993

). L’atrazine à 10 µM diminue les capacités cytotoxiques des cellules NK sur les cellules tumorales (Whalen et coll., 2003

). À 30 µM, elle perturbe la libération des granules lytiques dans les lignées cellulaires NK (Rowe et coll., 2007

). De même, la simazine affecte l’activité tumoricide et anti-virale des macrophages murins en diminuant la production d’oxyde nitrique et de TNFa (Kim et coll., 2002

). La simazine (mais non l’atrazine) perturbe l’activation de NFkB induite par le LPS (lipopolysaccharides) dans des lignées transfectées avec un gène reporter stable NFkB (Igarashi et coll., 2006

). Même à de faibles doses (1 µM) l’atrazine peut exercer un effet immunotoxique en inhibant la maturation de cellules dendritiques (Pinchuk et coll., 2007

),
via l’élimination des molécules du complexe majeur d’histocompatibilité (MHC I) de la surface de ces cellules, augmentant ainsi la vulnérabilité du système immunitaire. Dans les cellules nucléées normales humaines, l’atrazine (0,03 ; 0,3 et 3 µM) ou la simazine (0,01 ; 0,1 et 1 µM) perturbent la production de cytokines (Hooghe et coll., 2000

; Pruett et coll., 2006

).
L’atrazine apparaît comme un composé hématotoxique
in vitro à de faibles doses (<10 ppm) (Magnelli et coll., 1989

).
In vivo, l’administration de 59 mg/kg d’atrazine (par voie intra-péritonéale) entraîne une perturbation de l’hématopoïèse centrale après 10 jours de traitement (Mencoboni et coll., 1992

). Des effets comparables sont observés avec la phénylhydrazine hydrochloride à 50 mg/kg pendant 9 jours (Elorza et coll., 2008

). Chez le rat exposé à l’atrazine, il a été rapporté des activités hématotoxiques (Abarikwu et coll., 2010

). Les triazines semblent modifier l’activité ou l’expression de certaines protéines clés des voies de signalisation cellulaire impliquées dans le contrôle de la prolifération et de la survie cellulaire (AKT, PI-3 K, ERK, bcl2). Lim (2009

) montre que l’atrazine à de très faibles doses (100 ng/ml) induit 24 heures après l’exposition de cellules de muscle lisse, une diminution de la phosphorylation d’AKT, une protéine clé de la régulation de la prolifération souvent activée dans les cellules tumorales. Dans les cellules ovariennes humaines, l’atrazine (1 µM) active la voie dépendante de l’ERK (Albanito et coll., 2008

).
De nombreuses études réalisées
in vivo rapportent un effet pro-oxydant de l’atrazine et de la phénylhydrazine hydrochloride. Ces effets pro-oxydants sont observés dans le foie (lipoperoxydation) (Nwani et coll., 2010

; Singh et coll., 2010

) et dans les érythrocytes (Bhatti et coll., 2011

). Les effets pro-oxydants de l’atrazine sont modulables avec une exposition concomitante de sélénium (Adesiyan et coll., 2011

). Le stress oxydant lié à l’administration d’atrazine pendant les 3 premiers jours du développement embryonnaire chez le poisson zèbre serait à l’origine de la perturbation du système immunitaire inné ou non spécifique (Jin et coll., 2010a

). Lasserre et coll. (2009

) montrent que le traitement des cellules MCF7 pendant 24 heures avec 100 µg/l (0,5 µM) d’atrazine entraîne une diminution de l’expression de certaines protéines y compris les enzymes régulant le statut oxydo-réducteur.
L’atrazine n’apparaît pas comme un composé pro-apoptotique. Elle diminue la prolifération de fibroblastes en culture sans activer les voies de signalisation liées à la mort cellulaire programmée (Manske et coll., 2004

). Des dommages à l’ADN dans les cellules en culture exposées à l’atrazine ont été rapportés (Pino et coll., 1988

; Ribas et coll., 1995

; Taets et coll., 1998

, Manske et coll., 2004

).
En résumé, l’atrazine induit un stress oxydant associé à une peroxydation lipidique, ainsi qu’une perturbation de certaines enzymes des voies de régulation de la survie et de la prolifération cellulaire. De plus l’exposition à l’atrazine entraîne des modifications au niveau du système immunitaire ainsi qu’une toxicité au niveau de la moelle osseuse associée à une moindre différenciation myéloïde. Ces perturbations pourraient être à l’origine des étapes conduisant au développement des lymphomes. Par conséquent, les études mécanistiques concernant l’atrazine, apportent des arguments en faveur d’une plausibilité de la relation de causalité entre l’exposition à l’atrazine et l’apparition de certains troubles hématopoïétiques.
Pyréthrinoïdes (perméthrine)
Les pyréthrinoïdes sont des insecticides non persistants largement utilisés en agriculture ainsi qu’à l’intérieur des habitations. Ils apparaissent comme des composés immunosuppresseurs. L’exposition à la perméthrine pourrait être associée à des effets immunosuppresseurs en relation avec les phénomènes d’allergie (Prater et coll., 2003

et 2005

). L’application quotidienne d’une solution allant de 0,5 à 5 µM (environ 100 mg/jour/kg poids corporel) pendant 10 à 30 jours sur la région dorsale de souris immuno-sensibles (souche C57BL6/N) conduit à une baisse de la réponse des macrophages spléniques et de la production d’anticorps (Punareewattana et coll., 2001

). L’exposition de rats mâles Wistar pendant 28 jours à la cyperméthrine ou à la perméthrine (à des doses allant de 11 à 120 mg/kg de poids corporel) entraîne respectivement des modifications de certains paramètres sanguins (volume globulaire moyen des globules rouges, hématocrites, taux de globules blancs), une diminution de l’hypersensibilité retardée ou une augmentation d’aberrations chromosomiques dans la moelle osseuse (Institoris et coll., 1999

).
Une étude récente montre une corrélation entre les concentrations de chlordane et perméthrine, présents en mélange dans le sang de cordon et le taux de certaines cytokines (Neta et coll., 2011

). L’exposition à la perméthrine est notamment associée avec de faibles taux d’expression de la cytokine anti-inflammatoire IL-10 impliquée dans le mécanisme immunitaire de l’allergie.
La voie d’exposition semble être un facteur important dans la toxicité des pyréthrinoides. Dans l’étude de Tyrkiel et coll. (2001

), les rats ont été exposés à différentes doses de fenvalérate ou de perméthrine (à des doses dépassant 400 fois la dose journalière admissible). Les résultats montrent que la perméthrine peut induire, sans signe apparent de cytotoxicité, des dommages à l’ADN dans les cellules sexuelles quelle que soit la voie d’exposition (intra-péritonéale ou per os) et affecte l’ADN des cellules de la moelle osseuse uniquement lors d’une exposition orale. En revanche, l’exposition au fenvalérate n’induit pas de génotoxicité, mais ce composé apparaît cytotoxique sur les cellules sexuelles et de la moelle osseuse aux doses testées, quelle que soit la voie d’exposition. Les propriétés génotoxiques des pyréthrinoïdes ont été démontrées
in vitro à des doses élevées (200 à 1 000 µM) sur les cellules de sang périphérique humain pour la perméthrine (Undeger et Basaran, 2005

; Turkez et Togar, 2011

) et la cyperméthrine (Undeger et Basaran, 2005

) ainsi que sur les cellules de la muqueuse nasale.
In vivo, l’exposition dermique à la perméthrine à 1,3 mg/kg pendant 72 heures n’entraîne pas de dommages à l’ADN estimés par la mesure des bases oxydées (8-Oxo-2’-deoxyguanosine, 8-oxo-dg) dans les urines (Abu-Qare et Abou-Donia, 2000

).
In vitro, les doses de 100 µM de perméthrine entraînent un stress oxydant, mesuré par la production d’espèces radicalaires de l’oxygène et par l’activité des enzymes régulant le statut oxydoréducteur des cellules (Olgun et Misra, 2006

; Nasuti et coll., 2008).
In vivo, l’exposition aux pyréthrinoïdes 150 mg/kg (soit 1/10
e de LD50) entraîne une variation du statut oxydoréducteur des cellules sanguines liée à une modification de fluidité membranaire. L’exposition des animaux pendant 60 jours à une dose correspondant au dixième de la DL50 entraîne des dommages à l’ADN dans le striatum. Ces effets sont associés à une inhibition du complexe mitochondrial I due à une baisse de la fluidité membranaire (Falcioni et coll., 2010

).
Les pyréthrinoïdes peuvent affecter certaines voies de signalisation cellulaire. Aux doses de 25 à 100 µM, ils activent les cytochromes P450 (CYP2B1, 3A1) dans les hépatocytes de rat en culture primaire (Heder et coll., 2001

). Dans des cellules cancéreuses prostatiques, la perméthrine entraîne l’activation des MAP kinases et de l’activité tyrosine kinase de ERB2 (Tessier et Matsumura, 2001

). Les pyréthrinoïdes inhibent la transduction de signaux dans les lymphocytes humains (STAT 6) (Diel et coll., 2003

).
La perméthrine exerce des effets œstrogéniques et anti-androgéniques (antagoniste des récepteurs aux androgènes) à faible dose 0,1 µM (Sun et coll., 2007

; Xu et coll., 2008

; Zhang et coll., 2008

; Jin et coll., 2010b

) ce qui peut avoir des conséquences sur l’hématopoïèse dont le fonctionnement dépend des activités œstrogéniques environnantes.
La perméthrine peut induire l’apoptose. Prater et coll. (2002

) montrent par exemple qu’une seule dose de perméthrine (220 à 1 100 mg/kg) pendant 8 heures inhibe la prolifération des lymphocytes T spléniques et l’apoptose dans les thymocytes.
En résumé, beaucoup d’études sont relatives aux propriétés de la perméthrine. Ce pesticide est un perturbateur endocrinien qui à forte dose induit un stress oxydant, des dommages à l’ADN ainsi qu’une perturbation de l’hématopoïèse et du système immunitaire. La perméthrine affecte également certaines voies de signalisation (STAT6, ERB2, MAP kinase). Les propriétés de la perméthrine sont autant d’arguments en faveur de la plausibilité d’une relation entre l’exposition chronique à ce composé et l’apparition de pathologies hématopoïétiques.
Chloroacétamides (alachlore)
L’alachlore est un herbicide de la famille des chloroacétamides. Sa génotoxicité a été démontrée
in vivo et
in vitro dans plusieurs études. L’exposition de souris à l’alachlore dans l’eau de boisson entraîne des dommages cytogénétiques, des aberrations chromosomiques et un index mitotique élevé dans les cellules de la moelle osseuse (Meisner et coll., 1992

). Dans les cellules humaines lymphoblastoïdes en culture, l’alachlore (40 µg/ml) induit la formation de micronoyaux, d’aberration chromosomiques et des échanges de chromatides sœurs (Ribas et coll., 1995

, 1996

et 1997

; Mattiuzzo et coll., 2006

). Cependant, d’autres études ne rapportent pas d’effet génototoxique pour ce composé (Pinter et coll., 1989

; Gebel et coll., 1997

; Wetmore et coll., 1999

; Heydens et coll., 2000

).
L’alachlore pourrait perturber le système immunitaire en inhibant l’activation du promoteur de l’IFN β, la production d’oxyde nitrique et en activant NFκB dans les macrophages (Hong et coll., 2004

; Shimomura-shimizu et coll., 2005

; Ohnishi et coll., 2008

).
L’alachlore affecte certaines voies de signalisation cellulaires impliquées dans le contrôle de la survie et de la prolifération cellulaire (voie Wnt β-caténine, Bid 3, bcl2, MAP kinase) (Genter et coll., 2002

) et est aussi un activateur des PXR (Lemaire et coll., 2006

).
L’exposition à l’alachlore est associée à une perturbation du statut oxydo-réducteur (déplétion en GSH, modification de l’expression de GST, induction des protéines HSP
Heat Shock Protein, peroxydation lipidique) (Bagchi et coll., 1996

; Burman et coll., 2003

; Grizard et coll., 2007

; Li et coll., 2009

).
En résumé, la perturbation de certaines voies de signalisation et, notamment de la voie Wnt β-caténine et des voies anti-apoptotiques apportent des arguments en faveur d’un rôle de l’alachlore dans la dérégulation de l’hématopoïèse. Cependant, aucune étude n’a été réalisée sur la myélopoïèse. La modification de la réponse immunitaire après exposition à ce composé, conforte son rôle dans la régulation des étapes à l’origine de certaines pathologies hématopoïétiques. Mais ces hypothèses mécanistiques restent à confirmer.
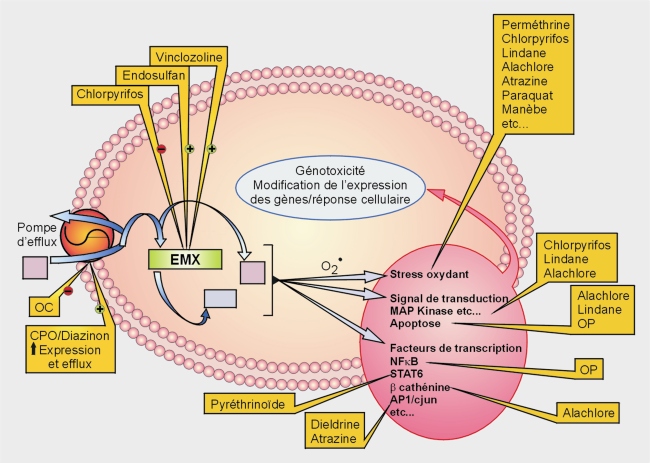
En conclusion, plusieurs travaux épidémiologiques (rapportés dans la partie des données épidémiologiques) suggèrent une association entre exposition à certains pesticides et les pathologies hématopoïétiques en particulier leucémies et lymphomes. Afin d’apporter des arguments scientifiques sur la plausibilité d’une telle relation, l’impact des pesticides au niveau cellulaire et moléculaire a été analysé dans les modèles d’étude in vivo ou in vitro en focalisant l’intérêt sur les voies de signalisation impliquées dans la survie et la prolifération cellulaire de façon générale mais aussi sur les principales voies de signalisation de la régulation de l’hématopoïèse (normale et pathologique) et de l’immunité, sur l’expression et/ou l’activité des facteurs impliqués (cytokines facteurs de croissance, facteurs de transcription…), à travers des propriétés génotoxiques du pesticide lui-même ou de son métabolite ou encore sur les capacités pro-oxydantes des composés.
Les pesticides, pour la plupart, peuvent interagir à différents niveaux cellulaires et moléculaires sur des voies de signalisation variées (figure 22.1

). Ce sont des composés généralement pro-oxydants. Mais la dérégulation du statut oxydant ne peut pas justifier la spécificité de leur impact sur des pathologies précises ou sur des voies de signalisation particulières.
Plusieurs pesticides (chlorpyrifos…) présentent un effet génotoxique clairement établi dans plusieurs systèmes cellulaires. D’autres (DDT, heptachlore, toxaphène, glyphosate) ne sont génotoxiques que dans certains modèles cellulaires. C’est parfois le métabolite qui est génotoxique. Ainsi, le métabolite du glyphosate aurait un potentiel génotoxique dans les lymphocytes de souris exposées in vivo. Les conséquences sur la survenue d’une pathologie de ces perturbations ne sont cependant pas clairement établies. La génotoxicité des pesticides n’est pas toujours à l’origine de leurs effets perturbateurs sur la physiologie ou la biologie cellulaire.
La plupart des pesticides examinés dans ce chapitre exercent des effets immunotoxiques ou immunoperturbateurs, sauf les phénoxyherbicides, les hydrocarbures halogénés et le glyphosate pour lesquels il existe peu de données à ce sujet. Les pesticides tels que le lindane, le chlordane, le DDT, certains organophosphorés, certaines triazines et la perméthrine affectent à la fois l’immunité et l’hématopoïèse, propriétés qui leur confèrent un rôle potentiel dans l’étiologie de pathologies hématopoïétiques.
Cependant, des études complémentaires utilisant spécifiquement des modèles hématopoïétiques semblent indispensables pour approfondir les mécanismes d’action et confirmer ces hypothèses.
Bibliographie
[1] ABARIKWU SO, ADEDARA IA, FAROMBI EO. Influence of quercetin on haematological indices and biomarkers of oxidative stress in the serum of rats exposed to atrazine.
Afr J Med Med Sci. 2010;
39:81
-88

[2] ABOUL-SOUD MA, AL-OTHMAN AM, EL-DESOKY GE, AL-OTHMAN ZA, YUSUF K, et coll. Hepatoprotective effects of vitamin E/selenium against malathion-induced injuries on the antioxidant status and apoptosis-related gene expression in rats.
J Toxicol Sci. 2011;
36:285
-296

[3] ABU-QARE A, ABOU-DONIA M. Increased 8-hydroxy-2’-deoxyguanosine, a biomarker of oxidative DNA damage in rat urine following a single dermal dose of DEET (N, N-diethyl-m-toluamide), and permethrin, alone and in combination.
Toxicol Lett. 2000;
117:151
-160

[4] ADESIYAN AC, OYEJOLA TO, ABARIKWU SO, OYEYEMI MO, FAROMBI EO. Selenium provides protection to the liver but not the reproductive organs in an atrazine-model of experimental toxicity.
Exp Toxicol Pathol. 2011;
63:201
-207

[5] ADIGUN AA, SEIDLER FJ, SLOTKIN TA. Disparate developmental neurotoxicants converge on the cyclic AMP signaling cascade, revealed by transcriptional profiles in vitro and in vivo.
Brain Res. 2010;
1316:1
-16

[6] AHMED RS, SUKE SG, SETH V, CHAKRABORTI A, TRIPATHI AK, et coll. Protective effects of dietary ginger (Zingiber officinales Rosc.) on lindane-induced oxidative stress in rats.
Phytother Res. 2008;
22:902
-906

[7] AHMED T, TRIPATHI AK, SUKE SG, KUMAR V, AHMED RS, et coll. Role of HSP27 and reduced glutathione in modulating malathion-induced apoptosis of human peripheral blood mononuclear cells : ameliorating effect of N-acetylcysteine and curcumin.
Toxicology in vitro : an international journal published in association with BIBRA. 2009;
23:1319
-1325

[8] ALBANITO L, LAPPANO R, MADEO A, CHIMENTO A, PROSSNITZ ER, et coll. G-protein-coupled receptor 30 and estrogen receptor-alpha are involved in the proliferative effects induced by atrazine in ovarian cancer cells.
Environ Health Perspect. 2008;
116:1648
-1655

[9] ALEGRIA-TORRES JA, DIAZ-BARRIGA F, GANDOLFI AJ, PEREZ-MALDONADO IN. Mechanisms of p,p’-DDE-induced apoptosis in human peripheral blood mononuclear cells.
Toxicol In Vitro. 2009;
23:1000
-1006

[10] ALI D, NAGPURE NS, KUMAR S, KUMAR R, KUSHWAHA B, et coll. Assessment of genotoxic and mutagenic effects of chlorpyrifos in freshwater fish Channa punctatus (Bloch) using micronucleus assay and alkaline single-cell gel electrophoresis.
Food Chem Toxicol. 2009;
47:650
-656

[11] ALI D, NAGPURE NS, KUMAR S, KUMAR R, KUSHWAHA B. Genotoxicity assessment of acute exposure of chlorpyrifos to freshwater fish Channa punctatus (Bloch) using micronucleus assay and alkaline single-cell gel electrophoresis.
Chemosphere. 2008;
71:1823
-1831

[12] ALLEN AL, KOLLER LD, POLLOCK GA, . Effect of toxaphene exposure on immune responses in mice.
J Toxicol Environ Health. 1983;
11:61
-69

[13] ALVAREZ-MOYA C, SILVA MR, ARAMBULA AR, SANDOVAL AI, VASQUEZ HC, et coll. Evaluation of genetic damage induced by glyphosate isopropylamine salt using Tradescantia bioassays.
Genet Mol Biol. 2011;
34:127
-130

[14] AMBALI SF, IDRIS SB, ONUKAK C, SHITTU M,, AYO JO. Ameliorative effects of vitamin C on short-term sensorimotor and cognitive changes induced by acute chlorpyrifos exposure in Wistar rats.
Toxicol Ind Health. 2010;
26:547
-558

[15] AMER SM, FAHMY MA, DONYA SM. Cytogenetic effect of some insecticides in mouse spleen.
J Appl Toxicol. 1996;
16:1
-3

[16] AMER SM, FAHMY MA, ALY FA, FARGHALY AA. Cytogenetic studies on the effect of feeding mice with stored wheat grains treated with malathion.
Mutat Res. 2002;
513:1
-10

[17] AMER SM, FAHMY MA. Cytogenetic effects of pesticides. I. Induction of micronuclei in mouse bone marrow by the insecticide Dursba.
Mutat Res. 1982;
101:247
-255

[18] ARINOBU Y, MIZUNO S, CHONG Y, SHIGEMATSU H, IINO T, et coll. Reciprocal activation of GATA-1 and PU.1 marks initial specification of hematopoietic stem cells into myeloerythroid and myelolymphoid lineages.
Cell Stem Cell. 2007;
1:416
-427

[19] AYUB S, VERMA J, DAS N. Effect of endosulfan and malathion on lipid peroxidation, nitrite and TNF-alpha release by rat peritoneal macrophages.
Int Immunopharmacol. 2003;
3:1819
-1828

[20] BAGCHI D, BAGCHI M, HASSOUN EA, STOHS SJ. In vitro and in vivo generation of reactive oxygen species, DNA damage and lactate dehydrogenase leakage by selected pesticides.
Toxicology. 1995;
104:129
-140

[21] BAGCHI D, BHATTACHARYA G, STOHS SJ. In vitro and in vivo induction of heat shock (stress) protein (Hsp) gene expression by selected pesticides.
Toxicology. 1996;
112:57
-68

[22] BALAJI M, SASIKALA K. Cytogenetic effect of malathion in in vitro culture of human peripheral blood.
Mutat Res. 1993;
301:13
-17

[23] BANERJEE BD, PASHA ST, HUSSAIN QZ, KONER BC, RAY A. A comparative evaluation of immunotoxicity of malathion after subchronic exposure in experimental animals.
Indian J Exp Biol. 1998;
36:273
-282

[24] BARNETT JB, BLAYLOCK BL, GANDY J, MENNA JH, DENTON R, et coll. Alteration of fetal liver colony formation by prenatal chlordane exposure.
Fundam Appl Toxicol. 1990;
15:820
-822

[25] BARNETT JB, BLAYLOCK BL, GANDY J, MENNA JH, DENTON R, et coll. Long-term alteration of adult bone marrow colony formation by prenatal chlordane exposure.
Fundam Appl Toxicol. 1990;
14:688
-695

[26] BARRY KH, KOUTROS S, ANDREOTTI G, SANDLER DP, BURDETTE LA, et coll. Genetic variation in nucleotide excision repair pathway genes, pesticide exposure and prostate cancer risk.
Carcinogenesis. 2012;
33:331
-337

[27] BARTOS T, SKAREK M, CUPR P, KOSUBOVA P, HOLOUBEK I. Genotoxic activity of a technical toxaphene mixture and its photodegradation products in SOS genotoxicity tests.
Mutat Res. 2005;
565:113
-120

[28] BATTAGLIA CL, GOGAL RM, JR, ZIMMERMAN K, MISRA HP. Malathion, lindane, and piperonyl butoxide, individually or in combined mixtures, induce immunotoxicity via apoptosis in murine splenocytes in vitro.
Int J Toxicol. 2010;
29:209
-220

[29] BAYOUMI AE, PEREZ-PERTEJO Y, ORDONEZ C, REGUERA RM, BALANA-FOUCE R, et coll. Changes in the glutathione-redox balance induced by the pesticides heptachlor, chlordane, and toxaphene in CHO-K1 cells.
Bull Environ Contam Toxicol. 2000;
65:748
-755

[30] BEACH TM, WHALEN MM. Effects of organochlorine pesticides on interleukin secretion from lymphocytes.
Hum Exp Toxicol. 2006;
25:651
-659

[31] BHATTI JS, SIDHU IP, BHATTI GK. Ameliorative action of melatonin on oxidative damage induced by atrazine toxicity in rat erythrocytes.
Mol Cell Biochem. 2011;
353(1-2):139
-149

[32] BINELLI A, RIVA C, COGNI D, PROVINI A. Genotoxic effects of p,p’-DDT (1,1,1-trichloro-2,2-bis-(chlorophenyl)ethane) and its metabolites in Zebra mussel (D. polymorpha) by SCGE assay and micronucleus test.
Environ Mol Mutagen. 2008;
49:406
-415

[33] BLASIAK J, JALOSZYNSKI P, TRZECIAK A, SZYFTER K. In vitro studies on the genotoxicity of the organophosphorus insecticide malathion and its two analogues.
Mutat Res. 1999;
445:275
-283

[34] BLAYLOCK BL, NEWSOM KK, HOLLADAY SD, SHIPP BK, BARTOW TA, et coll. Topical exposure to chlordane reduces the contact hypersensitivity response to oxazolone in BALB/c mice.
Toxicol Lett. 1995;
81:205
-211

[35] BLYLER G, LANDRETH KS, BARNETT JB. Gender-specific effects of prenatal chlordane exposure on myeloid cell development.
Fundam Appl Toxicol. 1994;
23:188
-193

[36] BOCHER M, BOLDICKE T, SASSE F. Cytotoxic effect of atrazine on murine B-lymphocytes in vitro.
Sci Total Environ. 1993;
132:429
-433

[37] BRATTON MR, FRIGO DE, VIGH-CONRAD KA, FAN D, WADSWORTH S, et coll. Organochlorine-mediated potentiation of the general coactivator p300 through p38 mitogen-activated protein kinase.
Carcinogenesis. 2009;
30:106
-113

[38] BRIZ V, MOLINA-MOLINA JM, SANCHEZ-REDONDO S, FERNANDEZ MF, GRIMALT JO, et coll. Differential estrogenic effects of the persistent organochlorine pesticides dieldrin, endosulfan, and lindane in primary neuronal cultures.
Toxicol Sci. 2011;
120:413
-427

[39] BRODKIN MA, MADHOUN H, RAMESWARAN M, VATNICK I. Atrazine is an immune disruptor in adult northern leopard frogs (Rana pipiens).
Environ Toxicol Chem. 2007;
26:80
-84

[40] BRUNBORG G, SODERLUND EJ, HOLME JA, DYBING E. Organ-specific and transplacental DNA damage and its repair in rats treated with 1,2-dibromo-3-chloropropane.
Chem Biol Interact. 1996;
101:33
-48

[41] BRYCE F, IVERSON F, ANDREWS P, BARKER M, CHERRY W, et coll. Effects elicited by toxaphene in the cynomolgus monkey (Macaca fascicularis): a pilot study.
Food Chem Toxicol. 2001;
39:1243
-1251

[42] BUCHMANN A, WILLY C, BUENEMANN CL, STROH C, SCHMIECHEN A, et coll. Inhibition of transforming growth factor beta1-induced hepatoma cell apoptosis by liver tumor promoters: characterization of primary signaling events and effects on CPP32-like caspase activity.
Cell Death Differ. 1999;
6:190
-200

[43] BUKOWSKA B. 2,4,5-T and 2,4,5-TCP induce oxidative damage in human erythrocytes: the role of glutathione.
Cell Biol Int. 2004;
28:557
-563

[44] BURMAN DM, SHERTZER HG, SENFT AP, DALTON TP, GENTER MB. Antioxidant perturbations in the olfactory mucosa of alachlor-treated rats.
Biochem Pharmacol. 2003;
66:1707
-1715

[45] BUROW ME, TANG Y, COLLINS-BUROW BM, KRAJEWSKI S, REED JC, et coll. Effects of environmental estrogens on tumor necrosis factor alpha-mediated apoptosis in MCF-7 cells.
Carcinogenesis. 1999;
20:2057
-2061

[46] CAMERON HL, FOSTER WG. Dieldrin promotes resistance to anoikis in breast cancer cells in vitro.
Reprod Toxicol. 2008;
25:256
-262

[47] CANALES-AGUIRRE A, PADILLA-CAMBEROS E, GOMEZ-PINEDO U, SALADO-PONCE H, FERIA-VELASCO A, et coll. Genotoxic effect of chronic exposure to DDT on lymphocytes, oral mucosa and breast cells of female rats.
Int J Environ Res Public Health. 2011;
8:540
-553

[48] CASSIDY RA, NATARAJAN S,, VAUGHAN GM. The link between the insecticide heptachlor epoxide, estradiol, and breast cancer.
Breast Cancer Res Treat. 2005;
90:55
-64

[49] CAVALCANTE DG, MARTINEZ CB, SOFIA SH. Genotoxic effects of Roundup on the fish Prochilodus lineatus.
Mutat Res. 2008;
655:41
-46

[50] CAVUŞOĞLU K, YAPAR K, ORUÇ E, YALÇIN E. Protective effect of Ginkgo biloba L. leaf extract against glyphosate toxicity in Swiss albino mice.
J Med Food. 2011;
14:1263
-1272

[51] CHO HS, KIM S, LEE SY, PARK JA, KIM SJ, et coll. Protective effect of the green tea component, L-theanine on environmental toxins-induced neuronal cell death.
Neurotoxicology. 2008;
29:656
-662

[52] CHUANG LF, HINTON DE, CHEUNG AT, CHUANG RY. Induction of differentiation in human myeloblastic leukemia ML-1 cells by heptachlor, a chlorinated hydrocarbon insecticide.
Toxicol Appl Pharmacol. 1991;
109:98
-107

[53] CHUANG LF, LIU Y, KILLAM K, JR, CHUANG RY. Modulation by the insecticides heptachlor and chlordane of the cell-mediated immune proliferative responses of rhesus monkeys.
In Vivo. 1992;
6:29
-32

[54] CHUANG LF, CHUANG RY. Heptachlor and the mitogen-activated protein kinase module in human lymphocytes.
Toxicology. 1998;
128:17
-23

[55] CHUANG LF, ROUGHT SE, CHUANG RY. Differential regulation of the major cyclin-dependent kinases, cdk2 and cdc2, during cell cycle progression in human lymphocytes exposed to heptachlor.
In Vivo. 1999;
13:455
-461

[56] CHUN HS, GIBSON GE, DEGIORGIO LA, ZHANG H, KIDD VJ, et coll. Dopaminergic cell death induced by MPP(+), oxidant and specific neurotoxicants shares the common molecular mechanism.
J Neurochem. 2001;
76:1010
-1021

[57] CICCHETTI R, ARGENTIN G. The role of oxidative stress in the in vitro induction of micronuclei by pesticides in mouse lung fibroblasts.
Mutagenesis. 2003;
18:127
-132

[58] CIMINO-REALE G, FERRARIO D, CASATI B, BRUSTIO R, DIODOVICH C, et coll. Combined in utero and juvenile exposure of mice to arsenate and atrazine in drinking water modulates gene expression and clonogenicity of myeloid progenitors.
Toxicol Lett. 2008;
180:59
-66

[59] CLARK HA, SNEDEKER SM. Critical evaluation of the cancer risk of dibromochloropropane (DBCP).
J Environ Sci Health C Environ Carcinog Ecotoxicol Rev. 2005;
23:215
-260

[60] COLE TB, BEYER RP, BAMMLER TK, PARK SS, FARIN FM, et coll. Repeated developmental exposure of mice to chlorpyrifos oxon is associated with paraoxonase 1 (PON1)-modulated effects on cerebellar gene expression.
Toxicol Sci. 2011;
123(1):155
-169

[61] COLT JS, ROTHMAN N, SEVERSON RK, HARTGE P, CERHAN JR, et coll. Organochlorine exposure, immune gene variation, and risk of non-Hodgkin lymphoma.
Blood. 2009;
113:1899
-1905

[62] COSNEFROY A, BRION F, MAILLOT-MARECHAL E, PORCHER JM, PAKDEL F, et coll. Selective activation of zebrafish estrogen receptor subtypes by chemicals by using stable reporter gene assay developed in a zebrafish liver cell line.
Toxicol Sci. 2012;
125(2):439
-449

[63] COSTA LG, GIORDANO G, GUIZZETTI M, VITALONE A. Neurotoxicity of pesticides: a brief review.
Front Biosci. 2008;
13:1240
-1249

[64] COSTA LG. Current issues in organophosphate toxicology.
Clin Chim Acta. 2006;
366:1
-13

[65] CRUMPTON TL, SEIDLER FJ, SLOTKIN TA. Developmental neurotoxicity of chlorpyrifos in vivo and in vitro: effects on nuclear transcription factors involved in cell replication and differentiation.
Brain Res. 2000;
857:87
-98

[66] CUENCA X, XHAARD A, MOUNIER N. Facteurs pronostiques dans les lymphomes non hodgkiniens et les lymphomes de Hodgkin.
Bull Cancer. 2009;
96:461
-473

[67] CUESTA A, MESEGUER J, ANGELES EM. Effects of the organochlorines p,p’-DDE and lindane on gilthead seabream leucocyte immune parameters and gene expression. .
Fish Shellfish Immunol. 2008;
25:682
-688

[68] CUI Y, GUO J, XU B, CHEN Z. Genotoxicity of chlorpyrifos and cypermethrin to ICR mouse hepatocytes.
Toxicol Mech Methods. 2011;
21:70
-74

[69] DAM K, SEIDLER FJ, SLOTKIN TA. Transcriptional biomarkers distinguish between vulnerable periods for developmental neurotoxicity of chlorpyrifos: Implications for toxicogenomics.
Brain Res Bull. 2003;
59:261
-265

[70] DANIEL V, HUBER W, BAUER K, SUESAL C, CONRADT C, et coll. Associations of dichlorodiphenyltrichloroethane (DDT) 4.4 and dichlorodiphenyldichloroethylene (DDE) 4.4 blood levels with plasma IL-4.
Arch Environ Health. 2002;
57:541
-547

[71] DAS GP, SHAIK AP, JAMIL K. Estimation of apoptosis and necrosis caused by pesticides in vitro on human lymphocytes using DNA diffusion assay.
Drug Chem Toxicol. 2006;
29:147
-156

[72] DAS PC, CAO Y, ROSE RL, CHERRINGTON N, HODGSON E. Enzyme induction and cytotoxicity in human hepatocytes by chlorpyrifos and N,N-diethyl-m-toluamide (DEET).
Drug Metabol Drug Interact. 2008;
23:237
-260

[73] DE SANJOSE S, BOSCH R, SCHOUTEN T, VERKUIJLEN S, NIETERS A, et coll. Epstein-Barr virus infection and risk of lymphoma: immunoblot analysis of antibody responses against EBV-related proteins in a large series of lymphoma subjects and matched controls.
Int J Cancer. 2007;
121:1806
-1812

[74] DEGRAEVE N, CHOLLET MC, MOUTSCHEN J. Cytogenetic and genetic effects of subchronic treatments with organophosphorus insecticides.
Archives of toxicology. 1984;
56:66
-67

[75] DIEL F, HORR B, BORCK H, IRMAN-FLORJANC T. Pyrethroid insecticides influence the signal transduction in T helper lymphocytes from atopic and nonatopic subjects.
Inflamm Res. 2003;
52:154
-163

[76] DIMITROV BD, GADEVA PG, BENOVA DK, BINEVA MV. Comparative genotoxicity of the herbicides Roundup, Stomp and Reglone in plant and mammalian test systems.
Mutagenesis. 2006;
2:375
-382

[77] DUNIER M, VERGNET C, SIWICKI AK, VERLHAC V. Effect of lindane exposure on rainbow trout (Oncorhynchus mykiss) immunity. IV. Prevention of nonspecific and specific immunosuppression by dietary vitamin C (ascorbate-2-polyphosphate).
Ecotoxicol Environ Saf. 1995;
30:259
-268

[78] DUTTA R, MONDAL AM, ARORA V, NAG TC, DAS N. Immunomodulatory effect of DDT (bis[4-chlorophenyl]-1,1,1-trichloroethane) on complement system and macrophages.
Toxicology. 2008;
25:78
-85

[79] DZWONKOWSKA A, HUBNER H. Induction of chromosomal aberrations in the Syrian hamster by insecticides tested in vivo.
Archives of toxicology. 1986;
58:152
-156

[80] EL-GENDY KS, ALY NM, EL-SEBAE AH. Effects of edifenphos and glyphosate on the immune response and protein biosynthesis of bolti fish (Tilapia nilotica).
J Environ Sci Health B. 1998;
33:135
-149

[81] ELORZA A, HYDE B, MIKKOLA HK, COLLINS S, SHIRIHAI OS. UCP2 modulates cell proliferation through the MAPK/ERK pathway during erythropoiesis and has no effect on heme biosynthesis.
J Biol Chem. 2008;
283:30461
-30470

[82] ENNACEUR S, RIDHA D, MARCOS R. Genotoxicity of the organochlorine pesticides 1,1-dichloro-2,2- bis(p-chlorophenyl)ethylene (DDE) and hexachlorobenzene (HCB) in cultured human lymphocytes.
Chemosphere. 2008;
71:1335
-1339

[83] FALCIONI ML, NASUTI C, BERGAMINI C, FATO R, LENAZ G, et coll. The primary role of glutathione against nuclear DNA damage of striatum induced by permethrin in rats.
Neuroscience. 2010;
168:2
-10

[84] FILIPOV NM, PINCHUK LM, BOYD BL, CRITTENDEN PL. Immunotoxic effects of short-term atrazine exposure in young male C57BL/6 mice.
Toxicol Sci. 2005;
86:324
-332

[85] FILKOWSKI J, BESPLUG J, BURKE P, KOVALCHUK I, KOVALCHUK O. Genotoxicity of 2,4-D and dicamba revealed by transgenic Arabidopsis thaliana plants harboring recombination and point mutation markers.
Mutat Res. 2003;
542:23
-32

[86] FLESSEL P, QUINTANA PJ, HOOPER K. Genetic toxicity of malathion : a review.
Environ Mol Mutagen. 1993;
22:7
-17

[87] FOURNIER M, FRIBORG J, GIRARD D, MANSOUR S, KRZYSTYNIAK K. Limited immunotoxic potential of technical formulation of the herbicide atrazine (AAtrex) in mice.
Toxicol Lett. 1992;
60:263
-274

[88] FOWLER PA, ABRAMOVICH DR, HAITES NE, CASH P, GROOME NP, et coll. Human fetal testis Leydig cell disruption by exposure to the pesticide dieldrin at low concentrations.
Hum Reprod. 2007;
22:2919
-2927

[89] FRIGO DE, VIGH KA, STRUCKHOFF AP, ELLIOTT S, BECKMAN BS, et coll. Xenobiotic-induced TNF-alpha expression and apoptosis through the p38 MAPK signaling pathway.
Toxicol Lett. 2005;
155:227
-238

[90] GABBIANELLI R, NASUTI C, FALCIONI G, CANTALAMESSA F. Lymphocyte DNA damage in rats exposed to pyrethroids: effect of supplementation with Vitamins E and C.
Toxicology. 2004;
203:17
-26

[91] GAGNAIRE B, GAY M, HUVET A, DANIEL JY, SAULNIER D, et coll. Combination of a pesticide exposure and a bacterial challenge: in vivo effects on immune response of Pacific oyster, Crassostrea gigas (Thunberg).
Aquat Toxicol. 2007;
84:92
-102

[92] GALANTAI R, EMODY-KISS B, SOMOSY Z, BOGNAR G, HORVATH G, et coll. Does malaoxon play a role in the geno- and cytotoxic effects of malathion on human choriocarcinoma cells.
Journal of environmental science and health Part B, Pesticides, food contaminants, and agricultural wastes. 2011;
46:773
-779

[93] GALLICCHIO VS, CASALE GP, WATTS T. Inhibition of human bone marrow-derived stem cell colony formation (CFU-E, BFU-E, and CFU-GM) following in vitro exposure to organophosphates.
Exp Hematol. 1987;
15:1099
-1102

[94] GARAJ-VRHOVAC V, GAJSKI G, RAVLIC S. Efficacy of HUMN criteria for scoring the micronucleus assay in human lymphocytes exposed to a low concentration of p,p’-DDT.
Braz J Med Biol Res. 2008;
4:473
-476

[95] GASNIER C, DUMONT C, BENACHOUR N, CLAIR E, CHAGNON MC, et coll. Glyphosate-based herbicides are toxic and endocrine disruptors in human cell lines.
Toxicology. 2009;
262:184
-191

[96] GAUTHIER JM, DUBEAU H, RASSART E. Induction of micronuclei in vitro by organochlorine compounds in beluga whale skin fibroblasts.
Mutat Res. 1999;
439:87
-95

[97] GAUTHIER M, ROBERGE CJ, PELLETIER M, TESSIER PA, GIRARD D. Activation of human neutrophils by technical toxaphene.
Clin Immunol. 2001;
98:46
-53

[98] GEBEL T, KEVEKORDES S, PAV K, EDENHARDER R, DUNKELBERG H. In vivo genotoxicity of selected herbicides in the mouse bone-marrow micronucleus test.
Arch Toxicol. 1997;
71:193
-197

[99] GENEROSO WM, CAIN KT, HUGHES LA. Tests for dominant-lethal effects of 1,2-dibromo-3-chloropropane (DBCP) in male and female mice.
Mutat Res. 1985;
156:103
-108

[100] GENTER MB, BURMAN DM, VIJAYAKUMAR S, EBERT CL, ARONOW BJ. Genomic analysis of alachlor-induced oncogenesis in rat olfactory mucosa.
Physiol Genomics. 2002;
12:35
-45

[101] GENTILE JM, GENTILE GJ, BULTMAN J, SECHRIEST R, WAGNER ED, et coll. An evaluation of the genotoxic properties of insecticides following plant and animal activation.
Mutat Res. 1982;
101:19
-29

[102] GHAFFARI S. Oxidative stress in the regulation of normal and neoplastic hematopoiesis.
Antioxid Redox Signal. 2008;
10:1923
-1940

[103] GIRI A, GIRI S, SHARMA GD. Malathion and fenvalerate induce micronuclei in mouse bone marrow cells.
Environ Mol Mutagen. 2011;
52:607
-613

[104] GREENLEE AR, ELLIS TM, BERG RL. Low-dose agrochemicals and lawn-care pesticides induce developmental toxicity in murine preimplantation embryos.
Environ Health Perspect. 2004;
112:703
-709

[105] GRIZARD G, OUCHCHANE L, RODDIER H, ARTONNE C, SION B, et coll. In vitro alachlor effects on reactive oxygen species generation, motility patterns and apoptosis markers in human spermatozoa.
Reprod Toxicol. 2007;
23:55
-62

[106] GRULICH AE, VAJDIC CM, KALDOR JM, HUGHES AM, KRICKER A, et coll. Birth order, atopy, and risk of non-Hodgkin lymphoma.
J Natl Cancer Inst. 2005;
97:587
-594

[107] GUPTA SC, MISHRA M, SHARMA A, DEEPAK BALAJI TG, KUMAR R, et coll. Chlorpyrifos induces apoptosis and DNA damage in Drosophila through generation of reactive oxygen species.
Ecotoxicol Environ Saf. 2010;
73:1415
-1423

[108] HAN EH, KIM HG, HWANG YP, CHOI JH, IM JH, et coll. The role of cyclooxygenase-2-dependent signaling via cyclic AMP response element activation on aromatase up-regulation by o,p’-DDT in human breast cancer cells.
Toxicol Lett. 2010;
198:331
-341

[109] HAN EH, KIM JY, KIM HK, HWANG YP, JEONG HG. o,p’-DDT induces cyclooxygenase-2 gene expression in murine macrophages: Role of AP-1 and CRE promoter elements and PI3-kinase/Akt/MAPK signaling pathways.
Toxicol Appl Pharmacol. 2008;
233:333
-342

[110] HANSEN ME, MATSUMURA F. Effects of heptachlor epoxide on components of various signal transduction pathways important in tumor promotion in mouse hepatoma cells. Determination of the most sensitive tumor promoter related effect induced by heptachlor epoxide.
Toxicology. 2001;
160:139
-153

[111] HANSEN ME, PESSAH IN, MATSUMURA F. Heptachlor epoxide induces a non-capacitative type of Ca2+ entry and immediate early gene expression in mouse hepatoma cells.
Toxicology. 2006;
220:218
-231

[112] HARADA T, YAMAGUCHI S, OHTSUKA R, TAKEDA M, FUJISAWA H, et coll. Mechanisms of promotion and progression of preneoplastic lesions in hepatocarcinogenesis by DDT in F344 rats.
Toxicol Pathol. 2003;
31:87
-98

[113] HARIGAE H. GATA transcription factors and hematological diseases.
Tohoku J Exp Med. 2006;
210:1
-9

[114] HASSOUN E, BAGCHI M, BAGCHI D, STOHS SJ. Comparative studies on lipid peroxidation and DNA-single strand breaks induced by lindane, DDT, chlordane and endrin in rats.
Comp Biochem Physiol C. 1993;
104:427
-431

[115] HATAKEYAMA M, ZOU E, MATSUMURA F. Comparison of the characteristic of estrogenic action patterns of beta-HCH and heregulin beta1 in MCF-7 human breast cancer cells.
J Biochem Mol Toxicol. 2002;
16:209
-219

[116] HEDER AF, HIRSCH-ERNST KI, BAUER D, KAHL GF, DESEL H. Induction of cytochrome P450 2B1 by pyrethroids in primary rat hepatocyte cultures.
Biochem Pharmacol. 2001;
62:71
-79

[117] HENSCHLER R, APPEL KE, HEYWORTH CM, GLATT H. Proliferation and differentiation of murine haemopoietic progenitor cells in stroma-free culture in the presence of metabolites of chlorinated pesticides.
Toxicol In Vitro. 2001;
15:31
-37

[118] HEYDENS WF, HEALY CE, HOTZ KJ, KIER LD, MARTENS MA, et coll. Genotoxic potential of glyphosate formulations: mode-of-action investigations.
J Agric Food Chem. 2008;
56:1517
-1523

[119] HEYDENS WF, WILSON AG, KRAUS LJ, HOPKINS WE, HOTZ KJ. Ethane sulfonate metabolite of alachlor: assessment of oncogenic potential based on metabolic and mechanistic considerations.
Toxicol Sci. 2000;
55:36
-43

[120] HODA MQ, SINHA SP. Protective role of ascorbic acid and vitamin B-complex against pesticide-induced clastogeny in bone marrow cells of mice.
Int J Vitam Nutr Res. 1991;
61:155
-158

[121] HOLE PS, DARLEY RL, TONKS A. Do reactive oxygen species play a role in myeloid leukemias.
Blood. 2011;
117:5816
-5826

[122] HONG CC, SHIMOMURA-SHIMIZU M, MUROI M, TANAMOTO K. Effect of endocrine disrupting chemicals on lipopolysaccharide-induced tumor necrosis factor-alpha and nitric oxide production by mouse macrophages.
Biol Pharm Bull. 2004;
27:1136
-1139

[123] HOOGHE RJ, DEVOS S, HOOGHE-PETERS EL. Effects of selected herbicides on cytokine production in vitro.
Life Sci. 2000;
66:2519
-2525

[124] HOOPER NK, AMES BN, SALEH MA, CASIDA JE. Toxaphene, a complex mixture of polychloroterpenes and a major insecticide, is mutagenic.
Science. 1979;
205:591
-593

[125] HRELJAC I, FILIPIC M. Organophosphorus pesticides enhance the genotoxicity of benzo(a)pyrene by modulating its metabolism.
Mutat Res. 2009;
671:84
-92

[126] HRELJAC I, ZAJC I, LAH T, FILIPIC M. Effects of model organophosphorous pesticides on DNA damage and proliferation of HepG2 cells.
Environ Mol Mutagen. 2008;
49:360
-367

[127] HU F, LI L, WANG C, ZHANG Q, ZHANG X, et coll. Enantioselective induction of oxidative stress by permethrin in rat adrenal pheochromocytoma (PC12) cells.
Environ Toxicol Chem. 2010;
29:683
-690

[128] HUEN K, HARLEY K, BRADMAN A, ESKENAZI B, HOLLAND N. Longitudinal changes in PON1 enzymatic activities in Mexican-American mothers and children with different genotypes and haplotypes.
Toxicol Appl Pharmacol. 2010;
244:181
-189

[129] IGARASHI A, OHTSU S, MUROI M, TANAMOTO K. Effects of possible endocrine disrupting chemicals on bacterial component-induced activation of NF-kappaB.
Biol Pharm Bull. 2006;
29:2120
-2122

[130] IMEL’BAEVA EA, TEPLOVA SN, KAMILOV FK. An evaluation of the effect of 2,4-dichlorophenoxyacetic acid derivatives on humoral and cellular immunities.
Zh Mikrobiol Epidemiol Immunobiol. 2000;
2:60
-63

[131] INSTITORIS L, UNDEGER U, SIROKI O, NEHEZ M, DESI I. Comparison of detection sensitivity of immuno- and genotoxicological effects of subacute cypermethrin and permethrin exposure in rats.
Toxicology. 1999;
137:47
-55

[132] IUCHI Y, KIBE N, TSUNODA S, SUZUKI S, MIKAMI T, et coll. Implication of oxidative stress as a cause of autoimmune hemolytic anemia in NZB mice.
Free Radic Biol Med. 2010;
48:935
-944

[133] JIN Y, CHEN R, LIU W, FU Z. Effect of endocrine disrupting chemicals on the transcription of genes related to the innate immune system in the early developmental stage of zebrafish (Danio rerio).
Fish Shellfish Immunol. 2010a;
28:854
-861

[134] JIN M, LI L, XU C, WEN Y, ZHAO M.J. Estrogenic activities of two synthetic pyrethroids and their metabolites.
Environ Sci. 2010b;
22:290
-296

[135] JOHNSON KW, HOLSAPPLE MP, MUNSON AE. An immunotoxicological evaluation of gamma-chlordane.
Fundam Appl Toxicol. 1986;
6:317
-326

[136] JOHNSON KW, KAMINSKI NE, MUNSON AE. Direct suppression of cultured spleen cell responses by chlordane and the basis for differential effects on in vivo and in vitro immunocompetence.
J Toxicol Environ Health. 1987;
22:497
-515

[137] JOHNSON VJ, ROSENBERG AM, LEE K, BLAKLEY BR. Increased T-lymphocyte dependent antibody production in female SJL/J mice following exposure to commercial grade malathion.
Toxicology. 2002;
170:119
-129

[138] JUNGE B, CARRION Y, BOSCO C, GALLEANO M, PUNTARULO S, et coll. Effects of iron overload and lindane intoxication in relation to oxidative stress, Kupffer cell function, and liver injury in the rat.
Toxicol Appl Pharmacol. 2001;
170:23
-28

[139] KANG JJ, CHEN IL, YEN-YANG HF. Mediation of gamma-hexachlorocyclohexane-induced DNA fragmentation in HL-60 cells through intracellular Ca2+ release pathway.
Food Chem Toxicol. 1998;
36:513
-520

[140] KANNAN K, KAJIWARA N, LE BOEUF BJ, TANABE S. Organochlorine pesticides and polychlorinated biphenyls in California sea lions.
Environ Pollut. 2004;
131:425
-434

[141] KANTHASAMY AG, KITAZAWA M, KANTHASAMY A, ANANTHARAM V. Role of proteolytic activation of protein kinase Cdelta in oxidative stress-induced apoptosis.
Antioxid Redox Signal. 2003;
5:609
-620

[142] KANTHASAMY AG, KITAZAWA M, YANG Y, ANANTHARAM V, KANTHASAMY A. Environmental neurotoxin dieldrin induces apoptosis via caspase-3-dependent proteolytic activation of protein kinase C delta (PKCdelta): Implications for neurodegeneration in Parkinson’s disease.
Mol Brain. 2008;
1:12

[143] KARROW NA, MCCAY JA, BROWN RD, MUSGROVE DL, GUO TL, et coll. Oral exposure to atrazine modulates cell-mediated immune function and decreases host resistance to the B16F10 tumor model in female B6C3F1 mice.
Toxicology. 2005;
209:15
-28

[144] KHANNA A, SHUKLA P, TABASSUM S. Role of Ocimum sanctum as a Genoprotective Agent on Chlorpyrifos-Induced Genotoxicity.
Toxicol Int. 2011;
18:9
-13

[145] KIM KR, SON EW, RHEE DK, PYO S. The immunomodulatory effects of the herbicide simazine on murine macrophage functions in vitro.
Toxicol In Vitro. 2002;
16:517
-523

[146] KIM JY, CHOI CY, LEE KJ, SHIN DW, JUNG KS, et coll. Induction of inducible nitric oxide synthase and proinflammatory cytokines expression by o,p’-DDT in macrophages.
Toxicol Lett. 2004;
147:261
-269

[147] KIM IS, PARK ES, LIM JY, KI CS, CHI HS. A novel mutation in the GATA1 gene associated with acute megakaryoblastic leukemia in a Korean Down syndrome patient.
J Korean Med Sci. 2008;
23:1105
-1108

[148] KITAZAWA M, ANANTHARAM V, KANTHASAMY AG. Dieldrin induces apoptosis by promoting caspase-3-dependent proteolytic cleavage of protein kinase Cdelta in dopaminergic cells: relevance to oxidative stress and dopaminergic degeneration.
Neuroscience. 2003;
119:945
-964

[149] KITAZAWA M, ANANTHARAM V, KANTHASAMY AG. Dieldrin-induced oxidative stress and neurochemical changes contribute to apoptopic cell death in dopaminergic cells.
Free Radic Biol Med. 2001;
31:1473
-1485

[150] KLIGERMAN AD, DOERR CL, TENNANT AH, PENG B. Cytogenetic studies of three triazine herbicides. II. In vivo micronucleus studies in mouse bone marrow.
Mutat Res. 2000;
471:107
-112

[151] KOUTROS S, ANDREOTTI G, BERNDT SI, HUGHES BK, LUBIN JH, et coll. Xenobiotic-metabolizing gene variants, pesticide use, and the risk of prostate cancer.
Pharmacogenet Genomics. 2011;
21:615
-623

[152] LA SALA G, FARINI D, DE FELICI M. Proapoptotic effects of lindane on mouse primordial germ cells.
Toxicological sciences : an official journal of the Society of Toxicology. 2009;
108:445
-451

[153] LAN Q, ZHENG T, ROTHMAN N, ZHANG Y, WANG SS, et coll. Cytokine polymorphisms in the Th1/Th2 pathway and susceptibility to non-Hodgkin lymphoma.
Blood. 2006;
107:4101
-4108

[154] LASSERRE JP, FACK F, REVETS D, PLANCHON S, RENAUT J, et coll. Effects of the endocrine disruptors atrazine and PCB 153 on the protein expression of MCF-7 human cells.
J Proteome Res. 2009;
8:5485
-5496

[155] LAVASTRE V, ROBERGE CJ, PELLETIER M, GAUTHIER M, GIRARD D. Toxaphene, but not beryllium, induces human neutrophil chemotaxis and apoptosis via reactive oxygen species (ROS): involvement of caspases and ROS in the degradation of cytoskeletal proteins.
Clin Immunol. 2002;
104:40
-48

[156] LEDIRAC N, ANTHERIEU S, D’UBY AD, CARON JC, RAHMANI R. Effects of organochlorine insecticides on MAP kinase pathways in human HaCaT keratinocytes : key role of reactive oxygen species.
Toxicol Sci . 2005;
86:444
-452

[157] LEMAIRE G, BALAGUER P, MAUVAIS P, MICHEL S, RAHMANI R. Activation of alpha- and beta-estrogen receptors by persistent pesticides in reporter cell lines lines.
Life Sciences. 2006;
79(12):1160
-1169

[158] LEMAIRE G, MNIF W, PASCUSSI JM, PILLON A, RABENOELINA F, et coll. Identification of new human pregnane X receptor ligands among pesticides using a stable reporter cell system.
Toxicol Sci. 2006;
91:501
-509

[159] LEMAIRE G, BALAGUER P, MICHEL S, RAHMANI R. Activation of retinoic acid receptor-dependent transcription by organochlorine pesticides.
Toxicol Appl Pharmacol. 2005;
202:38
-49

[160] LI AP, LONG TJ. An evaluation of the genotoxic potential of glyphosate.
Fundam Appl Toxicol. 1988;
10:537
-546

[161] LI Q, KOBAYASHI M, KAWADA T. Chlorpyrifos induces apoptosis in human T cells.
Toxicology. 2009;
255:53
-57

[162] LI Q, KOBAYASHI M, KAWADA T. Organophosphorus pesticides induce apoptosis in human NK cells.
Toxicology. 2007;
239:89
-95

[163] LI X, ZHANG X, ZHANG J, ZHANG X, STARKEY SR, et coll. Identification and characterization of eleven glutathione S-transferase genes from the aquatic midge Chironomus tentans (Diptera: Chironomidae).
Insect Biochem Mol Biol. 2009;
39:745
-754

[164] LIM S, AHN SY, SONG IC, CHUNG MH, JANG HC, et coll. Chronic exposure to the herbicide, atrazine, causes mitochondrial dysfunction and insulin resistance.
PLoS One. 2009;
4:e5186

[165] LINNAINMAA K. Induction of sister chromatid exchanges by the peroxisome proliferators 2,4-D, MCPA, and clofibrate in vivo and in vitro.
Carcinogenesis. 1984;
5:703
-707

[166] LU XT, MA Y, WANG C, ZHANG XF, JIN DA Q, HUANG CJ. Cytotoxicity and DNA damage of five organophosphorus pesticides mediated by oxidative stress in PC12 cells and protection by vitamin E.
J Environ Sci Health B. 2012;
47:445
-454

[167] MAGNARELLI G, SOUZA MS, DE D’ANGELO AM. Heptachlor and o-p’DDT effects on protein kinase activities associated with human placenta particulate fractions.
J Biochem Mol Toxicol. 2009;
23:185
-192

[168] MAGNELLI L, FIBBI G, CALDINI R, PUCCI M, DEL RM. Inhibition of spontaneous growth and induced differentiation of murine erythroleukaemia cells by paraquat and atrazine.
Food Chem Toxicol. 1989;
27:125
-128

[169] MALATESTA M, PERDONI F, SANTIN G, BATTISTELLI S, MULLER S, et coll. Hepatoma tissue culture (HTC) cells as a model for investigating the effects of low concentrations of herbicide on cell structure and function.
Toxicol In Vitro. 2008;
22:1853
-1860

[170] MANAS F, PERALTA L, RAVIOLO J, OVANDO HG, WEYERS A, et coll. Genotoxicity of glyphosate assessed by the comet assay and cytogenetic tests.
Environ Toxicol Pharmacol. 2009;
28:37
-41

[171] MANDAL TK, DAS NS. Correlation of testicular toxicity and oxidative stress induced by chlorpyrifos in rats.
Hum Exp Toxicol. 2011;
30:1529
-1539

[172] MANSKE MK, BELTZ LA, DHANWADA KR. Low-level atrazine exposure decreases cell proliferation in human fibroblasts.
Arch Environ Contam Toxicol. 2004;
46:438
-444

[173] MANSOUR SA, MOSSA AH. Adverse effects of lactational exposure to chlorpyrifos in suckling rats.
Hum Exp Toxicol. 2010;
29:77
-92

[174] MANSOUR SA, MOSSA AT. Adverse effects of exposure to low doses of chlorpyrifos in lactating rats.
Toxicol Ind Health. 2011;
27:213
-224

[175] MARC J, MULNER-LORILLON O, BOULBEN S, HUREAU D, DURAND G, et coll. Pesticide Roundup provokes cell division dysfunction at the level of CDK1/cyclin B activation.
Chem Res Toxicol. 2002;
15:326
-331

[176] MARTYNIUK CJ, KROLL KJ, DOPERALSKI NJ, BARBER DS, DENSLOW ND. Genomic and proteomic responses to environmentally relevant exposures to dieldrin: indicators of neurodegeneration.
Toxicol Sci. 2010;
117:190
-199

[177] MASOUD L, VIJAYASARATHY C, FERNANDEZ-CABEZUDO M, PETROIANU G, SALEH AM. Effect of malathion on apoptosis of murine L929 fibroblasts : a possible mechanism for toxicity in low dose exposure.
Toxicology. 2003;
185:89
-102

[178] MATTIOLI F, ROBBIANO L, ADAMO D, FEDERA R, MARTELLI A, et coll. Genotoxic effects of alpha-hexachlorocyclohexane in primary cultures of rodent and human hepatocytes.
Mutagenesis. 1996;
11:79
-83

[179] MATTIUZZO M, FIORE M, RICORDY R, DEGRASSI F. Aneuploidy-inducing capacity of two widely used pesticides.
Carcinogenesis. 2006;
27:2511
-2518

[180] MCGREGOR DB, BROWN A, CATTANACH P, EDWARDS I, MCBRIDE D, et coll. Responses of the L5178Y tk+/tk- mouse lymphoma cell forward mutation assay : III. 72 coded chemicals.
Environ Mol Mutagen. 1988;
12:85
-154

[181] MEDINA-DIAZ IM, ARTEAGA-ILLAN G, DE LEON MB, CISNEROS B, SIERRA-SANTOYO A, et coll. Pregnane X receptor-dependent induction of the CYP3A4 gene by o,p’-1,1,1,-trichloro-2,2-bis (p-chlorophenyl)ethane.
Drug Metab Dispos. 2007;
35:95
-102

[182] MEDIRATTA PK, TANWAR K, REETA KH, MATHUR R, BENERJEE BD, et coll. Attenuation of the effect of lindane on immune responses and oxidative stress by Ocimum sanctum seed oil (OSSO) in rats.
Indian J Physiol Pharmacol. 2008;
52:171
-177

[183] MEERA P, RAO PR, SHANKER R, TRIPATHI O. Immunomodulatory effects of gamma-HCH (Lindane) in mice.
Immunopharmacol Immunotoxicol. 1992;
14:261
-282

[184] MEISNER LF, BELLUCK DA, ROLOFF BD. Cytogenetic effects of alachlor and/or atrazine in vivo and in vitro.
Environ Mol Mutagen. 1992;
19:77
-82

[185] MEISTRICH ML, WILSON G, SHUTTLESWORTH GA, PORTER KL. Dibromochloropropane inhibits spermatogonial development in rats. Reprod Toxicol.
. 2003;
17:263
-271

[186] MENCOBONI M, LERZA R, BOGLIOLO G, FLEGO G, PANNACCIULLI I. Effect of atrazine on hemopoietic system.
In Vivo. 1992;
6:41
-44

[187] MIYAGI T, LAM KM, CHUANG LF, CHUANG RY. Suppression of chemokine-induced chemotaxis of monkey neutrophils and monocytes by chlorinated hydrocarbon insecticides.
In Vivo. 1998;
12:441
-446

[188] MLADINIC M, BEREND S, VRDOLJAK AL, KOPJAR N, RADIC B, et coll. Evaluation of genome damage and its relation to oxidative stress induced by glyphosate in human lymphocytes in vitro.
Environ Mol Mutagen. 2009;
50:800
-807

[189] MOGRABI B, CORCELLE E, DEFAMIE N, SAMSON M, NEBOUT M, et coll. Aberrant Connexin 43 endocytosis by the carcinogen lindane involves activation of the ERK/mitogen-activated protein kinase pathway.
Carcinogenesis. 2003;
24:1415
-1423

[190] MONROY CM, CORTES AC, SICARD DM, DE RESTREPO HG. [Cytotoxicity and genotoxicity of human cells exposed in vitro to glyphosate].
Biomedica. 2005;
25:335
-345

[191] MOORE PD, YEDJOU CG, TCHOUNWOU PB. Malathion-induced oxidative stress, cytotoxicity, and genotoxicity in human liver carcinoma (HepG2) cells.
Environ Toxicol. 2010;
25:221
-226

[192] MOORE PD, PATLOLLA AK, TCHOUNWOU PB. Cytogenetic evaluation of malathion-induced toxicity in Sprague-Dawley rats.
Mutat Res. 2011;
725:78
-82

[193] MOSTAFALOU S, EGHBAL MA, NILI-AHMADABADI A, BAEERI M, ABDOLLAHI M. Biochemical evidence on the potential role of organophosphates in hepatic glucose metabolism toward insulin resistance through inflammatory signaling and free radical pathways.
Toxicol Ind Health. 2012;
28:840
-851

[194] MUSCARELLA DE, KEOWN JF, BLOOM SE. Evaluation of the genotoxic and embryotoxic potential of chlorpyrifos and its metabolites in vivo and in vitro.
Environ Mutagen. 1984;
6:13
-23

[195] NAKADAI A, LI Q, KAWADA T. Chlorpyrifos induces apoptosis in human monocyte cell line U937.
Toxicology. 2006;
224:202
-209

[196] NAKASHIMA K, YOSHIMURA T, MORI H, KAWAGUCHI M, ADACHI S, et coll. [Effects of pesticides on cytokines production by human peripheral blood mononuclear cells--fenitrothion and glyphosate].
Chudoku Kenkyu. 2002;
15:159
-165

[197] NARITA S, GOLDBLUM RM, WATSON CS, BROOKS EG, ESTES DM, et coll. Environmental estrogens induce mast cell degranulation and enhance IgE-mediated release of allergic mediators.
Environ Health Perspect. 2007;
115:48
-52

[198] NASUTI C, CANTALAMESSA F, FALCIONI G, GABBIANELLI R. Different effects of Type I and Type II pyrethroids on erythrocyte plasma membrane properties and enzymatic activity in rats.
Toxicology. 2003;
191:233
-244

[199] NASUTI C, GABBIANELLI R, FALCIONI ML, DI SA, SOZIO P, et coll. Dopaminergic system modulation, behavioral changes, and oxidative stress after neonatal administration of pyrethroids.
Toxicology. 2007;
229:194
-205

[200] NDEBELE K, TCHOUNWOU PB, MCMURRAY RW. Coumestrol, bisphenol-A, DDT, and TCDD modulation of interleukin-2 expression in activated CD+4 Jurkat T cells.
Int J Environ Res Public Health. 2004;
1:3
-11

[201] NETA G, GOLDMAN LR, BARR D, APELBERG BJ, WITTER FR, HALDEN RU. Fetal Exposure to Chlordane and Permethrin Mixtures in Relation to Inflammatory Cytokines and Birth Outcomes.
Environ Sci Technol. 2011;
45(4):1680
-1687

[202] NUNEZ GM, ESTRADA I, CALDERON-ARANDA ES. DDT inhibits the functional activation of murine macrophages and decreases resistance to infection by Mycobacterium microti.
Toxicology. 2002;
174:201
-210

[203] NWANI CD, LAKRA WS, NAGPURE NS, KUMAR R, KUSHWAHA B, et coll. Toxicity of the herbicide atrazine: effects on lipid peroxidation and activities of antioxidant enzymes in the freshwater fish Channa punctatus (Bloch).
Int J Environ Res Public Health. 2010;
7:3298
-3312

[204] OHNISHI T, YOSHIDA T, IGARASHI A, MUROI M, TANAMOTO K. Effects of possible endocrine disruptors on MyD88-independent TLR4 signaling.
FEMS Immunol Med Microbiol. 2008;
52:293
-295

[205] OJHA A, YADUVANSHI SK, PANT SC, LOMASH V, SRIVASTAVA N. Evaluation of DNA damage and cytotoxicity induced by three commonly used organophosphate pesticides individually and in mixture, in rat tissues.
Environ Toxicol. 2011;
Epub ahead of print.

[206] OKOUMASSOUN LE, AVERILL-BATES D, MARION M, DENIZEAU F. Possible mechanisms underlying the mitogenic action of heptachlor in rat hepatocytes.
Toxicol Appl Pharmacol. 2003;
193:356
-369

[207] OLGUN S, GOGAL RM, JR, ADESHINA F, CHOUDHURY H, MISRA HP. Pesticide mixtures potentiate the toxicity in murine thymocytes.
Toxicology. 2004;
196:181
-195

[208] OLGUN S, MISRA HP. Pesticides induced oxidative stress in thymocytes.
Mol Cell Biochem. 2006;
290 (1-2):137-144 [Erratum in
Mol Cell Biochem 2007, Feb;296(1-2):205].

[209] OSABA L, AGUIRRE A, ALONSO A, GRAF U. Genotoxicity testing of six insecticides in two crosses of the Drosophila wing spot test.
Mutat Res. 1999;
439:49
-61

[210] PARENT-MASSIN D, THOUVENOT D. In vitro study of pesticide hematotoxicity in human and rat progenitors.
J Pharmacol Toxicol Methods. 1993;
30:203
-207

[211] PARK JA, KIM S, LEE SY, KIM CS, KIM DK, et coll. Beneficial effects of carnosic acid on dieldrin-induced dopaminergic neuronal cell death.
Neuroreport. 2008;
19:1301
-1304

[212] PELLETIER M, ROBERGE CJ, GAUTHIER M, VANDAL K, TESSIER PA, et coll. Activation of human neutrophils in vitro and dieldrin-induced neutrophilic inflammation in vivo.
J Leukoc Biol. 2001;
70:367
-373

[213] PEREZ-CARREON JI, DARGENT C, MERHI M, FATTEL-FAZENDA S, ARCE-POPOCA E, et coll. Tumor promoting and co-carcinogenic effects in medium-term rat hepatocarcinogenesis are not modified by co-administration of 12 pesticides in mixture at acceptable daily intake.
Food Chem Toxicol. 2009;
47:540
-546

[214] PEREZ-MALDONADO IN, PEREZ-VAZQUEZ FJ, GASPAR-RAMIREZ O, GONZALEZ-AMARO R, DIAZ-BARRIGA F. Variability in DDT-induced apoptosis in Mexican indigenous populations.
Toxicol Mech Methods. 2011;
21:675
-680

[215] PINCHUK LM, LEE SR, FILIPOV NM. In vitro atrazine exposure affects the phenotypic and functional maturation of dendritic cells.
Toxicol Appl Pharmacol. 2007;
223:206
-217

[216] PINO A, MAURA A, GRILLO P. DNA damage in stomach, kidney, liver and lung of rats treated with atrazine.
Mutat Res. 1988;
209:145
-147

[217] PINTER A, TOROK G, SURJAN A, CSIK M, BORZSONYI M, et coll. Genotoxicity of selected herbicides.
Ann Ist Super Sanita. 1989;
25:577
-582

[218] POLETTA GL, LARRIERA A, KLEINSORGE E, MUDRY MD. Genotoxicity of the herbicide formulation Roundup (glyphosate) in broad-snouted caiman (Caiman latirostris) evidenced by the Comet assay and the Micronucleus test.
Mutat Res. 2009;
672:95
-102

[219] POOL-ZOBEL BL, LOTZMANN N, KNOLL M, KUCHENMEISTER F, LAMBERTZ R, et coll. Detection of genotoxic effects in human gastric and nasal mucosa cells isolated from biopsy samples.
Environ Mol Mutagen. 1994;
24:23
-45

[220] PRADO G, BHALLI JA, MARCOS R. Genotoxicity of heptachlor and heptachlor epoxide in human TK6 lymphoblastoid cells.
Mutat Res. 2009;
673:87
-91

[221] PRASAD S, SRIVASTAVA S, SINGH M, SHUKLA Y. Clastogenic effects of glyphosate in bone marrow cells of swiss albino mice.
J Toxicol. 2009 [Epub 2008 Dec 15];
2009:308985:

[222] PRATER MR, GOGAL RM, JR, BLAYLOCK BL, LONGSTRETH J, HOLLADAY SD. Single-dose topical exposure to the pyrethroid insecticide, permethrin in C57BL/6N mice: effects on thymus and spleen.
Food Chem Toxicol. 2002;
4:1863
-1873

[223] PRATER MR, BLAYLOCK BL, HOLLADAY SD. Molecular mechanisms of cis-urocanic acid and permethrin-induced alterations in cutaneous immunity.
Photodermatol Photoimmunol Photomed. 2003;
19:287
-294

[224] PRATER MR, BLAYLOCK BL, HOLLADAY SD. Combined dermal exposure to permethrin and cis-urocanic acid suppresses the contact hypersensitivity response in C57BL/6N mice in an additive manner.
J Photochem Photobiol B. 2005;
78:29
-34

[225] PRETA G, DE KR, CHAKRABORTI S, GLAS R. MAP kinase-signaling controls nuclear translocation of tripeptidyl-peptidase II in response to DNA damage and oxidative stress.
Biochem Biophys Res Commun. 2010;
399:324
-330

[226] PRUETT SB, FAN R, OPPENHEIMER S. Greater than additive suppression of TLR3-induced IL-6 responses by administration of dieldrin and atrazine.
J Immunotoxicol. 2006;
3:253
-262

[227] PUNAREEWATTANA K, SMITH BJ, BLAYLOCK BL, LONGSTRETH J, SNODGRASS HL, et coll. Topical permethrin exposure inhibits antibody production and macrophage function in C57Bl/6N mice.
Food Chem Toxicol. 2001;
39:133
-139

[228] PURDUE MP, LAN Q, KRICKER A, GRULICH AE, VAJDIC CM, et coll. Polymorphisms in immune function genes and risk of non-Hodgkin lymphoma: findings from the New South Wales non-Hodgkin Lymphoma Study.
Carcinogenesis. 2007;
28:704
-712

[229] RADOSAVLJEVIC T, MLADENOVIC D, JAKOVLJEVIC V, VUCVIC D, RASC-MARKOVIC A, et coll. Oxidative stress in liver and red blood cells in acute lindane toxicity in rats.
Hum Exp Toxicol. 2009;
28:747
-757

[230] RAHMAN MF, MAHBOOB M, DANADEVI K, SALEHA BANU B, GROVER P. Assessment of genotoxic effects of chloropyriphos and acephate by the comet assay in mice leucocytes.
Mutat Res. 2002;
516:139
-147

[231] RANK J, JENSEN AG, SKOV B, PEDERSEN LH, JENSEN K. Genotoxicity testing of the herbicide Roundup and its active ingredient glyphosate isopropylamine using the mouse bone marrow micronucleus test, Salmonella mutagenicity test, and Allium anaphase-telophase test.
Mutat Res. 1993;
300:29
-36

[232] REINHARDT D, REINHARDT K, NEUHOFF C, SANDER A, KLUSMANN JH, et coll. GATA1-mutation associated leukemia in children with trisomy 21 mosaic.
Klin Padiatr. 2012;
224(3):153
-155

[233] RELFORD RL, AINSWORTH AJ, HARKNESS JE. Effects of a commercial malathion dip preparation on the cellular and humoral immune response of BALB/c mice.
Lab Anim Sci. 1989;
39:56
-59

[234] REUBER MD. Carcinogenicity of toxaphene: a review.
J Toxicol Environ Health. 1979;
5:729
-748

[235] REUS GZ, VALVASSORI SS, NUERNBERG H, COMIM CM, STRINGARI RB, et coll. DNA damage after acute and chronic treatment with malathion in rats.
J Agric Food Chem. 2008;
56:7560
-7565

[236] RIBAS G, FRENZILLI G, BARALE R, MARCOS R. Herbicide-induced DNA damage in human lymphocytes evaluated by the single-cell gel electrophoresis (SCGE) assay.
Mutat Res. 1995;
344:41
-54

[237] RIBAS G, SURRALLES J, CARBONELL E, XAMENA N, CREUS A, et coll. Genotoxicity of the herbicides alachlor and maleic hydrazide in cultured human lymphocytes.
Mutagenesis. 1996;
11:221
-227

[238] RIBAS G, CARBONELL E, CREUS A, XAMENA N, MARCOS R. Genotoxicity of humic acid in cultured human lymphocytes and its interaction with the herbicides alachlor and maleic hydrazide.
Environ Mol Mutagen. 1997;
29:272
-276

[239] RIVEDAL E, OPSAHL H. Role of PKC and MAP kinase in EGF- and TPA-induced connexin43 phosphorylation and inhibition of gap junction intercellular communication in rat liver epithelial cells.
Carcinogenesis. 2001;
22:1543
-1550

[240] RODGERS K, XIONG S. Contribution of mast cell mediators to alterations in macrophage function after malathion administration.
Fundam Appl Toxicol. 1996;
33:100
-108

[241] ROONEY AA, MATULKA RA, LUEBKE RW. Developmental atrazine exposure suppresses immune function in male, but not female Sprague-Dawley rats.
Toxicol Sci. 2003;
76:366
-375

[242] ROTHMAN N, SKIBOLA CF, WANG SS, MORGAN G, LAN Q, et coll. Genetic variation in TNF and IL10 and risk of non-Hodgkin lymphoma: a report from the InterLymph Consortium.
Lancet Oncol. 2006;
7:27
-38

[243] ROUGHT SE, YAU PM, SCHNIER JB, CHUANG LF, CHUANG RY. The effect of heptachlor, a chlorinated hydrocarbon insecticide, on p53 tumor suppressor in human lymphocytes.
Toxicol Lett. 1998;
94:29
-36

[244] ROUGHT SE, YAU PM, GUO XW, CHUANG LF, DOI RH, et coll. Modulation of CPP32 activity and induction of apoptosis in Human CEM X 174 lymphocytes by heptachlor, a chlorinated hydrocarbon insecticide.
J Biochem Mol Toxicol. 2000;
14:42
-50

[245] ROWE AM, BRUNDAGE KM, BARNETT JB. In vitro atrazine-exposure inhibits human natural killer cell lytic granule release.
Toxicol Appl Pharmacol. 2007;
221:179
-188

[246] RUDANT J, MENEGAUX F, LEVERGER G, BARUCHEL A, NELKEN B, et coll. Family history of cancer in children with acute leukemia, Hodgkin’s lymphoma or non-Hodgkin’s lymphoma: the ESCALE study (SFCE).
Int J Cancer. 2007;
121:119
-126

[247] RYU JC, KIM YJ, CHAI YG, . Mutation spectrum of 1,2-dibromo-3-chloropropane, an endocrine disruptor, in the lacI transgenic Big Blue Rat2 fibroblast cell line.
Mutagenesis. 2002;
17:301
-307

[248] SALVADORI DM, RIBEIRO LR, PEREIRA CA, BECAK W. Cytogenetic effects of malathion insecticide on somatic and germ cells of mice.
Mutat Res. 1988;
204:283
-287

[249] SAMINATHAN H, ASAITHAMBI A, ANANTHARAM V, KANTHASAMY AG, KANTHASAMY A.. Environmental neurotoxic pesticide dieldrin activates a non receptor tyrosine kinase to promote pkcdelta-mediated dopaminergic apoptosis in a dopaminergic neuronal cell model.
Neurotoxicology. 2011;
32:567
-577

[250] SANCHEZ BC, RALSTON-HOOPER KJ, KOWALSKI KA, DOROTA IH, ADAMEC J, et coll. Liver proteome response of largemouth bass (Micropterus salmoides) exposed to several environmental contaminants: potential insights into biomarker development.
Aquat Toxicol. 2009;
95:52
-59

[251] SARADHA B, VAITHINATHAN S, MATHUR PP, . Lindane induces testicular apoptosis in adult Wistar rats through the involvement of Fas-FasL and mitochondria-dependent pathways.
Toxicology. 2009;
255:131
-139

[252] SAULSBURY MD, HEYLIGER SO, WANG K, JOHNSON DJ. Chlorpyrifos induces oxidative stress in oligodendrocyte progenitor cells.
Toxicology. 2009;
259:1
-9

[253] SAULSBURY MD, HEYLIGER SO, WANG K, ROUND D. Characterization of chlorpyrifos-induced apoptosis in placental cells.
Toxicology. 2008;
244:98
-110

[254] SAXENA R, GARG P, JAIN DK, . In Vitro Anti-oxidant Effect of Vitamin E on Oxidative Stress Induced due to Pesticides in Rat Erythrocytes.
Toxicol Int. 2011;
18:73
-76

[255] SCHAALAN MF, ABDELRAOUF SM, MOHAMED WA, HASSANEIN FS. Correlation between maternal milk and infant serum levels of chlorinated pesticides (CP) and the impact of elevated CP on bleeding tendency and immune status in some infants in Egypt.
J Immunotoxicol. 2012;
9(1):15
-24

[256] SCHOP RN, HARDY MH, GOLDBERG MT, . Comparison of the activity of topically applied pesticides and the herbicide 2,4-D in two short-term in vivo assays of genotoxicity in the mouse.
Fundam Appl Toxicol. 1990;
15:666
-675

[257] SCHRADER TJ, BOYES BG, MATULA TI, HEROUX-METCALF C, LANGLOIS I, et coll. In vitro investigation of toxaphene genotoxicity in S. typhimurium and Chinese hamster V79 lung fibroblasts.
Mutat Res. 1998;
413:159
-168

[258] SETH V, AHMAD RS, SUKE SG, PASHA ST, BHATTACHARYA A, et coll. Lindane-induced immunological alterations in human poisoning cases.
Clin Biochem. 2005;
38:678
-680

[259] SHADNIA S, AZIZI E, HOSSEINI R, KHOEI S, FOULADDEL S, et coll. Evaluation of oxidative stress and genotoxicity in organophosphorus insecticide formulators.
Hum Exp Toxicol. 2005;
24:439
-445

[260] SHARMA H, ZHANG P, BARBER DS, LIU B. Organochlorine pesticides dieldrin and lindane induce cooperative toxicity in dopaminergic neurons: role of oxidative stress.
Neurotoxicology. 2010;
31:215
-222

[261] SHI Y, SONG Y, WANG Y, LIANG X, HU Y, et coll. p,p’-DDE induces apoptosis of rat Sertoli cells via a FasL-dependent pathway.
J Biomed Biotechnol. 2009;
2009:181282

[262] SHI YQ, WANG YP, SONG Y, LI HW, LIU CJ, et coll. p,p’-DDE induces testicular apoptosis in prepubertal rats via the Fas/FasL pathway.
Toxicol Lett. 2010;
193:79
-85

[263] SHIMOMURA-SHIMIZU M, SUGIYAMA K, MUROI M, TANAMOTO K. Alachlor and carbaryl suppress lipopolysaccharide-induced iNOS expression by differentially inhibiting NF-kappaB activation.
Biochem Biophys Res Commun. 2005;
332:793
-799

[264] SIDOROVA TS, MATESIC DF. Protective effect of the natural product, chaetoglobosin K, on lindane- and dieldrin-induced changes in astroglia: identification of activated signaling pathways.
Pharm Res. 2008;
25:1297
-1308

[265] SINGH S, KUMAR V, THAKUR S, BANERJEE BD, RAUTELA RS, et coll. Paraoxonase-1 genetic polymorphisms and susceptibility to DNA damage in workers occupationally exposed to organophosphate pesticides.
Toxicol Appl Pharmacol. 2011;
252:130
-137

[266] SLOTKIN TA, SEIDLER FJ. Oxidative and excitatory mechanisms of developmental neurotoxicity: transcriptional profiles for chlorpyrifos, diazinon, dieldrin, and divalent nickel in PC12 cells.
Environ Health Perspect. 2009;
117:587
-596

[267] SLOTKIN TA, SEIDLER FJ. Oxidative stress from diverse developmental neurotoxicants: antioxidants protect against lipid peroxidation without preventing cell loss.
Neurotoxicol Teratol. 2010a;
32:124
-131

[268] SLOTKIN TA, LOBNER D, SEIDLER FJ. Transcriptional profiles for glutamate transporters reveal differences between organophosphates but similarities with unrelated neurotoxicants.
Brain Res Bull. 2010b;
83:76
-83

[269] SMIALOWICZ RJ. The rat as a model in developmental immunotoxicology.
Hum Exp Toxicol. 2002;
21:513
-519

[270] SODERLUND EJ, BRUNBORG G, HOLME JA, HONGSLO JK, NELSON SD, et coll. Co-culture systems for assessing the stability and genotoxicity of reactive 1,2-dibromo-3-chloropropane (DBCP) metabolites.
Mutagenesis. 1991;
6:25
-30

[271] SONG Y, SHI Y, YU H, HU Y, WANG Y, et coll. p,p’-Dichlorodiphenoxydichloroethylene induced apoptosis of Sertoli cells through oxidative stress-mediated p38 MAPK and mitochondrial pathway..
Toxicol Lett. 2011;
202:55
-60

[272] SOTO AM, SONNENSCHEIN C. Environmental causes of cancer: endocrine disruptors as carcinogens.
Nat Rev Endocrinol. 2010;
6:363
-370

[273] SUN F, ANANTHARAM V, LATCHOUMYCANDANE C, KANTHASAMY A, KANTHASAMY AG. Dieldrin induces ubiquitin-proteasome dysfunction in alpha-synuclein overexpressing dopaminergic neuronal cells and enhances susceptibility to apoptotic cell death.
J Pharmacol Exp Ther. 2005;
315:69
-79

[274] SUN H, XU XL, XU LC, SONG L, HONG X, et coll. Antiandrogenic activity of pyrethroid pesticides and their metabolite in reporter gene assay.
Chemosphere. 2007;
66:474
-479

[275] SWERDLOW SH, CAMPO E, SETO M, MULLER-HERMELINK HK.WHO classification of tumours of haematopoietic and lymphoid tissues. Swerdlow SH éds, IARC, Lyon. 2008, pp.229-232.

[276] TAETS C, AREF S, RAYBURN AL, . The clastogenic potential of triazine herbicide combinations found in potable water supplies.
Environ Health Perspect. 1998;
106:197
-201

[277] TAKAGI S. Chronic toxicity of 2-methyl-4-chlorophenoxyacetic acid (MCPA) in mice.
Tohoku J Exp Med. 1990;
160:97
-107

[278] TARRAF C, EL-SABBAN M, BASSAM R, BEYROUTHY M, CHAMOUN J, et coll. Functional consequence of exposure to dieldrin on mammary development and function.
Food Addit Contam. 2003;
20:819
-828

[279] TELANG S, TONG C, WILLIAMS GM. Epigenetic membrane effects of a possible tumor promoting type on cultured liver cells by the non-genotoxic organochlorine pesticides chlordane and heptachlor.
Carcinogenesis. 1982;
3:1175
-1178

[280] TERAMOTO S, SHIRASU Y. Genetic toxicology of 1,2-dibromo-3-chloropropane (DBCP).
Mutat Res. 1989;
221:1
-9

[281] TESSIER DM, MATSUMURA F. Increased ErbB-2 tyrosine kinase activity, MAPK phosphorylation, and cell proliferation in the prostate cancer cell line LNCaP following treatment by select pesticides.
Toxicol Sci. 2001;
60:38
-43

[282] THEUS SA, TABOR DR, SODERBERG LS, BARNETT JB. Macrophage tumoricidal mechanisms are selectively altered by prenatal chlordane exposure.
Agents Actions. 1992;
37:140
-146

[283] THIEBLEMONT C, SALLES G. Contribution of bio-informatics analysis in non-Hodgkin’s lymphoma.
Hématologie. 2005;
Vol.11(1):59
-69

[284] THORPE E, WALKER A. The toxicology of dieldrin (HEOD). II. Comparative long-term oral toxicity studies in mice with dieldrin, DDT, Phenobarbitone, beta-BHC, and gamma-BHC.
Food Cosmet Toxicol. 1973;
11:433
-442

[285] THRASHER JD, HEUSER G, BROUGHTON A. Immunological abnormalities in humans chronically exposed to chlorpyrifos.
Arch Environ Health. 2002;
57:181
-187

[286] TISCH M, FAULDE MK, MAIER H. Genotoxic effects of pentachlorophenol, lindane, transfluthrin, cyfluthrin, and natural pyrethrum on human mucosal cells of the inferior and middle nasal conchae.
Am J Rhinol. 2005;
19:141
-151

[287] TITENKO-HOLLAND N, WINDHAM G, KOLACHANA P, REINISCH F, PARVATHAM S, et coll. Genotoxicity of malathion in human lymphocytes assessed using the micronucleus assay in vitro and in vivo : a study of malathion-exposed workers.
Mutat Res. 1997;
388:85
-95

[288] TORRES C, RIBAS G, XAMENA N, CREUS A, MARCOS R. Genotoxicity of four herbicides in the Drosophila wing spot test.
Mutat Res. 1992;
280:291
-295

[289] TROSKO JE, RUCH RJ. Gap junctions as targets for cancer chemoprevention and chemotherapy.
Curr Drug Targets. 2002;
3:465
-482

[290] TRYPHONAS H, BRYCE F, HUANG J, LACROIX F, HODGEN M, et coll. Effects of toxaphene on the immune system of cynomolgus (Macaca fascicularis) monkeys. A pilot study.
Food Chem Toxicol. 2000;
38:25
-33

[291] TRYPHONAS H, BONDY G, HODGEN M, COADY L, PARENTEAU M, et coll. Effects of cis-nonachlor, trans-nonachlor and chlordane on the immune system of Sprague-Dawley rats following a 28-day oral (gavage) treatment.
Food Chem Toxicol. 2003;
41:107
-118

[292] TURKEZ H, TOGAR B. Olive (Olea europaea L.) leaf extract counteracts genotoxicity and oxidative stress of permethrin in human lymphocytes.
J Toxicol Sci. 2011;
36:531
-537

[293] TYRKIEL E, WIADROWSKA B, LUDWICKI JK. Comparative study of the effect of synthetic pyrethroids on the induction of genetic changes in mice somatic and sex cells depending on the exposure route.
Rocz Panstw Zakl Hig. 2001;
52:97
-109

[294] UKPEBOR J, LLABJANI V, MARTIN FL, HALSALL CJ. Sublethal genotoxicity and cell alterations by organophosphorus pesticides in MCF-7 cells: implications for environmentally relevant concentrations.
Environ Toxicol Chem. 2011;
30:632
-639

[295] UNDEGER U, BASARAN N. Effects of pesticides on human peripheral lymphocytes in vitro: induction of DNA damage.
Arch Toxicol. 2005;
79:169
-176

[296] VAN DEN HEUVEL RL, LEPPENS H, SCHOETERS GE. Use of in vitro assays to assess hematotoxic effects of environmental compounds.
Cell Biol Toxicol. 2001;
17:107
-116

[297] VINDAS R, ORTIZ F, RAMIREZ V, CUENCA P. Genotoxicity of three pesticides used in Costa Rican banana plantations.
Rev Biol Trop. 2004;
52:601
-609

[298] VINUELA A, SNOEK LB, RIKSEN JA, KAMMENGA JE. Genome-wide gene expression analysis in response to organophosphorus pesticide chlorpyrifos and diazinon in C. elegans.
PLoS One. 2010;
5:e12145

[299] WALTER Z, CZAJKOWSKA A, LIPECKA K. Effect of malathion on the genetic material of human lymphocytes stimulated by phytohemagglutinin (PHA).
Hum Genet. 1980;
53:375
-381

[300] WANG SS, SLAGER SL, BRENNAN P, HOLLY EA, DE SS, et coll. Family history of hematopoietic malignancies and risk of non-Hodgkin lymphoma (NHL): a pooled analysis of 10 211 cases and 11 905 controls from the International Lymphoma Epidemiology Consortium (InterLymph).
Blood. 2007;
109:3479
-3488

[301] WETMORE BA, MITCHELL AD, MEYER SA, GENTER MB. Evidence for site-specific bioactivation of alachlor in the olfactory mucosa of the Long-Evans rat.
Toxicol Sci. 1999;
49:202
-212

[302] WHALEN MM, LOGANATHAN BG, YAMASHITA N, SAITO T. Immunomodulation of human natural killer cell cytotoxic function by triazine and carbamate pesticides.
Chem Biol Interact. 2003;
145:311
-319

[303] WHYSNER J, MONTANDON F, MCCLAIN RM, DOWNING J, VERNA LK, STEWARD RE 3RD, WILLIAMS GM. Absence of DNA adduct formation by phenobarbital, polychlorinated biphenyls, and chlordane in mouse liver using the 32P-postlabeling assay.
Toxicol Appl Pharmacol. 1998;
148:14
-23

[304] WIGER R, HOLME JA, HONGSLO JK, BRUNBORG G, HAUG K, et coll. Single-strand breaks, cell cycle arrest and apoptosis in HL-60 and LLCPK1 cells exposed to 1,2-dibromo-3-chloropropane.
Cell Biol Toxicol. 1998;
14:267
-282

[305] WILLIAMS GM, KROES R, MUNRO IC. Safety evaluation and risk assessment of the herbicide Roundup and its active ingredient, glyphosate, for humans.
Regul Toxicol Pharmacol. 2000;
31:117
-165

[306] WU XJ, LU WQ, MERSCH-SUNDERMANN V. Benzo(a)pyrene induced micronucleus formation was modulated by persistent organic pollutants (POPs) in metabolically competent human HepG2 cells.
Toxicol Lett. 2003;
144:143
-150

[307] WU JC, HSEU YC, TSAI JS, CHEN LC, CHYE SM, et coll. Fenthion and terbufos induce DNA damage, the expression of tumor-related genes, and apoptosis in HEPG2 cells.
Environ Mol Mutagen. 2011;
52:529
-537

[308] XU LC, LIU L, REN XM, ZHANG MR, CONG N, et coll. Evaluation of androgen receptor transcriptional activities of some pesticides in vitro.
Toxicology. 2008;
243:59
-65

[309] YAMASAKI H. Role of disrupted gap junctional intercellular communication in detection and characterization of carcinogens.
Mutat Res. 1996;
365:91
-105

[310] YU Y, YANG A, ZHANG J, HU S. Maternal exposure to the mixture of organophosphorus pesticides induces reproductive dysfunction in the offspring.
Environ Toxicol. 2011, Jul 26;
[Epub ahead of print].

[311] ZHANG J, ZHU W, ZHENG Y, YANG J, ZHU X. The antiandrogenic activity of pyrethroid pesticides cyfluthrin and beta-cyfluthrin.
Reprod Toxicol. 2008;
25:491
-496

[312] ZUCCHINI-PASCAL N, DE SG, RAHMANI R. Lindane and cell death: at the crossroads between apoptosis, necrosis and autophagy.
Toxicology. 2009;
256:32
-41

→ Aller vers SYNTHESE
 ). L’expression de certains facteurs de transcription pourrait être modulée par des modifications épigénétiques.
). L’expression de certains facteurs de transcription pourrait être modulée par des modifications épigénétiques. ). Ils sont constitués par les lymphocytes des ganglions, de la rate, des amygdales et ceux présents dans tous les organes (en particulier la moelle osseuse, l’intestin, les glandes…). Les lymphomes non hodgkiniens (LNH) résultent des proliférations de cellules tumorales issues des lymphocytes B (type le plus courant), T (CD4, CD8 ou Tγδ) ou NK, et bloquées à un stade de différenciation plus ou moins précoce. Ils forment un groupe diversifié de plus de 30 types différents. La classification des LNH la plus utilisée actuellement est celle publiée récemment par l’OMS (Swerdlow et coll., 2008
). Ils sont constitués par les lymphocytes des ganglions, de la rate, des amygdales et ceux présents dans tous les organes (en particulier la moelle osseuse, l’intestin, les glandes…). Les lymphomes non hodgkiniens (LNH) résultent des proliférations de cellules tumorales issues des lymphocytes B (type le plus courant), T (CD4, CD8 ou Tγδ) ou NK, et bloquées à un stade de différenciation plus ou moins précoce. Ils forment un groupe diversifié de plus de 30 types différents. La classification des LNH la plus utilisée actuellement est celle publiée récemment par l’OMS (Swerdlow et coll., 2008 ). On classe également les LNH selon leur développement (lymphomes indolents avec développement lent, et lymphomes agressifs) et selon leur évolution probable. La maladie de Hodgkin ou lymphome de Hodgkin est un type de lymphome caractérisé par la présence de grosses cellules atypiques, les cellules de Reed-Sternberg.
). On classe également les LNH selon leur développement (lymphomes indolents avec développement lent, et lymphomes agressifs) et selon leur évolution probable. La maladie de Hodgkin ou lymphome de Hodgkin est un type de lymphome caractérisé par la présence de grosses cellules atypiques, les cellules de Reed-Sternberg. ). Une perturbation des interleukines IL-4 et IL-10 est associée au risque de LNH (Lan et coll., 2006
). Une perturbation des interleukines IL-4 et IL-10 est associée au risque de LNH (Lan et coll., 2006 ; Rothman et coll., 2006
; Rothman et coll., 2006 ; Purdue et coll., 2007
; Purdue et coll., 2007 ).
). ), ainsi que des facteurs génétiques (LH, LNH) (Rudant et coll., 2007
), ainsi que des facteurs génétiques (LH, LNH) (Rudant et coll., 2007 ; Wang et coll., 2007
; Wang et coll., 2007 ), mais aussi l’exposition aux radiations, à la chimiothérapie, au benzène, au pétrole, aux polluants.
), mais aussi l’exposition aux radiations, à la chimiothérapie, au benzène, au pétrole, aux polluants. ; Kim et coll., 2008
; Kim et coll., 2008 ; Reinhardt et coll., 2012
; Reinhardt et coll., 2012 ) ;
) ; ).
). ). Toute perturbation de cet équilibre oxydo-réducteur pouvant conduire à une insuffisance des propriétés de la moelle osseuse en lien avec des dommages à l’ADN et l’altération du cycle cellulaire des progéniteurs hématopoïétiques. Ces dérèglements peuvent être à l’origine de pathologies hématopoïétiques (Ghaffari et coll., 2008
). Toute perturbation de cet équilibre oxydo-réducteur pouvant conduire à une insuffisance des propriétés de la moelle osseuse en lien avec des dommages à l’ADN et l’altération du cycle cellulaire des progéniteurs hématopoïétiques. Ces dérèglements peuvent être à l’origine de pathologies hématopoïétiques (Ghaffari et coll., 2008 ; Iuchi et coll., 2010
; Iuchi et coll., 2010 ).
). ; Henschler et coll., 2001
; Henschler et coll., 2001 ; Van den Heuvel et coll., 2001
; Van den Heuvel et coll., 2001 ).
). ), on observe une diminution de l’immunité humorale ainsi qu’une immunotoxicité dépendante de l’induction d’un stress oxydant. Les souris nourries pendant 1 mois avec de l’aliment contenant 12 µg, 120 µg ou 1,2 mg/kg de lindane ont leur réponse immunitaire perturbée (Meera et coll., 1992
), on observe une diminution de l’immunité humorale ainsi qu’une immunotoxicité dépendante de l’induction d’un stress oxydant. Les souris nourries pendant 1 mois avec de l’aliment contenant 12 µg, 120 µg ou 1,2 mg/kg de lindane ont leur réponse immunitaire perturbée (Meera et coll., 1992 ). Un autre organochloré, l’heptachlore, exerce un effet immunosuppresseur chez les rats exposés au cours du développement embryonnaire (Smialowicz, 2002
). Un autre organochloré, l’heptachlore, exerce un effet immunosuppresseur chez les rats exposés au cours du développement embryonnaire (Smialowicz, 2002 ). Chez la truite arc en ciel, l’injection de lindane à 10 mg/kg pendant 1 mois entraîne une lymphopénie (Dunier et coll., 1995
). Chez la truite arc en ciel, l’injection de lindane à 10 mg/kg pendant 1 mois entraîne une lymphopénie (Dunier et coll., 1995 ). De même, ce composé modifie l’expression à différents degrés de gènes liés au système immunitaire dans les leucocytes de poisson (daurade) : IL-1b, TNFa, MHCIa, MHCIIa, Mx, TLR9, IgML and TCRa (Cuesta et coll., 2008
). De même, ce composé modifie l’expression à différents degrés de gènes liés au système immunitaire dans les leucocytes de poisson (daurade) : IL-1b, TNFa, MHCIa, MHCIIa, Mx, TLR9, IgML and TCRa (Cuesta et coll., 2008 ). In vitro, ces composés exercent un effet pro-apoptotique sur des cellules immunitaires en culture (splénocytes, thymocytes, lignée HL-60) (Kang et coll., 1998
). In vitro, ces composés exercent un effet pro-apoptotique sur des cellules immunitaires en culture (splénocytes, thymocytes, lignée HL-60) (Kang et coll., 1998 ; Olgun et coll., 2004
; Olgun et coll., 2004 ; Battaglia et coll., 2010
; Battaglia et coll., 2010 ).
). ) ont observé chez des personnes empoisonnées au lindane une élévation du taux sérique de cytokines (IL-2, IL-4, TNFa). L’étude de Colt et coll. (2009
) ont observé chez des personnes empoisonnées au lindane une élévation du taux sérique de cytokines (IL-2, IL-4, TNFa). L’étude de Colt et coll. (2009 ) suggère qu’une corrélation entre le risque de LNH et l’exposition aux organochlorés est plausible chez les personnes portant certains variants de gènes de cytokines ou interleukines comme IFN, IL-4 IL-10 ou IL-8.
) suggère qu’une corrélation entre le risque de LNH et l’exposition aux organochlorés est plausible chez les personnes portant certains variants de gènes de cytokines ou interleukines comme IFN, IL-4 IL-10 ou IL-8. ; Tisch et coll., 2005
; Tisch et coll., 2005 ). Le lindane exerce un effet pro-oxydant ; cette propriété démontrée in vivo et in vitro dans divers modèles cellulaires s’exercerait via la production accrue d’espèces radicalaires et/ou l’augmentation de taux de GSH (glutathion réduit). In vitro, ces effets sont observés à la dose de 25 µM (Sharma et coll., 2010
). Le lindane exerce un effet pro-oxydant ; cette propriété démontrée in vivo et in vitro dans divers modèles cellulaires s’exercerait via la production accrue d’espèces radicalaires et/ou l’augmentation de taux de GSH (glutathion réduit). In vitro, ces effets sont observés à la dose de 25 µM (Sharma et coll., 2010 ) ; in vivo, une dose de 40 mg/kg pendant 24 heures induit chez le rat un stress oxydant mis en évidence par la présence de glutathion oxydé dans les sécrétions biliaires et d’une réponse inflammatoire au niveau hépatique (Junge et coll., 2001
) ; in vivo, une dose de 40 mg/kg pendant 24 heures induit chez le rat un stress oxydant mis en évidence par la présence de glutathion oxydé dans les sécrétions biliaires et d’une réponse inflammatoire au niveau hépatique (Junge et coll., 2001 ). Une exposition prolongée des animaux (4 semaines) à 30 mg/kg de lindane entraîne une peroxydation lipidique ainsi qu’une modification des défenses anti-oxydantes (Ahmed et coll., 2008
). Une exposition prolongée des animaux (4 semaines) à 30 mg/kg de lindane entraîne une peroxydation lipidique ainsi qu’une modification des défenses anti-oxydantes (Ahmed et coll., 2008 ). Des doses plus faibles (5 mg/kg) entraînent une perturbation du statut oxydoréducteur chez l’animal avec une augmentation des TBARS (Thiobarbituric Acid Reactive Substances), sous-produits des peroxydations lipidiques dans le foie et le plasma dès les premières heures de traitement (Radosavjevic et coll., 2009
). Des doses plus faibles (5 mg/kg) entraînent une perturbation du statut oxydoréducteur chez l’animal avec une augmentation des TBARS (Thiobarbituric Acid Reactive Substances), sous-produits des peroxydations lipidiques dans le foie et le plasma dès les premières heures de traitement (Radosavjevic et coll., 2009 ).
). ). Mais, il est aussi un inducteur de l’apoptose dans d’autres modèles cellulaires en culture : les splénocytes de souris (Battaglia et coll., 2010
). Mais, il est aussi un inducteur de l’apoptose dans d’autres modèles cellulaires en culture : les splénocytes de souris (Battaglia et coll., 2010 ) et aussi in vivo chez l’animal (La Sala et coll., 2009
) et aussi in vivo chez l’animal (La Sala et coll., 2009 ; Saradha et coll., 2009
; Saradha et coll., 2009 ). Le lindane exerce des effets spécifiques sur certaines protéines de la signalisation cellulaire (ERK1, MAP kinase, TPP2, caspase, P53) (Hatakeyama et coll., 2003
). Le lindane exerce des effets spécifiques sur certaines protéines de la signalisation cellulaire (ERK1, MAP kinase, TPP2, caspase, P53) (Hatakeyama et coll., 2003 ; Mograbi et coll., 2003
; Mograbi et coll., 2003 ; Ledirac et coll., 2005
; Ledirac et coll., 2005 ) ; il perturbe aussi les jonctions intercellulaires comme les « GAP Junctions » qui jouent un rôle critique dans la régulation de la prolifération cellulaire (Yamasaki, 1996
) ; il perturbe aussi les jonctions intercellulaires comme les « GAP Junctions » qui jouent un rôle critique dans la régulation de la prolifération cellulaire (Yamasaki, 1996 ; Trosko et Ruch, 2002
; Trosko et Ruch, 2002 ). En effet, l’exposition des lignées murines de cellules de Sertoli à 50 µM de lindane induit une accumulation intracellulaire de connexine, évènement qui peut être rapproché de la transformation néoplasique (Mograbi et coll., 2003
). En effet, l’exposition des lignées murines de cellules de Sertoli à 50 µM de lindane induit une accumulation intracellulaire de connexine, évènement qui peut être rapproché de la transformation néoplasique (Mograbi et coll., 2003 ). Certains auteurs montrent que le lindane est capable à des doses élevées (50 µM) d’induire dans les cellules tumorales, la translocation nucléaire d’une enzyme (tripetidylpeptidase II) ce qui entraîne une augmentation des processus apoptotiques via l’expression augmentée de p53 et l’activation de certaines caspases (Preta et coll., 2010
). Certains auteurs montrent que le lindane est capable à des doses élevées (50 µM) d’induire dans les cellules tumorales, la translocation nucléaire d’une enzyme (tripetidylpeptidase II) ce qui entraîne une augmentation des processus apoptotiques via l’expression augmentée de p53 et l’activation de certaines caspases (Preta et coll., 2010 ).
). ). Cependant, Telang et coll. (1982
). Cependant, Telang et coll. (1982 ) ont montré que ce composé inhibait les communications intercellulaires à l’instar des promoteurs de tumeurs connus et suggèrent un mécanisme d’action épigénétique. En revanche, l’exposition de cellules lymphoblastiques humaines TK6 à des doses d’heptachlore allant de 1 à 20 µM entraîne une augmentation de dommages à l’ADN (test des comètes) (Prado et coll., 2009
) ont montré que ce composé inhibait les communications intercellulaires à l’instar des promoteurs de tumeurs connus et suggèrent un mécanisme d’action épigénétique. En revanche, l’exposition de cellules lymphoblastiques humaines TK6 à des doses d’heptachlore allant de 1 à 20 µM entraîne une augmentation de dommages à l’ADN (test des comètes) (Prado et coll., 2009 ). L’exposition de cellules leucocytaires polymorphonucléées humaines pendant 40 min à de faibles doses d’heptachlore (0,01 à 10 nM induits des cassures d’ADN mesurées par la méthode Tunnel (Cassidy et coll., 2005
). L’exposition de cellules leucocytaires polymorphonucléées humaines pendant 40 min à de faibles doses d’heptachlore (0,01 à 10 nM induits des cassures d’ADN mesurées par la méthode Tunnel (Cassidy et coll., 2005 ). Ce composé aurait un potentiel mutagène dans les lymphomes de souris tk+/- (McGregor et coll., 1988
). Ce composé aurait un potentiel mutagène dans les lymphomes de souris tk+/- (McGregor et coll., 1988 ).
). ) à des concentrations assez élevées dans les cellules CHO.
) à des concentrations assez élevées dans les cellules CHO. ) ;
) ; ) ;
) ; ) et l’apoptose (diminution de l’expression de p53) (Rought et coll., 1998
) et l’apoptose (diminution de l’expression de p53) (Rought et coll., 1998 ).
). ) ; exerce un effet mitogénique sur les cellules mononuclées périphériques de singe et stimule la sécrétion d’IL-2 (Chuang et coll., 1992
) ; exerce un effet mitogénique sur les cellules mononuclées périphériques de singe et stimule la sécrétion d’IL-2 (Chuang et coll., 1992 ) et certaines fonctions immunitaires comme le chimiotactisme des leucocytes (Chuang et Chuang, 1998
) et certaines fonctions immunitaires comme le chimiotactisme des leucocytes (Chuang et Chuang, 1998 ; Chuang et coll., 1999
; Chuang et coll., 1999 ). Dans les lymphocytes humains (CEMx174), l’heptachlore présente des effets différentiels selon la dose : à faible concentration il supprime l’activation d’une protéase apoptotique alors qu’il l’augmente à forte concentration (Rought et coll., 2000
). Dans les lymphocytes humains (CEMx174), l’heptachlore présente des effets différentiels selon la dose : à faible concentration il supprime l’activation d’une protéase apoptotique alors qu’il l’augmente à forte concentration (Rought et coll., 2000 ). L’heptachlore exerce un effet immunosuppresseur chez les rats exposés au cours du développement embryonnaire (Smialowicz, 2002
). L’heptachlore exerce un effet immunosuppresseur chez les rats exposés au cours du développement embryonnaire (Smialowicz, 2002 ). L’étude de Colt et coll. (2009
). L’étude de Colt et coll. (2009 ) suggère qu’une interaction entre gène et environnement (gène immunité/exposition aux organochlorés) est plausible dans les cas de LNH.
) suggère qu’une interaction entre gène et environnement (gène immunité/exposition aux organochlorés) est plausible dans les cas de LNH. ), mais il perturbe la prolifération et la différenciation. La moelle osseuse de souris femelles nées de mères traitées avec des doses de 0 à 8 mg/kg/j de chlordane durant la gestation, présente chez les animaux âgés de 6 semaines, une diminution de la capacité de différenciation vers la lignée granulomonocytaire (Blyler et coll., 1994
), mais il perturbe la prolifération et la différenciation. La moelle osseuse de souris femelles nées de mères traitées avec des doses de 0 à 8 mg/kg/j de chlordane durant la gestation, présente chez les animaux âgés de 6 semaines, une diminution de la capacité de différenciation vers la lignée granulomonocytaire (Blyler et coll., 1994 ). Cet effet est déjà visible chez le fœtus (Barnett et coll., 1990
). Cet effet est déjà visible chez le fœtus (Barnett et coll., 1990 ). Le chlordane tout comme le lindane ou le DDT sont des composés associés à l’aplasie de la moelle osseuse (Mencoboni et coll., 1992
). Le chlordane tout comme le lindane ou le DDT sont des composés associés à l’aplasie de la moelle osseuse (Mencoboni et coll., 1992 ).
). et 1987
et 1987 ) et affecte les capacités tumorigènes des macrophages (Theus et coll., 1992
) et affecte les capacités tumorigènes des macrophages (Theus et coll., 1992 ). Comme l’heptachlore, il diminue la capacité des cellules NK à lyser les cellules tumorales (Beach et coll., 2006
). Comme l’heptachlore, il diminue la capacité des cellules NK à lyser les cellules tumorales (Beach et coll., 2006 ) et inhibe le chimiotactisme de cellules immunitaires (Miyagi et coll., 1998
) et inhibe le chimiotactisme de cellules immunitaires (Miyagi et coll., 1998 ). L’exposition de neutrophiles humains au chlordane (24 heures, de 0,1 à 50 µg/ml) induit un stress oxydant via l’activation de la PKC ainsi que la phagocytose sans modifier les propriétés de chimiotactisme ou apoptotique des cellules. Il est classé par les auteurs parmi les composés pro-inflammatoires (Gauthier et coll., 2001
). L’exposition de neutrophiles humains au chlordane (24 heures, de 0,1 à 50 µg/ml) induit un stress oxydant via l’activation de la PKC ainsi que la phagocytose sans modifier les propriétés de chimiotactisme ou apoptotique des cellules. Il est classé par les auteurs parmi les composés pro-inflammatoires (Gauthier et coll., 2001 ). L’effet pro-oxydant du chlordane est confirmé in vivo par les études de Bagchi et coll. (1995
). L’effet pro-oxydant du chlordane est confirmé in vivo par les études de Bagchi et coll. (1995 et 1996
et 1996 ) et Hassoun et coll. (1993
) et Hassoun et coll. (1993 ). Le chlordane ne présente pas de propriétés génotoxiques et apparaît agir par un mécanisme épigénétique (Whysner et coll., 1998
). Le chlordane ne présente pas de propriétés génotoxiques et apparaît agir par un mécanisme épigénétique (Whysner et coll., 1998 ).
). ). L’exposition cutanée au chlordane diminue chez la souris l’hypersensibilité aux allergènes (Blaylock et coll., 1995
). L’exposition cutanée au chlordane diminue chez la souris l’hypersensibilité aux allergènes (Blaylock et coll., 1995 ) et une exposition in utero augmente la résistance à l’infection au virus de l’influenza (Barnett et coll., 1995).
) et une exposition in utero augmente la résistance à l’infection au virus de l’influenza (Barnett et coll., 1995). ). Il active la transcription du gène codant pour le récepteur à l’acide rétinoïque (RAR) via les éléments de réponse RARE (présents dans les régions ADN régulatrices du gène) (Lemaire et coll., 2005
). Il active la transcription du gène codant pour le récepteur à l’acide rétinoïque (RAR) via les éléments de réponse RARE (présents dans les régions ADN régulatrices du gène) (Lemaire et coll., 2005 ). Il faut noter que l’acide rétinoïque intervient via RAR alpha dans la différenciation ostéoblastique et granulocytique.
). Il faut noter que l’acide rétinoïque intervient via RAR alpha dans la différenciation ostéoblastique et granulocytique. ) et mutagène (Hooper et coll., 1979
) et mutagène (Hooper et coll., 1979 ) mais ces données sont aujourd’hui controversées (Bartos et coll., 2005
) mais ces données sont aujourd’hui controversées (Bartos et coll., 2005 ). Le toxaphène serait un agent de faible activité mutagénique et génotoxique qui exercerait ses propriétés via des mécanismes indirects par exemple en interférant avec les enzymes de réparation de l’ADN (Schrader et coll., 1998
). Le toxaphène serait un agent de faible activité mutagénique et génotoxique qui exercerait ses propriétés via des mécanismes indirects par exemple en interférant avec les enzymes de réparation de l’ADN (Schrader et coll., 1998 ). La dose journalière tolérable (DJT) est de 0,2 mg/kg/jour. Le toxaphène apparaît comme un agent immunosuppresseur chez la souris et le singe (Allen et coll., 1983
). La dose journalière tolérable (DJT) est de 0,2 mg/kg/jour. Le toxaphène apparaît comme un agent immunosuppresseur chez la souris et le singe (Allen et coll., 1983 ; Tryphonas et coll., 2000
; Tryphonas et coll., 2000 ). Chez les singes, l’ingestion de 1 mg/kg/jour pendant un an induit divers troubles incluant une inflammation ainsi qu’une augmentation de l’activité hépatique microsomiale (Bryce et coll., 2001
). Chez les singes, l’ingestion de 1 mg/kg/jour pendant un an induit divers troubles incluant une inflammation ainsi qu’une augmentation de l’activité hépatique microsomiale (Bryce et coll., 2001 ), mais ne semble pas affecter l’hématopoïèse. Le toxaphène, bien que l’un des moins puissants des organochlorés, inhibe in vitro les propriétés chimio-attractantes des interleukines vis-à-vis des leucocytes (monocyte et neutrophile de singe) (Miyagi et coll., 1998
), mais ne semble pas affecter l’hématopoïèse. Le toxaphène, bien que l’un des moins puissants des organochlorés, inhibe in vitro les propriétés chimio-attractantes des interleukines vis-à-vis des leucocytes (monocyte et neutrophile de singe) (Miyagi et coll., 1998 ). Selon Lavastre et coll. (2002
). Selon Lavastre et coll. (2002 ), le toxaphène est un puissant stimulateur des neutrophiles et induit dans ces cellules une production accrue de DRO secondaire à l’activation de la protéine kinase C ou de certaines tyrosine kinases. Le toxaphène induit l’apoptose des neutrophiles via l’induction d’un stress oxydant. Des concentrations de toxaphène de 0,1 à 50 µg/ml n’induisent pas la nécrose des neutrophiles humains incubés 24 heures in vitro (Gauthier et coll., 2001
), le toxaphène est un puissant stimulateur des neutrophiles et induit dans ces cellules une production accrue de DRO secondaire à l’activation de la protéine kinase C ou de certaines tyrosine kinases. Le toxaphène induit l’apoptose des neutrophiles via l’induction d’un stress oxydant. Des concentrations de toxaphène de 0,1 à 50 µg/ml n’induisent pas la nécrose des neutrophiles humains incubés 24 heures in vitro (Gauthier et coll., 2001 ).
). ). La neurotoxicité de la dieldrine serait également liée à sa capacité à induire un stress oxydant (Kannan et coll., 2000
). La neurotoxicité de la dieldrine serait également liée à sa capacité à induire un stress oxydant (Kannan et coll., 2000 ; Chun et coll., 2001
; Chun et coll., 2001 ; Kitazawa et coll., 2001
; Kitazawa et coll., 2001 ). Le pré-traitement avec un anti-oxydant inhibe en général la neurotoxicité in vitro de ce composé (Cho et coll., 2008
). Le pré-traitement avec un anti-oxydant inhibe en général la neurotoxicité in vitro de ce composé (Cho et coll., 2008 ; Park et coll., 2008
; Park et coll., 2008 ; Sharma et coll., 2010
; Sharma et coll., 2010 ). La dieldrine à une dose de 10 µM inhibe la communication cellulaire via les jonctions serrées en agissant sur l’activation des voies ERK1/2 dans les cellules astrogliales de rat (Sidorova et Matesic, 2008
). La dieldrine à une dose de 10 µM inhibe la communication cellulaire via les jonctions serrées en agissant sur l’activation des voies ERK1/2 dans les cellules astrogliales de rat (Sidorova et Matesic, 2008 ).
). ) dans les cultures primaires de fibroblastes de poumon de souris. En revanche, en utilisant d’autres tests de génotoxicité sur la drosophile, Osaba et coll. (1999
) dans les cultures primaires de fibroblastes de poumon de souris. En revanche, en utilisant d’autres tests de génotoxicité sur la drosophile, Osaba et coll. (1999 ) n’ont pas trouvé d’effet génotoxique lié à l’exposition à la dieldrine.
) n’ont pas trouvé d’effet génotoxique lié à l’exposition à la dieldrine. et 2003
et 2003 ; Kanthasamy et coll., 2003
; Kanthasamy et coll., 2003 , 2005 et 2008
, 2005 et 2008 ). Ces processus impliquent à la fois des voies de signalisation (activation de kinases : PKC, Fyn) (Saminathan et coll., 2011
). Ces processus impliquent à la fois des voies de signalisation (activation de kinases : PKC, Fyn) (Saminathan et coll., 2011 ) ou des processus nucléaires (modification de la chromatine notamment hyperacétylation) (Song et coll., 2010
) ou des processus nucléaires (modification de la chromatine notamment hyperacétylation) (Song et coll., 2010 ). Toutefois, la dieldrine peut produire un effet opposé dans d’autres modèles cellulaires : par exemple, dans des cellules tumorales mammaires, la dieldrine à 10 µM augmente la résistance des cellules à l’apoptose (anoikis2
) via une augmentation de l’expression de la tyrosine kinase B (Cameron et Foster, 2008
). Toutefois, la dieldrine peut produire un effet opposé dans d’autres modèles cellulaires : par exemple, dans des cellules tumorales mammaires, la dieldrine à 10 µM augmente la résistance des cellules à l’apoptose (anoikis2
) via une augmentation de l’expression de la tyrosine kinase B (Cameron et Foster, 2008 ). Ces différences pourraient être liées à l’expression ou à la fonctionnalité de certaines voies de transduction en fonction du modèle cellulaire utilisé. Martyniuk et coll. (2010
). Ces différences pourraient être liées à l’expression ou à la fonctionnalité de certaines voies de transduction en fonction du modèle cellulaire utilisé. Martyniuk et coll. (2010 ) observent la multiplicité des voies de signalisation qui sont touchées dans l’hypothalamus de poisson après une exposition à la dieldrine (2,5 mg/kg dans l’alimentation) et relient les voies affectées à différentes pathologies. L’exposition à la dieldrine dans certains modèles cellulaires conduit également à une altération de l’activité du protéasome résultant en une accumulation de protéines dégradées (Sun et coll., 2005
) observent la multiplicité des voies de signalisation qui sont touchées dans l’hypothalamus de poisson après une exposition à la dieldrine (2,5 mg/kg dans l’alimentation) et relient les voies affectées à différentes pathologies. L’exposition à la dieldrine dans certains modèles cellulaires conduit également à une altération de l’activité du protéasome résultant en une accumulation de protéines dégradées (Sun et coll., 2005 ). Les produits des gènes régulés par la dieldrine sont localisés dans de nombreux compartiments cellulaires.
). Les produits des gènes régulés par la dieldrine sont localisés dans de nombreux compartiments cellulaires. ).
). ). La combinaison de faibles doses d’œstrogène endogènes et environnementales conduit à un effet additif sur la dégranulation des mastocytes (Narita et coll., 2007
). La combinaison de faibles doses d’œstrogène endogènes et environnementales conduit à un effet additif sur la dégranulation des mastocytes (Narita et coll., 2007 ). Par ailleurs, de faibles doses de dieldrine (1 nM et 1 pM) dans les explants de testicules de fœtus humain conduisent à une diminution de la sécrétion de testostérone ainsi que des dérégulations pouvant affecter le développement des organes reproducteurs et la fertilité (Fowler et coll., 2007
). Par ailleurs, de faibles doses de dieldrine (1 nM et 1 pM) dans les explants de testicules de fœtus humain conduisent à une diminution de la sécrétion de testostérone ainsi que des dérégulations pouvant affecter le développement des organes reproducteurs et la fertilité (Fowler et coll., 2007 ).
). ) montrent que la dieldrine est un composant pro-inflammatoire (production IL-8, production d’anions superoxydes dans les neutrophiles humains).
) montrent que la dieldrine est un composant pro-inflammatoire (production IL-8, production d’anions superoxydes dans les neutrophiles humains). ) et dans un modèle de mollusques aquatiques traités avec de très faibles doses 0,1 à 10 µg/ml (Binelli et coll., 2008
) et dans un modèle de mollusques aquatiques traités avec de très faibles doses 0,1 à 10 µg/ml (Binelli et coll., 2008 ). De même, l’exposition d’animaux pendant 5 mois (8 heures par jour et 6 jours par semaine) à une dose de 7 mg/m3 dans l’air ambiant entraîne une génotoxicité dans les lymphocytes et les cellules mammaires (Canales-Aguirre et coll., 2011
). De même, l’exposition d’animaux pendant 5 mois (8 heures par jour et 6 jours par semaine) à une dose de 7 mg/m3 dans l’air ambiant entraîne une génotoxicité dans les lymphocytes et les cellules mammaires (Canales-Aguirre et coll., 2011 ). Dans les lymphocytes humains de donneurs différents (Ennaceur et coll., 2008
). Dans les lymphocytes humains de donneurs différents (Ennaceur et coll., 2008 ), le DDE métabolite du DDT induit des dommages à l’ADN à des concentrations élevées (80 mM). La génotoxicité du DDT a été mise en évidence par la présence de micronoyaux dans les fibroblastes de Béluga (10 à 15 µg/ml), mais celle-ci disparaît lorsque le pesticide est ajouté, en présence de la fraction métabolique S93
(Gauthier et coll., 1999
), le DDE métabolite du DDT induit des dommages à l’ADN à des concentrations élevées (80 mM). La génotoxicité du DDT a été mise en évidence par la présence de micronoyaux dans les fibroblastes de Béluga (10 à 15 µg/ml), mais celle-ci disparaît lorsque le pesticide est ajouté, en présence de la fraction métabolique S93
(Gauthier et coll., 1999 ). En revanche, Wu et coll. n’ont pas observé d’augmentation de la fréquence de micronoyaux dans les lignées cellulaires HepG2 exposées pendant 24 heures au DDT entre 18 et 60 mM (Wu et coll., 2003
). En revanche, Wu et coll. n’ont pas observé d’augmentation de la fréquence de micronoyaux dans les lignées cellulaires HepG2 exposées pendant 24 heures au DDT entre 18 et 60 mM (Wu et coll., 2003 ).
). ; Cosnefroy et coll., 2012
; Cosnefroy et coll., 2012 ). Outre les récepteurs aux œstrogènes, le DDT a d’autres cibles intracellulaires comme la protéine kinase p38, le TNFa, le TGF b, les caspases, ou le proto-oncogène erb2 (Buchmann et coll., 1999
). Outre les récepteurs aux œstrogènes, le DDT a d’autres cibles intracellulaires comme la protéine kinase p38, le TNFa, le TGF b, les caspases, ou le proto-oncogène erb2 (Buchmann et coll., 1999 ; Tessier et Matsumura, 2001
; Tessier et Matsumura, 2001 ; Frigo et coll., 2005
; Frigo et coll., 2005 ). D’autres voies de signalisation peuvent être impliquées dans le mécanisme d’action du DDT. Ainsi, de faibles doses de DTT (0,01, 0,1 et 1 µM) stimulent la prolifération des lignées de cellules cancéreuses mammaires (Han et coll., 2010
). D’autres voies de signalisation peuvent être impliquées dans le mécanisme d’action du DDT. Ainsi, de faibles doses de DTT (0,01, 0,1 et 1 µM) stimulent la prolifération des lignées de cellules cancéreuses mammaires (Han et coll., 2010 ) en lien avec une augmentation de l’expression de l’aromatase, enzyme chargée de la transformation de certains précurseurs androgéniques (diandrostènedione, testostérone) en œstrogène dans les tissus mammaires. Cet effet sur l’aromatase serait induit par une production augmentée de prostaglandines, consécutive à une activation transcriptionnelle du gène cox2. Ces effets sont associés à la voie de signalisation dépendante de l’AMP cyclique et protéine kinase A, et des enzymes de type PI3K, p38 et AKT, enzymes clés dans la régulation de la prolifération et de la survie cellulaire. Les éléments de réponse à l’AMP cyclique et l’AP-1 sont impliqués dans l’impact du DDT sur les macrophages murins (Han et coll., 2008
) en lien avec une augmentation de l’expression de l’aromatase, enzyme chargée de la transformation de certains précurseurs androgéniques (diandrostènedione, testostérone) en œstrogène dans les tissus mammaires. Cet effet sur l’aromatase serait induit par une production augmentée de prostaglandines, consécutive à une activation transcriptionnelle du gène cox2. Ces effets sont associés à la voie de signalisation dépendante de l’AMP cyclique et protéine kinase A, et des enzymes de type PI3K, p38 et AKT, enzymes clés dans la régulation de la prolifération et de la survie cellulaire. Les éléments de réponse à l’AMP cyclique et l’AP-1 sont impliqués dans l’impact du DDT sur les macrophages murins (Han et coll., 2008 ) via l’activation de la protéine P38 (Bratton et coll., 2009
) via l’activation de la protéine P38 (Bratton et coll., 2009 ). La modulation de l’activité de la protéine kinase A par le DDT a été confirmée sur les cellules placentaires (10 µM, Magnarelli et coll., 2009
). La modulation de l’activité de la protéine kinase A par le DDT a été confirmée sur les cellules placentaires (10 µM, Magnarelli et coll., 2009 ).
). et 2010
et 2010 ). Des études menées dans les populations d’enfants au sud de Mexico (Perez-Maldonado et coll., 2006, 2011
). Des études menées dans les populations d’enfants au sud de Mexico (Perez-Maldonado et coll., 2006, 2011 ) montrent une corrélation entre les taux élevés de DDT (et DDE) et l’induction de l’apoptose dans les cellules sanguines mononuclées périphériques. Une relation est également observée avec les dommages à l’ADN. Dans les cultures primaires de cellules de Sertoli, le DDE (de 30 à 70 µM) induit un stress oxydant qui conduit à une activation de la protéine kinase p38 et des voies de l’apoptose (Song et coll., 2011
) montrent une corrélation entre les taux élevés de DDT (et DDE) et l’induction de l’apoptose dans les cellules sanguines mononuclées périphériques. Une relation est également observée avec les dommages à l’ADN. Dans les cultures primaires de cellules de Sertoli, le DDE (de 30 à 70 µM) induit un stress oxydant qui conduit à une activation de la protéine kinase p38 et des voies de l’apoptose (Song et coll., 2011 ). Harada et coll. (2003
). Harada et coll. (2003 ) montrent qu’une exposition au DDT (50 à 500 ppm pendant 4 semaines) chez le rat entraîne un stress oxydant qui pourrait être un élément clé de l’hépatocarcinogenèse.
) montrent qu’une exposition au DDT (50 à 500 ppm pendant 4 semaines) chez le rat entraîne un stress oxydant qui pourrait être un élément clé de l’hépatocarcinogenèse. ). Le DDT à faibles doses (2,5 µg/ml) inhibe in vitro l’activité des macrophages J774A.1 (production de NO., O2., TNFa et iNO synthase) et induit une cytotoxicité (Nunez et coll., 2002
). Le DDT à faibles doses (2,5 µg/ml) inhibe in vitro l’activité des macrophages J774A.1 (production de NO., O2., TNFa et iNO synthase) et induit une cytotoxicité (Nunez et coll., 2002 ). Le DDT module certains composants du système immunitaire, comme la production d’IL-2, jouant un rôle important dans la réponse immunitaire adaptative (Ndebele et coll., 2004
). Le DDT module certains composants du système immunitaire, comme la production d’IL-2, jouant un rôle important dans la réponse immunitaire adaptative (Ndebele et coll., 2004 ). Dans une population professionnellement exposée, les taux sériques de DDT ou de son métabolite le DDE sont corrélés avec une diminution du taux sérique de cytokines de type IL-2 et l’augmentation de cytokines de type IL-4 (Daniel et coll., 2002
). Dans une population professionnellement exposée, les taux sériques de DDT ou de son métabolite le DDE sont corrélés avec une diminution du taux sérique de cytokines de type IL-2 et l’augmentation de cytokines de type IL-4 (Daniel et coll., 2002 ). Le DDT peut affecter la réponse des lymphocytes T et des cellules NK. In vitro, le DDT, comme d’autres organochlorés, diminue, à faible dose (10 µM), la capacité des cellules NK humaines à lyser les cellules tumorales, en diminuant les taux de cytokines qui modulent leur activité cytotoxique (Beach et Whalen, 2006
). Le DDT peut affecter la réponse des lymphocytes T et des cellules NK. In vitro, le DDT, comme d’autres organochlorés, diminue, à faible dose (10 µM), la capacité des cellules NK humaines à lyser les cellules tumorales, en diminuant les taux de cytokines qui modulent leur activité cytotoxique (Beach et Whalen, 2006 ). Dans une étude de population (Schaalan et coll., 2012
). Dans une étude de population (Schaalan et coll., 2012 ), les auteurs montrent que les taux d’organochlorés (dont le DDT) dans le lait maternel sont associés à une augmentation de l’incidence de saignements chez l’enfant ainsi qu’à une diminution de la sécrétion de cytokines de type TNFa et IL-10, soulignant une immunotoxicité des organochlorés présents dans le lait maternel. L’effet immunosuppresseur du DDT pourrait être lié à la fois à son effet sur la structure du macrophage (condensation de l’hétérochromatine, perte des pseudopodes, vacuolisation du cytoplasme) et sur ses fonctions (production de TNFa, d’oxyde nitrique) (Kim et coll., 2004
), les auteurs montrent que les taux d’organochlorés (dont le DDT) dans le lait maternel sont associés à une augmentation de l’incidence de saignements chez l’enfant ainsi qu’à une diminution de la sécrétion de cytokines de type TNFa et IL-10, soulignant une immunotoxicité des organochlorés présents dans le lait maternel. L’effet immunosuppresseur du DDT pourrait être lié à la fois à son effet sur la structure du macrophage (condensation de l’hétérochromatine, perte des pseudopodes, vacuolisation du cytoplasme) et sur ses fonctions (production de TNFa, d’oxyde nitrique) (Kim et coll., 2004 ; Dutta et coll., 2008
; Dutta et coll., 2008 ). De plus, la présence de DDT dans le sérum humain entraîne une surproduction de certains composants du complément (C3b, C3d et C3a) et une diminution de son activité lytique (Dutta et coll., 2008
). De plus, la présence de DDT dans le sérum humain entraîne une surproduction de certains composants du complément (C3b, C3d et C3a) et une diminution de son activité lytique (Dutta et coll., 2008 ). Dans les monocytes humains, le DDE à faibles concentrations (10 µg/ml) induit une réponse pro-inflammatoire ; à plus fortes doses (80 µg/ml), le statut inflammatoire s’accompagne d’une activation des voies extrinsèques et intrinsèques de l’apoptose (Alegria-Torres, 2009
). Dans les monocytes humains, le DDE à faibles concentrations (10 µg/ml) induit une réponse pro-inflammatoire ; à plus fortes doses (80 µg/ml), le statut inflammatoire s’accompagne d’une activation des voies extrinsèques et intrinsèques de l’apoptose (Alegria-Torres, 2009 ).
). ). De plus fortes doses de DDT conduisent à un effet opposé. Il est connu que ce composé induit la production de cytokines pro-inflammatoires (Kim et coll., 2004
). De plus fortes doses de DDT conduisent à un effet opposé. Il est connu que ce composé induit la production de cytokines pro-inflammatoires (Kim et coll., 2004 ) dans les macrophages (effet hormétique : effet inverse observé entre faibles et fortes doses). La production de cytokines, induite après exposition au DDT, pourrait alors diminuer l’expression de PXR et conduire à une moindre activation des cytochromes P450 (Medina-Diaz et coll., 2007
) dans les macrophages (effet hormétique : effet inverse observé entre faibles et fortes doses). La production de cytokines, induite après exposition au DDT, pourrait alors diminuer l’expression de PXR et conduire à une moindre activation des cytochromes P450 (Medina-Diaz et coll., 2007 ). L’interaction du DDT avec les cytochromes impliqués dans la détoxication de nombreux médicaments peut ainsi interférer avec leur efficacité. Cet effet hormétique a été observé pour le DDT dans l’hépatocarcinogenèse (activé par les faibles doses et inhibé par les fortes doses) (Shutoh et coll., 2010). L’exposition de rats à de très faibles doses de DDT (0,06 mg/kg/j) pendant 4 semaines conduit à de faibles taux de stress oxydant dans l’hypothalamus, associés à une méthylation de l’ADN incomplète et à une régulation transcriptionnelle négative de certains gènes (Shutoh et coll., 2010).
). L’interaction du DDT avec les cytochromes impliqués dans la détoxication de nombreux médicaments peut ainsi interférer avec leur efficacité. Cet effet hormétique a été observé pour le DDT dans l’hépatocarcinogenèse (activé par les faibles doses et inhibé par les fortes doses) (Shutoh et coll., 2010). L’exposition de rats à de très faibles doses de DDT (0,06 mg/kg/j) pendant 4 semaines conduit à de faibles taux de stress oxydant dans l’hypothalamus, associés à une méthylation de l’ADN incomplète et à une régulation transcriptionnelle négative de certains gènes (Shutoh et coll., 2010). ) montre que le 2,4-D (acide 2,4-dichlorophénoxyacétique) et le MCPA (acide 4-chloro-2-méthylphénoxyacétique) n’induisent pas de dommages à l’ADN dans les lymphocytes périphériques chez l’animal après administration par voie intra-gastrique (100 mg/kg pendant deux semaines) ou in vitro dans les cellules CHO (exposition une heure à 10 µM). Une administration orale chez l’animal de 2,4-D à une dose élevée (LD16) exerce un effet immuno-suppresseur (Imel’baeva et coll., 2000
) montre que le 2,4-D (acide 2,4-dichlorophénoxyacétique) et le MCPA (acide 4-chloro-2-méthylphénoxyacétique) n’induisent pas de dommages à l’ADN dans les lymphocytes périphériques chez l’animal après administration par voie intra-gastrique (100 mg/kg pendant deux semaines) ou in vitro dans les cellules CHO (exposition une heure à 10 µM). Une administration orale chez l’animal de 2,4-D à une dose élevée (LD16) exerce un effet immuno-suppresseur (Imel’baeva et coll., 2000 ). Le dicamba (acide 3,6-dichloro-2-méthoxybenzoique) et son produit commercial aux doses de 200 µg/ml (environ 1M) induisent une génotoxicité dans les lymphocytes humains en culture (Filkowski et coll., 2003
). Le dicamba (acide 3,6-dichloro-2-méthoxybenzoique) et son produit commercial aux doses de 200 µg/ml (environ 1M) induisent une génotoxicité dans les lymphocytes humains en culture (Filkowski et coll., 2003 ).
). ).
). ). Il existe très peu d’études concernant l’impact des phénoxyherbicides au niveau cellulaire et moléculaire.
). Il existe très peu d’études concernant l’impact des phénoxyherbicides au niveau cellulaire et moléculaire. ) montrent que le DBCP (1,2-dibromo-3-chloropropane), un nématocide, induit des aberrations chromosomiques dans les cellules de la moelle osseuse, des mutations dominantes létales chez les rats germ-free. En revanche, cet effet ne serait pas reproductible chez la souris (Generoso et coll., 1985
) montrent que le DBCP (1,2-dibromo-3-chloropropane), un nématocide, induit des aberrations chromosomiques dans les cellules de la moelle osseuse, des mutations dominantes létales chez les rats germ-free. En revanche, cet effet ne serait pas reproductible chez la souris (Generoso et coll., 1985 ). Le DBCP (5 mg/kg) induit des cassures simples brins d’ADN dans le foie et les reins des rats traités, 20 min et 4 h après une injection intra-péritonéale (Brunborg et coll., 1996
). Le DBCP (5 mg/kg) induit des cassures simples brins d’ADN dans le foie et les reins des rats traités, 20 min et 4 h après une injection intra-péritonéale (Brunborg et coll., 1996 ). Une dose de 10 mg entraîne l’apparition de dommages à l’ADN dans tous les organes excepté la moelle osseuse et le colon. Des doses plus importantes (40 mg/kg) induisent des cassures simples brins dans la moelle osseuse et le colon (Brunborg et coll., 1996
). Une dose de 10 mg entraîne l’apparition de dommages à l’ADN dans tous les organes excepté la moelle osseuse et le colon. Des doses plus importantes (40 mg/kg) induisent des cassures simples brins dans la moelle osseuse et le colon (Brunborg et coll., 1996 ). Les dommages à l’ADN ont été observés dans les hépatocytes isolés de rat à de faibles concentrations (5 à 10 µM) (Soderlund et coll., 1991
). Les dommages à l’ADN ont été observés dans les hépatocytes isolés de rat à de faibles concentrations (5 à 10 µM) (Soderlund et coll., 1991 ). Chez le rat, le DBCP (4 doses de 87 mg/kg) pendant 4 jours induit l’apoptose dans les cellules de Sertoli, ce qui conduit à une perte de leur capacité de différenciation (Meistrich et coll., 2003
). Chez le rat, le DBCP (4 doses de 87 mg/kg) pendant 4 jours induit l’apoptose dans les cellules de Sertoli, ce qui conduit à une perte de leur capacité de différenciation (Meistrich et coll., 2003 ). L’effet pro-apoptotique du DBCP a été montré sur d’autres types cellulaires (HL-60, LLCPK1) à des doses élevées allant de 30 à 300 µM (Wiger et coll., 1998
). L’effet pro-apoptotique du DBCP a été montré sur d’autres types cellulaires (HL-60, LLCPK1) à des doses élevées allant de 30 à 300 µM (Wiger et coll., 1998 ). Le DBCP apparaît clairement comme un agent tumorigène dans différentes espèces quelle que soit la voie d’exposition (Clark et Snedeker, 2005
). Le DBCP apparaît clairement comme un agent tumorigène dans différentes espèces quelle que soit la voie d’exposition (Clark et Snedeker, 2005 ). Son effet mutagène est montré dans différentes études (Ryu et coll., 2002
). Son effet mutagène est montré dans différentes études (Ryu et coll., 2002 ; Clark et Snedeker, 2005
; Clark et Snedeker, 2005 ).
). ). Les OP inhibent l’acétylcholine estérase, enzyme qui hydrolyse l’acétylcholine, neurotransmetteur majoritaire du système nerveux central et périphérique. L’inhibition de cette enzyme entraîne une accumulation d’acétylcholine dans les synapses, ce qui a des conséquences graves sur la transmission synaptique.
). Les OP inhibent l’acétylcholine estérase, enzyme qui hydrolyse l’acétylcholine, neurotransmetteur majoritaire du système nerveux central et périphérique. L’inhibition de cette enzyme entraîne une accumulation d’acétylcholine dans les synapses, ce qui a des conséquences graves sur la transmission synaptique. ; Parent-Massin et coll., 1993
; Parent-Massin et coll., 1993 ; Nakadai et coll., 2006
; Nakadai et coll., 2006 ). Les personnes exposées au chlorpyrifos à la maison ou au travail présentent des changements de plusieurs paramètres immunologiques (Thrasher et coll., 2002
). Les personnes exposées au chlorpyrifos à la maison ou au travail présentent des changements de plusieurs paramètres immunologiques (Thrasher et coll., 2002 ). La capacité des organophosphorés à perturber l’immunité résulterait d’effets sur des cibles cellulaires précises régulant le processus d’immunité au niveau de :
). La capacité des organophosphorés à perturber l’immunité résulterait d’effets sur des cibles cellulaires précises régulant le processus d’immunité au niveau de : et 2009
et 2009 ). Les composés organophosphorés sont des composés pro-oxydants capables d’induire in vivo une augmentation de la peroxydation lipidique, d’induire la production d’espèces radicalaires, de perturber le fonctionnement mitochondrial, de diminuer l’activité des enzymes impliquées dans la régulation du stress oxydant (Saulsbury et coll., 2009
). Les composés organophosphorés sont des composés pro-oxydants capables d’induire in vivo une augmentation de la peroxydation lipidique, d’induire la production d’espèces radicalaires, de perturber le fonctionnement mitochondrial, de diminuer l’activité des enzymes impliquées dans la régulation du stress oxydant (Saulsbury et coll., 2009 ; Ambali et coll., 2010
; Ambali et coll., 2010 ; Gupta et coll., 2010
; Gupta et coll., 2010 ; Mansour et Mossa, 2010
; Mansour et Mossa, 2010 ; Slotkin et Seidler, 2010
; Slotkin et Seidler, 2010 ; Cole et coll., 2011
; Cole et coll., 2011 ; Saxena et coll., 2011
; Saxena et coll., 2011 ). Certains auteurs ont observé des effets différents sur le statut oxydo-réducteur selon la dose (Mandal et Das, 2011
). Certains auteurs ont observé des effets différents sur le statut oxydo-réducteur selon la dose (Mandal et Das, 2011 ). Ainsi, chez le rat albinos exposé à des doses de 5 à 10 mg/kg, le taux de péroxydation lipidique est élevé et l’activité des enzymes anti-oxydantes est réduite ; le contraire est observé à plus forte dose (20 à 30 mg/kg). Des effets sur des cibles spécifiques contrôlant l’entrée de cystéine dans la cellule via le transporteur cystine/glutamate ont été rapportés (Slotkin et coll., 2010
). Ainsi, chez le rat albinos exposé à des doses de 5 à 10 mg/kg, le taux de péroxydation lipidique est élevé et l’activité des enzymes anti-oxydantes est réduite ; le contraire est observé à plus forte dose (20 à 30 mg/kg). Des effets sur des cibles spécifiques contrôlant l’entrée de cystéine dans la cellule via le transporteur cystine/glutamate ont été rapportés (Slotkin et coll., 2010 ). Le chlorpyrifos est un agent pro-apoptotique, effet référencé dans diverses études in vitro et in vivo, en raison de son pouvoir pro-oxydant. L’activation de caspases (caspase 3) par le chlorpyrifos est controversée (Li et coll., 2007
). Le chlorpyrifos est un agent pro-apoptotique, effet référencé dans diverses études in vitro et in vivo, en raison de son pouvoir pro-oxydant. L’activation de caspases (caspase 3) par le chlorpyrifos est controversée (Li et coll., 2007 et 2009
et 2009 ; Das et coll., 2008
; Das et coll., 2008 ; Saulsbury et coll., 2008
; Saulsbury et coll., 2008 ). Ce composé active les voies de type MAP kinase (ERK, p38 JNK) ce qui conduirait à l’induction de l’apoptose. Il régule l’expression de certains facteurs de transcription (SP1, AP-1) (Crumpton et coll., 2000
). Ce composé active les voies de type MAP kinase (ERK, p38 JNK) ce qui conduirait à l’induction de l’apoptose. Il régule l’expression de certains facteurs de transcription (SP1, AP-1) (Crumpton et coll., 2000 ) et la voie de signalisation liée à l’AMP cyclique (adénylate cyclase, PDE et PKA) (Adigun et coll., 2010
) et la voie de signalisation liée à l’AMP cyclique (adénylate cyclase, PDE et PKA) (Adigun et coll., 2010 ). Des modulations de l’expression de cfos et de p53 dans certaines zones du cerveau après exposition expérimentale des animaux au chlorpyrifos ont aussi été observées (Dam et coll., 2003
). Des modulations de l’expression de cfos et de p53 dans certaines zones du cerveau après exposition expérimentale des animaux au chlorpyrifos ont aussi été observées (Dam et coll., 2003 ).
). ; Hreljac et Filipic, 2009
; Hreljac et Filipic, 2009 ; Ukpebor et coll., 2011
; Ukpebor et coll., 2011 ). Des effets génotoxiques (micronoyaux, coupures simples et doubles brins, échanges de chromatides) sont observés in vivo (larve de xénope, poisson, souris) (Amer et Fahmy, 1982
). Des effets génotoxiques (micronoyaux, coupures simples et doubles brins, échanges de chromatides) sont observés in vivo (larve de xénope, poisson, souris) (Amer et Fahmy, 1982 ; Shadnia et coll., 2005
; Shadnia et coll., 2005 ; Ali et coll., 2008
; Ali et coll., 2008 et 2009
et 2009 ; Rahman et coll., 2009
; Rahman et coll., 2009 ) et in vitro (lymphocytes de sang périphérique humain, lignée cellulaire NK, hépatocytes de souris) (Muscarella et coll., 1984
) et in vitro (lymphocytes de sang périphérique humain, lignée cellulaire NK, hépatocytes de souris) (Muscarella et coll., 1984 ; Vindas et coll., 2004
; Vindas et coll., 2004 ; Das et coll., 2006
; Das et coll., 2006 ; Li et coll., 2007
; Li et coll., 2007 ; Cui et coll., 2011
; Cui et coll., 2011 ; Khanna et coll., 2011
; Khanna et coll., 2011 ). La génotoxicité des OP pourrait être liée à leur propriété pro-oxydante (Shadnia et coll., 2005
). La génotoxicité des OP pourrait être liée à leur propriété pro-oxydante (Shadnia et coll., 2005 ). Chez l’homme, le polymorphisme du gène codant pour l’enzyme paraoxonase I (PON1) impliquée dans la détoxication des OP est en relation avec l’activité génotoxique de ces composés (Singh et coll., 2011
). Chez l’homme, le polymorphisme du gène codant pour l’enzyme paraoxonase I (PON1) impliquée dans la détoxication des OP est en relation avec l’activité génotoxique de ces composés (Singh et coll., 2011 ). Le polymorphisme génétique de PON1 peut intervenir dans la susceptibilité au stress oxydant associé aux organophosphorés (Huen et coll., 2010
). Le polymorphisme génétique de PON1 peut intervenir dans la susceptibilité au stress oxydant associé aux organophosphorés (Huen et coll., 2010 ).
). ). Trois études rapportent une génotoxicité de ces deux composés (Gentile et coll., 1982
). Trois études rapportent une génotoxicité de ces deux composés (Gentile et coll., 1982 ; Wu et coll., 2011
; Wu et coll., 2011 ; Barry et coll., 2012
; Barry et coll., 2012 ). Un effet pro-apoptotique du terbufos a été démontré dans les cellules HepG2 (Wu et coll., 2011
). Un effet pro-apoptotique du terbufos a été démontré dans les cellules HepG2 (Wu et coll., 2011 ) et les blastocytes (Greenlee et coll., 2004
) et les blastocytes (Greenlee et coll., 2004 ). Du point de vue mécanistique les données bibliographiques sont très insuffisantes pour apporter une quelconque conclusion sur le mécanisme d’action de ces composés.
). Du point de vue mécanistique les données bibliographiques sont très insuffisantes pour apporter une quelconque conclusion sur le mécanisme d’action de ces composés. ; Amer et coll., 2002
; Amer et coll., 2002 ; Moore et coll., 2011
; Moore et coll., 2011 ; Giri et coll., 2011
; Giri et coll., 2011 ) à des doses de 2,5 à 80 mg/kg de poids corporel via des injections intra-péritonéales (Amer et coll., 1996
) à des doses de 2,5 à 80 mg/kg de poids corporel via des injections intra-péritonéales (Amer et coll., 1996 ; Moore et coll., 2011
; Moore et coll., 2011 ; Giri et coll., 2011
; Giri et coll., 2011 ), l’alimentation (Amer et coll., 2002
), l’alimentation (Amer et coll., 2002 ), l’intubation (0,1 % de la dose commercialisée ; Hoda et coll., 1991
), l’intubation (0,1 % de la dose commercialisée ; Hoda et coll., 1991 ) ou une application cutanée (Salvadori et coll., 1988
) ou une application cutanée (Salvadori et coll., 1988 ) ; dans ce dernier cas les doses appliquées étaient très élevée 500 à 2 000 mg/kg. En revanche, une autre étude chez le rat ne montre pas de dommage à l’ADN dans les cellules de la moelle osseuse suite à l’exposition au malathion 8 ppm dans l’eau de boisson (Degraeve et coll., 1984
) ; dans ce dernier cas les doses appliquées étaient très élevée 500 à 2 000 mg/kg. En revanche, une autre étude chez le rat ne montre pas de dommage à l’ADN dans les cellules de la moelle osseuse suite à l’exposition au malathion 8 ppm dans l’eau de boisson (Degraeve et coll., 1984 ). Reus et coll. (2008
). Reus et coll. (2008 ) montrent que l’administration intra-péritonéale de malathion à des doses 100 fois supérieures à la DJA (100 et 150 mg/kg) chez le rat, pendant 1 ou 28 jours entraîne des dommages à l’ADN dans le sang périphérique et l’hippocampe (Reus et coll., 2008
) montrent que l’administration intra-péritonéale de malathion à des doses 100 fois supérieures à la DJA (100 et 150 mg/kg) chez le rat, pendant 1 ou 28 jours entraîne des dommages à l’ADN dans le sang périphérique et l’hippocampe (Reus et coll., 2008 ).
). ). Des résultats identiques ont été observés dans les leucocytes périphériques humains traités pendant 24 et 48 heures avec des doses de 66 nM à 66 µM (Balaji et coll., 1993
). Des résultats identiques ont été observés dans les leucocytes périphériques humains traités pendant 24 et 48 heures avec des doses de 66 nM à 66 µM (Balaji et coll., 1993 ). Cependant, certains auteurs n’observent qu’un faible potentiel du malathion à induire des dommages à l’ADN dans les lymphocytes humains exposés 1 heure à des concentrations de 25, 75, et 200 µM (Blasiak et coll., 1999
). Cependant, certains auteurs n’observent qu’un faible potentiel du malathion à induire des dommages à l’ADN dans les lymphocytes humains exposés 1 heure à des concentrations de 25, 75, et 200 µM (Blasiak et coll., 1999 ) ou à des concentrations de 5 à 100 µg/ml (Titenko-Holland et coll., 1997
) ou à des concentrations de 5 à 100 µg/ml (Titenko-Holland et coll., 1997 ). Le métabolite du malathion, le malaoxon semble plus efficace dans ce modèle (Blasiak et coll., 1999
). Le métabolite du malathion, le malaoxon semble plus efficace dans ce modèle (Blasiak et coll., 1999 ). En revanche, celui-ci n’exerce aucune activité génotoxique dans les cellules humaines placentaires contrairement à la molécule mère (Galantai et coll., 2011
). En revanche, celui-ci n’exerce aucune activité génotoxique dans les cellules humaines placentaires contrairement à la molécule mère (Galantai et coll., 2011 ). En 1993, Flessel et coll. (1993
). En 1993, Flessel et coll. (1993 ) rapportent que les tests de génotoxicité sont positifs lorsqu’on utilise le malathion de grade technique ou commercial ou son métabolite mais que le malathion pur n’exerce qu’un très faible effet génotoxique. L’exposition de cellules de moelle osseuse de hamster au malathion à des doses DL50/2 /5 ou /10 n’induit que de faibles effets clastogéniques (Dzwonkowska et coll., 1986
) rapportent que les tests de génotoxicité sont positifs lorsqu’on utilise le malathion de grade technique ou commercial ou son métabolite mais que le malathion pur n’exerce qu’un très faible effet génotoxique. L’exposition de cellules de moelle osseuse de hamster au malathion à des doses DL50/2 /5 ou /10 n’induit que de faibles effets clastogéniques (Dzwonkowska et coll., 1986 ). In vitro, l’exposition de cellules de moelle osseuse humaine au malaoxon entraîne une diminution de la capacité de différenciation des progéniteurs vers la lignée érythrocytaire et granulo-monocytaire (1 nM à 0,1 µM) (Gallicchio et coll., 1987
). In vitro, l’exposition de cellules de moelle osseuse humaine au malaoxon entraîne une diminution de la capacité de différenciation des progéniteurs vers la lignée érythrocytaire et granulo-monocytaire (1 nM à 0,1 µM) (Gallicchio et coll., 1987 ).
). ) et altérer in vitro leur production de nitrite, de TNFα et la peroxydation des lipides (Ayub et coll., 2003
) et altérer in vitro leur production de nitrite, de TNFα et la peroxydation des lipides (Ayub et coll., 2003 ). L’exposition d’animaux par voie orale au malathion peut faire varier la réponse humorale (Banerjee et coll., 1998
). L’exposition d’animaux par voie orale au malathion peut faire varier la réponse humorale (Banerjee et coll., 1998 ; Johnson et coll., 2002
; Johnson et coll., 2002 ), cependant l’exposition par voie cutanée chez la souris ne modifie pas l’immunité (Relford et coll., 1989
), cependant l’exposition par voie cutanée chez la souris ne modifie pas l’immunité (Relford et coll., 1989 ).
). ; Lu et coll., 2012
; Lu et coll., 2012 ).
). ; Aboul-Soud et coll., 2011
; Aboul-Soud et coll., 2011 ). L’exposition de rat au malathion à une dose équivalente à la DL50 entraîne au bout de 60 jours des dommages à l’ADN associés à une augmentation de la production d’oxygène radicalaire dans différents tissus (Ojha et coll., 2011
). L’exposition de rat au malathion à une dose équivalente à la DL50 entraîne au bout de 60 jours des dommages à l’ADN associés à une augmentation de la production d’oxygène radicalaire dans différents tissus (Ojha et coll., 2011 ). In vivo (Aboul-Soud et coll., 2011
). In vivo (Aboul-Soud et coll., 2011 ) et in vitro, le malathion apparaît comme un agent pro-apoptotique dans les splénocytes murins (Battaglia et coll., 2010
) et in vitro, le malathion apparaît comme un agent pro-apoptotique dans les splénocytes murins (Battaglia et coll., 2010 ), dans les cellules mononuclées de sang périphérique (Ahmed et coll., 2009
), dans les cellules mononuclées de sang périphérique (Ahmed et coll., 2009 ), dans les fibroblastes (Masoud et coll., 2003
), dans les fibroblastes (Masoud et coll., 2003 ) et dans les cellules d’hépatocarcinome HepG2 (Moore et coll., 2010
) et dans les cellules d’hépatocarcinome HepG2 (Moore et coll., 2010 ).
). ). Son activité pro-oxydante n’est pas forcément corrélée avec une atteinte à l’ADN, la génotoxicité du glyphosate semble controversée (pour une revue voir Williams et coll., 2000
). Son activité pro-oxydante n’est pas forcément corrélée avec une atteinte à l’ADN, la génotoxicité du glyphosate semble controversée (pour une revue voir Williams et coll., 2000 ). Une injection unique par voie intra-péritonéale de doses comparables voire plus faibles (25 mg/kg), induit chez la souris des cassures chromosomiques et des micronoyaux dans la moelle osseuse ainsi qu’une certaine cytotoxicité (Prasad et coll., 2009
). Une injection unique par voie intra-péritonéale de doses comparables voire plus faibles (25 mg/kg), induit chez la souris des cassures chromosomiques et des micronoyaux dans la moelle osseuse ainsi qu’une certaine cytotoxicité (Prasad et coll., 2009 ). Le glyphosate aux doses de 1 à 7 mM est cytotoxique pour les cellules humaines (GM38 et HT1080) (Monroy et coll., 2005
). Le glyphosate aux doses de 1 à 7 mM est cytotoxique pour les cellules humaines (GM38 et HT1080) (Monroy et coll., 2005 ). Dans d’autres modèles cellulaires, le glyphosate ne montre pas d’effet génotoxique (Li et Long, 1988
). Dans d’autres modèles cellulaires, le glyphosate ne montre pas d’effet génotoxique (Li et Long, 1988 ; Rank et coll., 1993
; Rank et coll., 1993 ; Dimitrov et coll., 2006
; Dimitrov et coll., 2006 ). Ces effets controversés peuvent être dus aux tests utilisés (Alvarez-Moya et coll., 2011
). Ces effets controversés peuvent être dus aux tests utilisés (Alvarez-Moya et coll., 2011 ). De plus, la génotoxicité observée dans certaines études in vitro ou in vivo correspond à des doses assez élevées (3 à 7 mM, 580 mg/ml -3,5 mM- et 400 mg/kg
). De plus, la génotoxicité observée dans certaines études in vitro ou in vivo correspond à des doses assez élevées (3 à 7 mM, 580 mg/ml -3,5 mM- et 400 mg/kg  ; Mladinic et coll., 2009
; Mladinic et coll., 2009 ).
). ; Dimitrov et coll., 2006
; Dimitrov et coll., 2006 ; Heydens et coll., 2008
; Heydens et coll., 2008 ; Gasnier et coll., 2009
; Gasnier et coll., 2009 ). Des effets génotoxiques de différentes formulations sont rapportés à des concentrations de formulation correspondant à des doses résiduelles de 120 nM de glyphosate seul. Le Round up, une des formulations la plus testée, exerce des effets génotoxiques dans les globules rouges de caïman après exposition de l’œuf (50 à 1 750 µg ou 10 µM/œuf) (Poletta et coll., 2009
). Des effets génotoxiques de différentes formulations sont rapportés à des concentrations de formulation correspondant à des doses résiduelles de 120 nM de glyphosate seul. Le Round up, une des formulations la plus testée, exerce des effets génotoxiques dans les globules rouges de caïman après exposition de l’œuf (50 à 1 750 µg ou 10 µM/œuf) (Poletta et coll., 2009 ). L’addition de Round up dans les cellules d’hépatome de rats à des doses allant de 1 à 10 mM induit des perturbations mitochondriales (membrane et activité de la chaîne respiratoire) et nucléaires suggérant une diminution de l’activité transcriptionnelle (Malatesta et coll., 2008
). L’addition de Round up dans les cellules d’hépatome de rats à des doses allant de 1 à 10 mM induit des perturbations mitochondriales (membrane et activité de la chaîne respiratoire) et nucléaires suggérant une diminution de l’activité transcriptionnelle (Malatesta et coll., 2008 ). Dans le même modèle cellulaire (Calvacante et coll., 2008
). Dans le même modèle cellulaire (Calvacante et coll., 2008 ), le métabolite du glyphosate, l’acide aminoéthylphosphonique aurait un potentiel génotoxique dans la lignée cellulaire HepG2 exposées à 2,5 - 7,5 mM, pendant 4 heures ou dans les lymphocytes de souris après exposition in vivo 48 heures aux doses de 200- 400 mg/kg.
), le métabolite du glyphosate, l’acide aminoéthylphosphonique aurait un potentiel génotoxique dans la lignée cellulaire HepG2 exposées à 2,5 - 7,5 mM, pendant 4 heures ou dans les lymphocytes de souris après exposition in vivo 48 heures aux doses de 200- 400 mg/kg. ).
). ) Des effets immunosuppresseurs sont observés dans les cultures primaires de lymphocytes humains uniquement aux doses de 1 mM (Nakashima et coll., 2002
) Des effets immunosuppresseurs sont observés dans les cultures primaires de lymphocytes humains uniquement aux doses de 1 mM (Nakashima et coll., 2002 ).
). ).
). ; Kligerman et coll., 2000
; Kligerman et coll., 2000 ). En revanche, de nombreuses études démontrent un impact des triazines sur l’immunité et la myélopoïèse. L’exposition expérimentale des animaux à l’atrazine ou la simazine modifierait la réponse humorale et cellulaire, exercerait un effet immunosuppresseur, diminuerait les capacités cytotoxiques des cellules Natural killer (NK), pourrait perturber la prolifération et la distribution des lymphocytes et la production de cytokines et diminuer la capacité de résistance de l’hôte au développement de mélanome dans le test de contaminations avec des cellules de mélanome B16F10 (Fournier et coll., 1992
). En revanche, de nombreuses études démontrent un impact des triazines sur l’immunité et la myélopoïèse. L’exposition expérimentale des animaux à l’atrazine ou la simazine modifierait la réponse humorale et cellulaire, exercerait un effet immunosuppresseur, diminuerait les capacités cytotoxiques des cellules Natural killer (NK), pourrait perturber la prolifération et la distribution des lymphocytes et la production de cytokines et diminuer la capacité de résistance de l’hôte au développement de mélanome dans le test de contaminations avec des cellules de mélanome B16F10 (Fournier et coll., 1992 ; Rooney et coll., 2003
; Rooney et coll., 2003 ; Filipov et coll., 2005
; Filipov et coll., 2005 ; Karrow et coll., 2005
; Karrow et coll., 2005 ; Brodkin et coll., 2007
; Brodkin et coll., 2007 ). Chez le poisson, l’administration d’atrazine au cours du développement embryonnaire (0,1 à 12,5 µg/l) pendant 3 jours conduit à une perturbation du système immunitaire avec une augmentation du recrutement des phagocytes et un impact sur l’expression de l’interleukine IL-1b (Jin et coll., 2010a
). Chez le poisson, l’administration d’atrazine au cours du développement embryonnaire (0,1 à 12,5 µg/l) pendant 3 jours conduit à une perturbation du système immunitaire avec une augmentation du recrutement des phagocytes et un impact sur l’expression de l’interleukine IL-1b (Jin et coll., 2010a ).
). ). L’atrazine à 10 µM diminue les capacités cytotoxiques des cellules NK sur les cellules tumorales (Whalen et coll., 2003
). L’atrazine à 10 µM diminue les capacités cytotoxiques des cellules NK sur les cellules tumorales (Whalen et coll., 2003 ). À 30 µM, elle perturbe la libération des granules lytiques dans les lignées cellulaires NK (Rowe et coll., 2007
). À 30 µM, elle perturbe la libération des granules lytiques dans les lignées cellulaires NK (Rowe et coll., 2007 ). De même, la simazine affecte l’activité tumoricide et anti-virale des macrophages murins en diminuant la production d’oxyde nitrique et de TNFa (Kim et coll., 2002
). De même, la simazine affecte l’activité tumoricide et anti-virale des macrophages murins en diminuant la production d’oxyde nitrique et de TNFa (Kim et coll., 2002 ). La simazine (mais non l’atrazine) perturbe l’activation de NFkB induite par le LPS (lipopolysaccharides) dans des lignées transfectées avec un gène reporter stable NFkB (Igarashi et coll., 2006
). La simazine (mais non l’atrazine) perturbe l’activation de NFkB induite par le LPS (lipopolysaccharides) dans des lignées transfectées avec un gène reporter stable NFkB (Igarashi et coll., 2006 ). Même à de faibles doses (1 µM) l’atrazine peut exercer un effet immunotoxique en inhibant la maturation de cellules dendritiques (Pinchuk et coll., 2007
). Même à de faibles doses (1 µM) l’atrazine peut exercer un effet immunotoxique en inhibant la maturation de cellules dendritiques (Pinchuk et coll., 2007 ), via l’élimination des molécules du complexe majeur d’histocompatibilité (MHC I) de la surface de ces cellules, augmentant ainsi la vulnérabilité du système immunitaire. Dans les cellules nucléées normales humaines, l’atrazine (0,03 ; 0,3 et 3 µM) ou la simazine (0,01 ; 0,1 et 1 µM) perturbent la production de cytokines (Hooghe et coll., 2000
), via l’élimination des molécules du complexe majeur d’histocompatibilité (MHC I) de la surface de ces cellules, augmentant ainsi la vulnérabilité du système immunitaire. Dans les cellules nucléées normales humaines, l’atrazine (0,03 ; 0,3 et 3 µM) ou la simazine (0,01 ; 0,1 et 1 µM) perturbent la production de cytokines (Hooghe et coll., 2000 ; Pruett et coll., 2006
; Pruett et coll., 2006 ).
). ). In vivo, l’administration de 59 mg/kg d’atrazine (par voie intra-péritonéale) entraîne une perturbation de l’hématopoïèse centrale après 10 jours de traitement (Mencoboni et coll., 1992
). In vivo, l’administration de 59 mg/kg d’atrazine (par voie intra-péritonéale) entraîne une perturbation de l’hématopoïèse centrale après 10 jours de traitement (Mencoboni et coll., 1992 ). Des effets comparables sont observés avec la phénylhydrazine hydrochloride à 50 mg/kg pendant 9 jours (Elorza et coll., 2008
). Des effets comparables sont observés avec la phénylhydrazine hydrochloride à 50 mg/kg pendant 9 jours (Elorza et coll., 2008 ). Chez le rat exposé à l’atrazine, il a été rapporté des activités hématotoxiques (Abarikwu et coll., 2010
). Chez le rat exposé à l’atrazine, il a été rapporté des activités hématotoxiques (Abarikwu et coll., 2010 ). Les triazines semblent modifier l’activité ou l’expression de certaines protéines clés des voies de signalisation cellulaire impliquées dans le contrôle de la prolifération et de la survie cellulaire (AKT, PI-3 K, ERK, bcl2). Lim (2009
). Les triazines semblent modifier l’activité ou l’expression de certaines protéines clés des voies de signalisation cellulaire impliquées dans le contrôle de la prolifération et de la survie cellulaire (AKT, PI-3 K, ERK, bcl2). Lim (2009 ) montre que l’atrazine à de très faibles doses (100 ng/ml) induit 24 heures après l’exposition de cellules de muscle lisse, une diminution de la phosphorylation d’AKT, une protéine clé de la régulation de la prolifération souvent activée dans les cellules tumorales. Dans les cellules ovariennes humaines, l’atrazine (1 µM) active la voie dépendante de l’ERK (Albanito et coll., 2008
) montre que l’atrazine à de très faibles doses (100 ng/ml) induit 24 heures après l’exposition de cellules de muscle lisse, une diminution de la phosphorylation d’AKT, une protéine clé de la régulation de la prolifération souvent activée dans les cellules tumorales. Dans les cellules ovariennes humaines, l’atrazine (1 µM) active la voie dépendante de l’ERK (Albanito et coll., 2008 ).
). ; Singh et coll., 2010
; Singh et coll., 2010 ) et dans les érythrocytes (Bhatti et coll., 2011
) et dans les érythrocytes (Bhatti et coll., 2011 ). Les effets pro-oxydants de l’atrazine sont modulables avec une exposition concomitante de sélénium (Adesiyan et coll., 2011
). Les effets pro-oxydants de l’atrazine sont modulables avec une exposition concomitante de sélénium (Adesiyan et coll., 2011 ). Le stress oxydant lié à l’administration d’atrazine pendant les 3 premiers jours du développement embryonnaire chez le poisson zèbre serait à l’origine de la perturbation du système immunitaire inné ou non spécifique (Jin et coll., 2010a
). Le stress oxydant lié à l’administration d’atrazine pendant les 3 premiers jours du développement embryonnaire chez le poisson zèbre serait à l’origine de la perturbation du système immunitaire inné ou non spécifique (Jin et coll., 2010a ). Lasserre et coll. (2009
). Lasserre et coll. (2009 ) montrent que le traitement des cellules MCF7 pendant 24 heures avec 100 µg/l (0,5 µM) d’atrazine entraîne une diminution de l’expression de certaines protéines y compris les enzymes régulant le statut oxydo-réducteur.
) montrent que le traitement des cellules MCF7 pendant 24 heures avec 100 µg/l (0,5 µM) d’atrazine entraîne une diminution de l’expression de certaines protéines y compris les enzymes régulant le statut oxydo-réducteur. ). Des dommages à l’ADN dans les cellules en culture exposées à l’atrazine ont été rapportés (Pino et coll., 1988
). Des dommages à l’ADN dans les cellules en culture exposées à l’atrazine ont été rapportés (Pino et coll., 1988 ; Ribas et coll., 1995
; Ribas et coll., 1995 ; Taets et coll., 1998
; Taets et coll., 1998 , Manske et coll., 2004
, Manske et coll., 2004 ).
). et 2005
et 2005 ). L’application quotidienne d’une solution allant de 0,5 à 5 µM (environ 100 mg/jour/kg poids corporel) pendant 10 à 30 jours sur la région dorsale de souris immuno-sensibles (souche C57BL6/N) conduit à une baisse de la réponse des macrophages spléniques et de la production d’anticorps (Punareewattana et coll., 2001
). L’application quotidienne d’une solution allant de 0,5 à 5 µM (environ 100 mg/jour/kg poids corporel) pendant 10 à 30 jours sur la région dorsale de souris immuno-sensibles (souche C57BL6/N) conduit à une baisse de la réponse des macrophages spléniques et de la production d’anticorps (Punareewattana et coll., 2001 ). L’exposition de rats mâles Wistar pendant 28 jours à la cyperméthrine ou à la perméthrine (à des doses allant de 11 à 120 mg/kg de poids corporel) entraîne respectivement des modifications de certains paramètres sanguins (volume globulaire moyen des globules rouges, hématocrites, taux de globules blancs), une diminution de l’hypersensibilité retardée ou une augmentation d’aberrations chromosomiques dans la moelle osseuse (Institoris et coll., 1999
). L’exposition de rats mâles Wistar pendant 28 jours à la cyperméthrine ou à la perméthrine (à des doses allant de 11 à 120 mg/kg de poids corporel) entraîne respectivement des modifications de certains paramètres sanguins (volume globulaire moyen des globules rouges, hématocrites, taux de globules blancs), une diminution de l’hypersensibilité retardée ou une augmentation d’aberrations chromosomiques dans la moelle osseuse (Institoris et coll., 1999 ).
). ). L’exposition à la perméthrine est notamment associée avec de faibles taux d’expression de la cytokine anti-inflammatoire IL-10 impliquée dans le mécanisme immunitaire de l’allergie.
). L’exposition à la perméthrine est notamment associée avec de faibles taux d’expression de la cytokine anti-inflammatoire IL-10 impliquée dans le mécanisme immunitaire de l’allergie. ), les rats ont été exposés à différentes doses de fenvalérate ou de perméthrine (à des doses dépassant 400 fois la dose journalière admissible). Les résultats montrent que la perméthrine peut induire, sans signe apparent de cytotoxicité, des dommages à l’ADN dans les cellules sexuelles quelle que soit la voie d’exposition (intra-péritonéale ou per os) et affecte l’ADN des cellules de la moelle osseuse uniquement lors d’une exposition orale. En revanche, l’exposition au fenvalérate n’induit pas de génotoxicité, mais ce composé apparaît cytotoxique sur les cellules sexuelles et de la moelle osseuse aux doses testées, quelle que soit la voie d’exposition. Les propriétés génotoxiques des pyréthrinoïdes ont été démontrées in vitro à des doses élevées (200 à 1 000 µM) sur les cellules de sang périphérique humain pour la perméthrine (Undeger et Basaran, 2005
), les rats ont été exposés à différentes doses de fenvalérate ou de perméthrine (à des doses dépassant 400 fois la dose journalière admissible). Les résultats montrent que la perméthrine peut induire, sans signe apparent de cytotoxicité, des dommages à l’ADN dans les cellules sexuelles quelle que soit la voie d’exposition (intra-péritonéale ou per os) et affecte l’ADN des cellules de la moelle osseuse uniquement lors d’une exposition orale. En revanche, l’exposition au fenvalérate n’induit pas de génotoxicité, mais ce composé apparaît cytotoxique sur les cellules sexuelles et de la moelle osseuse aux doses testées, quelle que soit la voie d’exposition. Les propriétés génotoxiques des pyréthrinoïdes ont été démontrées in vitro à des doses élevées (200 à 1 000 µM) sur les cellules de sang périphérique humain pour la perméthrine (Undeger et Basaran, 2005 ; Turkez et Togar, 2011
; Turkez et Togar, 2011 ) et la cyperméthrine (Undeger et Basaran, 2005
) et la cyperméthrine (Undeger et Basaran, 2005 ) ainsi que sur les cellules de la muqueuse nasale. In vivo, l’exposition dermique à la perméthrine à 1,3 mg/kg pendant 72 heures n’entraîne pas de dommages à l’ADN estimés par la mesure des bases oxydées (8-Oxo-2’-deoxyguanosine, 8-oxo-dg) dans les urines (Abu-Qare et Abou-Donia, 2000
) ainsi que sur les cellules de la muqueuse nasale. In vivo, l’exposition dermique à la perméthrine à 1,3 mg/kg pendant 72 heures n’entraîne pas de dommages à l’ADN estimés par la mesure des bases oxydées (8-Oxo-2’-deoxyguanosine, 8-oxo-dg) dans les urines (Abu-Qare et Abou-Donia, 2000 ).
). ; Nasuti et coll., 2008). In vivo, l’exposition aux pyréthrinoïdes 150 mg/kg (soit 1/10e de LD50) entraîne une variation du statut oxydoréducteur des cellules sanguines liée à une modification de fluidité membranaire. L’exposition des animaux pendant 60 jours à une dose correspondant au dixième de la DL50 entraîne des dommages à l’ADN dans le striatum. Ces effets sont associés à une inhibition du complexe mitochondrial I due à une baisse de la fluidité membranaire (Falcioni et coll., 2010
; Nasuti et coll., 2008). In vivo, l’exposition aux pyréthrinoïdes 150 mg/kg (soit 1/10e de LD50) entraîne une variation du statut oxydoréducteur des cellules sanguines liée à une modification de fluidité membranaire. L’exposition des animaux pendant 60 jours à une dose correspondant au dixième de la DL50 entraîne des dommages à l’ADN dans le striatum. Ces effets sont associés à une inhibition du complexe mitochondrial I due à une baisse de la fluidité membranaire (Falcioni et coll., 2010 ).
). ). Dans des cellules cancéreuses prostatiques, la perméthrine entraîne l’activation des MAP kinases et de l’activité tyrosine kinase de ERB2 (Tessier et Matsumura, 2001
). Dans des cellules cancéreuses prostatiques, la perméthrine entraîne l’activation des MAP kinases et de l’activité tyrosine kinase de ERB2 (Tessier et Matsumura, 2001 ). Les pyréthrinoïdes inhibent la transduction de signaux dans les lymphocytes humains (STAT 6) (Diel et coll., 2003
). Les pyréthrinoïdes inhibent la transduction de signaux dans les lymphocytes humains (STAT 6) (Diel et coll., 2003 ).
). ; Xu et coll., 2008
; Xu et coll., 2008 ; Zhang et coll., 2008
; Zhang et coll., 2008 ; Jin et coll., 2010b
; Jin et coll., 2010b ) ce qui peut avoir des conséquences sur l’hématopoïèse dont le fonctionnement dépend des activités œstrogéniques environnantes.
) ce qui peut avoir des conséquences sur l’hématopoïèse dont le fonctionnement dépend des activités œstrogéniques environnantes. ) montrent par exemple qu’une seule dose de perméthrine (220 à 1 100 mg/kg) pendant 8 heures inhibe la prolifération des lymphocytes T spléniques et l’apoptose dans les thymocytes.
) montrent par exemple qu’une seule dose de perméthrine (220 à 1 100 mg/kg) pendant 8 heures inhibe la prolifération des lymphocytes T spléniques et l’apoptose dans les thymocytes. ). Dans les cellules humaines lymphoblastoïdes en culture, l’alachlore (40 µg/ml) induit la formation de micronoyaux, d’aberration chromosomiques et des échanges de chromatides sœurs (Ribas et coll., 1995
). Dans les cellules humaines lymphoblastoïdes en culture, l’alachlore (40 µg/ml) induit la formation de micronoyaux, d’aberration chromosomiques et des échanges de chromatides sœurs (Ribas et coll., 1995 , 1996
, 1996 et 1997
et 1997 ; Mattiuzzo et coll., 2006
; Mattiuzzo et coll., 2006 ). Cependant, d’autres études ne rapportent pas d’effet génototoxique pour ce composé (Pinter et coll., 1989
). Cependant, d’autres études ne rapportent pas d’effet génototoxique pour ce composé (Pinter et coll., 1989 ; Gebel et coll., 1997
; Gebel et coll., 1997 ; Wetmore et coll., 1999
; Wetmore et coll., 1999 ; Heydens et coll., 2000
; Heydens et coll., 2000 ).
). ; Shimomura-shimizu et coll., 2005
; Shimomura-shimizu et coll., 2005 ; Ohnishi et coll., 2008
; Ohnishi et coll., 2008 ).
). ) et est aussi un activateur des PXR (Lemaire et coll., 2006
) et est aussi un activateur des PXR (Lemaire et coll., 2006 ).
). ; Burman et coll., 2003
; Burman et coll., 2003 ; Grizard et coll., 2007
; Grizard et coll., 2007 ; Li et coll., 2009
; Li et coll., 2009 ).
). ). Ce sont des composés généralement pro-oxydants. Mais la dérégulation du statut oxydant ne peut pas justifier la spécificité de leur impact sur des pathologies précises ou sur des voies de signalisation particulières.
). Ce sont des composés généralement pro-oxydants. Mais la dérégulation du statut oxydant ne peut pas justifier la spécificité de leur impact sur des pathologies précises ou sur des voies de signalisation particulières.