II. Épidémiologie
2013
7-
Maladie de Hodgkin
Le lymphome de Hodgkin est une prolifération lymphoïde, appartenant à la grande catégorie des lymphomes depuis la nouvelle classification des maladies hématologiques (Jaffe et coll., 2001

). Il représente environ 30 % de tous les lymphomes. Cette hémopathie maligne est caractérisée par la présence d’un petit nombre de cellules tumorales issues des lymphocytes B (cellules de Reed-Sternberg) au sein d’une réaction tissulaire abondante (lymphocytes T, histiocytes, polynucléaires éosinophiles…) pouvant s’accompagner de fibrose. La distribution est bimodale en fonction de l’âge avec un âge médian de 27 ans et 2 pics (adolescents et jeunes adultes : 15-35 ans ; et sujets plus âgés : >50 ans).
Classification et diagnostic
Selon la classification OMS 2008 (Swerdlow et coll., 2008

) on distingue deux catégories : le lymphome hodgkinien nodulaire à prédominance lymphocytaire (5 % des lymphomes hodgkiniens ; lymphome B d’origine folliculaire) et le lymphome hodgkinien classique dont on distingue 4 entités (le sous-type scléronodulaire : 70 % des LH, le sous--type riche en lymphocytes : 5 % des LH, le sous-type à cellularité mixte : 20-25 % des LH et le sous-type en déplétion lymphocytaire : 5 % des LH).
Les circonstances de découverte sont dans 80 % des cas, la présence d’une adénopathie périphérique cervicale, le plus souvent susclaviculaire. Dans 10 % des cas, des adénopathies médiastinales sont découvertes sur une radio thoracique systématique ou à l’occasion de signe de compression (toux, dyspnée , douleur…) ; enfin dans 10 % des cas, les signes d’appel sont une fièvre, des sueurs nocturnes, un amaigrissement. Le diagnostic est histologique. Un bilan d’extension doit être pratiqué pour définir le stade de la maladie. Selon la classification d’Ann Harbor modifiée, le stade I est caractérisé par l’atteinte d’un seul groupe ganglionnaire ; le stade II, atteinte de 2 ou plusieurs groupes ganglionnaires d’un même côté du diaphragme ; le stade III, atteinte sus et sous diaphragmatique et au stade IV, atteinte extraganglionnaire à distance d’une aire ganglionnaire atteinte, foie, moelle… (EMC, 2004

).
Le pronostic dépend principalement du stade, plus que du type histologique : le stade I a un très bon pronostic (80 % de survie à 10 ans) ; le LH nodulaire à prédominance lymphocytaire et le LH classique sous-type scléronodulaire sont de bon pronostic.
Étiologie et facteurs de risque
Un facteur infectieux a été suggéré. Des antécédents de mononucléose infectieuse augmentent de 2 à 13 fois le risque d’apparition. Le génome du virus d’Epstein-Barr (EBV) est retrouvé dans 20 à 80 % des cellules de Sternberg, principalement chez les sujets jeunes, les sous-types à cellularité mixte et les cas familiaux. Le risque de LH est majoré de 5 à 8 fois chez les sujets positifs pour le virus de l’immunodéficience humaine (VIH). Chez ces patients, l’association avec l’EBV est quasi constante (Küppers 2009

). Cependant, l’incidence des lymphomes non hodgkinien est supérieure à celle des LH chez les patients infectés par le VIH.
Aucun autre facteur environnemental n’a été démontré de façon certaine. L’exposition à des pesticides domestiques (insecticides) au cours de la grossesse serait un facteur de risque pour l’enfant (risque doublé), sauf pour le lymphome hodgkinien de type sclérose nodulaire (Rudant et coll., 2007

).
Il existe une prédisposition génétique comme le montre certains cas familiaux (environ 1 % des cas) et un risque augmenté mais inconstant chez les jumeaux homozygotes.
Incidence et mortalité
En France, avec 1 544 cas estimés en 2005, dont 51 % survenant chez l’homme, le lymphome de Hodgkin se situe au 24e rang des cancers. Il représente 0,5 % de l’ensemble des cancers incidents et se situe, par sa fréquence au 20e rang chez l’homme et au 21e rang chez la femme. Les taux d’incidence standardisés (sur l’âge de la population mondiale) sont de 2,3 pour 100 000 personnes-années chez l’homme et de 2,5 pour 100 000 personnes-années chez la femme. Le sex-ratio est de 0,92.
Ce cancer se situe au 24e rang des décès par cancer et représente 0,1 % de l’ensemble des décès par cancer. Les taux de mortalité standardisés (sur l’âge de la population mondiale) sont respectivement de 0,3 pour 100 000 personnes-années et 0,2 pour 100 000 personnes-années chez l’homme et chez la femme.
Les projections 2011 sont données dans le tableau 7.I

.
Tableau 7.I Projection de l’incidence et de la mortalité de la maladie de Hodgkin chez l’homme et chez la femme pour l’année 2011 en France d’après InVS et InCA, 2011
|
Homme
|
Femme
|
|
Incidence
|
Mortalité
|
Incidence
|
Mortalité
|
|
Nombre
de cas
|
Taux
|
Nombre
de décès
|
Taux
|
Nombre
de cas
|
Taux
|
Nombre
de décès
|
Taux
|
|
920
|
2,6
|
171
|
0,4
|
919
|
3,1
|
123
|
0,2
|
Taux standardisés sur l’âge de la population mondiale pour 100 000 personnes-années
Entre 1980 et 2005, l’incidence baisse chez l’homme mais augmente dans les années récentes chez la femme. Cette augmentation d’incidence chez la femme est d’une grande variabilité selon les registres et doit être interprétée avec prudence. Dans les années précédant 2000, la baisse d’incidence observée pourrait être due, en partie, au changement de classification qui place les formes nodulaires à prédominance lymphocytaire dans les LNH. Les projections pour 2011 ne prévoient pas de changement de tendance pour l’évolution de l’incidence. La mortalité baisse pour les deux sexes, probablement en raison des améliorations thérapeutiques (Bélot et coll., 2008

).
Selon les données de Globocan 2008
1
, portant sur 20 régions du monde, les taux d’incidence de la maladie de Hodgkin pour 100 000 personnes-années, standardisés pour l’âge et sur la population mondiale sont estimés à 1,2 pour 100 000 et 0,8 pour 100 000 respectivement pour l’homme et la femme, ce qui représente 0,5 % de l’ensemble des nouveaux cas de cancers estimés (Ferlay et coll., 2010

). Les taux d’incidence les plus élevés sont observés dans les régions les plus développées (Amérique du Nord, Australie, Nouvelle-Zélande, Europe), entre 2,1 pour 100 000 et 2,4 pour 100 000. Les taux les plus faibles (0,7) sont observés dans les régions en voie de développement. La stabilité de l’incidence, voire sa baisse comme observée en France, se retrouve ailleurs dans le monde. Mais, la réalité est plus complexe, en particulier dans les pays du Nord de l’Europe, où une diminution de l’incidence est observée chez l’homme et pas chez la femme, avec en parallèle une augmentation chez les jeunes (Hjalgrim et coll., 2001

).
En 2008, le nombre de morts a été estimé à 30 000 soit environ 0,4 % de l’ensemble des mortalités dues à des cancers. Le taux de mortalité est estimé à 0,4 ; il est plus élevé chez l’homme (0,6 pour 100 000 versus 0,3 pour 100 000). Les taux de mortalité les plus élevés sont observés dans les pays les plus développés (entre 1,7 pour 100 000 et 2,1 pour 100 000).
Exposition professionnelle aux pesticides et maladie de Hodgkin
Les données épidémiologiques concernant le lien entre pesticides et maladie de Hodgkin sont très peu nombreuses par rapport à d’autres pathologies lymphohématopoïétiques comme les leucémies ou le lymphome non-hodgkinien.
L’analyse sera articulée de la façon suivante : la synthèse des résultats des méta-analyses réalisées sur le sujet fera l’objet de la première partie. Seront abordés ensuite les résultats de cohortes concernant l’association entre une exposition professionnelle aux pesticides dans leur ensemble et le risque de maladie de Hodgkin. Dans une troisième partie, les résultats seront présentés par familles chimiques. Il s’agira essentiellement de données émanant de cohortes industrielles et de la cohorte prospective Agricultural Health Study. L’analyse ne portera pas sur les études cas-témoins.
Méta-analyses
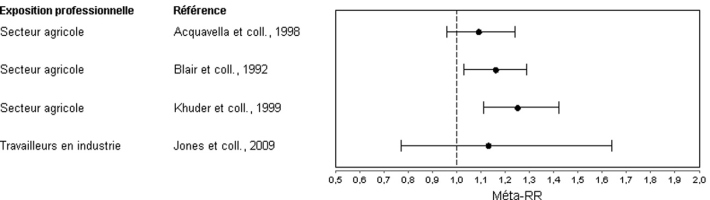
Entre 1992 et 2009, 4 méta-analyses incluant des données sur la maladie de Hodgkin et l’exposition professionnelle aux pesticides ont été publiées par des équipes différentes (Blair et coll., 1992

; Acquavella et coll., 1998

; Khuder et coll., 1999

; Jones et coll., 2009

) (tableau 7.II

). Parmi elles, une seule étude porte spécifiquement sur la maladie de Hodgkin (Khuder et coll., 1999

), les trois autres portent sur l’ensemble des cancers avec une analyse pour chaque type de cancer (Blair et coll., 1992

; Acquavella et coll., 1998

; Jones et coll., 2009

). Le nombre d’enquêtes épidémiologiques incluses dans ces méta-analyses varie de 12 à 30 et ont été publiées entre 1980 et 2003 (tableau 7.II

). Selon l’activité professionnelle considérée, 3 méta-analyses portent sur une exposition en milieu agricole (Blair et coll., 1992

; Acquavella et coll., 1998

; Khuder et coll., 1999

), et une concerne l’exposition en industrie de production de produits phytopharmaceutiques (Jones et coll., 2009

). Les résultats de ces méta-analyses (valeurs combinées des estimateurs de risque et intervalles de confiance à 95 %) sont repris dans la figure 7.1

.
Tableau 7.II Méta-analyses réalisées sur le risque de maladie de Hodgkin en milieu rural et chez les populations exposées professionnellement aux pesticides
|
Référence
|
Populations d’étude
Années de publication des études
|
Nombre d’étudesa
|
Type d’étude
Famille chimique
|
Méta-risque relatif de
maladie de Hodgkin
[IC 95 %]
|
Hétérogénéité
Valeur de p
(χ²)
|
Acquavella et coll., 1998 
(mise à jour de Blair et coll, 1992  ) (mortalité) |
Agriculteurs
1980-1994
|
26
8
8
10
|
Ensemble
Cohortes
Cas-témoins
PMR
|
1,09 [0,96–1,24]
1,04 [0,83-1,31]
1,11 [0,88-1,41]
1,12 [0,89-1,38]
|
0,0008
0,007
0,33
0,003
|
Blair et coll., 1992 
(mortalité) |
Agriculteurs
1980-1987
|
12
|
Ensemble
|
1,16 [1,03–1,29]
|
(5,53 chi carré)
|
Khuder et coll., 1999  b b
(incidence + mortalité) |
Agriculteurs
1981-1998
|
30
|
Ensemble
|
1,25 [1,11-1,42]
|
0,001
|
| | |
13
10
7
|
Type d’études :
Cas-témoins
Mortalité et morbidité
Cohortes
|
1,53 [1,18-1,98]
1,18 [1,02-1,36]
1,08 [0,97-1,20]
|
0,014
0,036
0,101
|
| | |
10
17
3
|
Pays :
États-Unis
Europe
Autres
|
1,23 [0,99-1,53]
1,26 [1,06-1,49]
1,33 [0,92-1,93]
|
0,036
0,001
0,289
|
| | |
8
|
Femmes
|
1,08 [0,91-1,29]
|
NR
|
Jones et coll., 2009 
(mortalité) |
Ouvriers en industrie de fabrication de produits phytopharmaceutiques
1980-2003
|
26
20
|
Cohortes
Phénoxy herbicides
|
1,13 [0,77-1,64]
1,15 [0,74-1,78]
|
<0,001
<0,001
|
a Nombre d’études mentionnées ; b Méta-analyse portant spécifiquement sur la maladie de Hodgkin ; NR : valeur non rapportée
Les résultats de ces méta-analyses ne sont que partiellement concordants : toutes soulignent un excès de risque de survenue de maladie de Hodgkin allant de 9 % à 25 % chez les professionnels exposés aux pesticides comparés à la population générale, cette augmentation de risque atteint un niveau de significativité statistique dans 2 méta-analyses sur les 4 (Blair et coll., 1992

; Khuder et coll., 1999

).
Rappelons que ces méta-analyses ne sont pas totalement indépendantes : Acquavella et coll. (1998

) ont réactualisé la méta-analyse de Blair et coll. (1992

) et un bon nombre d’études épidémiologiques se retrouvent dans plusieurs méta-analyses.
La plus forte augmentation significative du risque a été observée pour la combinaison des études cas-témoins portant sur les agriculteurs (Khuder et coll., 1999

) avec un excès de risque de survenue de maladie de Hodgkin de 53 %. Concernant des familles chimiques de pesticides, seule une méta-analyse présente des données pour les phénoxy herbicides (Jones et coll., 2009

). Une augmentation non significative du risque de maladie de Hodgkin a été rapportée chez les travailleurs exposés aux phénoxy herbicides pris dans leur ensemble.
La plupart des auteurs des 4 méta-analyses ont observé une hétérogénéité importante entre les résultats des différentes études épidémiologiques. Plusieurs regroupements d’études ont été réalisés afin d’essayer d’en identifier la (les) cause(s). Les regroupements d’études selon le type d’enquête épidémiologique n’ont pas permis de mettre clairement en évidence une augmentation de risque liée plus spécifiquement à un type d’enquête par rapport aux autres. Les valeurs de risques semblent toutefois plus élevées dans le cas de regroupements d’études cas-témoins : une méta-analyse a montré une augmentation significative du risque de 53 % (IC 95 % [1,18-1,98]) (Khuder et coll., 1999

) alors qu’une autre n’a pas mis en évidence une augmentation d’une telle ampleur (méta-RR=1,11 ; IC 95 % [0,88-1,41]) (Acquavella et coll., 1998

). Les valeurs de PMR (
Proportional Mortality Ratio) des études de mortalité et morbidité paraissent également légèrement plus élevées que celles des études de cohortes. Un regroupement des études selon les origines des populations étudiées a également été réalisé par Khuder et coll. (1999

) : les risques observés pour les études européennes sont très similaires à ceux des études américaines, avec des augmentations significatives ou à la limite de la significativité statistique de l’ordre de 26 et 23 % respectivement. Signalons également que la combinaison des études portant sur des femmes n’a pas montré d’augmentation significative de risque (Khuder et coll., 1999

).
En résumé, toutes les méta-analyses réalisées sur l’association entre l’exposition professionnelle aux pesticides et la survenue de maladie de Hodgkin ont globalement rapporté une augmentation du risque mais un degré de significativité statistique n’a été atteint que pour la moitié d’entre elles. La forte hétérogénéité existant entre les enquêtes épidémiologiques requiert une grande prudence dans l’interprétation des résultats.
Études de cohortes : pesticides tous types confondus
Dans la présente section, seuls seront repris les résultats des enquêtes de cohorte ayant étudié la relation entre l’exposition aux pesticides tous types confondus et la maladie de Hodgkin. Les cohortes focalisant sur un (des) type(s) ou famille(s) spécifique(s) de pesticides seront analysées dans les sections suivantes.
Agricultural Health Study (AHS)
Au sein de l’importante cohorte prospective nord-américaine AHS, l’incidence de la maladie de Hodgkin observée chez les applicateurs exploitants agricoles, applicateurs professionnels et chez leurs conjoints exposés aux pesticides dans leur ensemble est diminuée sans être statistiquement différente de celle de la population générale (tableau 7.III

). Les valeurs observées lors de la dernière réévaluation (Koutros et coll., 2010

) incluant les données jusqu’au 31 décembre 2006 sont tout à fait comparables à celles rapportées par Alavanja et coll. (2005

) incluant les données observées jusqu’en décembre 2002.
Tableau 7.III Incidences de la maladie de Hodgkin dans l’Agricultural Health Study
|
Référence
|
Maladie de Hodgkin
|
Applicateurs exploitant
agricoles
|
Conjoints des applicateurs exploitants agricoles
|
|
Ratio d’incidence standardisé (SIR) [IC 95 %]
| | | | | |
Alavanja et coll., 2005 
|
Ensemble
|
0,88 [0,44-1,57]
|
(n=11)
|
0,74 [0,20-1,91]
|
(n=4)
|
Koutros et coll., 2010 
|
Ensemble
|
0,96 [0,57-1,52]
|
(n=18)
|
0,85 [0,34-1,74]
|
(n=7)
|
|
Ratio d’incidence standardisé relatif (rSIR) [IC 95 %]a
| | | | | |
Koutros et coll., 2010 
|
Ensemble
|
1,13 [0,71-1,79]
|
(n=18)
|
1,16 [0,55-2,45]
|
(n=7)
|
|
Ratio de mortalité standardisé (SMR) [IC 95 %]
| | | | | |
Waggoner et coll., 2011 
|
Ensemble
|
1,03 [0,34-2,41]
|
(n=5)
|
/
|
(n=1)
|
|
Ratio de mortalité standardisé relatif (rSMR) [IC 95 %]b
| | | | | |
Waggoner et coll., 2011 
|
Ensemble
|
1,93 [0,80-4,63]
|
(n=5)
|
/
| |
a Ratio d’incidence standardisé relatif (rSIR) = Ratio d’incidence standardisé pour le site x divisé par le ratio d’incidence standardisé pour l’ensemble des cancers moins ratio d’incidence standardisé pour le site x (SIRx/SIRcancers-SIRx)
b Ratio de mortalité standardisé relatif (rSMR) = Ratio de mortalité standardisé pour le site x divisé par le ratio de mortalité standardisé pour l’ensemble des cancers moins ratio de mortalité standardisé pour le site x (SMRx/SMRcancers-SMRx)
c Pour les applicateurs professionnels, Alavanja et coll. 2005 mentionnent un SIR= 0,76 [0,10-4,21] (n=1), Koutros et coll. 2010
mentionnent un SIR= 0,76 [0,10-4,21] (n=1), Koutros et coll. 2010 mentionne 1 cas sans calcul du SIR
mentionne 1 cas sans calcul du SIR
Sachant qu’un risque plus faible de cancer était observé dans l’AHS pour l’ensemble des cancers, Koutros et coll. (2010

) ont voulu tenir compte de ce facteur en calculant des ratios d’incidence standardisés (SIR) relatifs (rSIR), en divisant la valeur observée pour un site déterminé par celle observée pour l’ensemble des cancers moins celle de ce site. En procédant de la sorte, les valeurs de rSIR observées sont légèrement supérieures à celles des SIR et montrent une légère augmentation du risque mais sans atteindre un degré de significativité statistique (tableau 7.III

).
Un taux de mortalité (SMR) dû à la maladie de Hodgkin observé au sein de l’AHS jusqu’en 2007 n’est présenté que pour les applicateurs exploitants agricoles (un cas seulement ayant été rapporté chez les conjoints) et montre une légère augmentation non significative du risque. La valeur de mortalité par maladie de Hodgkin rapportée à la mortalité pour l’ensemble des cancers sauf par maladie de Hodgkin (RSMR) a montré une augmentation plus forte que celle du SMR mais sans atteindre un degré de significativité statistique (Waggoner et coll., 2011

).
Cohortes autres que l’AHS
Les enquêtes épidémiologiques autres que l’AHS sur le lien entre une exposition aux pesticides tous types confondus et la maladie de Hodgkin sont reprises dans le tableau 7.IV

. Cette liste n’est pas exhaustive et afin d’éviter autant que possible toute redondance entre les études, pour chaque localisation géographique et pour un même groupe d’exposition, n’ont été retenues que les études les plus récentes ou les plus complètes. Neuf études ont ainsi été sélectionnées : 7 études européennes et 2 études issues d’Amérique du Nord. La plus importante étude européenne est celle de Pukkala et coll. (2009

) qui présente des données de suivi de 15 millions d’individus provenant de 5 pays nordiques : Suède, Norvège, Islande, Danemark et Finlande. Cette étude a montré une très légère augmentation d’incidence de maladie de Hodgkin chez les agriculteurs (hommes) mais une augmentation plus forte et statistiquement significative chez les femmes agricultrices. Une augmentation non significative a été observée chez les femmes jardiniers alors qu’une diminution non significative a été observée chez les hommes. Deux études Irlandaises ont rapporté des données d’incidence et de mortalité chez des agriculteurs et autres travailleurs agricoles (Dean, 1994

; Kelleher et coll., 1998

). Les résultats de ces études ne sont pas significatifs et pourraient paraître contradictoires : alors qu’un risque augmenté d’incidence de maladie de Hodgkin chez les agriculteurs masculins a été rapporté par Kelleher et coll. (1998

), une diminution de la mortalité a été observée chez les agriculteurs par Dean (1994

). Chez les utilisateurs de pesticides à usage agricole en Grande-Bretagne, des risques diminués de mortalité et d’incidence de maladie de Hodgkin ont été rapportés mais sans atteindre de significativité statistique (Frost et coll., 2011

). Sur les 7 études européennes, 3 émanent d’Italie (Faustini et coll., 1993

; Sperati et coll., 1999

; Bucci et coll., 2004

). Aucune de ces études n’a montré d’augmentation de risque de maladie de Hodgkin chez les travailleurs agricoles ou utilisateurs de pesticides possédant une licence pour l’achat et l’utilisation de pesticides toxiques, des réductions non significatives de risque ayant été rapportées. Une étude sur les deux en provenance d’Amérique du Nord, a également mentionné des diminutions (non significatives) de risque de maladie de Hodgkin (Semenciw et coll., 1994

). Dans l’autre étude, un risque accru de façon non significative de mortalité a été observé au sein d’une cohorte d’applicateurs de pesticides aériens (Cantor et Silberman, 1999

).
Tableau 7.IV Enquêtes de cohorte autres que l’Agricultural Health Study sur le lien entre exposition aux pesticides, tous types confondus, et maladie de Hodgkin
|
Références
|
Pays
|
Exposition
|
Nombre
de cas
|
Estimateur de risque
[IC 95 %]
| |
Bucci et coll., 2004 
|
Italie du Nord
(Forli, Emilie Romagne)
|
Travailleurs agricoles (hommes)
|
18
|
ASMR
|
0,80 [0,38-1,67]
|
Cantor et Silberman, 1999 
|
États-Unis
|
Applicateurs de pesticides aériens (hommes)
Instructeurs (=groupe de comparaison)
Applicateurs/instructeurs (exposés/non-exposés)
|
2
1
|
Rate
Rate
Rate ratio
|
1,2 [NR]
0,6 [NR]
1,99 [0,3-14,9]
|
Dean, 1994 
|
Irlande
|
Agriculteurs (y compris les proches) et autres travailleurs agricoles
| | | |
| | |
Hommes + femmes
|
328
|
SMR
|
0,93 [0,83-1,03] (lymphoid, Hodgkin)
|
| | |
Hommes
Femmes
|
244
84
|
SMR
SMR
|
0,92 [0,81-1,04]
0,95 [0,75-1,18]
|
Faustini et coll., 1993 
|
Italie
(Aprilia)
|
Travailleurs agricoles
Hommes
Femmes
Hommes + femmes
|
1
0
1
|
SMR
SMR
SMR
|
1,02 [0,03-5,68]
/
0,91 [0,02-5,06]
|
Frost et coll., 2011 
|
Grande-Bretagne
|
Utilisateurs de pesticides à usage agricole
Hommes
Femmes
Hommes
Femmes
|
4
0
24
0
|
SMR
SMR
SIR
SIR
|
0,82 [0,31-2,20]
/
0,92 [0,62-1,37]
/
|
Kelleher et coll., 1998 
|
Irlande (Occidentale)
|
Agriculteurs (hommes)
Autres/agriculture
|
?
?
|
SIR
SIR
|
1,43 [0,80-2,63]
0,97 [0,05-+++]
|
Pukkala et coll., 2009 
|
Pays nordiques (Danemark, Islande, Norvège, Suède, Finlande)
|
Agriculteurs :
Hommes
Femmes
Jardiniers :
Hommes
Femmes
|
733
114
180
131
|
SIR
SIR
SIR
SIR
|
1,03 [0,96-1,11]
1,21 [1,00-1,45]
0,96 [0,83-1,12]
1,13 [0,95-1,34]
|
Semenciw et coll., 1994 
|
Canada
(Manitoba, Saskatchewan, Alberta)
|
Agriculteurs (hommes)
|
34
|
SMR
|
0,75 [0,52-1,05]
|
Sperati et coll., 1999 
|
Italie Centrale
(Province de Viterbo)
|
Utilisateurs de pesticides ayant une licence pour l’achat et l’utilisation de pesticides toxiques
| | | |
| | |
Hommes + femmes
Hommes
Femmes
|
1
0
1
|
SMR
SMR
SMR
|
0,40 [0,01-2,25]
/
1,35 [0,03-7,53]
|
ASMR : Age Standardized Mortality Rate ratio; SMR: ratio de mortalité standardisé; SIR: ratio d’incidence standardisé; NR: non rapporté
En résumé, il y a très peu d’études de cohorte disponibles sur la survenue de maladie de Hodgkin par suite d’expositions aux pesticides et il est donc raisonnablement impossible de conclure quant à l’existence ou non d’une association entre les deux. Si dans la cohorte AHS (Koutros et coll., 2010

; Waggoner et coll., 2001

), les valeurs de mortalité et d’incidence relatives se voient augmentées de façon non significative, une tendance à l’augmentation de risque de maladie de Hodgkin se retrouve davantage dans les études d’incidence pour les autres études de cohortes. La seule valeur significative rapportée est l’augmentation d’incidence observée chez les agricultrices des pays nordiques, sans toutefois qu’une telle tendance ait été observée dans les autres cohortes.
Exposition à des familles ou substances actives de pesticides
La maladie de Hodgkin n’a été que très peu investiguée dans des études de cohorte ciblant des familles de pesticides ou des pesticides particuliers. Aucune donnée sur cette pathologie n’a pu être extraite des nombreuses études issues de l’AHS et ciblant des pesticides (ou familles de pesticides particuliers). Les données disponibles sont reprises dans le tableau 7.V

.
Tableau 7.V Résultats des différentes études sur le lien entre exposition à des pesticides ou classes de pesticides spécifiques et maladie de Hodgkin selon le groupe d’exposition
|
Substances
|
Références
Types d’étude
Pays
|
Exposition
|
Nombre de cas
|
Estimateur de risque
[IC 95 %]
|
|
Travailleurs en industrie
|
|
Alachlore
|
Acquavella et coll., 2004 
Cohorte rétrospective (mortalité, incidence) États-Unis (Muscatine, Iowa) |
Aussi contamination par eau
Exposition : toutes
Exposition : élevées
(Aucun cas rapporté pour les travailleurs avec exposition élevée durant 5 ans ou plus et avec au moins 15 ans depuis la première exposition)
|
1
1
|
SIR
SIR
|
1,43 [0,04-7,96]
2,00 [0,05-11,14]
|
|
2,4-D
|
Burns et coll., 2001 
Cohorte rétrospective États-Unis (Midland, Michigan) |
Travailleurs (hommes) en industrie de production, formulation et empaquetage (Down Chemical Company)
Ensemble
≥20 ans depuis le recrutement
|
1
1
|
SMR
SMR
|
1,54 [0,04-8,56]
1,70 [0,04-9,43]
|
|
2,4-D
|
Burns et coll., 2011 
Cohorte rétrospective États-Unis (Midland, Michigan) |
Travailleurs (hommes) en industrie de production, formulation et empaquetage (Down Chemical Company)
| | | |
| | |
Classification selon le nombre maximum et minimum de « personnes-années à risque » :
Cohorte 1 : cohorte entière
Cohorte 2
Cohorte 3 : la plus restrictive
|
1
1
1
|
SIR
SIR
SIR
|
0,97 [0,01-5,40]
1,05 [0,01-5,86]
1,30 [0,02-7,23]
|
|
MCPA
|
Coggon et coll., 1986 
Cohorte rétrospective |
Travailleurs (hommes) dans une industrie de production, formulation et application de MCPA et autres phénoxy
| | | |
| |
Royaume-Uni
|
2 groupes témoins : national (N), national avec facteur correctif rural (R)
Ensemble : N
Ensemble : R
|
1
1
|
SMR
SMR
|
0,28 [0,01-1,59]
0,29 [0,01-1,62]
|
| | |
Selon le grade d’exposition potentielle :
Background (N)
Faible
Forte
|
/
1
/
|
SMR
|
1,00 [0,03-5,57]
|
| | |
Selon la durée de l’exposition :
<1 mois (N)
1-6 mois
>6 mois
|
/
/
1
|
SMR
|
0,79 [0,02-4,40]
|
| | |
Temps de latence depuis la première exposition :
0 an (N)
5 ans
10 ans
|
1
/
/
|
SMR
|
0,41 [0,01-2,28]
|
|
Travailleurs dans des plantations de bananes
|
|
DBCP (dibromo chloropropane)
|
Wesseling et coll., 1996 
Cohorte rétrospective |
Travailleurs exposés dans des plantations de bananes (hommes)
Ensemble
Par nombre de mois de travail :
1-12
13-36
≥37
Par première année de travail :
1972-1975
1976-1979
|
9
6
2
1
3
6
|
SIR
SIR
SIR
SIR
SIR
SIR
|
1,17 [0,54-2,23]
1,75 [0,64-3,81]
0,76 [0,09-2,75]
0,62 [0,02-3,47]
0,92 [0,19-2,67]
1,36 [0,50-2,97]
|
|
DBCP (dibromo chloropropane)
|
Hofmann et coll., 2004 
Cohorte rétrospective |
Référence – population nationale – Hommes
Référence – population locale
|
11
11
|
SMR
SMR
|
1,04 [0,52-1,87]
1,17 [0,58-2,10]
|
|
Autres groupes d’exposition
|
|
Herbicides chlorophénoles, principalement 2,4-D et MCPA
|
Torchio et coll., 1994 
Italie (Piémont : Asti, Alessandria, Cuneo) |
Utilisateurs de pesticides (hommes) ayant une licence (agriculteurs) (référence provinciale)
|
11
|
SMR
|
0,95 [0,47-1,69]
|
|
2,4-D, MCPP, dicamba, DCPA, + beaucoup d’autres phénoxyherbicides
|
Zahm, 1997 
Cohorte rétrospective États-Unis/Canada |
Applicateurs de pesticides et autres employés d’une société de service d’entretien des pelouses
Tous les employés
|
1
|
SMR
|
0,49 [0,01-2,75]
|
SMR: ratio de mortalité standardisé; SIR: ratio d’incidence standardisé
Aucune donnée n’a été retrouvée dans des cohortes de travailleurs exposés principalement à des organochlorés, à des organophosphorés ou à des carbamates. Pour les triazines, seule l’étude de McLennan (2002

) rapporte une absence de cas alors que 0,5 cas étaient attendus.
Un seul cas incident de maladie de Hodgkin a été rapporté suite à une exposition à l’alachlore (chloroacétanilide) chez des travailleurs dans une industrie de production dans l’Iowa (Acquavella et coll., 2004

). Sur la base de ce seul cas, l’étude a rapporté une augmentation non significative de risque de maladie de Hodgkin en termes d’incidence, quelle que soit l’exposition (toutes les expositions ou seulement les fortes expositions). Ce cas n’appartenait pas au groupe de travailleurs potentiellement les plus exposés (au moins 5 ans d’expositions fortes/15 années au moins écoulées depuis la première exposition). Aucun cas de mortalité par suite de maladie de Hodgkin n’a été mis en évidence dans cette étude.
Les travailleurs exposés au DBCP, un hydrocarbure halogéné utilisé dans des plantations de bananes au Costa Rica, ont fait l’objet de deux études : une étude portant sur l’incidence (Wesseling et coll., 1996

) et l’autre sur la mortalité de ces travailleurs (Hofmann et coll., 2006

). Des résultats n’ont été rapportés pour la maladie de Hodgkin que pour les hommes, pas pour les femmes. Une augmentation non significative du risque de maladie de Hodgkin a été rapportée aussi bien pour la mortalité (nombre de cas observés : n=11) que pour l’incidence (n=9) sans qu’il y ait de tendance à l’augmentation de risque avec le nombre de mois de travail ni avec l’ancienneté de la première année de travail (Wesseling et coll., 1996

).
Phénoxy herbicides : MCPA et 2,4-D
Les préparations commerciales de phénoxy herbicides peuvent être contaminées par des dibenzo-dioxines polychlorinées (PCDDs) et par des dibenzo-furanes polychlorinés (PCDFs), formés durant le processus de fabrication. L’exposition concomitante au(x) phénoxy herbicide(s), au(x) chlorophénol(s) et à leur(s) contaminant(s) présente un problème particulier de facteurs confondants potentiels et ne permet pas de distinguer leurs effets respectifs. Afin de limiter autant que possible cette confusion, la présente section focalisera sur les phénoxy herbicides les moins potentiellement contaminés par des PCDDs/PCDFs c’est-à-dire sur l’acide 4-chloro-2-méthyl phénoxyacétique (MCPA) et l’acide 2,4-dichlorophénoxy acétique (2,4-D). Dans la plupart des études, l’exposition à un de ces deux phénoxy herbicides ne peut pas être distinguée de celle de l’autre.
Une étude internationale portant sur des travailleurs en usine de production de phénoxy herbicides et sur d’autres les pulvérisant, a rapporté une diminution non significative du risque de maladie de Hodgkin sur la base du seul cas observé parmi les travailleurs non exposés aux TCDD ou aux dioxines (SMR=0,27 ; IC 95 % [0,01-1,51]) (Kogevinas et coll., 1997

).
Travailleurs en industrie
Aucune des dernières réactualisations de données sur des travailleurs en industrie de production et/ou de formulation de MCPA provenant d’études réalisées en Allemagne (Becher et coll., 1996

), aux Pays-Bas (Boers et coll., 2010

), au Royaume-Uni (Coggon et coll., 1986

) et au Danemark (Lynge et coll., 1998

) n’a rapporté de cas de maladie de Hodgkin dans ces différentes cohortes si ce n’est un cas unique observé par Coggon et coll. (1986

). Une augmentation non significative du risque de maladie de Hodgkin a été rapportée dans cette dernière étude. Une cohorte américaine de travailleurs dans une industrie (
Dow Chemical Company) de production, formulation et empaquetage de 2,4-D au Michigan a été suivie pour la mortalité à la suite de cancers (Burns et coll., 2001

) et pour l’incidence de ceux-ci chez ces travailleurs (Burns et coll., 2011

). Aucune de ces deux études n’a montré d’effet significatif sur le risque de maladie de Hodgkin. Une augmentation du risque est observée pour l’étude de mortalité alors que le risque pour les valeurs d’incidence se voit très faiblement diminué dans la cohorte entière.
Agriculteurs et autres professionnels exposés
Deux cohortes d’autres professionnels exposés à des phénoxy herbicides non contaminés (utilisateurs de pesticides ayant une licence d’utilisation, applicateurs employés pour le contrôle des mauvaises herbes ou employés dans une société de service d’entretien des pelouses) ont rapporté des valeurs de mortalité chez des utilisateurs en Italie et aux États-Unis/Canada. Ces études ont montré des diminutions non significatives de risque de maladie de Hodgkin : des diminutions dans deux études de mortalité (Torchio et coll., 1994

; Zahm, 1997

).
En résumé, les données épidémiologiques disponibles ciblant des pesticides particuliers sont nettement trop peu nombreuses. Elles portent sur des nombres de cas extrêmement réduits et sont donc insuffisantes pour pouvoir conclure quant aux risques de maladie de Hodgkin que pourraient représenter certains de ces agents.
En conclusion, la recherche d’un lien entre l’exposition professionnelle aux pesticides et la survenue de maladie de Hodgkin n’a généré qu’une littérature limitée. Les quatre méta-analyses réalisées sur l’association entre l’exposition professionnelle aux pesticides et la survenue de maladie de Hodgkin ont globalement rapporté une augmentation du risque mais un degré de significativité statistique n’a été atteint que pour deux d’entre elles. La forte hétérogénéité existant entre les enquêtes épidémiologiques requiert une grande prudence dans l’interprétation des résultats. Au sein de la cohorte AHS, l’incidence de la maladie de Hodgkin observée chez les applicateurs exploitants agricoles, applicateurs professionnels et chez leurs conjoints exposés aux pesticides dans leur ensemble n’est pas augmentée, ou l’est légèrement mais sans être statistiquement différente de celle de la population générale. L’étude européenne qui fournit des données de suivi de 15 millions d’individus provenant de 5 pays nordiques (Suède, Norvège, Islande, Danemark et Finlande) a montré une très légère augmentation d’incidence de maladie de Hodgkin chez les agriculteurs (hommes) mais une augmentation plus forte et statistiquement significative chez les femmes agricultrices. Aucune des autres études européennes n’a présenté d’augmentation de risque de maladie de Hodgkin chez les utilisateurs de pesticides et travailleurs dans le secteur agricole ou chez les agricultrices.
Bibliographie
[1] ACQUAVELLA J, OLSEN G, COLE P, IRELAND B, KANEENE J, et coll. Cancer among farmers: a meta-analysis.
Ann Epidemiol. 1998;
8:67
-74

[2] ACQUAVELLA J, DELZELL E, CHENG H, LYNCH CF, JOHNSON G. Mortality and cancer incidence among alachlor manufacturing workers 1968-99.
Occup Environ Med. 2004;
61:680
-685

[3] ALAVANJA MC, SANDLER DP, LYNCH CF, KNOTT C, LUBIN JH, et coll. Cancer incidence in the Agricultural Health Study.
Scand J Work Environ Health. 2005;
31 (Suppl 1):39
-45

[4] BECHER H, FLESCH‑JANYS D, KAUPPINEN T, KOGEVINAS M, STEINDORF K, et coll. Cancer mortality in German male workers exposed to phenoxy herbicides and dioxins.
Cancer Causes Control. 1996;
7:312
-321

[5] BÉLOT A, VELTEN M, GROSCLAUDE P, BOSSARD N, LAUNOY G, et coll. Estimation nationale de l’incidence et de la mortalité par cancer en France entre 1980 et 2005.
Saint Maurice, InVS, 2008 : 1- 132.

[6] BLAIR A, ZAHM SH, PEARCE NE, HEINEMAN EF, FRAUMENI JF, JR.. Clues to cancer etiology from studies of farmers.
Scand J Work Environ Health. 1992;
18:209
-215

[7] BOERS D, PORTENGEN L, BUENO‑DE‑MESQUITA HB, HEEDERIK D, VERMEULEN R. Cause-specific mortality of Dutch chlorophenoxy herbicide manufacturing workers.
Occup Environ Med. 2010;
67:24
-31

[8] BUCCI L, NANNI O, RAVAIOLI A, FALCINI F, RICCI R, et coll. Cancer mortality in a cohort of male agricultural workers from Northern Italy.
J Occup Environ Med. 2004;
46:249
-256

[9] BURNS CJ, BEARD KK, CARTMILL JB. Mortality in chemical workers potentially exposed to 2,4-dichlorophenoxyacetic acid (2,4-D) 1945-94: an update.
Occup Environ Med. 2001;
58:24
-30

[10] BURNS C, BODNER K, SWAEN G, COLLINS J, BEARD K, LEE M. Cancer incidence of 2,4-D production workers.
Int J Environ Res Public Health. 2011;
8:3579
-3590

[11] CANTOR KP, SILBERMAN W. Mortality among aerial pesticide applicators and flight instructors: follow-up from 1965-1988.
Am J Ind Med. 1999;
36:239
-247

[12] COGGON D, PANNETT B, WINTER PD, ACHESON ED, BONSALL J. Mortality of workers exposed to 2 methyl-4 chlorophenoxyacetic acid.
Scand J Work Environ Health. 1986;
12:448
-454

[13] DEAN G. Deaths from primary brain cancers, lymphatic and haematopoietic cancer in agricultural workers in the Republic of Ireland.
J Epidemiol Community Health. 1994;
48:364
-368

[14]EMC.Hématologie. 2004, 1 : 115 - 134.

[15] FAUSTINI A, FORASTIERE F, DI BETTA L, MAGLIOLA EM, PERUCCI CA. Cohort study of mortality among farmers and agricultural workers.
Med Lav. 1993;
84:31
-41

[16] FERLAY J, SHIN H-R, BRAY F, FORMAN D, MATHERS C, PARKIN DM. Estimates of worldwide burden of cancer in 2008.
GLOBOCAN 2008a. Int J Cancer. 2010;
127:2893
-2917

[17] FROST G, BROWN T, HARDING A-H. Mortality and cancer incidence among British agricultural pesticide users.
Occup Med. 2011;
61:303
-310

[18] HJALGRIM H, ASKLING J, PUKKALA E, HANSEN S, MUNKSGAARD L, FRISCH M. Incidence of Hodgkin’s disease in Nordic countries.
Lancet. 2001;
358:297
-298

[19] HOFMANN J, GUARDADO J, KEIFER M, WESSELING C. Mortality among a cohort of banana plantation workers in Costa Rica.
Int J Occup Environ Health. 2006;
12:321
-328

[20]INVS.INCA. Projection de l’incidence et de la mortalité par cancer en France en 2011. Rapport technique. Saint Maurice, InVS, 2011 : 1 - 78.
[disponible à partir de l’URL :
http://www.invs.sante.fr/].

[21] JAFFE ES, HARRIS NL, STEIN H, VARDIMAN JW.(Eds) World Health Organization Classification of tumours. Pathology and genetics of tumours of haematopoietic and lymphoid tissues. IARC Press, Lyon, 2001.

[22] JONES DR, SUTTON AJ, ABRAMS KR, FENTY J, WARREN F, et coll. Systematic review and meta-analysis of mortality in crop protection product manufacturing workers.
Occup Environ Med. 2009;
66:7
-15

[23] KELLEHER C, NEWELL J, MACDONAGH‑WHITE C, MACHALE E, EGAN E, et coll. Incidence and occupational pattern of leukaemias, lymphomas, and testicular tumours in Western Ireland over an 11 year period.
J Epidemiol Community Health. 1998;
52:651
-656

[24] KHUDER SA, MUTGI AB, SCHAUB EA, TANO BDK. Meta-analysis of hodgkin’s disease among farmers.
Scand J Work Environ Health. 1999;
25:436
-441

[25] KOGEVINAS M, BECHER H, BENN T, BERTAZZI P, BOFFETTA P, et coll. Cancer mortality in workers exposed to phenoxy herbicides, chlorophenols, and dioxins.
Am J Epidemiol. 1997;
145:1061
-1075

[26] KOUTROS S, ALAVANJA MC, LUBIN JH, SANDLER DP, HOPPIN JA, et coll. An update of cancer incidence in the Agricultural Health Study.
J Occup Environ Med. 2010;
52:1098
-1105

[27] KÜPPERS R. The biology of Hodgkin’s lymphoma.
Nat Rev Cancer. 2009;
9:15
-27

[28] LYNGE E. Cancer incidence in Danish phenoxy herbicide workers, 1947-1993.
Environ Health Perspect. 1998;
106 (suppl 2):683
-688

[29] MACLENNAN PA, DELZELL E, SATHIAKUMAR N, MYERS SL, CHENG H, et coll. Cancer incidence among triazine herbicide manufacturing workers.
J Occup Environ Med. 2002;
44:1048
-1058

[30] PUKKALA E, MARTINSEN JI, LYNGE E, GUNNARSDOTTIR HK, SPAREN P, et coll. Occupation and cancer – follow-up of 15 million people in five Nordic countries.
Acta Oncol. 2009;
48:646
-790

[31] RUDANT J, MENEGAUX F, LEVERGER G, BARUCHEL A, NELKEN B, et coll. Household Exposure to Pesticides and Risk of Childhood Hematopoietic Malignancies: The ESCALE Study (SFCE).
Environ Health Perspect. 2007;
115:1787
-1793

[32] SEMENCIW RM, MORRISON HI, MORISON D, MAO Y. Leukemia mortality and farming in the prairie provinces of Canada.
Can J Public Health. 1994;
85:208
-211

[33] SPERATI A, RAPITI E, SETTIMI L, QUERCIA A, TERENZONI B, FORASTIERE F. Mortality among male licensed pesticide users and their wives.
Am J Ind Med. 1999;
36:142
-146

[34] SWERDLOW SH, CAMPO E, HARRIS NL. WHO classification of tumours of haematopoietic and lymphoid tissues.
Lyon, France, IARC, 2008.

[35] TORCHIO P, LEPORE AR, CORRAO G, COMBA P, SETTIMI l et coll. Mortality study on a cohort of Italian licensed pesticide users.
Sci Total Environ. 1994;
149:183
-191

[36] WAGGONER JK, KULLMAN GJ, HENNEBERGER PK, UMBACH DM, BLAIR A, et coll. Mortality in the Agricultural Health Study, 1993-2007.
Am J Epidemiol. 2011;
173:71
-83

[37] WESSELING C, AHLBOM A, ANTICH D, RODRIGUEZ AC, CASTRO R. Cancer in banana plantation workers in Costa Rica.
Int J Epidemiol. 1996;
25:1125
-1131

[38] ZAHM SH. Mortality study of pesticide applicators and other employees of a lawn care service company.
J Occup Environ Med. 1997;
39:1055
-1067

→ Aller vers SYNTHESE
 ). Il représente environ 30 % de tous les lymphomes. Cette hémopathie maligne est caractérisée par la présence d’un petit nombre de cellules tumorales issues des lymphocytes B (cellules de Reed-Sternberg) au sein d’une réaction tissulaire abondante (lymphocytes T, histiocytes, polynucléaires éosinophiles…) pouvant s’accompagner de fibrose. La distribution est bimodale en fonction de l’âge avec un âge médian de 27 ans et 2 pics (adolescents et jeunes adultes : 15-35 ans ; et sujets plus âgés : >50 ans).
). Il représente environ 30 % de tous les lymphomes. Cette hémopathie maligne est caractérisée par la présence d’un petit nombre de cellules tumorales issues des lymphocytes B (cellules de Reed-Sternberg) au sein d’une réaction tissulaire abondante (lymphocytes T, histiocytes, polynucléaires éosinophiles…) pouvant s’accompagner de fibrose. La distribution est bimodale en fonction de l’âge avec un âge médian de 27 ans et 2 pics (adolescents et jeunes adultes : 15-35 ans ; et sujets plus âgés : >50 ans). ) on distingue deux catégories : le lymphome hodgkinien nodulaire à prédominance lymphocytaire (5 % des lymphomes hodgkiniens ; lymphome B d’origine folliculaire) et le lymphome hodgkinien classique dont on distingue 4 entités (le sous-type scléronodulaire : 70 % des LH, le sous--type riche en lymphocytes : 5 % des LH, le sous-type à cellularité mixte : 20-25 % des LH et le sous-type en déplétion lymphocytaire : 5 % des LH).
) on distingue deux catégories : le lymphome hodgkinien nodulaire à prédominance lymphocytaire (5 % des lymphomes hodgkiniens ; lymphome B d’origine folliculaire) et le lymphome hodgkinien classique dont on distingue 4 entités (le sous-type scléronodulaire : 70 % des LH, le sous--type riche en lymphocytes : 5 % des LH, le sous-type à cellularité mixte : 20-25 % des LH et le sous-type en déplétion lymphocytaire : 5 % des LH). ).
). ). Cependant, l’incidence des lymphomes non hodgkinien est supérieure à celle des LH chez les patients infectés par le VIH.
). Cependant, l’incidence des lymphomes non hodgkinien est supérieure à celle des LH chez les patients infectés par le VIH. ).
).
 ).
). ). Les taux d’incidence les plus élevés sont observés dans les régions les plus développées (Amérique du Nord, Australie, Nouvelle-Zélande, Europe), entre 2,1 pour 100 000 et 2,4 pour 100 000. Les taux les plus faibles (0,7) sont observés dans les régions en voie de développement. La stabilité de l’incidence, voire sa baisse comme observée en France, se retrouve ailleurs dans le monde. Mais, la réalité est plus complexe, en particulier dans les pays du Nord de l’Europe, où une diminution de l’incidence est observée chez l’homme et pas chez la femme, avec en parallèle une augmentation chez les jeunes (Hjalgrim et coll., 2001
). Les taux d’incidence les plus élevés sont observés dans les régions les plus développées (Amérique du Nord, Australie, Nouvelle-Zélande, Europe), entre 2,1 pour 100 000 et 2,4 pour 100 000. Les taux les plus faibles (0,7) sont observés dans les régions en voie de développement. La stabilité de l’incidence, voire sa baisse comme observée en France, se retrouve ailleurs dans le monde. Mais, la réalité est plus complexe, en particulier dans les pays du Nord de l’Europe, où une diminution de l’incidence est observée chez l’homme et pas chez la femme, avec en parallèle une augmentation chez les jeunes (Hjalgrim et coll., 2001 ).
). ; Acquavella et coll., 1998
; Acquavella et coll., 1998 ; Khuder et coll., 1999
; Khuder et coll., 1999 ; Jones et coll., 2009
; Jones et coll., 2009 ) (tableau 7.II
) (tableau 7.II ). Parmi elles, une seule étude porte spécifiquement sur la maladie de Hodgkin (Khuder et coll., 1999
). Parmi elles, une seule étude porte spécifiquement sur la maladie de Hodgkin (Khuder et coll., 1999 ), les trois autres portent sur l’ensemble des cancers avec une analyse pour chaque type de cancer (Blair et coll., 1992
), les trois autres portent sur l’ensemble des cancers avec une analyse pour chaque type de cancer (Blair et coll., 1992  ; Acquavella et coll., 1998
; Acquavella et coll., 1998 ; Jones et coll., 2009
; Jones et coll., 2009 ). Le nombre d’enquêtes épidémiologiques incluses dans ces méta-analyses varie de 12 à 30 et ont été publiées entre 1980 et 2003 (tableau 7.II
). Le nombre d’enquêtes épidémiologiques incluses dans ces méta-analyses varie de 12 à 30 et ont été publiées entre 1980 et 2003 (tableau 7.II ). Selon l’activité professionnelle considérée, 3 méta-analyses portent sur une exposition en milieu agricole (Blair et coll., 1992
). Selon l’activité professionnelle considérée, 3 méta-analyses portent sur une exposition en milieu agricole (Blair et coll., 1992 ; Acquavella et coll., 1998
; Acquavella et coll., 1998  ; Khuder et coll., 1999
; Khuder et coll., 1999 ), et une concerne l’exposition en industrie de production de produits phytopharmaceutiques (Jones et coll., 2009
), et une concerne l’exposition en industrie de production de produits phytopharmaceutiques (Jones et coll., 2009 ). Les résultats de ces méta-analyses (valeurs combinées des estimateurs de risque et intervalles de confiance à 95 %) sont repris dans la figure 7.1
). Les résultats de ces méta-analyses (valeurs combinées des estimateurs de risque et intervalles de confiance à 95 %) sont repris dans la figure 7.1 .
. ; Khuder et coll., 1999
; Khuder et coll., 1999 ).
). ) ont réactualisé la méta-analyse de Blair et coll. (1992
) ont réactualisé la méta-analyse de Blair et coll. (1992 ) et un bon nombre d’études épidémiologiques se retrouvent dans plusieurs méta-analyses.
) et un bon nombre d’études épidémiologiques se retrouvent dans plusieurs méta-analyses. ) avec un excès de risque de survenue de maladie de Hodgkin de 53 %. Concernant des familles chimiques de pesticides, seule une méta-analyse présente des données pour les phénoxy herbicides (Jones et coll., 2009
) avec un excès de risque de survenue de maladie de Hodgkin de 53 %. Concernant des familles chimiques de pesticides, seule une méta-analyse présente des données pour les phénoxy herbicides (Jones et coll., 2009 ). Une augmentation non significative du risque de maladie de Hodgkin a été rapportée chez les travailleurs exposés aux phénoxy herbicides pris dans leur ensemble.
). Une augmentation non significative du risque de maladie de Hodgkin a été rapportée chez les travailleurs exposés aux phénoxy herbicides pris dans leur ensemble.
 ) alors qu’une autre n’a pas mis en évidence une augmentation d’une telle ampleur (méta-RR=1,11 ; IC 95 % [0,88-1,41]) (Acquavella et coll., 1998
) alors qu’une autre n’a pas mis en évidence une augmentation d’une telle ampleur (méta-RR=1,11 ; IC 95 % [0,88-1,41]) (Acquavella et coll., 1998 ). Les valeurs de PMR (Proportional Mortality Ratio) des études de mortalité et morbidité paraissent également légèrement plus élevées que celles des études de cohortes. Un regroupement des études selon les origines des populations étudiées a également été réalisé par Khuder et coll. (1999
). Les valeurs de PMR (Proportional Mortality Ratio) des études de mortalité et morbidité paraissent également légèrement plus élevées que celles des études de cohortes. Un regroupement des études selon les origines des populations étudiées a également été réalisé par Khuder et coll. (1999 ) : les risques observés pour les études européennes sont très similaires à ceux des études américaines, avec des augmentations significatives ou à la limite de la significativité statistique de l’ordre de 26 et 23 % respectivement. Signalons également que la combinaison des études portant sur des femmes n’a pas montré d’augmentation significative de risque (Khuder et coll., 1999
) : les risques observés pour les études européennes sont très similaires à ceux des études américaines, avec des augmentations significatives ou à la limite de la significativité statistique de l’ordre de 26 et 23 % respectivement. Signalons également que la combinaison des études portant sur des femmes n’a pas montré d’augmentation significative de risque (Khuder et coll., 1999 ).
). ). Les valeurs observées lors de la dernière réévaluation (Koutros et coll., 2010
). Les valeurs observées lors de la dernière réévaluation (Koutros et coll., 2010 ) incluant les données jusqu’au 31 décembre 2006 sont tout à fait comparables à celles rapportées par Alavanja et coll. (2005
) incluant les données jusqu’au 31 décembre 2006 sont tout à fait comparables à celles rapportées par Alavanja et coll. (2005 ) incluant les données observées jusqu’en décembre 2002.
) incluant les données observées jusqu’en décembre 2002. mentionnent un SIR= 0,76 [0,10-4,21] (n=1), Koutros et coll. 2010
mentionnent un SIR= 0,76 [0,10-4,21] (n=1), Koutros et coll. 2010 mentionne 1 cas sans calcul du SIR
mentionne 1 cas sans calcul du SIR ) ont voulu tenir compte de ce facteur en calculant des ratios d’incidence standardisés (SIR) relatifs (rSIR), en divisant la valeur observée pour un site déterminé par celle observée pour l’ensemble des cancers moins celle de ce site. En procédant de la sorte, les valeurs de rSIR observées sont légèrement supérieures à celles des SIR et montrent une légère augmentation du risque mais sans atteindre un degré de significativité statistique (tableau 7.III
) ont voulu tenir compte de ce facteur en calculant des ratios d’incidence standardisés (SIR) relatifs (rSIR), en divisant la valeur observée pour un site déterminé par celle observée pour l’ensemble des cancers moins celle de ce site. En procédant de la sorte, les valeurs de rSIR observées sont légèrement supérieures à celles des SIR et montrent une légère augmentation du risque mais sans atteindre un degré de significativité statistique (tableau 7.III ).
). ).
). . Cette liste n’est pas exhaustive et afin d’éviter autant que possible toute redondance entre les études, pour chaque localisation géographique et pour un même groupe d’exposition, n’ont été retenues que les études les plus récentes ou les plus complètes. Neuf études ont ainsi été sélectionnées : 7 études européennes et 2 études issues d’Amérique du Nord. La plus importante étude européenne est celle de Pukkala et coll. (2009
. Cette liste n’est pas exhaustive et afin d’éviter autant que possible toute redondance entre les études, pour chaque localisation géographique et pour un même groupe d’exposition, n’ont été retenues que les études les plus récentes ou les plus complètes. Neuf études ont ainsi été sélectionnées : 7 études européennes et 2 études issues d’Amérique du Nord. La plus importante étude européenne est celle de Pukkala et coll. (2009 ) qui présente des données de suivi de 15 millions d’individus provenant de 5 pays nordiques : Suède, Norvège, Islande, Danemark et Finlande. Cette étude a montré une très légère augmentation d’incidence de maladie de Hodgkin chez les agriculteurs (hommes) mais une augmentation plus forte et statistiquement significative chez les femmes agricultrices. Une augmentation non significative a été observée chez les femmes jardiniers alors qu’une diminution non significative a été observée chez les hommes. Deux études Irlandaises ont rapporté des données d’incidence et de mortalité chez des agriculteurs et autres travailleurs agricoles (Dean, 1994
) qui présente des données de suivi de 15 millions d’individus provenant de 5 pays nordiques : Suède, Norvège, Islande, Danemark et Finlande. Cette étude a montré une très légère augmentation d’incidence de maladie de Hodgkin chez les agriculteurs (hommes) mais une augmentation plus forte et statistiquement significative chez les femmes agricultrices. Une augmentation non significative a été observée chez les femmes jardiniers alors qu’une diminution non significative a été observée chez les hommes. Deux études Irlandaises ont rapporté des données d’incidence et de mortalité chez des agriculteurs et autres travailleurs agricoles (Dean, 1994 ; Kelleher et coll., 1998
; Kelleher et coll., 1998 ). Les résultats de ces études ne sont pas significatifs et pourraient paraître contradictoires : alors qu’un risque augmenté d’incidence de maladie de Hodgkin chez les agriculteurs masculins a été rapporté par Kelleher et coll. (1998
). Les résultats de ces études ne sont pas significatifs et pourraient paraître contradictoires : alors qu’un risque augmenté d’incidence de maladie de Hodgkin chez les agriculteurs masculins a été rapporté par Kelleher et coll. (1998 ), une diminution de la mortalité a été observée chez les agriculteurs par Dean (1994
), une diminution de la mortalité a été observée chez les agriculteurs par Dean (1994 ). Chez les utilisateurs de pesticides à usage agricole en Grande-Bretagne, des risques diminués de mortalité et d’incidence de maladie de Hodgkin ont été rapportés mais sans atteindre de significativité statistique (Frost et coll., 2011
). Chez les utilisateurs de pesticides à usage agricole en Grande-Bretagne, des risques diminués de mortalité et d’incidence de maladie de Hodgkin ont été rapportés mais sans atteindre de significativité statistique (Frost et coll., 2011 ). Sur les 7 études européennes, 3 émanent d’Italie (Faustini et coll., 1993
). Sur les 7 études européennes, 3 émanent d’Italie (Faustini et coll., 1993 ; Sperati et coll., 1999
; Sperati et coll., 1999 ; Bucci et coll., 2004
; Bucci et coll., 2004 ). Aucune de ces études n’a montré d’augmentation de risque de maladie de Hodgkin chez les travailleurs agricoles ou utilisateurs de pesticides possédant une licence pour l’achat et l’utilisation de pesticides toxiques, des réductions non significatives de risque ayant été rapportées. Une étude sur les deux en provenance d’Amérique du Nord, a également mentionné des diminutions (non significatives) de risque de maladie de Hodgkin (Semenciw et coll., 1994
). Aucune de ces études n’a montré d’augmentation de risque de maladie de Hodgkin chez les travailleurs agricoles ou utilisateurs de pesticides possédant une licence pour l’achat et l’utilisation de pesticides toxiques, des réductions non significatives de risque ayant été rapportées. Une étude sur les deux en provenance d’Amérique du Nord, a également mentionné des diminutions (non significatives) de risque de maladie de Hodgkin (Semenciw et coll., 1994 ). Dans l’autre étude, un risque accru de façon non significative de mortalité a été observé au sein d’une cohorte d’applicateurs de pesticides aériens (Cantor et Silberman, 1999
). Dans l’autre étude, un risque accru de façon non significative de mortalité a été observé au sein d’une cohorte d’applicateurs de pesticides aériens (Cantor et Silberman, 1999 ).
). ; Waggoner et coll., 2001
; Waggoner et coll., 2001 ), les valeurs de mortalité et d’incidence relatives se voient augmentées de façon non significative, une tendance à l’augmentation de risque de maladie de Hodgkin se retrouve davantage dans les études d’incidence pour les autres études de cohortes. La seule valeur significative rapportée est l’augmentation d’incidence observée chez les agricultrices des pays nordiques, sans toutefois qu’une telle tendance ait été observée dans les autres cohortes.
), les valeurs de mortalité et d’incidence relatives se voient augmentées de façon non significative, une tendance à l’augmentation de risque de maladie de Hodgkin se retrouve davantage dans les études d’incidence pour les autres études de cohortes. La seule valeur significative rapportée est l’augmentation d’incidence observée chez les agricultrices des pays nordiques, sans toutefois qu’une telle tendance ait été observée dans les autres cohortes. .
. ) rapporte une absence de cas alors que 0,5 cas étaient attendus.
) rapporte une absence de cas alors que 0,5 cas étaient attendus. ). Sur la base de ce seul cas, l’étude a rapporté une augmentation non significative de risque de maladie de Hodgkin en termes d’incidence, quelle que soit l’exposition (toutes les expositions ou seulement les fortes expositions). Ce cas n’appartenait pas au groupe de travailleurs potentiellement les plus exposés (au moins 5 ans d’expositions fortes/15 années au moins écoulées depuis la première exposition). Aucun cas de mortalité par suite de maladie de Hodgkin n’a été mis en évidence dans cette étude.
). Sur la base de ce seul cas, l’étude a rapporté une augmentation non significative de risque de maladie de Hodgkin en termes d’incidence, quelle que soit l’exposition (toutes les expositions ou seulement les fortes expositions). Ce cas n’appartenait pas au groupe de travailleurs potentiellement les plus exposés (au moins 5 ans d’expositions fortes/15 années au moins écoulées depuis la première exposition). Aucun cas de mortalité par suite de maladie de Hodgkin n’a été mis en évidence dans cette étude. ) et l’autre sur la mortalité de ces travailleurs (Hofmann et coll., 2006
) et l’autre sur la mortalité de ces travailleurs (Hofmann et coll., 2006 ). Des résultats n’ont été rapportés pour la maladie de Hodgkin que pour les hommes, pas pour les femmes. Une augmentation non significative du risque de maladie de Hodgkin a été rapportée aussi bien pour la mortalité (nombre de cas observés : n=11) que pour l’incidence (n=9) sans qu’il y ait de tendance à l’augmentation de risque avec le nombre de mois de travail ni avec l’ancienneté de la première année de travail (Wesseling et coll., 1996
). Des résultats n’ont été rapportés pour la maladie de Hodgkin que pour les hommes, pas pour les femmes. Une augmentation non significative du risque de maladie de Hodgkin a été rapportée aussi bien pour la mortalité (nombre de cas observés : n=11) que pour l’incidence (n=9) sans qu’il y ait de tendance à l’augmentation de risque avec le nombre de mois de travail ni avec l’ancienneté de la première année de travail (Wesseling et coll., 1996 ).
). ).
). ), aux Pays-Bas (Boers et coll., 2010
), aux Pays-Bas (Boers et coll., 2010 ), au Royaume-Uni (Coggon et coll., 1986
), au Royaume-Uni (Coggon et coll., 1986 ) et au Danemark (Lynge et coll., 1998
) et au Danemark (Lynge et coll., 1998 ) n’a rapporté de cas de maladie de Hodgkin dans ces différentes cohortes si ce n’est un cas unique observé par Coggon et coll. (1986
) n’a rapporté de cas de maladie de Hodgkin dans ces différentes cohortes si ce n’est un cas unique observé par Coggon et coll. (1986 ). Une augmentation non significative du risque de maladie de Hodgkin a été rapportée dans cette dernière étude. Une cohorte américaine de travailleurs dans une industrie (Dow Chemical Company) de production, formulation et empaquetage de 2,4-D au Michigan a été suivie pour la mortalité à la suite de cancers (Burns et coll., 2001
). Une augmentation non significative du risque de maladie de Hodgkin a été rapportée dans cette dernière étude. Une cohorte américaine de travailleurs dans une industrie (Dow Chemical Company) de production, formulation et empaquetage de 2,4-D au Michigan a été suivie pour la mortalité à la suite de cancers (Burns et coll., 2001 ) et pour l’incidence de ceux-ci chez ces travailleurs (Burns et coll., 2011
) et pour l’incidence de ceux-ci chez ces travailleurs (Burns et coll., 2011 ). Aucune de ces deux études n’a montré d’effet significatif sur le risque de maladie de Hodgkin. Une augmentation du risque est observée pour l’étude de mortalité alors que le risque pour les valeurs d’incidence se voit très faiblement diminué dans la cohorte entière.
). Aucune de ces deux études n’a montré d’effet significatif sur le risque de maladie de Hodgkin. Une augmentation du risque est observée pour l’étude de mortalité alors que le risque pour les valeurs d’incidence se voit très faiblement diminué dans la cohorte entière. ; Zahm, 1997
; Zahm, 1997 ).
).