| |
| Med Sci (Paris). 2002 January; 18(1): 25–27. Published online 2002 January 15. doi: 10.1051/medsci/200218125.PML, un nouvel intermédiaire de l’effet antiviral de l’interféron Tarik Regad and Mounira K. Chelbi-Alix* UPR 9045 Cnrs, Institut André Lwoff, 7, rue Guy Moquet, 94801 Villejuif Cedex, France |
Les interférons (IFN) sont des cytokines douées de nombreuses activités biologiques, telles que l’inhibition de la réplication virale, l’inhibition de la multiplication cellulaire, l’induction de l’apoptose ainsi que la modulation de la différenciation et de la réponse immunitaire. L’activité antivirale des IFN est à l’origine de leur découverte. Cette propriété a conduit à l’utilisation des IFN de type I1 dans le traitement de certaines infections virales, dues par exemple aux virus de papillomes et à ceux des hépatites B et C. L’IFN induit ses diverses activités biologiques en augmentant l’expression dans la cellule de plus de 200 protéines. Le rôle de la plupart de ces protéines n’est pas encore élucidé. L’expression de certaines est directement impliquée dans le mécanisme de l’action antivirale de l’IFN : c’est la protéine kinase dépendante de l’ARN double brin (PKR), le système 2’5’oligoadénylate synthétase /RNase L, et certaines formes de protéines Mx [1]. Cependant, l’invalidation des trois gènes PKR, RNase L et Mx ne suffit pas à abolir complètement la réponse antivirale de l’IFNα, suggérant l’implication d’autres gènes dans la réponse antivirale. Des données récentes montrent que PML (promyelocytic leukaemia), protéine induite par l’IFN, est responsable de certains effets antiviraux de cette cytokine. |
Structure et localisation de PML Le gène PML a été découvert dans la leucémie aiguë promyélocytaire associée à la translocation t(15;17) (→) qui conduit à sa fusion avec le gène codant pour le récepteur de l’acide rétinoïque (RARα). PML code pour une protéine nucléaire qui est localisée soit de façon diffuse dans le nucléoplasme, soit sur les corps nucléaires (CN), structures de la matrice nucléaire dont la fonction est encore inconnue. (→) m/s 1994, n°8-9, p. 817 et 2001, n°1, p. 14 Plus d’une trentaine de protéines sont associées aux corps nucléaires, mais PML semble en être l’organisateur car ces structures sont absentes dans les cellules PML−/− [2]. En outre, PML est modifiée de façon covaente par SUMO-1 (small ubiquitin modifier) selon un processus qui ressemble à ’ubiquitinylation et pour lequel trois sites de liaison ont été identifiés (→). Cette modification par SUMO-1 est indispensable à l’intégrité des corps nucléaires. (→) m/s 2000, n°11, p. 1242 Ceux-ci sont aussi altérés dans certaines conditions physiopathologiques, en premier lieu dans la leucémie aiguë promyélocytaire, mais aussi en réponse au stress ou à certaines infections virales. Ils sont en revanche augmentés au cours de traitements par l’IFN. PML est une phosphoprotéine appartenant à la famille RBCC, caractérisée par la présence de quatre motifs. Le premier est un doigt de zinc de type C3HC4 (RING finger) qui est impliqué dans des contacts protéine/protéine. Le motif suivant est composé de deux boites B qui sont des doigts de zinc présents en un ou deux exemplaires dans une sous-famille des protéines RBCC. Les boîtes B sont immédiatement suivies par un domaine de dimérisation par hélices hydrophobes, le domaine coiled-coil. Chacun de ces domaines est important pour la localisation de PML sur les corps nucléaires. Enfin, PML comprend un signal de localisation nucléaire. Du fait d’épissages alternatifs, il existe en fait plusieurs protéines PML très variables dans leurs extrémités C-terminales [3]. |
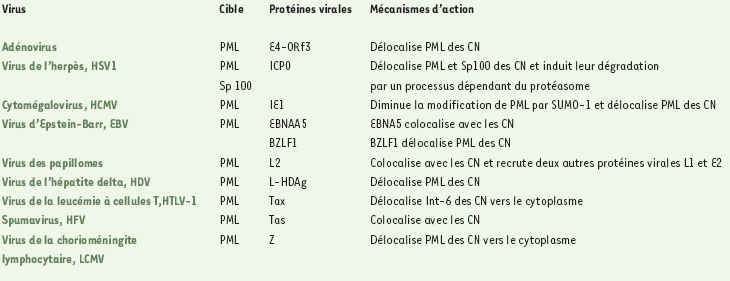
Corps nucléaires PML et infections virales Plusieurs études ont mis en évidence la capacité de virus de familles différentes à modifier ou à détruire les corps nucléaires [1, 4]. Les raisons de ces phénomènes ne sont pas claires, mais on peut envisager qu’en désorganisant ces structures, certains virus développent une stratégie pour détourner la machinerie cellulaire à leur profit afin de se multiplier efficacement. Les corps nucléaires seraient également choisis par certains virus pour commencer leur réplication dans le noyau des cellules infectées. Il en résulte une modification de la structure des corps nucléaires car certaines protéines virales s’y accumulent et entraînent leur désorganisation (Tableau 1).  | Tableau 1. Modification des corps nucléaires (CN) par les protéines virales. |
La possibilité d’un rôle de PML, ou des corps nucléaires, dans la défense contre les infections virales avait été évoquée devant l’induction de l’expression de PML par l’IFN [5]. Le promoteur du gène PML contient en effet des éléments de réponse fonctionnels pour l’IFNα/ß et l’IFNγ [6]. L’IFN induit aussi l’expression de cinq autres protéines qui sont associées aux corps nucléaires comme Sp100, Sp110, Sp140, ISG20 (interferon-stimulated gene product of 20 kd) et PA28, le composant 11S du protéasome [1], suggérant que les corps nucléaires pourraient jouer un rôle dans la réponse à l’IFN. Nous avons montré que l’expression constitutive du gène humain PML dans diverses lignées cellulaires leur permet de résister à certains virus de familles différentes, comme le virus de la stomatite vésiculaire, le virus de la grippe [7,8] ou le HFV (pour human foamy virus) [9]. L’étude des mécanismes précis de cet effet protecteur de PML nous a permis de révéler que cette protéine était capable d’interférer directement avec la réplication du HFV. |
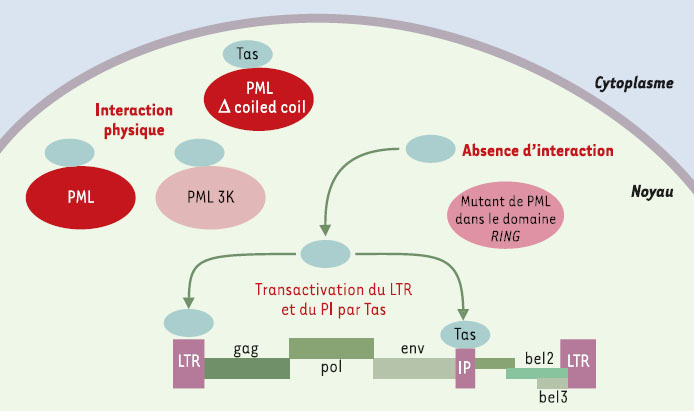
PML, un nouveau maillon de l’effet antiviral de l’interféron Découverts dans les années 1950, les spumavirus HFV (human foamy virus), sont des rétrovirus animaux complexes sans pathologie associée. Leur génome comporte deux gènes structuraux, gag et env, qui codent tous deux pour les protéines entrant dans la composition du virion, le gène pol codant pour les protéines enzymatiques, et trois autres gènes régulateurs dont l’un code pour la protéine Tas. Tas est le transacti-vateur nucléaire indispensable à l’expression du génome viral à partir du promoteur LTR (long terminal repeat) localisé en 5’, mais aussi d’un promoteur interne situé à l’extrémité 3’ du gène env. Ce promoteur interne permet l’expression des gènes régulateurs de façon indépendante de celle des gènes structuraux, ce qui permet donc deux niveaux de contrôle de la transcription (Figure 1).  | Figure 1. Inhibition de la réplication du spumavirus HFV par PML Le génome du virus HFV est constitué de deux gènes structuraux, gag et env, codant tous deux pour les protéines entrant dans la composition du virion et du gène pol codant pour les protéines enzymatiques. Ces gènes sont encadrés par les LTR (long terminal repeat), séquences non codantes qui interviennent dans l’expression du virus, son intégration et sa réplication. Dans le cas du HFV, les gènes régulateurs sont nommés bel1, bel2, bel3, pour between env and LTR. Bel1, renommé Tas (transactivating spuma) est le transactivateur nucléaire indispensable à l’expression virale à partir du LTR mais également à partir d’un promoteur interne (PI) situé à l’extrémité 3’ du gène env. L’expression des gènes régulateurs est donc indépendante de celle des gènes structuraux. La protéine PML inhibe la réplication virale en interagissant directement avec la protéine virale Tas, ce qui l’empêche de se fixer sur le promoteur LTR et le promoteur interne. Cet effet nécessite l’intégrité du domaine RING finger de PML et la région N-terminale de Tas. |
La surexpression de la protéine PML dans différentes lignées cellulaires bloque la réplication virale en agissant au niveau de la transcription du génome viral [9]. PML interagit en effet directement avec la protéine Tas et l’empêche de se lier sur le LTR et le promoteur interne, ce qui bloque donc l’effet transacti-vateur de Tas. L’interaction avec Tas nécessite l’intégrité du domaine RING finger de PML et de la région N-termina-le de Tas. Les mutants de PML dans ce motif ne sont plus capables de bloquer la transcription virale. En revanche, les mutants pour le domaine coiled-coil ou pour les trois lysines cibles des modifications par SUMO (PML 3K) répriment la transcription comme la protéine sauvage (Figure 1) suggérant que l’activité antivirale de PML est indépendante de l’intégrité des corps nucléaires. En outre, l’effet protecteur de la surexpression de PML contre l’infection par le virus HFV est comparable à celui observé dans des cellules traitées avec une forte dose d’IFNα. Dans les fibro-blastes embryonnaires de souris traités à l’IFNα, la transactivation par Tas ainsi sont inhibées. En revanche, dans les mêmes cellules invalidées pour le gène de PML, l’effet antiviral de l’IFN contre ce virus est fortement diminué [9] . Ces résultats montrent donc que PML, qu’elle soit nucléoplasmique ou localisée sur les corps nucléaires, interfère avec la réplication du virus HFV. Elle agit en effet comme répresseur trans-criptionnel du LTR et du promoteur interne du HFV, et semble bien jouer un rôle clé dans l’effet antiviral de l’IFN. Il restera à déterminer si ce mécanisme d’effet antiviral est propre au HFV, ou si PML a la capacité d’inter-agir avec d’autres tran-sactivateurs viraux. |
Nos recherches sont soutenues par le Cnrs et l’Association pour la Recherche contre le Cancer (ARC).
|
Footnotes |
1. Regad, T, Chelbi-Alix MK. Role and fate of PML nuclear bodies in response to inter-feron and viral infections. Oncogene 2001; 20 : 7274–86. 2. Negorev, D, Maul GG. Cellular protein localized at and interacting within ND10/PML nuclear bodies/PODs suggest functions of a nuclear depot. Oncogene 2001; 20 : 7234–42. 3. Jensen K, Shiels C, Freemont PS. PML protein isoforms and the RBCC/TRIM motif. Oncogene 2001; 20 : 7223–33. 4. Chelbi-Alix MK, de The H. Herpes virus induced proteasome-dependent degradation of the nuclear bodies-associated PML and Sp100 proteins. Oncogene 1999; 18: 935–41. 5. Chelbi-Alix MK, Pelicano L, Quignon F, et al. 1995. Induction of the PML protein by interferons in normal and APL cells. Leukemia 1995; 9 : 2027–33. 6. Stadler M, Chelbi-Alix MK, Koken MH, et al. Transcriptional induction of the PML growth suppressor gene by interferons is mediated through an ISRE and a GAS element. Oncogene 1995; 11 : 2565–73. 7. Chelbi-Alix MK, Pelicano L, Quignon F, Koken MHM, de Thé H. Regulation of cell growth differentiation and genetics in cancers. In : Tsiftsoglou AS, Sartorelli AC, Housman DE, Dexter MT, eds. Tumor Biology 1996; 99: 17–27. 8. Chelbi-Alix MK, Quignon F, Pelicano L, Koken MH, de The H. Resistance to virus infection conferred by the interferon-induced promyelocytic leukemia protein. J Virol 1998; 72 :1043–51. 9. Regad T, Saib A, Lallemand-Breitenbach V, Pandolfi PP, de The H, Chelbi-Alix MK. PML mediates the interferon-induced antiviral state against a complex retrovirus via its association with the viral transactivator. EMBO J 2001; 20 : 3495–505 |