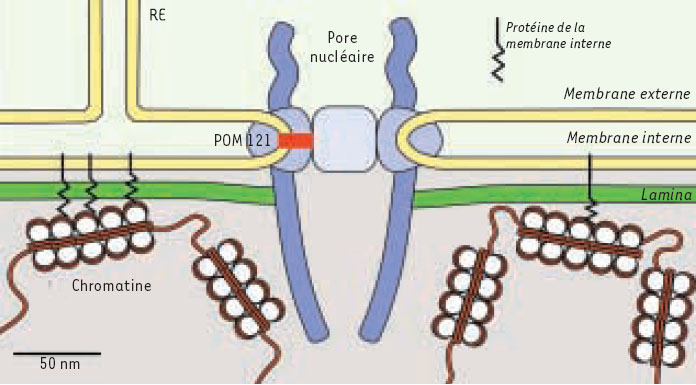
La dynamique de l’enveloppe nucléaire est totalement bouleversée en mitose. Chez les eucaryotes supérieurs, l’enveloppe est entièrement dispersée dans les périodes de prophase et prométaphase, puis réassemblée à la fin de la mitose. Jusqu’à présent, on connaissait surtout les mécanismes biochimiques associés à la rupture de l’enveloppe nucléaire. Le schéma qui découlait de ces études in vivo stipulait que la rupture débute avec la dépolymérisation de la lamina, due à la phosphorylation de ses constituants, puis survient une déstabilisation et une vésiculation des membranes [8]. On sait maintenant qu’in vivo,lors de la mitose, les protéines membranaires de l’enveloppe nucléaire sont dispersées dans le réticuum endoplasmique, et ne s’accumulent pas dans des vésicules [5]. Par ailleurs, Georgatos et al. avaient aussi observé sur des préparations de celules fixées que les micro-tubules étaient co-locaisées avec des invaginations qui apparaissaient dans l’enveloppe lors de la prophase, mais dont la fonction est restée jusqu’à maintenant controversée [9].
Nous avons donc précisé la chronologie de la rupture de l’enveloppe nucléaire in vivo [10]. Une première observation montre que la perméabilisation de l’enveloppe nucléaire intervient avant la dépolymérisation de la lamina, contrairement à ce que suggéraient les données in vitro. En outre, nous avons pu vérifier que les microtubules sont impliqués dans le mécanisme. Dans la période qui précède la perméabilisation, et jusqu’à une heure avant cette modification, des plis, co-localisés avec des faisceaux de microtubules, se forment le long de l’enveloppe nucléaire, dans la région des centrosomes. Environ 10 minutes avant la perméabilisation, des invaginations de l’enveloppe, ayant les centrosomes àleur base, croissent à l’intérieur du noyau. En utilisant la même technique de “photoblanchiment” que précédemment, nous avons pu montrer qu’en parallèle, la lamina est mise sous tension et étirée sous l’effet des microtubules, localement et dans des régions généralement éloignées des centrosomes. Finalement, la perméabilisation se produit lors de l’apparition de trous dans l’enveloppe, dans la région où l’étirement est maximal, suggérant un déchirement de la lamina. Par la suite, de nouveaux trous apparaissent et la plupart des protéines de l’enveloppe commencent à se disperser, puis, lorsque l’enveloppe nucléaire est fragmentée, les fragments initialement attachés aux chromosomes s’en détachent et sont entraînés vers les centrosomes, où ils sont finalement dispersés. Ce mouvement suggère qu’un moteur moléculaire migrant vers le pôle négatif des microtubules, tel que la dynéine [11], est impliqué dans le mécanisme.
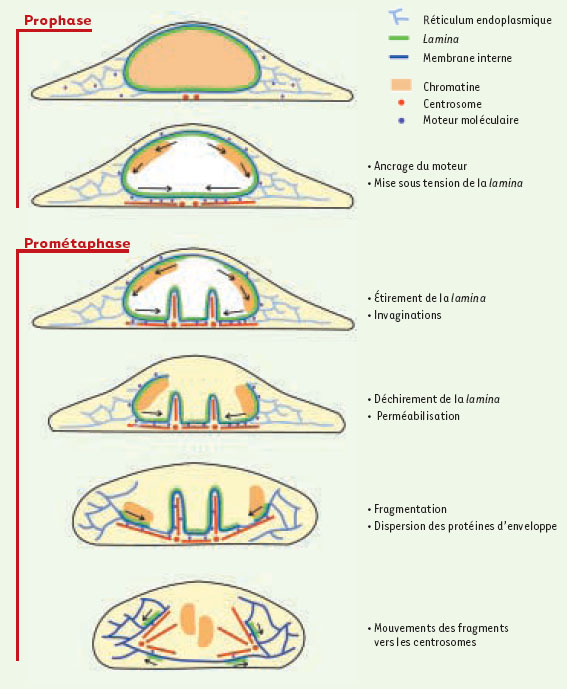
La récapitulation de ces événements dynamiques nous fait proposer le modèle suivant (Figure 2): en prophase, un moteur moléculaire migrant vers le pôle négatif des microtubules est ancré sur l’enveloppe nucléaire et la connecte aux microtubules (Figure 2B). L’enveloppe nucléaire est alors tirée par ces moteurs en direction des centrosomes, ce qui provoque une accumulation de membranes et de lamina autour des centrosomes. Cette accumulation entraîne la formation des invaginations observées à l’intérieur du noyau (Figure 2C). Mais les forces dirigées vers les centrosomes affectent principalement les régions distantes de ces invaginations, où la lamina est étirée et finalement déchirée (Figure 2D). La perméabilisation a alors lieu, mais la tension se poursuit, facilitant la formation de nouveaux trous, puis la fragmentation, et finalement l’attraction des fragments vers les centrosomes (Figure 2E,F).
 | Figure 2. Modèle de la rupture de l’enveloppe nucléaire. |
Le processus mécanique que nous proposons n’explique pas tout, et la dispersion des protéines de l’enveloppe est sans doute principalement dépendante de leur phosphorylation. Par ailleurs, plusieurs questions subsistent: comment se transmet la force produite par les microtubules, qui sont dans le cytoplasme, à la lamina, qui, elle, se trouve à l’intérieur du noyau ? L’ancrage des pores nucléaires sur la lamina permet de relier mécaniquement le cytoplasme à la lamina, mais la connexion entre les pores et le moteur moléculaire reste à établir. En outre, si les microtubules sont dépolymérisés en prophase, la rupture de l’enveloppe nucléaire a toujours lieu, même si elle met en jeu un mécanisme différent, d’où la question suivante: quelle est la fonction d’un tel mécanisme, puisque la phosphorylation des protéines de l’enveloppe semble suffire pour les disperser. Il est possible que l’association de facteurs mécaniques et biochimiques augmente l’efficacité de la rupture de l’enveloppe et permette une entrée complète et irréversible en méta-phase, mais cela reste à montrer.
L’analyse de la dynamique des protéines dans les cellules vivantes nous rappelle que les systèmes biologiques ne sont pas uniquement régis par des interactions biochimiques entre molécules, mais aussi par leur cinétique. Les techniques d’imagerie en microscopie confocale permettent de reconstituer des structures en 3 dimensions, d’observer leurs transformations au cours du temps et de quantifier divers paramètres contrô-ant des processus qui, de prime abord, apparaissent fondamentaux et pourtant s’avèrent extrêmement difficiles à étudier in vitro dans leur globalité.