| |
| Med Sci (Paris). 2002 January; 18(1): 45–54. Published online 2002 January 15. doi: 10.1051/medsci/200218145.Les kératines : un autre regard sur la biologie de la peau Olivier Bousquet* and Pierre A. Coulombe Department of Biological Chemistry, School of Medicine, The Johns Hopkins University, 725 N. Wolfe Street, Baltimore, MD 21205, États-Unis. www.jhmi.edu/~pacoulom/ |
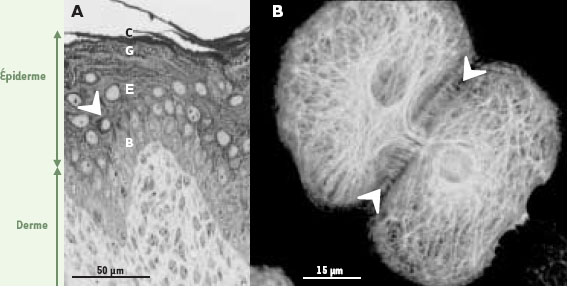
Avec une surface d’environ 2 m2 et un poids moyen représentant 15 % de celui d’un adulte, la peau est l’organe le plus important du corps humain. Elle est composée de deux principaux tissus, l’épiderme, qui siège à l’extérieur, et un tissu conjonctif qui comporte le derme et l’hypoderme. Sa destruction ou son altération a des conséquences extrêmement graves pour l’organisme, pouvant rapidement entraîner la mort. Il s’agit donc d’un organe vital agissant comme une véritable barrière face aux agressions chimiques ou à l’entrée de microorganismes. C’est l’épiderme, un épithélium stratifié hautement spécialisé, localisé à la surface de la peau, qui assure l’essentiel de la fonction protectrice [1]. Cela est rendu possible grâce à la structure particulière de ce tissu composé principalement de kératinocytes. Ces cellules sont disposées en quatre couches qui sont (de la profondeur vers la surface) les cellules basales, les cellules épineuses, les cellules granuleuses et les cellules mortes de la couche cornée (Figure 1A). Cette couche superficielle est constituée d’un amas de cellules très aplaties dépourvues de noyau et d’organites : les cornéocytes. Ces cellules desquament à la surface de la peau et doivent être continuellement remplacées. L’épiderme est donc un tissu qui se renouvelle constamment et où le taux de cellules perdues à la surface est contrebalancé par le taux de cellules produites au niveau de la couche basale, unique couche composée de kératinocytes mitotiquement actifs [1]. Sous l’effet de signaux encore mal définis, les kératinocytes basaux entrent dans un processus de différenciation, commencent leur migration vers la surface et acquièrent progressivement les caractéristiques structurales et fonctionnelles des cornéocytes [2]. La fonction de barrière de l’épiderme est assurée à la surface par une structure produite par les cornéocytes et appelée enveloppe cellulaire. Située contre la membrane plasmique, l’enveloppe cellulaire est composée de nombreuses protéines réticulées par des transglutaminases formant un complexe protéique macromoléculaire particulièrement stable et insoluble [3]. La protection de l’organisme est aussi assurée par la formidable cohésion cellulaire de l’épiderme qui lui permet de résister aux continuelles frictions mécaniques que subit la peau. Cette cohésion est due à la présence d’un très grand nombre de jonctions cellulaires de type jonctions adhérentes, desmosomes (interactions cellules/cellules) et hémidesmosomes (interactions cellules/matrice extracellulaire). La force de cohésion de ces jonctions est renforcée par un réseau filamenteux supracellulaire composé de kératines [4] (Figure 1B). 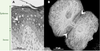 | Figure 1. A. Coupe de peau provenant de la queue d’une souris colorée au bleu de toluidine et montrant l’organisation de l’épiderme. C : cornéocytes ; G : cellules granuleuses ; E : cellules épineuses ; B : cellules basales ; le matériel foncé indiqué par les flèches représente les kératines. B. Immunofluorescence montrant l’organisation du réseau de kératines K5/K14 dans des kératinocytes de souris en culture. Les flèches blanches indiquent les jonctions cellulaires où s’ancrent les filaments de kératines pour former une structure supracellulaire. |
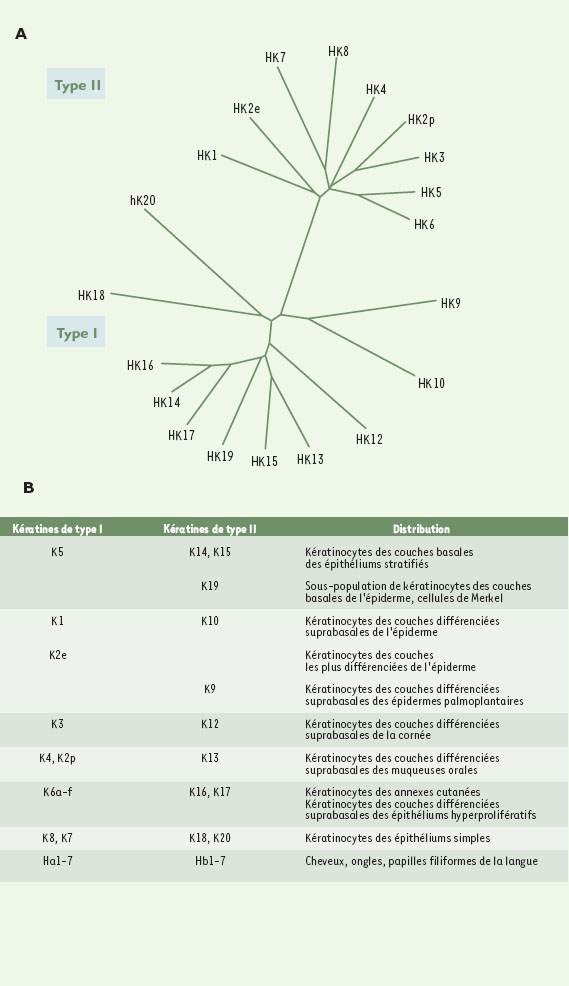
Les kératines sont des protéines du cytosquelette appartenant à la famille des protéines de filaments intermédiaires (IFP). Selon les critères utilisés (structure des gènes, homologie de séquences ou propriétés d’assemblage), les nombreux gènes (plus de 50) codant pour ces protéines peuvent être classés en 5 ou 6 types [5, 6]. Les IFP ont toutes la même organisation structurale. Elles possèdent un domaine central en hélice αd’environ 310 acides aminés, encadré par un domaine amino-terminal et un domaine carboxy-terminal non hélicoïdaux de taille extrêmement variable. La plupart de ces protéines sont spécifiques d’un type ou d’un état de différenciation cellulaire et forment des réseaux composés de filaments de 10 nm de diamètre, reliant la membrane nucléaire à la membrane cytoplasmique [7]. Les kératines, regroupant à elles seules plus de 35 protéines différentes, sont exprimées dans les épithéliums. Les kératines acides (K1 à K8 et Ha1 à Ha7) représentent les IFP de type I et les kératines basiques (K9 à K20 et Hb1 à Hb6) les IFP de type II (Figure 2A). Les gènes k1-k20 sont exprimés dans les épithéliums “mous” représentés par des tissus glandulaires (pancréas, glandes salivaires…) et par les épithéliums simples (foie, intestin…) ou stratifiés (épiderme, cornée, langue…) [8]. Les épithéliums “durs” (cheveux, ongles) expriment les gènes ha1-ha7 et hb1-hb6 [9].  | Figure 2. A. Arbre phylogénique reconstruit d’après les séquences protéiques des kératines humaines. Pour plus de simplicité, les kératines des épithéliums “durs” (cheveux, ongles) n’ont pas été représentées et la kératine HK6 représentée est HK6a, les autres isoformes lui seraient superposées compte tenu de la très grande homologie de séquences entre ces protéines. Cet arbre a été obtenu avec les logiciels CLUSTALW (http://www2.ebi.ac.uk/clu stalw/) et TreeViewPPC. B. Distribution tissulaire et cellulaire des différentes kératines. |
La polymérisation des filaments de kératines débute obligatoirement par la formation d’un hétérodimère comprenant une protéine de type I et une protéine de type II [10]. Une cellule épithé-iale doit donc coordonner l’expression d’au moins deux gènes pour produire un réseau de kératines dans son cytoplasme. Le contrôle de ’expression de la plupart de ces gènes concerne donc des paires de gènes et est spécifique d’un état de différenciation cellu-aire (Figure 2B). Ce phénomène est bien illustré par les épithéliums stratifiés. Dans ces épithé-iums, les cellules basales, mitotiquement actives, expriment principalement k5 et kl4, tandis que les kératinocytes différen-ciés des couches supérieures expriment d’autres paires de kératines selon le programme de différenciation qui est exécuté. Par exemple, la paire K1-K10 est caractéristique de l’épiderme, la paire K4-K13 est exprimée dans les épithéliums humides comme la langue ou l’œsophage et la paire de kératines K3-K12 est spécifique de la cornée [11]. Ce profil d’expression est très conservé chez les vertébrés supérieurs, quoique sa signification soit encore mal connue. Cependant, il semblerait que chaque paire de kératines confèrerait des propriétés mécaniques spécifiques adaptées aux cellules dans lesquelles elles sont exprimées [12]. Une des caractéristiques des filaments de kératines est leur capacité d’élaborer des réseaux constitués de câbles ou tonofilaments correspondant à la juxtaposition de plusieurs filaments de 10 nm de diamètre. Ces câbles relient la région périnucléaire à la membrane cytoplasmique, où ils sont ancrés au niveau des desmosomes et des hémidesmosomes. Dans l’épiderme, un tissu particulièrement riche en desmosomes, l’organisation des réseaux de kératines transcende les limites de la cellule pour former un réseau supracellulaire [4]. C’est dans ce contexte que la fonction des kératines prend véritablement tout son sens. En effet, ces protéines ont une telle importance dans la cohésion et l’élasticité de l’épiderme qu’une perte, même partielle, de leur fonction entraîne une fragilisation de ce tissu. De ce fait, de nombreuses maladies sont dues à des mutations localisées dans les gènes codant pour ces protéines [13, 14]. En général, le moindre frottement au niveau de la peau provoque, chez ces malades, une lyse des kératinocytes et leur dissociation du tissu épidermique. L’identité du gène muté et le caractère de la mutation déterminent le tableau clinique de la maladie [15]. Par exemple, des mutations dans k5 ou k14 provoquent des épidermolyses bulleuses simples (EBS), maladies caractérisées par un défaut de cohésion dermoépidermique provoquant la formation de cloques à la suite de traumatismes mécaniques minimes. Des mutations dans k1 ou k10 provoquent, quant à elles, des hyperkératoses épidermiques caractérisées par la dissociation des couches suprabasales de l’épiderme. Récemment, il a été montré que certaines mutations impliquées dans ces maladies modifient les propriétés mécaniques des filaments de kératines [16]. Parmi les différentes kératines exprimées dans l’épiderme, trois ont particulièrement retenu notre attention. Il s’agit de K6, K16 et K17. Dans des conditions normales, elles présentent la particularité d’avoir une expression faible et restreinte à des structures bien précises. En revanche, leur expression est très fortement augmentée et plus étendue à la suite d’une lésion de la peau ou dans les épithéliums stratifiés subissant une différenciation anormale ou une hyperprolifération. |
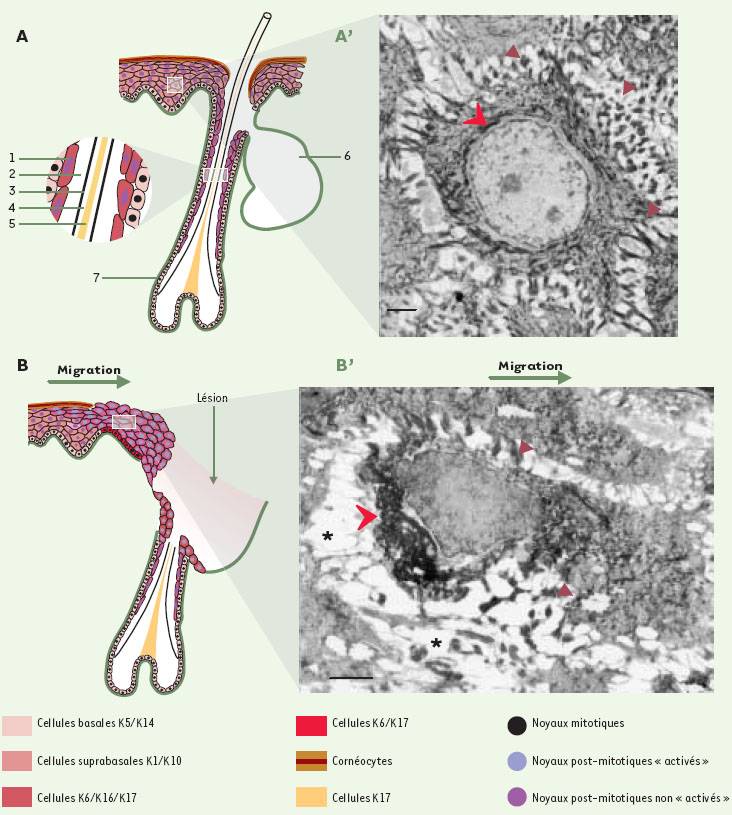
Les kératines K6, K16 et K17 Chez l’homme, il existe 6 gènes codant pour 6 isoformes de K6 appelés hk6a à hk6f, qui ont des séquences nucléotidiques (séquences non codantes comprises) extrêmement voisines [17]. Une étude réalisée par RTPCR a montré que les ARNm les plus exprimés étaient ceux codant pour HK6a, et dans une moindre mesure, HK6b, les quatre autres isoformes étant très peu représentées [17]. Il est intéressant de noter qu’il existe chez les bovins au moins trois gènes k6 fonctionnels [18] et deux chez la souris (mk6α et mk6β)[19]. La comparaison de leur séquence suggère qu’il n’existe pas un schéma commun rendant compte de leur diversification. Au cours de l’évolution, la duplication des gènes k6 a donc dû avoir lieu d’une manière indépendante, vraisemblablement après la séparation de ces espèces [17]. Enfin, les séquences en acides aminés des isoformes de K6 sont très proches de celle de K5. En effet, il y a 66 %, 90 % et 56 % d’identité entre, respectivement, le domaine amino-terminal, le domaine central et l’extrémité carboxy-terminale de ces protéines [20]. La très grande homologie de séquence entre les gènes k16, k17 et k14 a rendu leur clonage très délicat. Les séquences complètes de k16 et de k17 n’ont été établies sans équivoque que très récemment et ont montré une très grande conservation entre les séquences murines et humaines [21, 22]. L’identité entre leurs séquences nucléotidiques et d’acides aminés est si importante que ces trois protéines constituent véritablement un sousgroupe à l’intérieur des kératines de type I (figure 2A). En fait, K14 et K16 ne diffèrent significativement qu’à leur extrémité carboxy-terminale. Quant à K17, elle possède un domaine amino-terminal relativement distinct de celui de K14 et de K16, mais sa partie carboxyterminale est très proche de celle de K14 [20]. Dans des conditions normales, K6, K16 et K17 sont absentes de l’épiderme mais sont présentes dans les différentes annexes cutanées. Dans les follicules pileux, elles sont exprimées au niveau de la gaine épithéliale externe et dans les glandes sudoripares apocrines [23]. K17 est aussi présente dans le cheveu adulte au niveau de la médullaire (la partie centrale du poil) [24]. K17 est donc, à ce jour, la seule kératine des épithéliums “mous” à être aussi exprimée dans un épithélium “dur”. Dans les glandes sudoripares eccrines, K6 et K16 sont localisées dans le conduit sudorifère alors que K17 est présente dans les cellules myoépithéliales du glomérule sudoripare [20]. Ces trois kératines sont aussi synthétisées au niveau de la matrice et/ou du lit de l’ongle. Enfin, K6, K16 et K17 sont présentes de manière très hétérogène dans les épidermes palmoplantaires. L’expression de k6, k16 et k17 peut être induite dans un certain nombre de maladies associées à une augmentation de la prolifération et/ou une différenciation anormale du tissu épithélial [25, 26]. Des exemples classiques de telles maladies sont le psoriasis, les carcinomes des cellules basales ou des couches différenciées, les infections par le virus du papillome humain et même les dermatofibromes qui affectent principalement le derme [27]. Leur expression est aussi très fortement augmentée lors du processus de cicatrisation. Récemment, des travaux réalisés chez l’homme et la souris, ont montré une forte induction de k6, k16 et k17 dans l’épiderme bordant la plaie dès les premières heures qui suivent la blessure [29]. K16 est détectée uniquement au niveau des kératinocytes post-mitotiques, K17 et K6 sont, elles, présentes dans toutes les couches de l’épiderme [22, 29] (Figures 3A et 3B). Cette accumulation de nouvelles kératines se fait au détriment de K1 et K10 normalement exprimées en abondance dans les kératinocytes nouvellement différenciés [28, 29]. Ce changement dans l’expression des kératines est aussi observé chez les bovins [30] et représente donc une réponse commune aux mammifères. Pendant la réépithélialisation des plaies, K6, K16 et K17 doivent exercer un rôle spécifique ne pouvant pas être assuré par les kératines normalement exprimées dans les épithé-liums stratifiés. 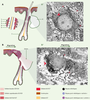 | Figure 3. Schéma représentant l’expression de k6, k16 et k17 dans l’épiderme et les follicules pileux dans des conditions normales (A) et au cours du processus de cicatrisation (B). 1 : gaine épithéliale externe ; 2 : gaine épithéliale interne ; 3 : cuticule ; 4 : écorce ; 5 : médullaire ; 6 : glande sébacée ; 7 : follicule pileux. A’ et B’ : microscopie électronique à transmission montrant une cellule épineuse non “ activé e” (A’) et une cellule épineuse “activée ” (B’). Dans les conditions normales, l’expression de k6, k16 et k17 est restreinte aux cellules de la couche interne de la gaine épithéliale externe des follicules pileux (A). Les cellules épineuses présentent de nombreux desmosomes (A’ flèches bistres) et le réseau de kératines couvre l’ensemble du cytoplasme en formant une cage autour du noyau (flèche rouge). Barre : 1 mm. Pendant le processus de cicatrisation, l’expression de k6, k16 et k17 est induite dans l’épiderme en bordure de la plaie et est fortement augmentée dans les cellules de la gaine externe des follicules pileux (B). Les cellules épineuses “ activées ” sont polarisées, le réseau de kératines (flèche rouge) forme un agrégat derrière le noyau, les desmosomes (flèches bistres) sont moins nombreux et de larges espaces (astérisques) se forment entre les cellules. Barre : 1 mm. |
Enfin, ces kératines sont aussi impliquées dans un certain nombre de maladies héréditaires connues sous le nom de Pachyonychia congénitale (PC). Ces maladies se caractérisent par une déformation et un épaississement des ongles et, selon les variantes cliniques considérées, des lésions dans d’autres épithéliums stratifiés [31]. Les deux principales formes sont la maladie de Jadassohn-Lewandwsky ou PC-1 due à des mutations dans hk6a ou hk16 et la maladie de Jackson-Lawler ou PC-2 due à des mutations dans hk17 [32]. En parfait accord avec la distribution de ces kératines, les différents types de PC présentent, à des degrés divers, une altération des follicules pileux, des glandes sudoripares et de la peau palmo-plantaire. Les patients souffrant de PC-1 présentent en plus des lésions au niveau de l’épiderme buccal, et ceux atteints de PC-2 possèdent des dents dès la naissance [31]. Histologiquement, le principal tissu touché par ces maladies est le lit de l’ongle, un épithélium exprimant fortement k6, k16 et k17 [24]. Les différentes caractéristiques de ces kératines laissent penser qu’elles ont non seulement un rôle structural bien spécifique mais qu’elles interviennent aussi dans la différenciation de la peau. |
Rôle cyto-architectural et activation des kératinocytes Les premières observations suggérant un rôle cytoarchitectural important pour ces kératines proviennent d’études portant sur la cicatrisation. k6, k16 et k17 sont en effet connus pour leur forte induction dans l’épiderme au niveau des kératinocytes situés en bordure des plaies. Cette induction a lieu dès les premières heures (~ 6h) qui suivent la lésion de la peau [29]. La présence de ces kératines et les changements dans l’expression de certains gènes qui ont lieu dans les premières 24 heures caractérisent la phase d’activation des kératinocytes [33]. Cette phase précède la migration de ces cellules vers le centre de la plaie. Les kératinocytes activés sont hypertrophiés et passent d’une forme polygonale à une forme allongée et polarisée, le réseau de kératines se fragmente et se rétracte de la périphérie cellulaire vers la membrane nucléaire et le nombre de desmosomes décroît considérablement [29] (Figures 3A’ et 3B’). Cette observation a une grande importance car on peut raisonnablement penser qu’un kératinocyte, présentant un réseau de kératines K1/K10 sous la forme de câbles reliant la région périnucléaire aux desmosomes, ne présente pas la plasticité requise pour une cellule en migration. Des expériences réalisées sur des cultures cellulaires et l’obtention de différents types de souris transgéniques ont montré que K16 joue un rôle important dans l’activation des kératinocytes. L’expression de hk16 dans des cellules épithéliales en culture ou dans les kératinocytes post-mitotiques de souris transgéniques provoquent une agrégation du réseau de kératines endogène dans la région périnucléaire de ces cellules [34, 29]. D’autres souris transgéniques, chez lesquelles hk16 est cette fois exprimé dans les cellules basales, présentent aussi une compaction et une réorganisation du réseau de kératines K5-K14 endogène ainsi qu’une diminution de l’adhérence cellulaire [35]. Dans tous les cas, la morphologie de ces différents kératinocytes affectés est remarquablement semblable à celle d’un kératinocyte activé. En revanche, aucun de ces changements ne peut être observé lorsque le domaine carboxy- terminal de HK16 est remplacé par celui de HK14 [35]. Récemment, des expériences de rhéologie ont montré que le domaine carboxy-terminal de HK14, qui n’est pas nécessaire à la formation des filaments, participe significativement aux propriétés élastiques d’une suspension de filaments de kératines in vitro [36]. Ces propriétés dépendent en grande partie d’interactions entre le domaine carboxyterminal et les filaments de kératines eux-mêmes [36]. Ainsi, l’expression de k16 dans des cellules épithéliales peut changer profondément la nature des interactions au sein d’un réseau de kératines et provoquer ainsi une réorganisation ou une agrégation du réseau. Toutefois, il est important de noter que la présence de K16 n’implique pas forcément la désorganisation d’un réseau de kératines. En effet, dans les conditions normales, les cellules exprimant k16 ont un réseau de kératines couvrant l’ensemble du cytoplasme. De plus, lorsque les kératinocytes, provenant des souris transgéniques exprimant k16 dans les cellules basales, sont mis en culture, ils ne présentent pas tous une désorganisation de leur réseau de kératines [37]. Cela implique que l’action de K16 ne dépend pas uniquement de sa concentration, tant relative qu’absolue, mais aussi du contexte dans lequel elle est exprimée, à savoir l’état de différenciation des cellules et l’identité des kératines endogènes [12, 37]. Si K16 joue un rôle dans l’activation des kératinocytes épidermiques pendant la cicatrisation, MK6α semble, elle, jouer un rôle dans celle des kératinocytes des follicules pileux [38]. En effet, à la suite d’une blessure peu profonde, ces cellules sont aussi capables de migrer vers l’épiderme et de coloniser le site de lésion [39]. Or, chez des souris dépourvues de mk6α, la prolifération et la migration de ces kératinocytes s’effectuent avec retard [38]. Malgré une meilleure connaissance de la fonction de ces protéines lors du processus de cicatrisation, les mécanismes moléculaires impliqués et leur rôle dans les tissus normaux restent toujours à élucider. La présence de ces kératines dans des épidermes mitotiquement très actifs a conduit à la notion bien établie que ces protéines sont des marqueurs biochimiques de l’hyperproli-fération. Cependant, dans la grande majorité des cas, l’expression de ces gènes in vivo se situe dans des cellules épithéliales post-mitotiques. De plus, l’expression de k6 et k16 peut être expérimentalement découplée de la prolifération cellulaire dans des cultures de kératinocytes [40]. Comme l’ont fait remarquer Sun et al., l’induction de l’expression de k6, k16 et k17 doit plutôt être interprétée comme l’indication de la mise en place d’une voie de différenciation épithéliale alternative [40]. |
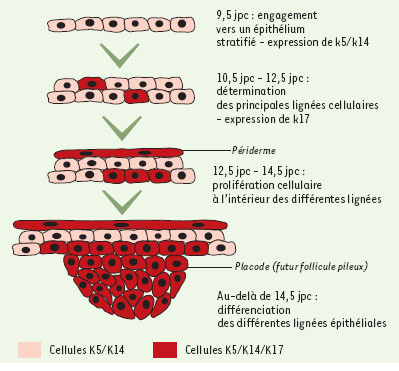
Rôle au cours du développement et de la différenciation de l’épiderme Pour mieux connaître l’organogenèse des mammifères, il est indispensable d’identifier les étapes au cours desquelles les différentes lignées cellulaires apparaissent et où la différenciation a lieu. Pour cela, l’épiderme embryonnaire représente un excellent système car il se développe et se différencie à partir de l’ectoderme épidermique qui ne comporte qu’une seule assise cellulaire, pour former un épithélium stratifié dont la couche cellu-laire la plus externe, le périderme, sera ensuite éliminée lorsque les couches internes seront différenciées en épiderme vrai. En parallèle, certaines cellules de l’ectoderme épidermique s’engagent dans une voie de différenciation différente. Sous le contrôle des cellules mésodermiques sous-jacentes, ces cellules vont se diviser et s’agréger pour former une structure appelée placode. Ces placodes vont ensuite s’allonger et s’enfoncer dans le mésenchyme pour former les annexes cutanées. Le suivi, au cours du développement, de l’expression des gènes codant pour différentes kératines a considérablement accru notre compréhension de ce processus [41]. L’expression de k6, k16 et k17 dans les différents appendices cutanés, et leur forte induction lors de la cicatrisation, font de ces gènes d’excellents candidats pour apporter de nouveaux éléments dans notre compréhension de la morphogenèse de la peau. L’étude de l’expression de k17 au cours du développement en est un excellent exemple. Chez la souris, la kératine K17 commence à être présente dans quelques cellules de l’ectoderme épidermique lorsque celui-ci n’est composé que d’une seule assise cellulaire [22] (Figure 4). A ce stade, ces cellules expriment toutes K8-K18 et K5-K14 et conservent leur caractère pluripotent [42]. Lorsque l’ectoderme épidermique commence à se stratifier et comporte deux à trois assises cellulaires, K17 est présente dans la couche inférieure et dans la couche la plus externe. Dans la couche inférieure, K17 est exprimée dans des groupes de 2 à 3 cellules régulièrement espacées le long de la surface dorsale de l’embryon. Le suivi de l’expression de K17 montre que ces cellules vont ensuite former les placodes puis les futurs follicules pileux (Figure 4). Dans la couche cellulaire externe, K17 est d’abord détectée dans des cellules isolées puis, transitoirement, dans la totalité du périderme. A la naissance, le profil d’expression de K17 est semblable à celui de l’adulte c’est-à-dire essentiellement restreint aux follicules pileux. L’expression de k17 dans une sous-population cellulaire de l’ectoderme épidermique révè-le donc l’engagement de ces cellules dans une voie de différenciation non épidermique menant à la formation du périderme et des différentes annexes cutanées. Cela est à rapprocher des conséquences que la mutation de k17 peut provoquer sur le développement des dents, des glandes sudoripares et de certains poils chez les patients atteints de PC-II [31]. Ainsi, K17 semble jouer un rôle important lors de la différenciation de la peau. La manière dont elle intervient n’est pas encore connue, mais une hypothèse peut être avancée.  | Figure 4. Schéma représentant l’expression de K17 au cours du développement embryonnaire chez la souris. jpc : jour post-coïtum. |
La plupart des tissus exprimant k17 sont capables de migrer ou de se contracter. C’est le cas des cellules qui composent les placodes ou des kératinocytes activés en bordure des plaies qui, tous, migrent à travers un tissu conjonctif. C’est aussi le cas des cellules myoépithé-liales des tissus glandulaires qui se contractent afin d’expulser le contenu glandulaire vers les canaux. La migration et la contraction sont deux mécanismes faisant intervenir un réseau d’actine particulièrement important. Récemment, différents laboratoires ont montré que les interactions croisées entre les IFP et les filaments d’actine, via des protéines du type plectine ou BPAG1 (bullous pemphigoid antigen 1), sont essentielles [43]. Les réseaux de kératine contenant K17 pourraient donc avoir des propriétés uniques leur permettant d’établir ce type d’interactions. Ces interactions croisées seraient nécessaires pour coordonner la migration ou la contraction des cellules au sein d’un tissu. K16 est un autre exemple de protéine pouvant intervenir dans la différenciation de la peau. Nous avons vu plus haut que l’expression de hk16 dans les cellules basales de souris transgéniques provoque des modifications morphologiques et structurales majeures dans ces cellules. Mais le changement le plus remarquable observé dans ces souris concerne le développement, la différenciation et la maturation de la peau [35]. Dans les toutes premières semaines qui suivent la naissance, l’épiderme de ces souris est plus épais et présente une hyperprolifération des cellules basales. A l’inverse, comparés aux souris témoins, les follicules pileux sont moins nombreux et mal orientés et les kératinocytes de la gaine externe prolifèrent peu. Trois semaines après la naissance, ces souris n’ont pratiquement pas de poils; en revanche, les cellules des follicules pileux prolifèrent et l’épiderme s’amincit. Un retour à la normale est observé 4 à 5 semaines après la naissance. Malgré tout, les poils ont un retard dans leur développement et une mauvaise orientation. C’est le premier exemple montrant que l’expression ectopique d’une kératine est capable d’affecter la différenciation d’un épithélium. Différentes observations suggèrent que la voie de signalisation du récepteur du facteur de croissance épidermique (EGFR, epidermal growth factor receptor) est impliquée. A la naissance, à niveau d’expression équivalent, EGFR est deux fois plus phosphorylé dans les souris transgéniques que dans les souris témoins. Cette phosphorylation revient à la normale une semaine après la naissance. De plus, des expériences ont montré qu’in vivo le récepteur de l’EGF et son ligand EGF jouent un rôle dans la prolifération de l’épiderme et la différenciation des follicules pileux [44]. Nous ne savons toujours pas comment K16 interfère avec la voie de signalisation du récepteur de l’EGF, mais il est intéressant de noter que son niveau d’expression augmente pendant la cicatrisation et que ce récepteur est supposé jouer un rôle important lors de ce phénomène [45]. |
Chez l’adulte, la régénération de nombreux tissus fait intervenir des mécanismes moléculaires semblables à ceux qui sont utilisés pendant le développement embryonnaire. Cela semble aussi s’appliquer à la morphogenèse de la peau. L’étude des kératines K6, K16 et K17 indique en effet que le programme génomique, intervenant lors du processus de cicatrisation, doit avoir une certaine relation avec celui qui est exécuté à certains stades du développement embryonnaire. Dans les deux cas, des cellules doivent s’engager dans une voie de différenciation épithéliale différente, proliférer et migrer. Dans les deux cas, ces kératines sont exprimées très tôt, avant même la prolifération et la migration. Nous avons vu dans l’introduction que le rôle des kératines ne prend véritablement tout son sens qu’au sein d’un tissu car elles peuvent y former un réseau supracelu-laire. De même, K6, K16 et K17 sont exprimées dans des cellules qui doivent se différencier, proliférer ou migrer non pas individuellement mais au sein d’un groupe ou d’un feuillet cellulaire. Le rôle de ces protéines doit donc être indissociable de ce contexte. Une des possibilités est qu’elles coordonnent l’activation, la prolifération et/ou la migration de ces cellules en leur permettant de rester solidaires tout en leur apportant la plasticité requise à leurs nouvelles propriétés. Cette coordination implique aussi que toutes ces cellules agissent en phase les unes avec les autres tout au long du processus de différenciation. L’importance des kératines K6, K16 et K17 dans l’activation des kératinocytes et les conséquences de l’expression ectopique de hk16 sur l’état de phosphorylation du récepteur de l’EGF permettent de proposer une hypothèse très attrayante. Ces kératines pourraient en effet intervenir aussi dans la mise en phase des cellules en interagissant avec des protéines impliquées dans des voies de signalisation, dans la migration ou dans le cycle cellulaire. Même s’il n’existe pas encore de preuve directe pour un tel rôle, cette hypothèse se trouve renforcée par des travaux montrant que K16 a la capacité de stimuler la prolifération cellulaire [46] et qu’une autre kératine, la kératine K18, peut se lier aux protéines 14-3-3 impliquées dans le contrôle du cycle cellulaire [47]. Le rôle des kératines K6, K16 et K17 est encore non élucidé. Cependant, il apparaît de plus en plus clairement qu’elles n’ont pas uniquement un rôle structural mais interviennent d’une manière beaucoup plus subtile. A n’en pas douter, de meilleures connaissances sur leurs propriétés et leurs protéines associées apporteront un regard nouveau sur la biologie de la peau. |
Ce travail a été financé par les subventions AR44232 et AR42047 du NIH.
|
1. Holbrook KA, Wolff K. The structure and development of skin. In: Fitzpatrick TB, et al., eds. Dermatology in general medicine. New York: McGraw-Hill, 1993 : 97–144. 2. Fuchs E, Byrne C. The epidermis: rising to the surface. Curr Opin Genet Dev 1994; 4 : 725–36. 3. Steinert PM. The complexity and redundancy of epithelial barrier function. J Cell Biol 2000; 151 : F5–7. 4. Fuchs E. Keratins and the skin. Annu Rev Cell Dev Biol 1995; 11 : 123–53. 5. Fuchs E, Weber K. Intermediate filaments: structure, dynamics, function, and disease. Annu Rev Biochem 1994; 63 : 345–82. 6. Herrmann H, Aebi U. Intermediate filaments and their associates: multi-talented structural elements specifying cytoarchitecture and cytodynamics. Curr Opin Cell Biol 2000; 12 : 79–90. 7. Coulombe PA, Bousquet O, Ma L, et al. The ’ins’ and ’outs’ of intermediate filament organization. Trends Cell Biol 2000; 10 : 420–8. 8. Moll R, Franke WW, Schiller DL, et al. The catalog of human cytokeratins: patterns of expression in normal epithelia, tumors and cultured cells. Cell 1982; 31 : 11–24. 9. Powell BC, Rogers GE. The role of keratin proteins and their genes in the growth, structure and properties of hair. EXS 1997; 78 : 59–148. 10. Coulombe PA. The cellular and molecular biology of keratins: beginning a new era. Curr Opin Cell Biol 1993; 5 : 17–29. 11. O’Guin WM, Schermer A, Lynch M, et al. Differenciation-specific expression of keratin pairs. In: Goldman RD, Steinert PM, eds. Cellular and molecular biology of intermediate filaments. New York: Plenum Publishing Company, 1990 : 301–34. 12. Paladini RD, Coulombe PA. The functional diversity of epidermal keratins revealed by the partial rescue of the keratin 14 null phenotype by keratin 16. J Cell Biol 1999; 146 : 1185–201. 13. Fuchs E, Cleveland DW. A structural scaffolding of intermediate filaments in health and disease. Science 1998; 279 : 514–9. 14. Irvine AD, McLean WH. Human keratin diseases: the increasing spectrum of disease and subtlety of the phenotype-genotype correlation. Br j Dermatol 1999; 140 : 815–28. 15. Coulombe PA, Fuchs E, Molecular mechanisms of keratin gene disorders and other bullous diseases of the skin. In: Citi S, ed. Molecular mechanisms of epithelial cell junctions: from development to disease. Austin, TX: R.G. Landes Company, 1994 : 259–85. 16. Ma L, Yamada S, Wirtz D, et al. A ’hot-spot’ mutation alters the mechanical properties of keratin filament networks. Nat Cell Biol 2001; 3 : 503–6. 17. Takahashi K, Paladini RD, Coulombe PA. Cloning and characterization of multiple human genes and cDNAs encoding highly related type II keratin 6 isoforms.J Biol Chem 1995; 270 : 18581–92. 18. Blessing M, Zentgraf H, Jorcano JL. Differentially expressed bovine cytokeratin genes. Analysis of gene linkage and evolutionary conservation of 5’-ups-tream sequences. EMBO J 1987; 6 : 567–75. 19. Takahashi K, Yan B, Yamanishi K, et al. The two functional keratin 6 genes of mouse are differentially regulated and evolved independently from their human orthologs. Genomics 1998; 53 : 170–83. 20. McGowan K, Coulombe PA. The wound repair-associated keratins 6, 16, and 17. Insights into the role of intermediate filaments in specifying keratinocyte cytoarchitecture. Subcell Biochem 1998; 31 : 173–204. 21. Porter RM, Hutcheson AM, Rugg EL, et al. cDNA cloning, expression, and assembly characteristics of mouse keratin 16. J Biol Chem 1998; 273 : 32265–72. 22. McGowan KM, Coulombe PA. Onset of keratin 17 expression coincides with the definition of major epithelial lineages during skin development. J Cell Biol 1998; 143 : 469–86. 23. Yoshikawa K, Katagata Y, Kondo S. Relative amounts of keratin 17 are higher than those of keratin 16 in hairfollicle-derived tumors in comparison with nonfollicular epithelial skin tumors. J Invest Dermatol 1995; 104 : 396–400. 24. McGowan KM, Coulombe PA. Keratin 17 expression in the hard epithelial context of the hair and nail, and its relevance for the pachyonychia congenita phenotype.J Invest Dermatol 2000; 114 : 1101–7. 25. Moll R, Krepler R, Franke WW. Complex cytokeratin polypeptide patterns observed in certain human carcinomas. Differentiation 1983; 23 : 256–69. 26. Weiss RA, Eichner R, Sun TT. Monoclonal antibody analysis of keratin expression in epidermal diseases: a 48-and 56-kdalton keratin as molecular markers for hyperproliferative keratinocytes.J Cell Biol 1984; 98 : 1397–406. 27. Stoler A, Duvic M, Fuchs E. Unusual patterns of keratin expression in the overlying epidermis of patients with dermatofibromas: biochemical alterations in the epidermis as a consequence of dermal tumors. J Invest Dermatol 1989; 93 : 728–38. 28. Mansbridge JN, Knapp AM. Changes in keratinocyte maturation during wound healing. J Invest Dermatol 1987; 89 : 253–63. 29. Paladini RD, Takahashi K, Bravo NS, et al. Onset of reepithelialization after skin injury correlates with a reorganization of keratin filaments in wound edge keratinocytes: defining a potential role for keratin 16. J Cell Biol 1996; 132 : 381–97. 30. Ramirez A, Vidal M, Bravo A, et al. A 5’-upstream region of a bovine keratin 6 gène confers tissue-specific expression and hyperproliferation-related induction in transgenic mice. Proc Natl Acad Sci USA 1995; 92 : 4783–7. 31. Feinstein A, Friedman J, Schewach-Millet M. Pachyonychia congenita. J Am Acad Dermatol 1988; 19 : 705–11. 32. McLean WH, Rugg EL, Lunny DP, et al. Keratin 16 and keratin 17 mutations cause pachyonychia congenita. Nat Genet 1995; 9 : 273–8. 33. Coulombe PA. Towards a molecular definition of keratinocyte activation after acute injury to stratified epithelia. Biochem Biophys Res Commun 1997; 236 : 231–8. 34. Takahashi K, Folmer J, Coulombe PA. Increased expression of keratin 16 causes anomalies in cytoarchitecture and keratinization in transgenic mouse skin. J Cell Biol 1994; 127 : 505–20. 35. Paladini RD, Coulombe PA. Directed expression of keratin 16 to the progenitor basal cells of transgenic mouse skin delays skin maturation. J Cell Biol 1998; 142 : 1035–51. 36. Bousquet O, Ma L, Yamada S, Gu C, Idei T, Takahashi K, Wirtz D, Coulombe PA. The nonhelical tail domain of keratin 14 promotes filament bundling and enhances the mechanical properties of keratin intermediate filaments in vitro. J Cell Biol 2001; 155 : 747–53 37. Wawersik M, Coulombe PA. Forced expression of keratin 16 alters the adhesion, differentiation, and migration of mouse skin keratinocytes. Moi Biol Cell 2000; 11 : 3315–27. 38. Wojcik SM, Bundman DS, Roop DR. Delayed wound healing in keratin 6a knockout mice. Mol Cell Biol 2000; 20 : 5248–55. 39. Clark RAF. Mechanisms of cutaneous wound repair. In: Fitzpatrick TB, et al. eds. Dermatology in general medicine, vol. 1. New York: McGraw-Hill, 1993: 473–88. 40. Schermer A, Jester JV, Hardy C, et al. Transient synthesis of K6 and K16 keratins in regenerating rabbit corneal epithelium: keratin markers for an alternative pathway of keratinocyte differentiation. Differentiation 1989; 42 : 103–10. 41. Byrne C, Tainsky M, Fuchs E. Programming gene expression in developing epidermis. Development 1994; 120 : 2369–83. 42. Sanes JR, Rubenstein JL, Nicolas JF. Use of a recombinant retrovirus to study post-implantation cell lineage in mouse embryos. EMBO J 1986; 5 : 3133–42. 43. Bousquet O, Coulombe PA. Cytoskeleton: missing links found? Curr Biol 1996; 6 : 1563–6. 44. Murillas R, Larcher F, Conti CJ, et al. Expression of a dominant negative mutant of epidermal growthfactor receptor in the epidermis of transgenic mice elicits striking alterations in hair fol-licle development and skin structure. EMBO J 1995; 14 : 5216–23. 45. Stoscheck CM, Nanney LB, King LEJ. Quantitative determination of EGF-R during epidermal wound healing. J Invest Dermatol 1992; 99 : 645–9. 46. Paramio JM, Casanova ML, Segrelles C, et al. Modulation of cell proliferation by cytokeratins K10 and K16. Mol Cell Biol 1999; 19 : 3086–94. 47. Liao J, Omary MB. 14-3-3 proteins associate with phosphorylated simple epithelial keratins during cell cycle progression and act as a solubility cofactor. J Cell Biol 1996; 133 : 345–57. |