| |
| Med Sci (Paris). 2002 January; 18(1): 91–96. Published online 2002 January 15. doi: 10.1051/medsci/200218191.L’électroporation in vivo chez l’embryon Sophie Bel-Vialar* Centre de Biologie du développement, Cnrs UMR 5547, 118, route de Narbonne, Bâtiment 4R3, 31062 Toulouse, France |
L’une des stratégies les plus informatives pour appréhender les mécanismes génétiques contrôlant le développement embryonnaire ou le fonctionnement d’organes adultes est la manipulation génique suivie de l’analyse des effets phénotypiques obtenus. Ces stratégies sont limitées au développement précoce chez le xénope ou le poisson zèbre, coûteuses et difficiles chez la souris et, jusqu’à récemment, impossibles chez le poulet. Ce dernier point constituait un réel problème car le poulet est l’un des organismes favoris des embryologistes. En effet, l’embryon aviaire est très accessible et il est facile de prélever et de transplanter des tissus dans l’embryon vivant en cours de développement. Cependant, le manque de moyens disponibles pour modifier génétiquement cet organisme a diminué sa valeur pour les études moléculaires du développement. La mise au point de nouvelles techniques efficaces et contrôlées s’avérait donc nécessaire. La technique d’électroporation in vivo, qui a tout d’abord été développée chez le poulet, permet maintenant de réhabiliter ce modèle comme modèle de choix, alliant les techniques de greffes à la modification génique. L’électroporation est en fait applicable à tous les organismes et peut être utilisée non seulement pour modifier l’expression d’un gène mais aussi pour cartographier des régions de contrôle ou mener des études de complémentation. Facile, rapide, efficace, peu onéreuse et avec peu de contraintes, il s’agit d’une méthode prometteuse pour le transfert de gènes in vivo dans tous les organismes. Enfin, ses applications ne s’arrêtent pas à des études de biologie fondamentale, et elle commence à être envisagée dans des stratégies thérapeutiques de traitement de tumeurs. |
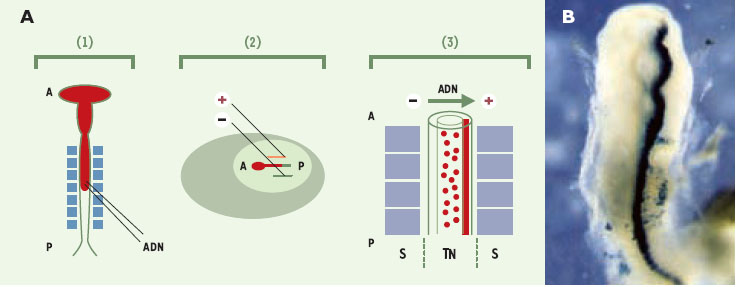
Principes de l’électroporation in vivo : l’exemple du tube neural aviaire L’électroporation est utilisée depuis longtemps pour transférer de l’ADN dans des bactéries ou dans des cellules eucaryotes en culture [1,2]. Elle consiste à appliquer un champ électrique bref grâce à deux électrodes placées de part et d’autre des parois d’une chambre contenant une suspension mixte d’ADN et de cellules. Lors du choc électrique, les parois cellulaires sont perméabilisées et l’ADN est transféré dans les cellules selon une orientation polarisée (chargé négativement, il est attiré par l’anode). Cette méthode expose les cellules à de très hauts voltages qui, nocifs, entraînent la mort de 50 à 75 % des cellules. Si cette perte peut être acceptable pour des cultures cellulaires, elle ne l’est bien évidemment pas pour des tissus qui subiraient alors des dommages irréversibles. La modulation des paramètres de base de cette technique a permis son application à la transfection d’ADN in vivo dans des tissus ou dans des embryons entiers [3,4]. La modification principale est la réduction du voltage qui permet d’accroître la viabilité cellulaire jusqu’à un niveau acceptable pour le maintien de l’intégrité des tissus. Cette technique a tout d’abord été mise au point pour le transfert de gènes dans le tube neural d’embryons de poulet (Figure 1A). Pour accéder à l’embryon, une fenêtre est découpée dans la coquille et la solution d’ADN est injectée dans le tube neural à l’aide d’une micropipette. Puis, deux électrodes sont appliquées en parallèle de chaque côté de l’embryon. Une différence de voltage est alors créée, permettant l’entrée de l’ADN dans une seule direction, du coté du tube neural placé le long de l’anode. Ceci procure l’avantage d’obtenir, sur le même embryon, un côté témoin qui ne reçoit pas l’ADN et peut être comparé avec le côté du tube neural modifié. Les œufs sont refermés hermétiquement et incubés à 37°C pour permettre la progression du développement de l’embryon et l’expression du gène transféré. Les embryons sont ensuite isolés et fixés afin d’analyser leur phénotype. L’utilisation du gène rapporteur codant pour la ß-galactosidase (lacZ) permet de visualiser l’expression du transgène (Figure 1B). Cette expression peut être détectée deux à trois heures après l’électroporation et persiste au moins pendant trois jours. Elle reste cependant transitoire car l’ADN ne s’intègre pas au génome. 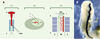 | Figure 1. Protocole d’électroporation d’un gène hôte dans le tube neural d’un embryon de poulet de stade 10 somites. A. L’ADN plasmidique est njecté dans le tube neural à l’aide d’une micropipette (1), l’ADN injecté est représenté en rouge. Un choc électrique est créé grâce à deux électrodes placées à la surface du blastomère de chaque coté de l’embryon (2), et l’ADN pénètre dans les cellules du tube neural de façon unidirectionnelle (3). B. Expression de la ß-galactosidase (lacZ) sous le contrôle d’un promoteur fort CMV (cytomégalovirus) dans le tube neural 18 h après électroporation. Toutes les cellules électroporées expriment le plasmide. Pour une électroporation de ce type, les conditions sont pour des électrodes de 4 mm de long espacées de 4 mm : cinq chocs électriques de 20 volts de 50 ms chacun, espacés par des pauses de 5 ms. Le vecteur utilisé dans ce cas est pcDNA3 (invitrogen). S : somites; TN : tube neural ; A : pôle antérieur ; P : pôle postérieur. |
|
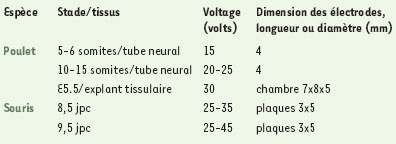
Mise au point des paramètres d’électroporation dans différents contextes expérimentaux Afin d’établir les conditions optimales à chaque type d’électroporation, il est utile d’utiliser un vecteur possédant un gène rapporteur (ß-galactosidase ou GFP, green fluorescent protein), dont on peut visualiser facilement l’expression, sous le contrôle d’un promoteur fort de type ß-actine, cytomégalovirus ou Rous sarcoma virus (RSV). Les différents facteurs qui influent sur l’efficacité de transfert et la viabilité cellulaire sont les paramètres d’électroporation, la concentration ionique de la solution d’ADN mais aussi la nature du tissu à électroporer. Le vecteur d’expression conditionne la bonne expression de l’ADN transféré et est donc choisi en fonction de l’espèce étudiée. Le voltage est déterminé en fonction de la géométrie des électrodes et de leur espacement afin d’obtenir un champ électrique permettant de concilier une bonne survie de l’embryon et une expression satisfaisante du gène hôte (Tableau 1). Ce paramètre est aussi modulé en fonction du stade embryonnaire étudié. Par exemple, le voltage appliqué est plus faible pour un embryon de 5-6 somites que pour un embryon de 10-12 somites (Tableau 1). La concentration d’ADN est aussi un facteur qui influe sur l’efficacité et la spécificité de la transfection. Si l’ADN est trop concentré, on peut observer une surexpression massive qui peut se révéler gênante pour l’analyse, ou une perte de spécificité d’expression dans le cas où le gène hôte est placé sous le contrôle de régions de contrôle spécifiques. Enfin, le choc électrique provoque souvent des défauts morphologiques irréversibles, et cette méthode n’est donc pas adéquate pour étudier le rôle d’un gène dans la morphogenèse d’un tissu. L’ensemble de ces paramètres est donc à ajuster en fonction du contexte expérimental.  | Tableau 1.Exemples de paramètres utilisés pour l’électroporation in vivo d’embryons ou de tissus. Dans tous les exemples cités ci-dessus, l’espacement entre les deux électrodes est de 4-5 mm et 4 à 5 chocs électriques d’une durée de 50 ms sont appliqués successivement [ 3, 12]. |
|
Comparaison avec d’autres techniques de transfert de gène in vivoPlusieurs autres méthodes de transfert d’ADN in vivo chez le poulet, qui ont été développées plus ou moins récemment, peuvent être comparées à la technique d’électroporation. La première, développée en 1992, utilise des rétrovirus et requiert une étape de clonage dans un vecteur rétroviral et l’infection virale des tissus à transfecter [5]. Son avantage majeur est que l’ADN est intégré de façon stable au génome des cellules hôtes, ce qui permet une expression continue du gène transféré sur une longue période. Il existe en revanche plusieurs contraintes : la taille de l’ADN que l’on peut cloner dans les vecteurs rétroviraux actuellement disponibles est très limitée (2,5 kilobases maximum); cette technique nécessite une préparation de virus à titre élevé, étape souvent assez critique ; de nombreux rétrovirus sont fortement immunogènes et, enfin, l’expression du gène hôte n’est détectée que 24 heures après le transfert. Deux autres techniques de transfert de gènes permettant une expression transitoire ont été utilisées avec succès in vivo, le bombardement de micro-particules et la lipofection [6,7]. La première consiste à injecter de l’ADN grâce à un “canon à gènes” et la seconde est fondée sur la capacité qu’ont les liposomes de fusionner avec les membranes cellulaires. Dans les deux cas, la concentration d’ADN à transférer n’est que très peu modulable. De plus, la comparaison de ces deux méthodes avec l’électroporation a montré que si les trois techniques ont une efficacité de transfection quasi similaire, l’expression est beaucoup plus forte avec l’électroporation [8]. Cette dernière méthode est donc à retenir dans les cas d’expression transitoire d’autant plus qu’il n’existe aucune contrainte de taille d’ADN, contrairement aux vecteurs rétroviraux. En outre, l’expression du plasmide est très homogène d’une cellule à l’autre, et ne confère aucune immunogénicité. Les efforts portent à l’heure actuelle sur l’utilisation de la technique d’électroporation pour transférer des vecteurs rétroviraux [9]. Cela permettrait à la fois une expression rapide du gène transféré, et son intégration de façon stable dans le génome grâce au vecteur rétroviral. En parallèle, des études sont en cours afin d’améliorer la capacité de clonage dans les rétrovirus. |
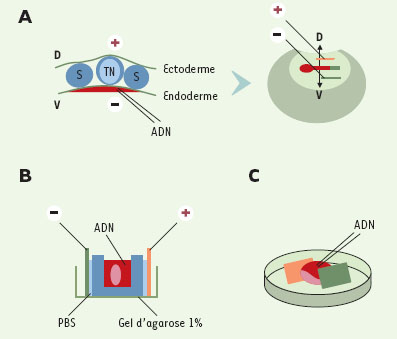
Exemples d’applications en biologie L’électroporation in vivo est en théorie applicable à tout type de tissus ou organismes, à condition que le protocole soit ajusté selon le contexte expérimental. Ainsi, on peut adapter la forme des électrodes, leur placement par rapport à l’embryon et le site d’injection d’ADN. Par exemple, chez le poulet, si l’on place les électrodes de façon transversale par rapport à l’embryon, il est possible de cibler de façon spécifique l’endoderme, en injectant l’ADN sous l’embryon [10] (Figure 2A), ou l’ectoderme en appliquant l’ADN sur la surface de l’embryon [3]. L’électroporation des somites est en revanche plus délicate [11]. Leur structure rend en effet difficile l’entrée des plasmides, et il faut donc d’une part “lester” la solution d’ADN (c’est-à-dire la rendre plus visqueuse en ajoutant par exemple du carboxyméthylcellulose) pour limiter sa diffusion et d’autre part, augmenter le voltage pour obtenir une efficacité de transfection satisfaisante. Dans certains cas (par exemple les tissus adultes), l’électroporation doit s’effectuer ex vivo. Dans ce cas, pour éviter une trop grande destruction cellulaire provoquée par une attirance du tissu contre l’une des électrodes, un système de chambre en gel d’agarose est utilisé afin de protéger les tissus tout en gardant une bonne efficacité de transfection [12] (Figure 2B). 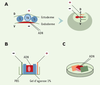 | Figure 2.Exemples de protocoles utilisés dans différents cas d’électroporation. A. Électroporation de l’endoderme. L’ADN est injecté sous l’endoderme (le schéma illustre cette injection en coupe transversale). L’anode est placée sur le blastoderme tandis que la cathode est placée sous l’embryon. Le champ électrique est donc créé selon un axe dorso-ventral. L’ADN est dans ce cas transféré exclusivement dans l’endoderme (d’après [ 10]). B. Électroporation d’un tissu ex vivo. Le tissu est placé dans une chambre en gel d’agarose en milieu PBS. Les électrodes sont placées de chaque côté de la chambre et l’ADN est injecté directement dans le PBS qui baigne le tissu (d’après [ 13]). C. Électroporation d’un embryon de souris. Les embryons de 8 ou 8,5 jpc sont disséqués avec précaution sans endommager les membranes vitellines et placés dans une chambre conçue spécialement. L’ADN est injecté dans la cavité amniotique et le placement de l’embryon par rapport aux électrodes dépend de la région que l’on veut cibler (voir figure 3C). A : pôle antérieur ; P : pôle postérieur ; D : pôle dorsal ; V : pôle ventral; S : somites ; TN : tube neural. |
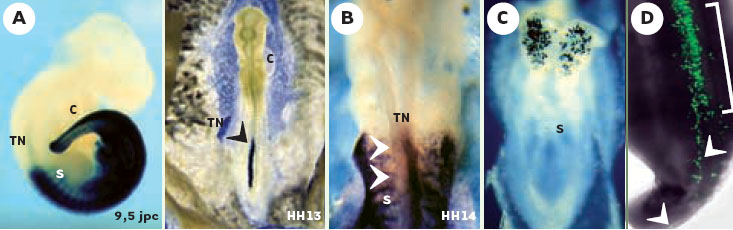
L’électroporation devient aussi une méthode de choix pour réaliser des études de complémentation génique chez des souris mutantes dont le phénotype est caractérisé (Figure 2C). Il est en effet possible, par la technique d’électroporation, de tester la capacité de gènes candidats de “sauver” un phénotype perte de fonction, à un moment spécifique du développement et dans une région embryonnaire ou un tissu adulte ciblés. Cette stratégie permet ainsi de disséquer des cascades d’activation génique impliquées dans le développement ou certaines fonctions vitales adultes. Elle peut aussi être préférée à des techniques de transgenèse beaucoup plus lourdes et onéreuses si l’on veut exprimer un gène de façon transitoire ou de façon ciblée, à des stades particuliers de l’embryogenèse (Figure 3C). Cependant, il est très difficile de manipuler les embryons murins in utero et l’électroporation requiert donc une extraction des embryons suivie de leur culture in vitro après l’électroporation [13]. La durée de culture étant très limitée, ceci peut être une contrainte justifiant le choix d’une autre méthode de transfert de gène pour certaines stratégies expérimentales.  | Figure 3. Exemples d’applications biologiques de l’électroporation in vivo. A. Expression d’une construction portant le gène lacZ sous le contrôle d’un élément régulateur murin du gène Hoxb9 spécifique du tube neural. A gauche, un embryon de souris de 9,5 jpc, dans lequel cette construction a été njectée par transgenèse dans le pronucléus de l’œuf fécondé. L’ADN est intégré au hasard dans le génome et de manière stable. A droite, un embryon de poulet qui a reçu la même construction dans le tube neural par électroporation au stade 8 somites. Dans ce cas, l’ADN n’est pas intégré au génome et l’expression est transitoire. Dans les deux organismes, l’élément régulateur dirige l’expression du gène lacZ spécifiquement dans la partie postérieure du tube neural. B. Utilisation d’un mutant dominant négatif. Une construction exprimant une forme mutée du récepteur RARa1 de xénope (dnRARa1) a été électroporée dans la partie gauche du tube neural d’un embryon de poulet au stade HH9 (8 somites). L’ embryon a été prélevé au stade HH14 (25 somites) pour analyser l’expression du gène Hoxb4 par hybridation in situ. La présence de cette construction, qui bloque la voie de signalisation par l’acide rétinoïque, empêche l’induction de Hoxb4 (noter l’absence d’expression de Hoxb4 dans la partie gauche du tube neural). C. Expression de la ß-galactosidase après électroporation dans l’embryon murin. Vue dorsale d’un embryon de 9,0 jpc exprimant la ß-gal dans le cerveau antérieur. L’ADN (CMV-lacZ) a été injecté dans la cavité amniotique d’embryons de 8,0 jpc et les embryons ont été cultivés 12 heures in vitro après électroporation (25 volts/50 ms) (image gracieusement fournie par N.Itasaki, NIMR, Londres). D. Expression d’une GFP à localisation nucléaire dans le tube neural de l’embryon de poulet. Une solution d’ADN à 4mg/ml a été déposée dans la région caudale d’un embryon de poulet de 12 somites (promoteur ß-actine/CMV; 4 chocs de 25 volts/50 ms). Les embryons ont été prélevés après 36h et analysés en microscopie confocale (image gracieusement fournie par Luc Mathis, Institut Pasteur). S : somite ; TN : tube neural ; C : cœur. |
Le transfert de gène par électroporation a aussi été appliqué avec succès chez la drosophile, l’ascidie, le xénope à des stades tardifs du développement, et l’embryon de poisson zèbre [14–16]. Elle a par exemple été utilisée chez l’ascidie pour cartographier des régions régulatrices du gène brachyury [14]. La possibilité d’utiliser cette même méthode dans différentes espèces en fait un outil précieux pour étudier la conservation moléculaire de gènes importants entre différentes espèces ou pour évaluer l’importance fonctionnelle de régions régulatrices [17,18]. Ainsi, l’lectroporation d’embryon aviaire nous a permis de cartographier avec précision un élément régulateur du gène Hoxb9 murin dirigeant son expression spécifique dans le tube neural (Figure 3A). L’électroporation n’est pas limitée à la surexpression d’un gène [19], mais permet aussi d’interrompre la fonction d’un gène en utilisant des mutants dominants négatifs. Ainsi, l’électroporation d’un mutant dominant négatif du récepteur de l’acide rétinoïque de type α1 (dnRARa1) de xénope [20] a permis de montrer que la voie de signalisation de l’acide rétinoïque est requise pour l’expression du gène Hoxb4 de poulet dans le tube neural (Figure 3B) [21]. De plus, chez le poulet, cette technique présente l’avantage de pouvoir être combinée à des techniques de greffe. Il est possible par exemple d’électroporer un embryon donneur de ovo puis de prélever du tissu ou des cellules qui seront greffés dans un embryon hôte. L’utilisation d’un gène rapporteur GFP, associé aux régions régulatrices d’un gène donné, permet également de suivre l’expression de ce gène au cours du temps. De plus, l’électroporation peut être ciblée à de petits groupes de cellules et la GFP est cette fois utile pour suivre leur comportement ou leur devenir dans l’embryon en développement (Figure 3D) [22]. |
Applications thérapeutiques L’électroporation in vivo n’est pas limitée à la seule manipulation d’animaux modèles pour répondre à des questions de biologie du développement. Depuis peu, cette technique est très sérieusement envisagée en tant que stratégie thérapeutique chez l’homme, en particulier dans le cadre de traitements anticancéreux. L’efficacité du transfert de composés chimiques ou de gènes dans les cellules tumorales peut en effet constituer une limitation de ces traitements. L’électroporation a tout d’abord été appliquée pour le transfert de drogues anti-tumorales, ce que l’on appelle électrochimiothérapie [23]. Dans ce cas, la drogue est injectée par voie intraveineuse puis les électrodes sont appliquées au contact de la tumeur solide. Cette stratégie a été utilisée avec succès dans le traitement de carcinomes du cou et de la tête par injection de bléomycine, et ne provoque aucun effet secondaire gênant pour le patient [23]. Dans le cadre de la thérapie génique des cancers, par transfert de gènes suicides ou de gènes immuno-stimulateurs dans la tumeur, l’électroporation pourrait s’avérer un outil intéressant pour cibler des tumeurs accessibles, comme les tumeurs cutanées ou sous-cutanées. Rols et al. ont en effet montré qu’il est possible chez la souris de transférer des protéines ou des gènes par électroporation dans des tumeurs solides [26]. Une expression génique prolongée, pendant au moins neuf mois, a même été obtenue dans le muscle squelettique [27,28]. Enfin, la possibilité d’utiliser l’électroporation pour transférer un gène dans des artères mésentériques de rat ouvre la voie d’une thérapie génique ciblée au système vasculaire [29]. |
L’électroporation in vivo offre donc de nouvelles possibilités d’études du contrôle de l’expression des gènes et de leur fonction au cours du développement embryonnaire mais aussi de l’organogenèse. Mise au point récemment, elle est pourtant déjà bien implantée dans les laboratoires de biologie et devient une des méthodes de référence pour modifier l’expression génique de façon transitoire en biologie du développement. La puissance de cette technique ne s’arrête pas là puisqu’elle offre maintenant de réels espoirs thérapeutiques chez l’homme. |
S. Bel-Vialar était financée par une bourse post-doctorale de longue durée de l’EMBO et par le Cnrs. Je remercie les membres du groupe de Fabienne Pituello au CBD à Toulouse et Luc Mathis pour leurs commentaires sur le manuscrit. |
1. Andreason G, Evans G. Introduction and expression of DNA molecules in eukaryotic cells by electroporation. Biotechniques 1988;6 : 650–60. 2. Shillito R, Saul M, Paszkowski J, Muller M, Potrykus I. High efficiency direct gene transfer to plants. Biotechnology 1985; 3: 1099–103. 3. Ittasaki N, Bel-Vialar S, Krumlauf R. “Shocking” developments in chick embryology: electroporation and in ovo gene expression. Nat Cell Biol 1999; 1 : E203–7. 4. Momose T, Tonegawa A, Takeuchi J, Ogawa H, Umesono K, Yasuda K. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev Growth Differ 1999; 41 : 335–44. 5. Petropoulos C, Payne W, Salter D, Hughes S. Using avian retroviral vectors for gene transfer. J Virology 1992; 66: 3391–7. 6. Furth PA. Gene transfer by biolistic process. Mol Biotechnol 1997; 7: 139–43. 7. Rosenblum CI, Chen HY.In ovo transfection of chicken embryos using cationic liposomes. Transgenic Res 1995; 4: 192–8. 8. Muramatsu, T, Mizutani Y, Ohmori Y, Okumura JI. Comparison of three non-viral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem Biophys Res Commun 1997; 230 : 376–80. 9. Baer A, Schubeler D, Bode J. Transcriptional properties of genomic transgene integration sites marked by electroporation or retroviral infection. Biochemistry 2000; 39: 7041–9. 10. Grapin-Botton A, Majithia AR, Melton DA. Key events of pancreas formation are triggered in gut endoderm by ectopic expression of pancreatic regulatory genes. Genes Dev 2001; 15 : 444–54. 11. Dubrulle J, McGrew MJ, Pourquie O. FGF signaling controls somite boundary position and regulates segmentation clock control of spatiotemporal Hox gene activation. Cell 2001; 106 : 219–32. 12. Fukuda K, Sakamoto N, Narita T, et al. Application of efficient and specific gene transfer systems and organ culture techniques for the elucidation of mechanisms of epithelialmesenchymal interaction in the developing gut. Dev Growth Differ 2000; 42 : 207–11. 13. Osumi N, Inoue T. Gene transfer into cultured mammalian embryos by electroporation. Methods 2001; 24: 35–42. 14. Corbo JC, Levine M, Zeller RW. Characterization of a notochord-specific enhancer from the Brachyury promoter region of the ascidian, Ciona intestinalis. Development 1997; 124 : 589–602. 15. Eide FF, Eisenberg SR, Sanders TA. Electroporation-mediated gene transfer in free-swimming embryonic Xenopus laevis. FEBS Lett 2000; 486 : 29–32. 16. Kamdar KP, Wagner TN, Finnerty V. Electroporation of Drosophila embryos. Methods Mol Biol 1995; 48 : 239–43. 17. Manzanares M, Wada H, Itasaki N, Trainor PA, Krumlauf R, Holland PW. Conservation and elaboration of Hox gene regulation during evolution of the vertebrate head. Nature 2000; 408 : 854–7. 18. Manzanares M, Bel-Vialar S, Ariza-McNaughton L, et al. Independent regulation of initiation and maintenance phases of Hoxa3 expression in the vertebrate hindbrain. Development 2001; 128 : 3595–607. 19. Giudicelli F, Taillebourg E, Charnay P, Gilardi-Hebenstreit P. Krox-20 patterns the hindbrain through both cell-autonomous and non cell-autonomous mechanisms. Genes Dev 2001; 15 : 567–80. 20. Blumberg B, Bolado J Jr, Moreno TA, Kintner C, Evans RM, Papalopulu N. An essential role for retinoid signaling in anteroposterior neural patterning. Development 1997; 124 : 373–9. 21. Gould A, Itasaki N, Krumlauf R. Initiation of rhombomeric Hoxb4 expression requires induction by somites and a retinoid pathway. Neuron 1998; 21: 39–51. 22. Mathis L, Kulesa PM, Fraser SE. FGF receptor signalling is required to maintain neural progenitors during Hensen’s node progression. Nat Cell Biol 2001; 3 : 559–66. 23. Mir LM, Glass LF, Sersa G, et al. Effective treatment of cutaneous and subeutaneous malignant tumours by electrochemotherapy. Br J Cancer 1998; 77 : 2336–42. 24. Orlowsky S, Mir LM. Un nouveau traitement antitumoral : l’electrochimiothérapie. Med Sci 1998; 14 : 1235–9. 25. Rols MP, Bachaud JM, Giraud P, Cherreau C, Roche H, Teissié J. Electrochemotherapy of cutaneous metastases in malignant melanoma. Melanoma Res 2000; 10 : 468–74 26. Rols MP, Delteil C, Golzio M, Dumond P, Cros S, Teissie J. In vivo electrically mediated protein and gene transfer in murine melanoma. Nat Biotechnol 1998; 16: 168–71. 27. Mir LM, Bureau MF, Gehl J, et al. High-efficiency gene transfer into skeletal muscle mediated by electric pulses. Proc Natl Acad Sci USA 1999; 96 : 4262–7. 28. Vicat JM, Boisseau S, Jourdes P, et al. Muscle transfection by electroporation with high-voltage and short- pulse currents provides high-level and long-lasting gene expression. Hum Gene Ther 2000; 11 : 909–16. 29. Martin JB, Young JL, Benoit JN, Dean DA. Gene transfer to intact mesenteric arteries by electroporation. J Vasc Res 2000; 37 : 372–80. |