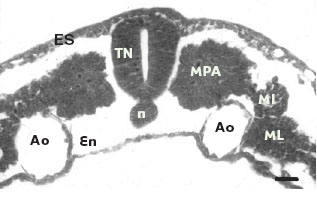
Chez les vertébrés, à l’issue de la gastrulation et de la neurulation, l’embryon est organisé en grands feuillets primordiaux (Figure 1). Le feuillet le plus ventral est l’endoderme qui donne naissance à l’épithélium de surface des muqueuses digestive et respiratoire ainsi qu’à l’épithélium glandulaire de nombreuses glandes annexées à ces tractus. Le feuillet intermédiaire ou mésoderme est organisé en domaines orientés selon l’axe médio-latéral. Le domaine axial est matérialisé par la notochorde et la plaque préchordale, le domaine para-axial est constitué des mésodermes somitique et céphalique, le domaine intermédiaire de la pièce intermédiaire et, enfin, le domaine latéral des lames latérales (somatopleure dorsale et splanchnopleure ventrale). Le feuillet le plus dorsal est l’ectoderme subdivisé en deux domaines : le domaine latéral forme l’ectoderme de surface, précurseur de l’épiderme, alors que le domaine médian forme la plaque neurale puis le tube neural qui donne naissance au système nerveux central. Il faut noter que, lors des mouvements de la délimitation, la splanchnopleure s’associe à l’endoderme et donne naissance aux différentes tuniques de la muqueuse digestive à l’exception de l’épithélium de revêtement. Par ailleurs, les cellules endothéliales des futurs vaisseaux sanguins de l’embryon dérivent du mésoderme.
| Figure 1. Coupe transversale d’un embryon de poulet (stade 10 somites) à l’issue de la neurulation. L’embryon se présente sous forme de trois feuillets primordiaux. Le feuillet le plus ventral est l’endoderme (En). Le feuillet intermédiaire est le mésoderme avec ses différents domaines : notochorde (n), mésoderme para-axial (MPA), pièce intermédiaire (MI), mésoderme latéral (ML). Les aortes (Ao) se situent entre le mésoderme et l’endoderme. Le feuillet le plus dorsal est constitué de l’ectoderme de surface (ES) et du tube neural (TN). Coloration : crésyl violet. Barre = 20 µm. |
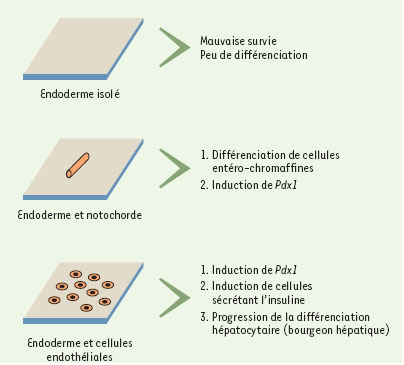
Le développement de l’endoderme est assez mal compris. Toutefois, il est établi que certains tissus agissent comme des inducteurs de la différenciation endodermique. Ainsi, si on greffe isolément de l’endoderme dans le cœlome embryonnaire, celui-ci survit mal et ne se différencie pas. En revanche, si on associe endoderme et notochorde, les cellules endodermiques survivent mieux et peuvent se différencier en cellules entéro-chromaffines (Figure 2) [1]. La notochorde est capable d’induire l’expression du gène Pdx1 [2] codant pour un facteur de transcription à homéodomaine, marqueur de la région duodéno-pancréatique, impliqué dans les étapes précoces de l’organogenèse pancréatique. En revanche, la notochorde seule n’est pas suffisante pour induire l’expression du gène codant pour l’insuline [2]. La splanchnopleure contrôle la cytodifférenciation régionale de l’endoderme. Ainsi, l’association de mésenchyme du proventricule, une des régions du tube digestif aviaire, à de l’endoderme de gésier chez l’embryon de poulet conduit à la formation de glandes proventriculaires par l’endoderme [3].
| Figure 2. Interactions tissulaires impliquées dans la différenciation endodermique. Si de l’endoderme est cultivé seul, il survit mal et ne se différencie pas. En présence de notochorde, il exprime le gène Pdx1, marqueur de la région pancréato-duodénale et forme des cellules entéro-chromaffines. En présence de cellules endothéliales, il exprime le gène Pdx1 et le gène codant pour l’insuline. Par ailleurs, les cellules endothéliales permettent la poursuite de la prolifération cellulaire du bourgeon hépatique. |
Un nouveau rôle des cellules endothéliales vient d’être mis en évidence sur le développement et la différenciation de l’endoderme. Il est possible de cultiver in vitro de l’endoderme de souris et de suivre sa différenciation. Si on procède à des co-cultures de l’endoderme murin provenant de l’intestin antérieur ou moyen avec des cellules endothéliales, on induit l’expression d’insuline [2] (Figure 2). En revanche, en l’absence de cellules endothéliales, il n’y a jamais d’expression d’insuline. Chez l’amphibien Xenopus laevis, il est possible de réaliser une ablation des précurseurs de l’aorte embryonnaire en extirpant les cellules de la pièce intermédiaire qui donnent naissance au pronéphros. Cette ablation des précurseurs de l’aorte conduit à l’absence de différenciation des cellules sécrétant l’insuline [2]. Dans la mesure où le pronéphros est aussi manquant dans cette expérience, le rôle propre de l’ablation de la pièce intermédiaire se pose. En fait, dans certains cas, l’aorte se régénère même en l’absence de pronéphros. Dans ce cas de régénérescence, des cellules sécrétant de l’insuline se différencient en l’absence de pronéphros. Ainsi, l’induction de la différenciation de cellules sécrétant de l’insuline dépend donc des cellules endothéliales et non pas des cellules pronéphrotiques. Le mutant murin flk1−/−, dépourvu du gène codant pour le récepteur 2 du VEGF (vascular endothelial growth factor), n’a pas de cellules endothéliales [4]. L’analyse précise du développement du bourgeon hépatique chez le mutant homozygote montre que la spécification des cellules endodermiques de cette région est normale avec une expression normale de marqueurs tels que l’albumine, la transthyrétine ou le gène Hex à E9 (9e jour embryonnaire) [5]. En revanche, à E9,5, les cellules hépatiques ne prolifèrent pas, contrairement à celles des souris sauvages ou du mutant hétérozygote. Si on cultive des explants, il est possible de vérifier que les cellules endodermiques du bourgeon hépatique du mutant homozygote sont capables de se différencier si la vascularisation est normale, montrant bien que l’anomalie réside donc au niveau des cellules endothéliales dans ce modèle génétique. Enfin, si on inhibe l’angiogenèse d’explants hépatiques issus d’embryons de souris normaux en utilisant le NK4 (puissant agent pharmacologique anti-angiogénique), on perturbe la différenciation normale des cellules hépatocytaires [5]. Tous ces résultats montrent que les cellules endothéliales sont potentiellement impliquées dans le contrôle de la différenciation endodermique. Une question importante à résoudre est de démontrer que des cellules endothéliales sont bien présentes à ces stades de développement chez l’embryon normal. En utilisant le marqueur de surface PECAM (platelet endothelial cell adhesion molecule ou CD31), il est possible de mettre en évidence de telles cellules autour du futur épithélium hépatique dès E8,5 chez la souris mais aussi dans le mésenchyme du poumon, du pancréas ou autour des glandes gastriques [5]. Des souris transgéniques chez lesquelles le VEGF164 (coexprimé avec le marqueur eGFP pour enhanced green fluorescent protein) est mis sous le contrôle du promoteur du gène Pdx1 présentent une augmentation de la vascularisation au niveau de l’ébauche pancréatique. Il en résulte une hyperplasie des composants endocrines (îlots de Langerhans) et une réduction des acinus exocrines [2]. De plus, comme Pdx1 est exprimé précocement au niveau de l’ébauche gastrique, on observe une expression d’insuline par des cellules de l’épithélium gastrique, montrant la différenciation endocrine de cette population.
Tous ces travaux se situent dans le prolongement des études expérimentales réalisées par Nicole Le Douarin lors de sa thèse [6]. En effet, elle avait montré que le mésoderme cardiaque donne naissance au mésenchyme hépatique et qu’il joue un rôle majeur dans l’induction de la différenciation hépatocytaire. On peut donc désormais étendre ces observations et proposer que les cellules endothéliales provenant du mésoderme cardiaque jouent un tel rôle. De plus, les cellules endothéliales jouent un rôle inducteur beaucoup plus général dans de nombreux systèmes d’origine endodermique. On peut aussi se demander si un tel rôle trophique des cellules endothéliales ne concerne pas des organes provenant d’autres feuillets embryonnaires. Les données cellulaires présentées cidessus sont importantes et on peut penser que, dans un avenir assez proche, les études porteront sur la caractérisation des différents signaux et sur l’identification des molécules impliquées dans l’induction, par les cellules endothéliales, de la différenciation de l’endoderme.