Chez les mammifères, lors du développement, les gonades mâles et femelles sont morphologiquement identiques et appelées gonades indifférenciées. Ensuite, la gonade se développera soit en testicule, soit en ovaire selon que le chromosome Y sera présent ou absent. On sait depuis une décennie que le gène sry (sex-determining region of the Y chromosome), responsable de la formation des testicules par l’intermédiaire d’une cascade d’événements morphogénétiques, est localisé sur le chromosome Y. Des souris transgéniques de génotype XX, dans les gonades desquelles on force l’expression de Sry, présentent une inversion du sexe: elles possèdent des testicules à la place d´ovaires [1]. La protéine SRY contient une séquence consensus HMG (high mobility group) lui permettant de se lier aux molécules d’ADN et d’en infléchir la courbure, ce qui suggère qu’elle pourrait avoir un effet sur la transcription de gène(s). Les cibles moléculaires directes de SRY restent toutefois méconnues. sox9 est un bon candidat: il est transcrit en particulier dans les gonades où son expression augmente fortement et uniquement chez les embryons mâles juste après l’activation de SRY. Dans les testicules, sox9 est exprimé dans les cellules de Sertoli, lesquelles contribuent à la formation de ces organes.
Chez l’homme, sox9 semble impliqué dans le développement des organes sexuels puisque des anomalies d´expression de ce gène entraînent des inversions de sexe. C’est le cas de 75 % des individus XY présentant soit une mutation ou une délétion d’un allèle du gène SOX9, soit un réarrangement de la partie 5´non codante. Tous ces individus sont également porteurs d’une dysplasie dite campomélique, grave malformation des os (➜). Parallèlement, une duplication de SOX9 a été détectée chez un patient de génotype XX présentant une inversion du sexe femelle en sexe mâle. Ces données indiquent que chez l´homme SOX9 joue un rôle important dans la détermination du sexe.
(➜) m/s 2001 n°10, p. 1242
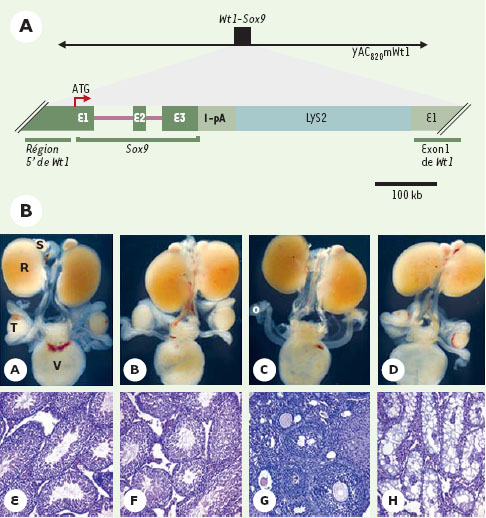
Chez la souris, la contribution de Sox9 à la détermination du sexe est moins évidente. En effet des souris hétérozygotes Sox9+/- ne présentent pas d’inversion du sexe mais meurent à la naissance ([2] et nos propres observations). Afin de pouvoir analyser le rôle spécifique de Sox9 dans la détermination du sexe, nous avons produit des souris transgéniques qui expriment de façon ectopique Sox9 dans leurs gonades [3]. Le vecteur de transgenèse permet d´exprimer Sox9 sous le contrôle des régions régulatrices du gène Wt1 (Wilm´s tumour suppressor 1) (Figure 1). Wt1 est transcrit dans les gonades indifférenciées d’embryons mâles et femelles, et son expression persiste au stade adulte dans les cellules de Sertoli des testicules et les cellules de la granulosa des ovaires. De ce fait, les animaux transgéniques de génotype XX diffèrent des témoins qui n´expriment pas Sox9 dans leur gonades. Deux souris transgéniques XX ont ainsi été obtenues, et toutes deux présentent une inversion du sexe. Elles possèdent tous les organes génitaux masculins et ont un comportement sexuel de type mâle. Toutefois, elles sont stériles car la présence de deux chromosomes X dans leurs génomes ne permet pas la production de spermatozoïdes [4]. Nous avons également obtenu un animal mâle (XY) transgénique capable de transmettre le transgène à sa descendance. Tous les animaux XX transgéniques de génération F1 présentent une inversion du sexe, démontrant que l’expression ectopique de Sox9 dans les gonades d’animaux XX conduit à la formation de testicules. L’analyse macroscopique des organes génitaux de souris transgéniques XX non pubères montre peu de différence avec ceux des mâles de génotype XY (Figure 1). Seuls les testicules des premiers sont de plus petite taille, différence qui s’accentue après la puberté. Histologiquement, des cellules de Sertoli confinées à la périphérie des tubes séminifères sont présentes en nombre normal, de même que des cellules de Leydig dans le tissu interstitiel de ces testicules. Cependant, aucune cellule germinale n’est visible chez les souris transgéniques XX (Figure 1).
| Figure 1. Souris transgéniques XX surexprimant Sox9 dans leurs gonades. A. Représentation schématique du vecteur permettant l´expression de Sox9 sous le contrôle des régions régulatrices de Wt1. Un large fragment d´ADN (YAC820mWt1) couvrant 620 kb du locus Wt1 a été utilisé afin de couvrir les régions régulatrices de Wt1 dont la localisation reste imprécise. YAC : yeast artificial chromosome, E: exon, I-pA: intron suivi d’une séquence de polyadénylation, LYS2: marqueur de levure lysine 2. B. Comparaison du phénotype des souris transgéniques et témoins. (A-D) vue macroscopique de l´appareil urogénital de nouveau-nés. (E-H) vue microscopique de coupes de testicules adultes. (A, E) : animaux témoins XY (XY+/+); (B, F) : animaux transgéniques XY (XY Tr/+); (C, G) : animaux témoins XX (XX +/+); (D, H) : animaux transgéniques XX (XX Tr/+). Tr/+: animal transgénique, +/+: animal témoin. T: testicule ; O: ovaire ; S: glande surrénale ; R: rein ; V: vessie. Ces images sont issues de [3]. |
Afin de tester la fonctionnalité de notre vecteur d’expression, nous avons analysé l´expression de Sox9 dans les gonades d’embryons transgéniques XX. Nous avons également étudié la fonctionnalité des cellules de Sertoli en analysant l´expression du gène codant pour l’hormone mâle, MIS (Müllerian inhibiting substance), qui est un marqueur spécifique de ces cellules, et peut être aussi une cible directe de sox9 [5]. sox9 et MIS sont exprimés dans les testicules de souris transgéniques XX, indiquant que les cellules de Sertoli sont fonctionnelles et que la protéine Sox9 codée par notre vecteur peut activer les gènes en aval de la cascade moléculaire de la détermination du sexe [3].
Les données expérimentales obtenues à partir de l’expression ectopique de Sox9 dans les gonades de souris de génotype XX montrent que la présence de ce gène est suffisante pour induire le développement de testicules, ceci indépendamment du gène Sry. La similitude des phénotypes des souris XX transgéniques qui expriment dans leurs gonades Sry et de celles qui expriment Sox9 suggère que Sox9 peut se substituer à Sry. Il est maintenant intéressant de comprendre le lien moléculaire entre ces deux gènes, et en particulier de déterminer si Sox9 est une cible directe de Sry et s’il est l’unique cible de Sry. Les réponses à ces questions permettront d´élucider es premières étapes de la cascade de la détermination du sexe, qui restent encore méconnues bien que de nombreux gènes impliqués dans cette cascade aient été isolés et identifiés depuis la découverte du gène sry.