La communication intercellulaire se fait grâce à l’échange de messages chimiques qui agissent sur la face extracellulaire de récepteurs membranaires. Parmi ces récepteurs, un grand nombre appartient à la famille des récepteurs couplés aux protéines G (RCPG). Ces récepteurs sont des protéines transmembranaires capables de reconnaître des messages aussi différents que la lumière, les odeurs, les molécules du goût, des hormones ou des neurotransmetteurs. Leurs gènes représentent jusqu’à 1 à 2 % du génome humain. Les RCPG contrôlent l’activité physiologique de la majorité des cellules chez l’homme et sont la cible privilégiée de nombreux médicaments et de la plupart des drogues [1].
Les RCPG sont des protéines allostériques qui sont spontanément en équilibre entre plusieurs états : des états inactifs, R, et des états actifs, R* (Figure 1). Un agoniste du récepteur déplace l’équilibre vers R*, tandis que certains ligands, qui sont appelés agonistes inverses, déplacent l’équilibre vers R. En l’absence d’agoniste, un antagoniste neutre n’a aucun effet sur cet équilibre, mais en présence d’agoniste, l’antagoniste déplace l’équilibre vers R. Des mutations des RCPG peuvent aussi déplacer l’équilibre vers R* et donc rendre le récepteur actif, même en l’absence d’agoniste. Cette activité du récepteur, indépendante d’un agoniste, est appelée activité constitutive. D’après ce qui précède, cette activité constitutive peut être inhibée par un agoniste inverse, mais pas par un antagoniste neutre. De plus, le récepteur constitutivement actif conserve en partie ses capacités de réponse à un agoniste.
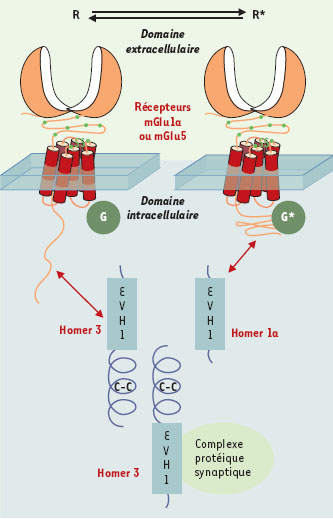
| Figure 1. Rôle des protéines Homer dans l’activation constitutive des récepteurs mGlu1a et mGlu5. Les protéines Homer possèdent un domaine structural EVH1 (pour Ena/VASP homology 1) qui interagit avec le domaine C-terminal intracellulaire des récepteurs mGlu1a et mGlu5 et d’autres protéines d’échafaudage (complexe protéique synaptique). Les protéines Homer possèdent aussi un domaine coiled-coil (C-C) qui leur permet de former des dimères. Ainsi, le dimère Homer 3 établit un lien physique entre les récepteurs mGlu1a ou mGlu5 et le complexe protéique synaptique en question. L’isoforme Homer 1a, qui ne possède pas de domaine C-C, ne peut donc pas former de dimère et se comporte comme un dominant négatif des interactions des protéines Homer dimériques. Une autre particularité de la protéine Homer1a est d’être synthétisée rapidement lors d’une activité neuronale intense (gène précoce). Dans les conditions normales, le dimère Homer 3 et le complexe protéique synaptique avec lequel il interagit constitueraient des contraintes structurales importantes au niveau de la queue intracellulaire des récepteurs mGlu1a ou mGlu5, empêchant ces récepteurs d’activer spontanément la protéine G (G). L’équilibre est déplacé vers l’état inactif du récepteur (R) d’où son absence d’activité constitutive dans les conditions normales. Une excitation neuronale intense induit l’expression de la protéine Homer1a qui entre alors en compétition avec la protéine Homer 3 pour la liaison avec les récepteurs. L’hypothèse suggérée est que les contraintes structurales au niveau du domaine C-terminal intracellulaire des récepteurs mGlu1a ou mGlu5 sont alors modifiées et que les récepteurs activent spontanément la protéine G (G*). |
L’activité constitutive de certains RCPG peut résulter de mutations et être à l’origine de maladies génétiques [1]. On connaît cependant un cas d’activité constitutive physiologique de RCPG non muté, le récepteur H3 de l’histamine [2], et un exemple de contrôle de l’activité constitutive de RCPG non mutés, les récepteurs du glutamate couplés à des protéines G, mGlu1a et mGlu5 [3]. Les RCPG ne sont pas uniquement associés aux protéines G, mais interagissent aussi avec d’autres protéines intracellulaires. C’est le cas des récepteurs mGlu1a et mGlu5 qui sont associés à une famille de protéines intracellulaires appelées Homer (Homer 1, Homer 2 et Homer 3) (Figure 1). Ces protéines sont exprimées de façon constitutive dans les neurones et forment des homodimères reliant les récepteurs mGlu1a ou mGlu5 à des complexes protéiques intracellulaires, dont les récepteurs de l’IP3 et ryanodine des stocks calciques du réticulum endoplasmique [4, 5] (➜). Seule la protéine Homer 1a ne peut former de dimère et se comporte comme un dominant négatif naturel, en interrompant les interactions entre les autres protéines Homer et les récepteurs. Homer 1a est, en outre, la seule forme inductible exprimée, notamment après une activité neuronale intense, lors de phénomènes de plasticité synaptique ou d’une épilepsie. Plusieurs fonctions des protéines Homer ont été identifiées : la guidance axonale [6], le contrôle de la voie de signalisation intracellulaire des récepteurs mGlu1a et mGlu5 [4] et leur adressage aux neurites [7] et membranaire [8]. Des résultats plus récents révèlent maintenant que ces protéines contrôlent l’activité des deux récepteurs [3].
(➜) m/s 2000 n°3, p. 440
Les neurones granulaires du cervelet en culture expriment, spontanément, uniquement le récepteur mGlu1a et la protéine Homer 3, qui interagissent spontanément. Si l’on supprime cette interaction, le récepteur mGlu1a devient constitutivement actif [3]. De même, des récepteurs mGlu5 mutés de façon à ne plus interagir avec Homer 3, et transfectés dans ces neurones, sont constitutivement actifs. Ces observations montrent que l’interaction entre le récepteur et la protéine intracellulaire Homer 3 réprime l’activité constitutive du récepteur. La question se pose alors de savoir si cette interaction peut faire l’objet d’un contrôle physiologique. Si l’on dépolarise ces neurones, en activant par exemple des récepteurs canaux du glutamate (N-méthyl-D-aspartate et kaïnate), ou en bloquant des canaux potassiques (à l’aide de tétraéthylammonium et de 4-aminopyridine), on induit la synthèse endogène de la protéine Homer 1a. Cette protéine se fixe alors sur le récepteur mGlu1a et, par son action de dominant négatif, empêche son interaction avec Homer 3, ce qui déclenche une activité constitutive du récepteur (Figure 1). Il est intéressant de constater que la durée d’action (plusieurs jours) de Homer 1a peut persister au-delà de sa période de synthèse, qui est de quelques heures seulement. L’activité constitutive du récepteur mGlu1a, qui résulte de la synthèse de Homer 1a, peut donc être considérée comme une mémoire cellulaire d’une hyperactivité transitoire antérieure du neurone. Le rôle physiologique de cette activité constitutive reste aujourd’hui inconnu.
Ces résultats dévoilent un nouveau concept : des RCPG non mutés peuvent être activés, dans des conditions d’hyperactivité cellulaire, par des protéines d’interaction intracellulaires, et ceci en l’absence de ligand extracellulaire. Bien que déclenché par des facteurs environnementaux, ce type d’activation dépend uniquement de l’état de la cellule elle-même et non plus uniquement des messages que lui envoient les cellules avoisinantes. Ce concept ouvre des perspectives nouvelles pour la conception de médicaments qui modifieraient l’association entre RCPG et protéines intracellulaires.