On a beaucoup parlé au conditionnel des perspectives thérapeutiques ouvertes par les cellules souches embryonnaires, mais on n’avait pas jusque-là de démonstration expérimentale de leurs capacités de remplacer réellement des cellules adultes défaillantes. L’équipe d’Ole Isacson (Harvard Medical School, Boston, USA) fait aujourd’hui franchir ce cap en démontrant la capacité de cellules souches de souris de se substituer à des neurones fœtaux dopaminergiques, anatomiquement et fonctionnellement, après implantation intra-cérébrale dans un modèle de maladie de Parkinson chez le rat [1].
Le travail fondateur de cette série de recherches a été la publication de l’équipe de Ron McKay dans Nature Biotechnology l’an dernier [2], puisque cet article présentait ce que l’on pourrait appeler une «recette de cuisine» permettant de guider la différenciation de cellules ES (de souris) vers une différenciation en neurones (à 72 %), notamment en neurones dopaminergiques (1/3 de la population neuronale). Comme il existait clairement un phénomène d’amplification puisque, à partir de 3 millions de cellules ES, on obtenait 27 millions de neurones dopaminergiques (incidemment, on ne greffe en moyenne chez les patients parkinsoniens qu’entre 1 et 2 millions de ces neurones), ces résultats avaient immédiatement une résonance thérapeutique. L’équipe d’Isacson a… « résonné » et, de fait, bien raisonné sur les obstacles à surmonter. Car le problème connu que pose l’utilisation des cellules ES à des fins thérapeutiques est leur propension à donner des tératomes après implantation chez un hôte. La technique présentée par l’équipe de McKay était complexe, mais scientifiquement solide, argumentée, cohérente avec les données de la littérature développementale ; elle reproduisait en culture les diverses étapes connues de la maturation de ces neurones en «forçant» à chaque fois les cellules vers l’objectif grâce à l’apport de facteurs protéiques bien définis. Elle ne permettait toutefois pas, apparemment, d’obtenir une différenciation totale de la population cellulaire et, donc, d’éviter la formation de tératomes.
La base du raisonnement d’Isacson a été l’observation d’une différence de comportement des cellules ES en culture en fonction de leur densité. A forte densité (106/ml), les cellules ES de souris formant des corps embryoïdes ne se différencient pas, ou quasiment pas, en neurones et en cellules gliales. En revanche, lorsque l’on abaisse simplement la densité de 2 ou 3 log, on peut obtenir jusqu’à 95 % de différenciation neuronale et gliale dans les cultures ! Cet enrichissement ne dépend pas de facteurs solubles mais de signaux transmis par des contacts inter-cellulaires. L’auteur a fait usage de cette différenciation conditionnelle pour explorer la capacité des cellules ES comme substituts de neurones dopaminergiques fœtaux pour le traitement de la maladie de
Parkinson. Des suspensions de cellules issues de corps embryoïdes provenant d’un début de différenciation des cellules ES à 4 J à la concentration de 2 000 cellules par µl (au lieu des 100 000 cellules par µl habituelles) ont donc été implantées dans le striatum de rats préalablement soumis à une lésion chimique de l’innervation dopaminergique par la toxine 6-hydoxydopamine. Après 3 mois, le greffon de cellules embryonnaires s’était agrandi (formant une masse de plus de 10 000 cellules), mais la plupart des cellules dérivées étaient des neurones. Une fraction significative (>20%) de ces neurones étaient dopaminergiques, ainsi que le révélaient des marquages immunohistochimiques de la tyrosine hydroxylase, enzyme de synthèse des catécholamines, de la décarboxylase d’acide aminé aromatique et du transporteur de la dopamine.
Ces cellules dérivées des cellules ES ne se sont pas contentées de prendre un phénotype dopaminergique, elles ont aussi occupé anatomiquement et fonctionnellement la place des neurones manquants. Ainsi, une imagerie en tomographie par émission de positons a permis de visualiser au niveau des greffes des marqueurs pré-synaptiques de l’innervation (par fluoro-DOPA, précurseur de la dopamine, et par CFT, un ligand sélectif du transporteur de la dopamine). Celle de marqueurs de l’activité métabolique (fluoro-désoxyglucose et IRM fonctionnelle) a permis de vérifier la récupération fonctionnelle des circuits nerveux non seulement dans le striatum, mais aussi dans le cortex sen-sori-moteur ipsilatéral.
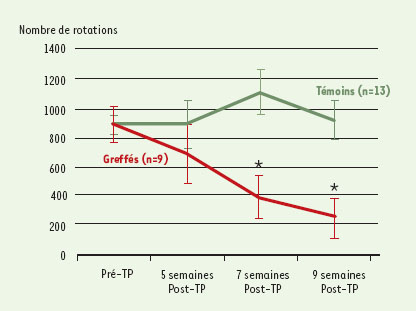
Cette récupération anatomique, comparable à celle que l’on peut observer à la suite d’une greffe de neurones dopaminergiques fœtaux prélevés dans la zone mésencéphalique ventrale, s’est accompagnée d’un bénéfice comportemental très net (Figure 1). La lésion unilatérale de l’innervation dopaminergique s’accompagne chez le rat de phénomènes de rotations sous induction pharmacologique. La quantification de ces rotations est très représentative de l’état de dénervation (et de réinnervation fonctionnelle) dans ce modèle. Comme le montre la Figure 1, l’implantation de cellules ES a induit une diminution très significative du nombre de rotations, puisque l’on passe de plus de 800 rotations chez les témoins à environ 250. Le décours temporel de cet effet thérapeutique est très intéressant à souligner. En effet, on voit que les résultats comportementaux deviennent clairement significatifs 7 semaines après l’implantation. Or, dans les mêmes conditions, une greffe de neurones fœtaux dopaminergiques donnera des effets similaires en 5 semaines, deux semaines plus tôt. Sachant que les neurones fœtaux utilisés sont prélevés à environ deux semaines de vie intrautérine, il est extrêmement tentant de considérer que ce délai différent est dû, tout simplement, à la maturation intra-cérébrale normale des cellules ES !
| Figure 1. Analyse du comportement des rats parkinsoniens après greffe. Nombre de rotations effectuées en 30 minutes par deux groupes de rats dont un striatum a été lésé par injection de 6-OHDA, et qui ont reçu ensuite une implantation intra-striatale soit de 2 000 cellules ES (greffés) soit de sérum physiologique (témoins). Le nombre de tours étant identique avant la transplantation (pré-TP), le groupe traité présente après l’implantation (post-TP) une nette amélioration progressive, devenant significative (*) à 7 semaines et s’amplifiant encore à 9. |
L’équipe d’Isacson ne cache toutefois pas, dans son article, que l’obtention des conditions expérimentales permettant ce développement non tumoral de cellules fonctionnelles n’est pas encore parfaitement assurée : 5 rats sur 19 ont dû être sacrifiés, et sortis de l’étude, du fait de l’existence de tératomes intra-cérébraux. Les marqueurs de prolifération n’ont toutefois révélé aucune persistance de cette capacité dans les greffons des 14 animaux finalement étudiés. Un raffinement des conditions est donc à l’évidence nécessaire pour satisfaire des exigences thérapeutiques, mais elles ne semblent pas tota-ement hors d’atteinte.
Si les cellules ES humaines sont capables de se comporter comme leurs équivalents murins, la «banque de cellules» dont rêvent depuis longtemps les neuro-transplanteurs est donc peutêtre à portée de main. Encore faudrait-i que les chercheurs puissent à présent étudier ces cellules ES établies à partir de blastocystes humains, ce que la loi eur interdit pour l’essentiel de faire… aussi bien à Harvard qu’en France !