| |
| Med Sci (Paris). 2002 February; 18(2): 193–204. Published online 2002 February 15. doi: 10.1051/medsci/2002182193.Établissement des axes embryonnaires au cours du développement du poisson zèbre Bernard Thisse and Christine Thisse Institut de Génétique et de Biologie Moléculaire et Cellulaire, Cnrs/Inserm/ULP, 1, rue Laurent Fries, BP 163, CU de Strasbourg, 67404 Illkirch Cedex, France |
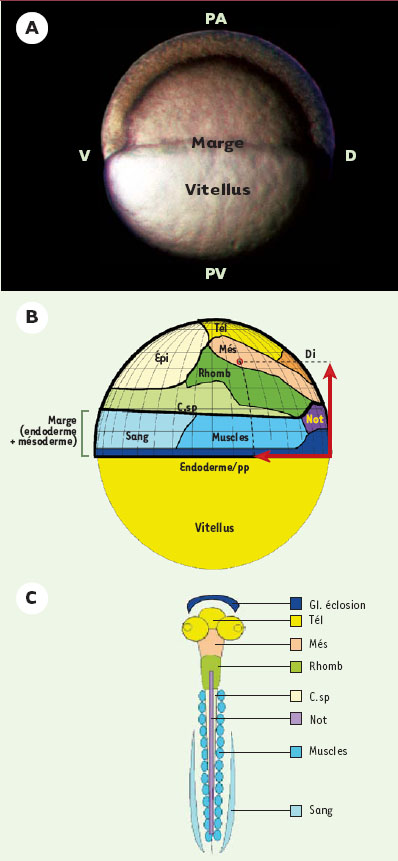
Une des questions centrales de la biologie du développement contemporaine est la nature moléculaire de l’information conduisant les cellules de l’embryon précoce vers un devenir particulier. Un bon modèle animal utilisé pour répondre à cette question est le poisson zèbre (Danio rerio). Ce modèle présente en effet un certain nombre d’avantages : il permet une analyse génétique (grande collection de mutants, stratégies d’analyse du génome en plein essor) ainsi qu’une approche embryologique classique facilitée par la transparence des embryons et leur développement très rapide (gastrulation après 5 h de développement). Après fécondation, la première cellule, située au sommet d’une grande réserve vitelline, va subir une succession de divisions synchrones, conduisant à un ensemble de cellules identiques et totipotentes. Jusqu’au stade de transition miblastuléenne (1 024 cellules), le développement s’effectue sous contrôle de l’information maternelle. Ce n’est qu’à partir de ce stade que le génome zygotique commence à être transcrit. Les cellules, situées toutes au pôle animal1,, vont commencer à se diviser de manière asynchrone puis vont progressivement recouvrir la réserve vitelline1, au cours du mouvement d’épibolie1,. La gastrulation commence lorsque 50 % du vitellus est recouvert par les cellules embryonnaires. À partir de ce stade, trois mouvements sont à considérer : le mouvement d’épibolie1 qui se poursuit jusqu’à ce que toute la réserve vitelline soit recouverte par les cellules embryonnaires, le mouvement d’invagination des cellules de la marge (Figure 1) qui va permettre la formation des deux feuillets embryonnaires profonds, l’endoderme et le mésoderme, et le mouvement de convergence qui conduit les cellules ventrales vers la face dorsale de l’embryon où s’allonge l’axe embryonnaire [1]. C’est immédiatement après la transition mi-blastuléenne qu’une cascade d’événements moléculaires va progressivement conduire les cellules de l’embryon à adopter un devenir particulier tel qu’on peut le définir sur la carte des territoires présomptifs établie à la fin du stade blastula (Figure 1B). À ce stade, les cellules embryonnaires forment une couche unique recouvrant l’hémisphère animal du vitellus. Par analogie avec le système de coordonnées utilisé pour définir une position sur le globe terrestre on peut caractériser le devenir d’une cellule donnée en fin de stade blastula en fonction de deux coordonnées : sa longitude, qui correspond à la position de cette cellule de long de l’axe dorso-ventral (D/V, avec pour méridien d’origine l’axe embryonnaire qui se forme dorsalement) et sa latitude qui correspond à la position de cette même cellule le long de l’axe margino-animal (Figure 1B).  | Figure 1.Carte des territoires présomptifs d’un embryon de poisson zèbre au stade de blastula tardive. A. Les cellules embryonnaires sont disposées sur l’hémisphère animal de la réserve vitelline. Le mouvement d’épibolie conduit les cellules de la marge jusqu’au niveau de l’équateur. PA : pôle animal ; PV : pôle végétal ; D : dorsal ; V : ventral. B. Carte des territoires présomptifs de l’embryon au même stade qu’en A (5h de développement, d’après [ 54, 55]). La région marginale comprend des cellules endodermiques, les cellules mésodermiques incluant la plaque préchordale (pp), la notochorde (Not), les muscles et le territoire sanguin. Au niveau de l’ectoderme, on distingue la moelle épinière ou corde spinale (C. sp), le rhombencéphale (Rhomb), le mésencéphale (Més), le diencéphale (Di), le télencéphale (Tél) et l’épiderme (Épi). Le devenir de chaque cellule peut être défini selon ses coordonnées (flèches rouges) : sa longitude (le long de l’ave D/V) et sa latitude (le long de l’axe marge/pôle animal ou antéro-postérieur, A/P). C. Structures dérivant des territoires présomptifs décrits en B. Même code couleur. La glande d’éclosion (Gl) dérive de la plaque préchordale. |
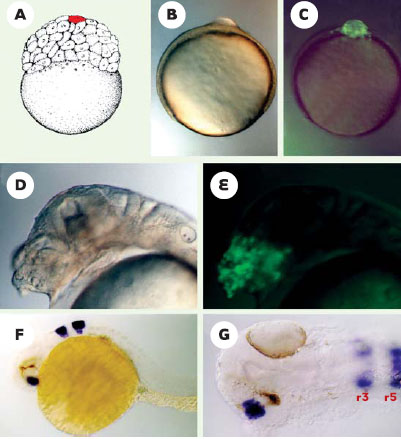
|
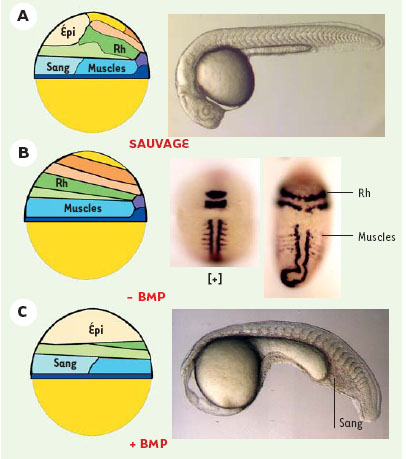
L’axe dorso/ventral : les BMP et leurs inhibiteurs De manière générale, les méthodologies employées pour perturber la formation des axes embryonnaires sont soit « la perte de fonction » d’éléments requis pour la formation de ces axes, via par exemple la genèse de mutations après mutagenèse ENU (éthyl-nitroso-urée) [2, 3] ou en inhibant la fonction des gènes d’intêret par la technique de morpholino knock-down [4], soit au contraire en réalisant des expériences dites « gain de fonction » via la surexpression de facteurs par injection d’ARN dans des embryons à des stades très précoces de développement. Chez le xénope, des études antérieures ont montré que l’identité des cellules le long de l’axe D/V dépend de l’activité de molécules sécrétées, appartenant à la superfamille des TGFβ : les BMP (bone morphogenetic proteins) (pour revue voir [5]). Chez le poisson zèbre, ces facteurs BMP sont exprimés très précocement dans les territoires ventraux et ventro-latéraux de l’embryon et confèrent aux cellules qu’ils stimulent une identité ventrale [6–9]. Ainsi, par rapport à la situation sauvage (Figure 2A), manipuler l’axe D/V revient à modifier la dose de BMP que vont recevoir les cellules de la blastula. On va ainsi obtenir deux types de phénotypes : un phénotype de dorsalisation (Figure 2B) ou un phénotype de ventralisation (Figure 2C). Le phénotype de dorsalisation (Figure 2B) résulte de la perte d’activité des BMP (mutation ou inactivation des gènes codant pour ces facteurs ou surexpression d’inhibiteurs spécifiques). Par rapport à la situation sauvage, on observe, chez les embryons dorsalisés, un élargissement des territoires dorso-latéraux tant au niveau du feuillet mésodermique que du feuillet ectodermique (Figure 2B). Les embryons ont une forme allongée, d’où le nom par exemple de la mutation aubergine qui inactive le gène BMP7 [9]. Au niveau de la couche mésodermique, le territoire somitique (musculaire) s’élargit au détriment du mésoderme ventral (sang) et, dans les cas extrêmes, les sillons somitiques font tout le tour de l’embryon. Pour l’ectoderme, les mêmes élargissements et circularisations des territoires dorso-latéraux sont observés avec une disparition concomitante de l’épiderme (Figure 2B). À l’opposé, la surexpression des BMP induit un phénotype de ventralisation consistant en un élargissement du territoire mésodermique ventral hématopoïétique, au détriment du mésoderme dorsal, notochordal (Figure 2C). Dans l’ectoderme, l’expansion de l’épiderme au détriment du neurectoderme (future plaque neurale) conduit à une réduction voire à une disparition totale du cerveau (Figure 2C). 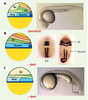 | Figure 2. Le profil embryonnaire le long de l’axe D/V dépend de l’activité des BMP. A. Situation sauvage. À gauche, carte des territoires présomptifs en fin de stade blastula. Épi : épiderme; Rh : rhombencéphale. À droite, vue latérale d’un embryon à 36 h de développement. B. (-BMP) Phénotype de dorsalisation obtenu après inhibition de la voie des BMP. Sur la carte des territoires présomptifs, le territoire somitique (muscles) apparaît élargi au détriment du mésoderme ventral (sang). Le cerveau est élargi au détriment de l’épiderme (Épi). Ceci est visualisé après analyse par hybridation in situ avec le marqueur musculaire MyoD qui révèle une circularisation des somites ou avec Krox20, spécifique des rhombomères 3 et 5 (Rh) montrant également une circularisation de ces structures neuroectodermiques chez l’embryon dorsalisé. [+] Expression des mêmes marqueurs chez l’embryon sauvage. C. (+BMP) A l’opposé, une surexpression des BMP induit un phénotype de ventralisation. On observe dans le mésoderme un élargissement des territoires ventraux (sanguins) avec une disparition des territoires les plus dorsaux (notochorde). Dans l’ectoderme, on observe une expansion de l’épiderme et une forte réduction du cerveau. Ces altérations sont visibles sur la carte des territoires présomptifs à gauche, ou à droite chez un embryon en vue latérale : la partie céphalique est absente et la quantité de sang apparaît plus abondante comparée au témoin sauvage en A. |
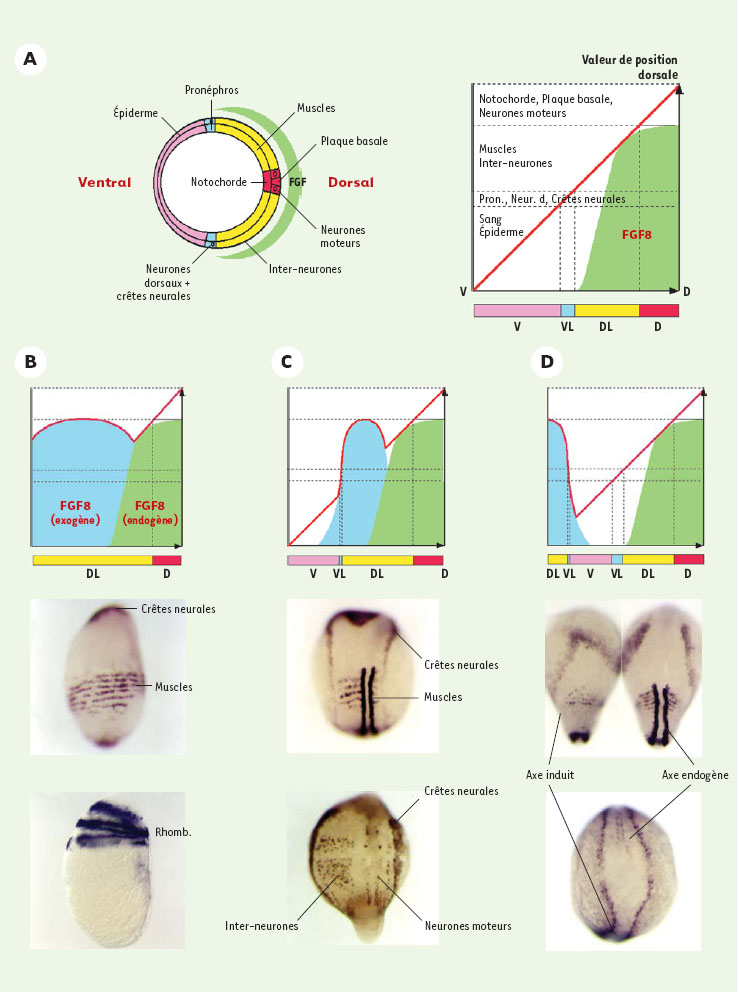
Plusieurs membres de la famille des BMP, BMP2b, BMP4 et BMP7 présentent des activités biologiques équivalentes [10, 11]. Les mutants de BMP2b (swirl) [8] ou de BMP7 (aubergine/snailhouse) [9] conduisent à des phénotypes identiques de dorsalisation extrême. Le double mutant BMP2b/BMP7 ne présente pas de phénotype additionnel. Ces deux facteurs ne peuvent donc pas se substituer l’un à l’autre puisque la présence d’un gène BMP2b fonctionnel chez le mutant aubergine n’empêche pas la perte des territoires ventraux de l’embryon. Par des expériences d’injection d’ARN, on a montré que BMP2b et BMP7 agissent de manière synergique lorsque les deux transcrits sont exprimés dans la même cellule. Leur action coopérative, probablement sous la forme d’hétérodimères, augmente de façon spectaculaire leur activité comparée à celle d’un monomère seul [9]. Ceci montre que l’établissement de l’axe D/V ne dépend pas de l’activité de monomères de BMP mais résulte de l’action d’hétérodimères BMP2b/BMP7. Modulation de l’activité des BMP Différents facteurs inhibiteurs des BMP, tels que Noggin, Chordin et Follistatin ont été identifiés chez le xénope [ 12– 14]. Ces facteurs sécrétés agissent en se liant aux BMP, les empêchant ainsi de se fixer et de stimuler leurs récepteurs spécifiques (pour revue voir [ 5, 15, 16]). Un gène chordin a été caractérisé chez le poisson zèbre et le mutant de ce gène conduit à un phénotype de ventralisation, résultant de la perte de son activité antagoniste des BMP [ 17]. Par une approche biochimique, il a été montré qu’une métalloprotéase, Tolloid, ou son homologue, Xolloid, chez le xénope, contrôle négativement l’activité de Chordin par clivage, restaurant ainsi l’activité BMP [ 18, 19]. Chez le poisson zèbre, les mutants de tolloid conduisent à des phénotypes de dorsalisation qui résultent de l’augmentation d’activité de Chordin et donc de la diminution de l’activité des BMP [ 20]. Alors qu’une seule copie de noggin et follistatin a été isolée dans différentes espèces [12, 14], chez le poisson zèbre trois gènes noggin ont été caractérisés [21, 22] ainsi que deux gènes follistatin. L’un de ces gènes, noggin1, est exprimé comme le gène noggin de xénope à la marge dorsale de l’embryon, dès le stade blastula. Comme dans d’autres espèces, la surexpression de noggin1 inhibe l’activité des BMP. En ce qui concerne les gènes follistatin, leur surexpression entraîne une inactivation des BMP. Cependant, ces gènes s’expriment trop tard au cours du développement du poisson zèbre pour jouer un rôle dans l’établissement de l’axe D/V. Enfin, par une analyse génétique, une mutation ogon a été isolée et code pour un nouveau gène qui possède des propriétés inhibitrices de l’activité des BMP [23]. La régulation de l’activité morphogénique des BMP ne se limite pas à l’interaction avec des facteurs inhibiteurs sécrétés par les régions dorsales de l’embryon de poisson zèbre, tels que chordin, noggin1 ou ogon. En effet, un autre niveau de contrôle de l’activité de ces gènes a été mis en évidence, situé au niveau du contrôle de leur expression. Les gènes BMP (BMP2b et BMP7) sont initialement exprimés dans toutes les cellules de la blastula, puis les transcrits disparaissent progressivement des territoires dorsaux. Le contrôle de cette expression est effectué par les FGF et en particulier par le FGF8 [24]. Ce facteur fibroblastique de croissance avait été précédemment décrit dans d’autres espèces comme une molécule signal impliquée dans la croissance du bourgeon de membre [25] ainsi que dans le développement du cerveau moyen [26]. Chez le poisson zèbre, ce gène est exprimé très précocement à la marge de la blastula puis sous la forme d’un gradient dorso-ventral dans la région marginale de la gastrula, ce qui suggère qu’il puisse être impliqué dans l’axogenèse D/V. De fait, l’expression ectopique du FGF8 induit une gamme de phénotypes de dorsalisation. Cependant, contrairement aux facteurs sécrétés Noggin et Chordin, le FGF8, agissant via son récepteur et sa voie de signalisation intracellulaire, conduit à une inhibition de l’expression des gènes codant pour les BMP. Une analyse détaillée des phénotypes induits par la surexpression d’inhibiteurs des BMP (le FGF8 dans le cas illustré) ainsi que l’interprétation de ces phénotypes est présentée sur la Figure 3.
 | Figure 3. Manipulations de l’axe D/V via le contrôle de l’activité morphogénique des BMP. A. Section d’un embryon suivant l’axe D/V au stade gastrula permettant de mettre en évidence l’organisation des tissus mésodermiques et ectodermiques le long de cet axe. On peut ainsi distinguer les territoires dorsaux (D, en rouge) comprenant la notochorde dans le feuillet mésodermique, la plaque basale du tube neural et les neurones moteurs dans l’ectoderme ; les territoires dorsaux latéraux (DL, en jaune) comprenant les muscles pour le mésoderme, les inter-neurones pour l’ectoderme ; les territoires ventraux latéraux (VL, en bleu) comprenant le pronéphros pour le mésoderme ; les neurones dorsaux et les crêtes neurales pour l’ectoderme ; les territoires ventraux (V, en rose) comprenant le sang pour le mésoderme et l’épiderme pour le feuillet ectodermique. Le croissant vert représente le gradient d’expression du FGF8 au stade gastrula. On peut définir les différents territoires le long de l’axe D/V en fonction d’une valeur de position dorsale. Selon ce modèle, les différents territoires sont formés en réponse à la valeur de position dorsale que mesure chaque cellule le long de l’axe D/V. L’information positionnelle dorsale, nulle sur la face ventrale de l’embryon et maximale sur la face dorsale (courbe rouge) représente la résultante de l’interaction entre les BMP ventralement et leurs inhibiteurs dorsaux. En fonction de la valeur de cette information de position, les cellules vont adopter un sort ventral (rose), ventro-latéral (bleu), dorso-latéral (jaune) ou dorsal (rouge). La pertinence de ce modèle est illustrée par l’étude de l’inhibition de l’expression des BMP par le FGF8 dans des expériences de surexpression. La surface verte sur ce graphe correspond à la contribution du FGF8 à l’établissement de l’axe D/V (fondé sur son territoire d’expression dorsal et dorso-latéral, ainsi que sur son activité biologique : capable d’induire des structures dorso-latérales mais incapables d’induire les sorts les plus dorsaux). B. Lorsque l’embryon est saturé en FGF8 (injection d’ARN sens au stade une cellule), l’expression des BMP est réprimée dans tout l’embryon et en conséquence toutes les cellules adoptent un sort dorso-latéral caractérisé par la circularisation du territoire musculaire (embryon du haut) ou des rhombomères (Rhomb) du cerveau postérieur (embryon du bas). Ce phénotype est identique au phénotype de perte de fonction des BMP présenté en figure 2B. En pareil cas, la courbe de l’information positionnelle (rouge) est déplacée vers les valeurs correspondant aux territoires dorso-latéraux pour toutes les cellules à l’exception de celles des territoires dorsaux endogènes. C. Lorsque le clone sécrétant le FGF8 est en position latérale on observe un élargissement des territoires dorsolatéraux tant dans le mésoderme (élargissement unilatéral des sillons somitiques) que dans l’ectoderme (élargissement unilatéral de la plaque neurale bordée par les cellules des crêtes neurales ; augmentation unilatérale du nombre d’inter-neurones). D. Lorsque le clone est en position ventrale, il conduit à la formation d’un axe secondaire partiellement défectif comprenant les territoires dorsolatéraux mais pas les territoires dorsaux (notochorde et partie ventrale du tube neural). L’embryon du haut est photographié sous ses deux faces, dorsale (axe endogène) et ventrale (axe induit). Les mêmes résultats peuvent être observés en inhibant l’activité des BMP par la surexpression d’autres facteurs inhibiteurs qui tels Noggin et Chordin agissent en fixant les BMP les empêchant ainsi de stimuler leur récepteur spécifique. |
Ainsi, en résumé, chez le poisson zèbre, la coordonnée « longitude » d’une cellule, c’est-à-dire son information spatiale le long de l’axe D/V est définie par l’action morphogénique de facteurs sécrétés appartenant à la superfamille des TGFβ, les BMP, dont l’action est ellemême contrôlée à deux niveaux : expression de leur gène (contrôlé par les FGF) et leur liaison à leurs récepteurs (contrôlée via des molécules sécrétées par les régions dorsales de l’embryon). |
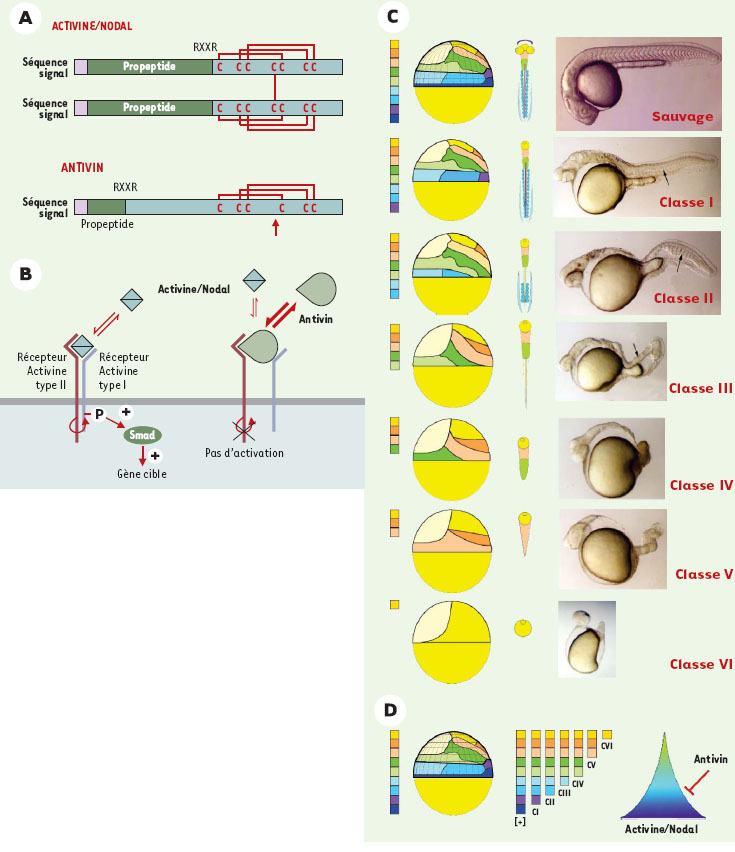
L’axe antéro-postérieur : Activine/Nodal et leur inhibiteur Antivin Outre l’information D/V, pour définir son identité spatiale au sein de la blastula, une cellule donnée requiert une coordonnée de latitude, c’est-à-dire une information moléculaire sur sa position le long de l’axe margino-animal. Cette coordonnée permet de définir sa position le long de l’axe antéro-postérieur (A/P) en fin d’embryogenèse. En effet, l’observation de la carte des territoires présomptifs (Figure 1B à comparer avec Figure 1C) montre que les territoires situés au pôle animal vont conduire à la formation des yeux et du cerveau antérieur (télencéphale et diencéphale) alors que des territoires situés dans des régions progressivement plus végétales se différencient en structures neurales plus postérieures telles que le cerveau moyen (mésencéphale) puis le cerveau postérieur (rhombencéphale) et enfin la moelle épinière. En revanche, dans la région marginale, les cellules qui vont former les feuillets internes (mésoderme et endoderme) présentent une polarité opposée. En effet, les cellules situées dans la position la plus végétale sont les premières à s’invaginer lors de la gastrulation. Ces cellules vont ensuite migrer sous le neurectoderme en direction du pôle animal. Ainsi, en conséquence de ce mouvement d’invagination, les cellules les plus marginales à la fin du stade blastula vont être situées dans les territoires mésodermiques antérieurs (exemple la glande d’éclosion qui dérive de la plaque préchordale). En revanche, les cellules mésodermiques plus éloignées de la marge et qui s’invaginent donc plus tard au cours de la gastrulation vont engendrer des dérivés mésodermiques situés plus postérieurement. La nature moléculaire des signaux qui établit ce profil d’organisation A/P est le résultat de l’activité d’une autre sous-famille de TGFβ, différente des BMP, comprenant les facteurs Activine/Nodal. Cette démonstration a été rendue possible grâce à l’isolement d’une nouvelle molécule, Antivin (Atv), un facteur sécrété appartenant également à la superfamille des TFGβ, apparenté à Lefty [27, 28]. Ces deux facteurs présentent des caractéristiques structurales différentes de celles des TGFβ classiques [29, 30] suggérant qu’ils agissent non pas à l’état dimérique mais à l’état monomérique (Figure 4A). Une analyse in vivo a montré qu’Atv/Lefty agissent comme inhibiteurs compétitifs des facteurs Activine ou Nodal au niveau de leur fixation à leur récepteur spécifique ([31] et Figure 4B).  | Figure 4.Le patron embryonnaire le long de l’axe A/P dépend de l’activité des facteurs Activine/Nodal. A. Les facteurs appartenant à la superfamille des TGFβ sont synthétisés sous la forme de préproprotéines qui subissent une maturation via une digestion endopeptidique (au site RXXR). Ils agissent sous la forme de dimères liés de manière covalente par un pont disulfure entre deux cystéines [ 29, 30]. Atv présente un propeptide très court, le monomère étant ainsi 2 fois plus long que celui des TGFβ classiques. Atv ne possède pas la cystéine (flèche) nécessaire à la dimérisation. B. Les Activines et Nodal agissent sous la forme de dimères covalents qui se lient à un récepteur de type II. La fixation du ligand sur le récepteur de type II conduit au recrutement d’un récepteur de type I. Une fois ce complexe ternaire formé, le récepteur de type I est phosphorylé par l’activité kinase du récepteur de type II. Le récepteur de type I ainsi activé va stimuler la voie de signalisation aval via la phosphorylation de protéines Smad. La conséquence finale de cette stimulation sera l’activation transcriptionnelle de gènes cibles. Du fait de sa structure secondaire, Atv agit à l’état monomérique, se lie au récepteur de type II sans l’activer et joue ainsi un rôle d’inhibiteur compétitif de la voie Activine/Nodal. C. Gamme de phénotypes obtenus après surexpression d’Atv. Les phénotypes illustrés par les photos (à droite) sont interprétés au niveau de la carte des territoires présomptifs (code couleur et dessins) au stade blastula tardive représenté à gauche ainsi qu’au stade 24 h de développement (dessin de droite). Classe I : absence d’endoderme et de plaque préchordale ; classe II : absence d’endoderme, de plaque préchordale et de notochorde ; classe III : absence complète d’endoderme et de mésoderme ; classe IV : absence d’endoderme, de mésoderme et de moelle épinière ; classe V : absence d’endoderme, de mésoderme, de moelle épinière et de rhom-bencéphale ; classe VI : ne subsiste qu’un peu de télencéphale et un œil. D. Le patron A/P dépend de l’activité des facteurs Activine/Nodal, maximale à la marge, décroissant graduellement vers le pôle animal, les autres territoires étant formés en réponse à une stimulation par des valeurs intermédiaires des facteurs Activine/Nodal. [+] : situation sauvage. |
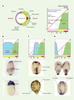
L’utilisation des propriétés inhibitrices d’Atv sur la voie de signalisation Activine/Nodal a permis d’identifier ces facteurs comme étant les facteurs responsables de la définition de la position A/P d’une cellule donnée. Ceci a été réalisé via des expériences de surexpression d’Atv par injection d’ARN codant pour ce facteur, aux stades précoces de l’embryogenèse (Figure 4C). L’injection d’une faible dose d’Atv conduit à un phénotype dit de classe I caractérisé par une délétion de l’endoderme et du mésoderme céphalique. En l’absence du mésoderme axial antérieur, la partie ventrale du diencéphale n’est pas induite et, en conséquence, les vésicules optiques fusionnent et se différencient en un œil unique (phénotype de cyclopie). Une dose croissante d’Atv conduit à un phénotype de classe II, pour lequel les embryons sont dépourvus d’endoderme, de mésoderme céphalique ainsi que de mésoderme axial, notochordal. L’absence de notochorde conduit à une fusion du mésoderme paraxial qui forme les somites. Une dose encore plus forte conduit à un phénotype de classe III, pour lequel les embryons ne possèdent plus ni endoderme ni mésoderme. Ainsi, la surexpression d’Atv conduit à une délétion dépendante de la dose et progressive de l’endoderme et des différentes sous-populations mésodermiques. Mais, le plus surprenant est qu’en l’absence totale de ces feuillets embryonnaires internes, la couche ectodermique se développe normalement (à l’exception des neurones ventraux dont l’induction dépend du mésoderme axial et qui ne sont donc pas induits) avec une organisation A/P identique à celle d’un embryon sauvage. Ceci montre que, chez le poisson zèbre, contrairement aux modèles préalablement établis dans d’autres espèces [32], la formation des structures ectodermiques est indépendante de l’induction du mésoderme [31]. Les facteurs Activine et Nodal ont été décrits dans différentes espèces comme capables d’induire différents types de sous-populations mésodermiques [33–37]. Ce phénotype Atv de classe III est très similaire à celui obtenu par l’inactivation totale de la voie de signalisation Nodal comme chez le double mutant cyclops/squint (chez qui les deux gènes nodal-related 1 et 2 sont inactivés [38]) ou en l’absence totale de l’activité du gène one-eyed pinhead qui code pour un co-facteur essentiel à l’activité des facteurs Nodal [39, 40]. Alors que la surexpression d’Atv conduit à une délétion progressive de l’endoderme et du mésoderme, le phénotype résultant de son inactivation par injection d’un morpholino antisens conduit au phénotype inverse, c’est-à-dire à une surproduction d’endoderme et de mésoderme [41]. L’ensemble de ces observations (expression des gènes, inhibition compétitive, phénotypes de surexpression et de perte de fonction) suggèrent donc que le rôle physiologique d’Atv est d’inhiber au stade blastula la fonction inductrice du mésoderme par les facteurs Nodal. En utilisant les propriétés inhibitrices d’Atv, peut-on, outre la région marginale (soit l’endoderme et le mésoderme), déléter de manière progressive toutes les structures le long de l’axe A/P ? Oui, ceci est possible (Figure 4D). L’injection de doses plus fortes d’ARN codant pour Atv conduit à des embryons de phénotype de classe IV qui sont des embryons dépourvus d’endoderme, de mésoderme et de moelle épinière. Les embryons de classe V présentent de plus une absence du rhombencépha-le. Enfin, pour le phénotype le plus extrême, dit phéno-type de classe VI, il ne subsiste plus que l’œil et une partie du télencéphale, c’est-à-dire les structures les plus antérieures dérivant des cellules situées au pôle animal au stade blastula. L’injection de doses plus fortes d’ARN codant pour Atv est en revanche incapable de conduire à la délétion de ces structures les plus antérieures. Ce pôle animal représente donc l’état de base pour la voie de signalisation Activine/Nodal [42]. Afin de démontrer que l’inhibition progressive des structures le long de l’axe A/P résulte de l’inhibition de la voie de signalisation Activine/Nodal et non de l’interférence entre Atv et d’autres voies de signalisation, des expériences de sauvetages phénotypiques par co-injection de doses croissantes de facteurs Activine ou Nodal ont été effectuées. Il est ainsi possible de régénérer progressivement des structures plus postérieures. Partant d’embryons de classe VI, la co-injection d’Activine ou de Nodal conduit à des embryons présentant des phénotypes de classe V, puis IV, puis III et ainsi de suite jusqu’à la situation sauvage [42]. L’ensemble de ces expériences montre donc que le patron embryonnaire suivant l’axe A/P est obtenu via l’établissement d’un gradient d’activité Activine/Nodal, maximal à la marge de la blastula et décroissant progressivement en direction du pôle animal. Les structures dérivant des territoires les plus marginaux (endoderme et mésoderme céphalique) sont induites pour les plus fortes valeurs de signalisation alors que les structures dérivant du pôle animal se développent en l’absence de stimulation, chaque territoire intermédiaire étant déterminé en fonction du niveau de stimulation des cellules par la voie de signalisation Activine/Nodal (Figure 4D). |
Le pôle animal : un état basal pour la voie de signalisation Activine/Nodal Lors de ces expériences, seules les structures dérivant des cellules situées au pôle animal au stade blastula sont apparues insensibles à l’inhibition par Atv de la voie de signalisation Activine/Nodal. Ceci suggère que la formation des yeux et du cerveau antérieur s’effectue en l’absence totale de stimulation de cette voie. Ainsi, ces territoires antérieurs peuvent être considérés comme l’état basal pour cette voie de signalisation. Pour démontrer la validité de cette hypothèse, les cellules du pôle animal ont été injectées avec des concentrations croissantes d’Activine/Nodal [42] (Figure 5A-C). À 24 h de développement, les cellules dérivant du blastomère injecté sont localisées dans la partie céphalique de l’embryon. Pour une forte dose d’Activine /Noda une notochorde ectopique est formée à la place du cerveau antérieur (Figure 5 D-E). Pour des doses inférieures d’Activine/Nodal, le télencéphale et les yeux sont remplacés par des territoires correspondant au cerveau postérieur (Figure 5 F-G). Ainsi, en fonction de la dose d’Activine /Nodal injectée, les cellules du pôle animal sont capables d’engendrer une gamme de structures récapitulant les éléments formés le long de l’axe margino-animal chez l’embryon sauvage. Une forte stimulation conduit à la formation de structures dérivant de la région marginale (Figure 5D-E) alors que des doses plus faibles conduisent à la formation, dans la partie la plus antérieure de l’embryon, de structures neurales normalement produites dans des régions plus postérieures (Figure 5F-G). Ceci démontre que le pôle animal ne répond pas normalement à la voie de signalisation Activine / Nodal, mais peut être respécifié si on ajoute ces facteurs localement. 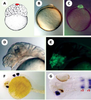 | Figure 5. Respécification des cellules du pôle animal en des structures plus postérieures par les facteurs Activine/Nodal. A.Schéma d’un embryon au stade 128 cellules. La cellule marquée en rouge correspond à celle injectée avec différentes doses d’ARN codant pour les facteurs Activine/Nodal et de l’ARN codant pour la GFP. B. En fin de gastrulation, le clone de cellules dérivant du blastomère injecté forme une protrusion au pôle animal. C. La fluorescence de la GFP est localisée dans cette protrusion. D. A 24 h de développement, les embryons présentant la protrusion décrite en (B) et (C) présentent une notochorde ectopique à la place de l’œil et du télencéphale, visualisée ici morphologiquement. E. La fluorescence est bien visible dans cette structure néoformée. F. Pour une dose plus faible de facteurs Activine/Nodal, à 24 h, le télencéphale et l’œil sont remplacés par de l’ectoderme plus postérieur, d’origine rhombomérique (exprimant le marqueur Krox20, spécifique des rhombomères 3 et 5). G. Vue dorsale du même embryon montrant à la fois l’expression sauvage (rhombomères 3 et 5) de Krox20 ainsi que l’expression ectopique de ce même marqueur dans la partie céphalique. Chez cet embryon, l’œil gauche est remplaçé par du rhombencéphale. |
|
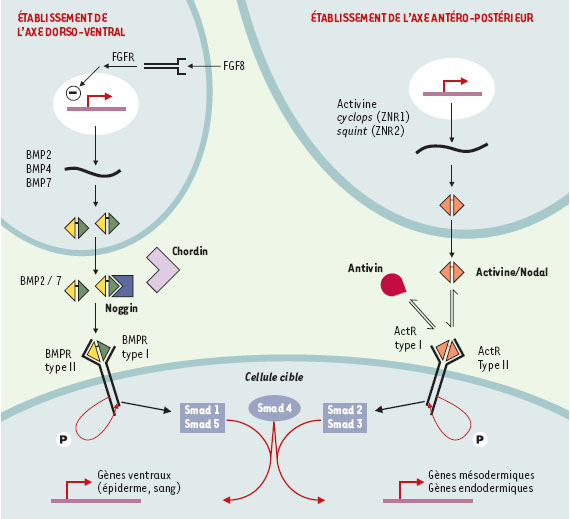
Conclusions et perspectives Ainsi, au stade blastula, une cellule donnée est définie selon un système de coordonnées perpendiculaires : la longitude (l’axe D/V) et la latitude (l’axe margino-animal ou A/P). Ces coordonnées sont définies via deux gradients d’activité de molécules sécrétées appartenant à la superfamille des TGFβ : les BMP (pour l’axe D/V) et les facteurs Activine/Nodal pour l’axe A/P. La modulation fine et spécifique de ces voies de signalisation par différents inhibiteurs est à l’origine de l’établissement graduel et ordonné des différents types cellulaires, première étape vers la formation d’un embryon. L’étape suivante de l’étude va consister en l’analyse de l’interaction entre ces deux voies de signalisation. Nous savons, grâce à des études réalisées chez le xénope, que certains éléments de la cascade de transduction du signal sont communs aux deux voies BMP et Activine/Nodal [43]. C’est en particulier le cas pour Smad4 qui forme un complexe actif par hétérodimérisation avec les protéines Smad1 et Smad5 (qui sont les protéines Smad activées par la voie des BMP) ou avec les protéines Smad2 et Smad3 (qui sont les protéines Smad activées par la voie des Activine et Nodal). Un résumé des mécanismes de régulation et d’interactions entre ces voies est présenté en Figure 6.
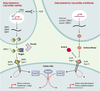 | Figure 6. Modèle de régulation et d’interaction entre les voies de signalisation responsables de l’axogenèse D/V et de l’axogenèse A/P. L’établissement de l’axe D/V dépend de l’activité morphogénique des BMP dont l’activité est contrôlée au niveau de leur trancription par le FGF8 ains que pour leur liaison à leur récepteur par Chordin et Noggin. La fixation du ligand BMP sur son récepteur va stimuler la voie de signalisation aval via la phosphorylation des protéines Smad1 et Smad5. L’établissement de l’axe A/P dépend de l’activité morphogénique des facteurs Activine / Nodal, dont l’activité est modulée par un inhibiteur compétitif, Antivin, qui empêche l’activation de leur récepteur. Lorsque le complexe récepteur de type II / récepteur de type I est formé, ceci stimule la voie de signalisation aval via la phosphorylation des protéines Smad2 et Smad3. Il existe une interaction entre ces deux voies de signalisation par l’intermédiaire de Smad4 qui forme un complexe actif par hétérodimérisation avec les protéines Smad1 et Smad5 (qui sont les protéines smad activées par la voie des BMP) ou avec les protéines Smad2 et Smad3 (qui sont les protéines activées par la voie des Activine et Nodal). |
Dans un deuxième temps, il s’agira d’analyser au niveau moléculaire la réponse des cellules à la stimulation par ces deux voies de signalisation. Ceci permettra de comprendre comment l’information spatiale reçue par ces cellules se traduit en un devenir tissulaire spécifique. Enfin, ces études devront être élargies à l’analyse de l’interaction entre la signalisation par les molécules de la famille des TGFβ avec d’autres voies de signalisation, comme les Wnt et l’acide rétinoïque. Ces molécules sont impliquées dans différents processus développementaux importants. La voie de signalisation Wnt en particulier paraît impliquée dans l’induction céphalique et dans certains aspects du contrôle du patron antéro-postérieur de l’embryon [44–49]. La surexpression de la voie de signalisation de Wnt8 conduit à la délétion du cerveau antérieur [44] alors que son inhibition par injection de formes dominantes négative ou d’inhibiteurs spécifiques conduit à une antériorisation du neurectoderme telle que toute la plaque neurale exprime des marqueurs spécifiques du cerveau antérieur [49]. La voie des rétinoïdes, quant à elle, est impliquée entre autres dans la formation du profil antéro-postérieur du système nerveux central plus particulièrement dans le cerveau postérieur (pour revue, voir [50, 51–53]). Ces deux voies de signalisation font appel à des facteurs sécrétés qui contrôlent certains aspects de la mise en place du patron antéro-postérieur de la plaque neurale. Leurs effets sur l’axogenèse antéro-postérieure sont plus restreints que ceux des TGFβ, ce qui suggère qu’elles agissent en aval des TGFβ au cours du développement embryonnaire précoce pour moduler l’activité des signaux primaires. Les études en cours et futures tenteront de placer ces différentes voies les unes par rapport aux autres résultant en un développement harmonieux de l’embryon. |
Glossaire | Épibolie | Mouvement conduisant au recouvrement de la réserve vitelline par les cellules embryonnaires situées au pôle animal. | | Glande d’éclosion | Partie la plus antérieure du mésoderme axial qui sécrète des protéases nécessaires à la dégradation du chorion et permettant l’éclosion. | | Pôle animal | Partie la plus antérieure de l’embryon (tête). | | Pôle végétal | Pôle situé à l’opposé du pôle animal (tissus postérieurs). | | Réserve vitelline | Jaune de l’œuf. |
|
Footnotes |
1. Kimmel CB, Warga RM. Tissue-specific cell lineages originate in the gastrula of the zebrafish. Science 1986; 231 : 365–8. 2. Haffter P, Granato M, Brand M, et al. The identification of genes with unique and essential functions in the development of the zebrafish, danio rerio. Development 1996; 123 : 1–36. 3. Driever W, Solnica-Krezel L, Schier AF, et al. A genetic screen for mutations affecting embryogenesis in zebrafish. Development 1996; 123 : 37–46. 4. Nasevicius A, Ekker S. Effective targeted gene knockdown in zebrafish. Nat Genet 2000; 26 : 216–20. 5. DeRobertis EM, Larrain J, Oelgeschlâger M, Wessely O. The establishment of Spemann’s organizer and patterning of the vertebrate embryo. Nat Genet 2000; 1 : 171–81. 6. Kishimoto K Lee KL, Zon L. Hammerschmidt M, Schulte-Merker S. The molecular nature of zebrafish swirl : BMP2 function is essential during early dorsoventral patterning. Development 1997; 124 : 4457–66. 7. Nikaido M, Tada M, Saji T, Ueno N. Conservation of BMP signaling in zebrafish mesoderm patterning. Mech Dev 1997; 61 : 75–88. 8. Nguyen VH, Schmid B, Trout J, Connors SA, Ekker M, Mullins MC. Ventral and lateral regions of the zebrafish gastrula, including the neural crest progenitors, are established by a bmp2b/swirl pathway of genes. Dev Biol 1998; 1 : 93–110. 9. Schmid B, Fürthauer M, Connors SA, et al. Equivalent genetic roles for bmp7/snailhouse and bmp2b/swirl in dorsoventral pattern formation. Development 2000; 127 : 957–67. 10. Hawley SHB, Wünnenberg-Stapleton K, Hashimoto C, et al. Disruption of BMP signals in embryonic Xenopus ectoderm leads to direct neural induction. Genes Dev 1995; 9 : 2923–35. 11. Nishimatsu S, Thomsen GH. Ventral mesoderm induction and patterning by bone morphogenetic protein heterodimers in Xenopus embryos. Mech Dev 1998; 74 : 75–88. 12. Smith WC, Harland RM. Expression cloning of noggin, a new dorsalizing factor localized to the Spemann organizer in Xenopus embryos. Cell 1992; 70 : 829–40. 13. Sasai Y, Lu B, Steinbeisser H, Geissert D, Gont LK, DeRobertis EM. Xenopus chordin: a novel dorsalizing factor activated by organizer-specific homeobox genes. Cell 1994; 79 : 779–90. 14. Fainsod A, Deissler K, Yelin R, et al. The dorsalizing and neural inducing gene follistatin is an antagonist of BMP-4. Mech Dev 1997; 63 : 39–50 15. De Robertis E. M. Dismantling the organizer. Nature 1995; 374 : 407–8. 16. Holley SA, Jackson PD, Sasai Y , et al. Conserved system for dorso-ventral patterning in insects and vertebrates involving sog and chordin. Nature 1995; 376 : 249–53. 17. Schulte-Merker S, Lee KJ, McMahon AP, Hammerschmidt M. The zebrafish organizer requires chordino. Nature 1997; 387 : 862–3. 18. Piccolo S, Agius E, Lu B, Goodman S, Dale L, De Robertis EM. Cleavage of Chordin by Xolloid metalloprotease suggests a role for proteolytic processing in the regulation of Spemann organizer activity. Cell 1997; 91 : 407–16. 19. Marques G, Musacchio M, Shimell MJ, Wunnenberg-Stapleton K, Cho KW, O’Connor MB. Production of a DPP activity gradient in the early Drosophila embryo through the opposing actions of the SOG and TLD proteins. Cell 1997; 91 : 417–26. 20. Connors SA, Trout J, Ekker M, Mullins MC. The role of tolloid/mini fin in dorsoventral pattern formation of the zebrafish embryo. Development 1999; 126 : 3119–30. 21. Bauer H, Meier A, Hild M, et al. Follistatin and noggin are excluded from the zebrafish organizer. Dev Biol 1998; 204 : 488–507. 22. Fürthauer M, Thisse B, Thisse C. Three different noggin genes antagonize the activity of Bone Morphogenetic Proteins in the zebrafish embryo. Dev Biol 1999; 214 : 181–96. 23. Miller-Bertoglio V, Carmany-Rampey A, Fürthauer M, et al. Maternal and zygotic activity of the zebrafish mercedes / ogon / short-tail locus antagonizes BMP signaling. Dev Biol 1999; 214 : 72–86. 24. Fürthauer M, Thisse C, Thisse B. A role for FGF-8 in the dorsoventral patterning of the zebrafish gastrula. Development 1997; 124 : 4253–64. 25. Crossley PH, Minowada G, McArthur CA, Martin GR. Roles for FGF8 in the induction, initiation and maintenance of chick limb development. Cell 1996; 84 : 127–36. 26. Crossley PH, Martinez S, Martin GR. Midbrain development induced by fgf8 in the chick embryo. Nature 1996; 380 : 66–8. 27. Meno C, Saijoh Y, Fujii H, et al. Left-right asymmetric expression of the TGFb family member lefty in mouse embryos. Nature 1996; 381 : 151–5. 28. Oulad-Abdelghani M, Chazaud C, Biullet P, Matteri MG, Dollé P, Chambon P. Stra 3/Lefty, a retinoid acidinducible novel member of the transforming growth factor b family. Int J Dev Biol 1998; 42 : 23–32. 29. Daopin S, Piez K.A, Ogawa Y, Davies DR. Crystal structure of transforming growth factor-beta 2: an unsual fold for the superfamily. Science 1992; 257 : 369–73. 30. Schlunegger MP, Grutter MG. An unusual feature revealed by the crystal structure at 2.2 A resolution of human transforming growth factorbeta 2. Nature 1992; 395 : 185–9. 31. Thisse C, Thisse B. Antivin, a novel and divergent member of the TGFβ superfamily, negatively regulates mesoderm induction. Development 1999; 126 : 229–40. 32. Ruiz y Altaba A. Neural expression of the Xenopus homeobox gene Xhox3: evidence for a patterning neural signal that spreads through the ectoderm. Development 1990; 108 : 595–604. 33. Thomsen G, Woolf T, Whitman M, et al. Activins are expressed early in Xenopus embryogenesis and can induce axial mesoderm and anterior structures. Cell 1990; 63 : 485–93. 34. Green JBA, New HJ, Smith JC. Responses of embryonic Xenopus cells to activin and FGF are separated by multiple dose thresholds and correspond to distinct axes of the mesoderm. Cell 1992; 71 : 731–9. 35. Gurdon JB, Harger P, Mitchell A, Lemaire P. Activin signalling and response to a morphogen gradient. Nature 1994; 371 : 487–92. 36. Jones CM, Kuehn MR, Hogan BL, Smith JC, Wright CV. Nodal-related signals induce axial mesoderm and dorsalize mesoderm during gastrulation. Development 1995; 121 : 3651–61. 37. Gristman K, Talbot WS, Schier AF. Nodal signaling patterns the organizer. Development 2000; 127 : 921–32. 38. Feldman B, Gates MA, Egan ES, et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature 1998; 395 : 181–5. 39. Schier AF, Neuhauss SC, Helde KA, Talbot WS, Driever W. The one-eyed pinhead gene functions in mesoderm and endoderm formation in zebrafish and interacts with no tail. Development 1997; 124 : 327–42. 40. Gritsman K, Zhang J, Cheng S, Heckscher E, Talbot WS, Schier A. F. The EGF-CFC protein one-eyed pinhead is essential for nodal signaling. Cell 1999; 97 : 121–32. 41. Agathon A, Thisse B, Thisse C. Morpholino knock-down of Antivin1 and Antivin2 upregulates Nodal signaling. Genesis 2001; 30 : 178–82. 42. Thisse B, Wright CVE, Thisse C. Activin and Nodalrelated factors control antero-posterior patterning of the zebrafish embryo. Nature 2000; 403 : 425–7. 43. Candia AF, Watabe T, Hawley SH, et al. Cellular interpretation of multiple TGF-beta signals: intracellular antagonism between activin/BVg1 and BMP-2/4 signaling mediated by Smads. Development 1997; 124 : 4467–80. 44. Kelly GM, Greenstein P, Erezyilmaz DF, Moon RT. Zebrafish wnt8 and wnt8b share a common activity but are involved in distinct developmental pathways. Development 1995; 121 : 1787–99. 45. Glinka A, Wu W, Deluis H, Monaghan AP, Blumenstock C, Niehrs C. Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction. Nature 1998; 391 : 357–62. 46. Piccolo S, Aguis E, Leyns L, et al. The head inducer Cerberus is a multifunctional antagonist of Nodal, BMP and Wnt signals. Nature 1999; 397 : 707–10. 47. Bradley L, Sun B, Collins-Racie L, LaVallie E, McCoy J, Sive H. Different activities of the frizzled-related proteins frzb2 and sizzled2 during Xenopus anteroposterior patterning. Dev Biol 2000; 227 : 118–32. 48. Shinya M, Eschbach C, Clark M, Lehrach H, Furutani-Seiki M. Zebrafish Dkk1, induced by the pre-MBT Wnt signaling, is secreted from the prechordal plate and patterns the anterior neural plate. Mech Dev 2000; 98 : 3–17. 49. Kazanskaya O, Glinka A, Niehrs C. The role of Xenopus dickkopf1 in prechordal plate specification and neural patterning. Development 2000; 127 : 4981–92. 50. Maden, M. Heads or tails? Retinoid acid will decide. Bioessays 1999; 21 : 809–12. 51. Chen Y, Pollet N, Niehrs C, Pieler T. Increased XRALDH2 activity has a posteriorizing effect on the central nervous system of Xenopus embryos. Mech Dev 2001; 101 : 91–103. 52. Sakai Y, Meno C, Fujii H, et al. The retinoic acidinactivating enzyme CYP26 is essential for establishing an uneven distribution of retinoic acid along the anterio-posterior axis within the mouse embryo. Genes Dev 2001; 15 : 213–25. 53. Abu-Abed S, Dollé P, Metzger D, Beckett B, Chambon P, Petkovich M. The retinoic acid-metabolizing enzyme, CYP26A1, is essential for normal hindbrain patterning, vertebral identity, and development of posterior structures. Genes Dev 2001; 15 : 226–40. 54. Kimmel CB, Warga RM, Schilling TF. Origin and organisation of the zebrafish fate map. Development 1990, 108 : 581–94. 55. Woo K, Fraser SC. Order and coherence in the fate map of the zebrafish nervous system. Development 1995; 121 : 2595–609. |