| |
| Med Sci (Paris). 2002 February; 18(2): 217–225. Published online 2002 February 15. doi: 10.1051/medsci/2002182217.Apports de la microscopie réalisée in situ sur animal vivant dans l’étude du cancer Anne-Claire Lavigne, Virginie Carrière, François Amalric, Jean-Philippe Girard, and Christine M’Rini* Laboratoire de Biologie Vasculaire, IPBS/Cnrs, 205, route de Narbonne, 31077 Toulouse, France |
Ces 20 dernières années, l’explosion de nombreuses techniques de biologie cellulaire et moléculaire a fourni une pléthore de nouvelles pistes dans la compréhension de la physiologie et de la physiopathologie humaine et animale. Cependant, il est aussi progressivement apparu évident que la «boîte de culture» ne pouvait pas prendre pleinement la mesure de ce qui se passe à l’échelle d’un corps humain ou animal dans toute la complexité d’un fonctionnement intégré dans des boucles régulatrices et de contrôle. De ce fait, et depuis peu, les techniques expérimentales réalisées sur animal vivant et intact reprennent toute leur justification dans une recherche sophistiquée. La microscopie réalisée in vivo, ou microscopie intravitale, est l’une de ces techniques. A ce jour, très peu de laboratoires dans le monde la développent et pourtant, en visualisant des phénomènes in situ directement chez l’animal vivant, elle est une étape ultime dans le transfert des connaissances acquises lors d’études fondamentales vers l’application à la médecine humaine [1]. Appliquée au cancer, elle est utilisée essentiellement pour l’étude de la vascularisation intratumorale. Cependant, des tentatives récentes et isolées laissent présager qu’elle devrait avoir un intérêt majeur dans l’étude des mouvements des cellules immunitaires au cours du développement d’une tumeur cancéreuse ainsi que dans celui du recrutement des métastases par les vaisseaux des tissus secondairement envahis. |
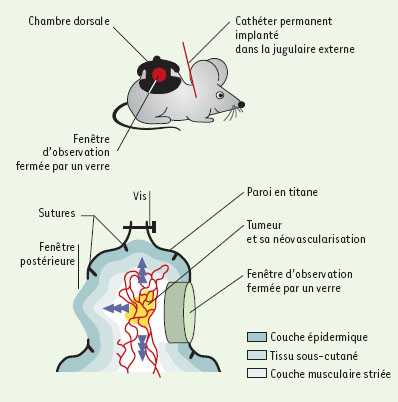
La technique de microscopie intravitale appliquée à l’étude de la pathologie cancéreuse La technique de microscopie intravitale consiste à observer puis enregistrer, par l’intermédiaire d’un microscope adapté, des phénomènes fluorescents, cinétiques dans l’espace et le temps, apparaissant à l’échelle d’un tissu ou d’un organe chez un animal intact, éveillé ou endormi. La souris est l’animal le plus étudié actuellement mais, selon la problématique scientifique, rat, lapin ou hamster peuvent aussi être utilisés. Les sites d’implantation de la tumeur Cette technique implique en premier lieu la préparation de l’animal et l’exposition ou dénudation des organes ou tissus à observer. C’est dans cette étape préparatoire, qui doit éviter de nuire à la survie de l’animal ou de modifier le fonctionnement physiologique de l’organe observé, que réside la difficulté majeure de cette technique. Appliquée à l’étude de la pathologie cancéreuse, cette étape est simplifiée car la tumeur étudiée est implantée par l’expérimentateur dans un lieu choisi pour être accessible à l’observation par microscopie intravitale. La tumeur est inoculée sous forme de suspension de cellules tumorales ou de tumeur déjà organisée. Plusieurs sites d’implantation sont envisageables. La tumeur peut être implantée dans un tissu qui sera ultérieurement extériorisé par microchirurgie (inoculation sous-cutanée, dans le muscle crémaster ou dans le foie) ou dans des cavités naturelles (comme la chambre antérieure de l’œil ou la cornée). Elle peut être amenée à se développer dans des chambres transparentes greffées à l’animal (comme les chambres de métal et de verre implantées sur le dos de l’animal ou les fenêtres pratiquées dans la boîte crânienne, les basjoues ou les oreilles des rongeurs) [ 2]. Différents critères de sélection orientent le choix de l’expérimentateur vers l’un ou de l’autre de ces sites d’implantation : (1) la possibilité de faire des observations répétées pendant plusieurs jours voire plusieurs semaines ; (2) l’absence d’interférence du procédé d’implantation sur la tumeur (tel qu’un processus inflammatoire pouvant suivre le positionnement d’une chambre de métal et de verre) ; (3) la rapidité avec laquelle se développent la tumeur et la vascularisation intratumorale ; (4) le type de réponse immunitaire habituellement développé au site d’implantation ; et (5) la volonté d’implanter la tumeur dans son site naturel. Les chambres de métal et de verre La procédure d’implantation la plus utilisée est celle qui se fait dans les chambres de métal et de verre, et particulièrement celles positionnées autour du pli de peau dorsale de la souris [ 3– 7]. Pour mettre en place une telle chambre, la souris est anesthésiée puis suspendue à une potence par la peau du dos qui, sous le poids de l’animal, forme un pli cutané d’environ 2 cm de hauteur. L’éxérèse d’un disque de peau est réalisée dans le pan antérieur du pli, mettant ainsi en évidence la face interne du pan postérieur. La chambre de métal et de verre est alors positionnée de part et d’autre du pli dorsal de façon à ce que l’ouverture cutanée pratiquée soit placée en face des fenêtres antérieure et postérieure de la chambre ( Figure 1). La fenêtre antérieure de la chambre sous laquelle apparaît la face interne du pan cutané postérieur est refermée par un verre fin. La fenêtre postérieure qui est en contact avec la face externe du pan cutané postérieur n’est pas refermée permettant ainsi le développement tridimensionnel de la tumeur. Au cours de la même séance, et afin que l’administration de molécules ou de cellules fluorescentes soit possible de façon répétée lors des séances de microscopie intravitale, un cathéter permanent est implanté à l’animal dans la jugulaire externe. Deux à trois à jours après le positionnement de la chambre de métal et de verre, et en l’absence de réaction inflammatoire patente, les cellules tumorales ou les morceaux de tumeur sont respectivement injectées ou implantés sous le verre de la fenêtre antérieure. Les tumeurs utilisées le plus souvent sont des tumeurs humaines (par exemple mélanome, adénocarcinome colique humain, rhabdomyosarcome, cancer de la prostate, cancer du sein ou gliome malin) implantées dans des souris immunitairement déficientes. Cependant, des tumeurs murines implantées chez des souris syngéniques sont de plus en plus fréquemment utilisées (comme la lignée B16 de mélanome murin implantée chez la souris C57/Bl6 ou les lignées d’adénocarcinome mammaire murin [TS/A ou HCa-1], etc.). 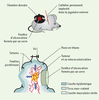 | Figure 1. Chambre dorsale de métal et de verre. C’est dans une chambre transparente de métal et de verre greffée chirurgicalement sur le dos de l’animal qu’est le plus souvent implantée la suspension de cellules tumorales ou la tumeur déjà organisée destinée à être étudiée par microscopie intravitale. Cette chambre est constituée de deux parois de titane, symétriques, centrées chacune par une fenêtre se faisant vis-à-vis. Un pli est formé par l’étirement de la peau du dos de la souris. Un des deux pans de ce pli est enlevé chirurgicalement sur une surface correspondant à la taille des fenêtres de la chambre. Les deux parois de la chambre sont alors positionnées et fixées de part et d’autre du pli cutané. A travers une des deux fenêtres de la chambre apparaît la face souscutanée interne du pan postérieur du pli cutané. C’est dans cette fenêtre dite d’observation que sont déposées les cellules tumorales avant qu’elle soit refermée par un verre. Un cathéter jugulaire permanent est implanté à la souris afin de pouvoir injecter les produits fluorescents nécessaires à l’étude par microscopie intravitale. |
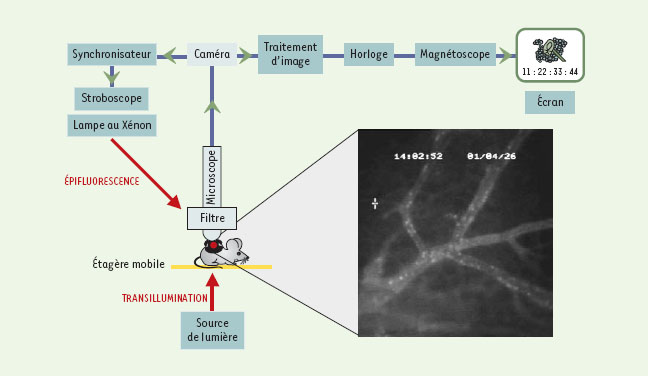
L’étude par microscopie intravitale de la tumeur se développant dans la chambre est ainsi rendue possible de façon répétée (pendant environ 1 mois avec les chambres dorsales) et atraumatique pour l’animal. Lors de l’examen par microscopie, l’animal est soit endormi, soit simplement immobilisé dans un tube avant d’être placé sous les objectifs du microscope (Figure 2). 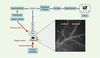 | Figure 2.Plate-forme de microscopie intravitale. La souris porteuse de la chambre dorsale dans laquelle se développe la masse tumorale est immobilisée dans un tube de plexiglas. La chambre est positionnée dans une fente de la paroi du tube, ce qui la place à l’extérieur de celui-ci. La fenêtre d’observation est placée sous les objectifs du microscope à fluorescence qui est relié à une caméra de haute sensibilité. Un magnétoscope enregistre les événements fluorescents visibles par ailleurs, en direct, sur un écran de télévision (schéma adapté de [ 45]). |
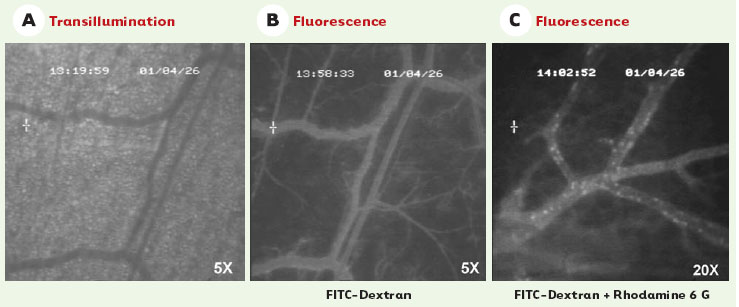
La technique de microscopie intravitale proprement-dite Appliquée à la pathologie cancéreuse, cette technique est surtout utilisée pour l’étude du développement de la microcirculation intratumorale et des phénomènes qui se déroulent en son sein, comme l’adhérence de cellules sur la paroi vasculaire. Pour être visible à travers le microscope, les phénomènes étudiés sont rendus fluorescents. Divers types de marqueurs fluorescents sont utilisés selon le phénomène étudié. Pour visualiser la microcirculation intratumorale (son développement mais aussi ses propriétés hémodynamiques), des marqueurs plasmatiques, comme le dextran marqué à la fluorescéine (FITC-dextran), sont utilisés. Des vaisseaux de très petit calibre (moins de 5 micromètres de diamètre) qui ne sont pas visibles par transillumination sous le microscope (Figure 3A) bénéficient ainsi de l’utilisation de la fluorescence (Figure 3B). Le poids moléculaire des marqueurs est choisi précisément pour ne pas diffuser à l’extérieur du vaisseau. 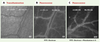 | Figure 3. Images obtenues par microscopie intravitale. A. Microcirculation visualisée par transillumination. B. Microcirculation après injection d’un marqueur fluorescent plasmatique, le dextran marqué à la fluorescéine. La comparaison entre A et B illustre l’avantage de l’utilisation de marqueurs fluorescents qui dessinent et rendent visibles des vaisseaux qui sont imperceptibles lorsqu’ils sont étudiés par simple transillumination. C. L’injection d’un marqueur nucléaire fluorescent, comme la rhodamine 6G, permet de visualiser sous le microscope les cellules sanguines nucléées circulantes et de suivre leur passage et leur comportement dans le vaisseau. |
Pour pouvoir étudier leur comportement dans la microcirculation intratumorale, les cellules sanguines sont rendues fluorescentes soit in vivo soit ex vivo avant d’être réinjectées à l’animal. La fluorescence in vivo est obtenue par l’injection de marqueurs fluorescents membranaires ou nucléaires (tels que la rhodamine–6G) (Figure 3C) dans la circulation générale de la souris. Des cellules naturellement fluorescentes issues d’animaux exprimant des protéines fluorescentes comme la GFP (green fluorescent protein) dans un type cellulaire défini [8] ou des cellules transfectées ex vivo par l’ADN codant pour ces protéines fluorescentes peuvent aussi être injectées à l’animal, et leur comportement étudié dans la microcirculation d’intérêt. Les cellules tumorales peuvent aussi être rendues fluorescentes. La microscopie intravitale permet alors de suivre le développement en volume de la tumeur ou permet d’étudier la transmigration de métastases à travers les vaisseaux d’un tissu pouvant être le siège d’une localisation tumorale secondaire [9]. Les marqueurs nucléaires comme l’acridine orange sont très agressifs pour les cellules tumorales et les tuent très rapidement. Les expérimentateurs préfèrent donc utiliser de la calcéine AM ou des billes fluorescentes de très petit diamètre qui ne provoquent pas de lésions membranaires. Dans le cas où les cellules tumorales sont fluorescentes, le contraste avec les vaisseaux intratumoraux, apparaissant en sombre, suffit à visualiser le lit vasculaire intratumoral. Une fois la souris installée sous le microscope, le marquage réalisé et l’émission fluorescente des marqueurs provoquée par l’action d’une lampe au xénon ou à mercure, les phénomènes sont filmés par une caméra fonctionnant à très bas niveau de lumière et enregistrés sur cassettes vidéo (Figures 2 et 3). L’enregistrement sur cassettes permet la mise en mémoire de l’expérience et l’analyse a posteriori d’un certain nombre de paramètres qui seront détaillés dans les chapitres suivants. En pratique, c’est surtout à l’étude de la microcirculation intratumorale elle-même et des phénomènes qui s’y déroulent (comme l’adhérence de cellules sur la paroi vasculaire) que la microscopie intravitale est utile (Figure 4).
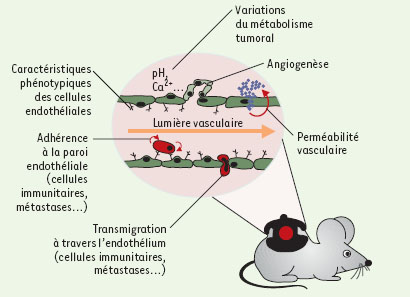
 | Figure 4. Schéma récapitulatif des phénomènes pouvant être étudiés par microscopie intravitale dans le cancer. |
|
Étude de l’angiogenèse et de la microcirculation intratumorale La vascularisation intratumorale est, depuis une dizaine d’année, un des grands thèmes de la recherche dans le domaine de la santé, parce qu’elle est essentielle au développement des tumeurs cancéreuses et, par voie de conséquence, une cible thérapeutique de choix. L’étude de la cinétique de son développement est l’un des deux grands champs d’application de la technique de microscopie intravitale. Les paramètres étudiés par microscopie intravitale Parallèlement à l’analyse macroscopique du volume tumoral (calculé selon l’équation : T = 2/3 x A x H, où A est la surface de la tumeur et H l’épaisseur de la tumeur), trois types de paramètres, hémodynamiques, morphologiques et fonctionnels sont extraits de l’étude de la microcirculation intratumorale par microscopie intravitale. La mise au point de ces paramètres a été faite essentiellement par les équipes de R. Jain aux États-Unis et de M. Menger en Allemagne. Les paramètres hémodynamiques sont le débit sanguin et les forces de cisaillement. Les paramètres morphologiques sont la longueur vasculaire, la surface vasculaire totale, le nombre de vaisseaux et l’extrapolation du développement en trois dimensions du réseau vasculaire. Les paramètres fonctionnels sont la densité vasculaire totale qui est la somme de toutes les longueurs vascu-laires ramenée à la surface de la tumeur vascularisée, la densité fonctionnelle vasculaire totale qui est la densité des vaisseaux perfusés et l’index de perfusion qui est le rapport de la densité fonctionnelle vasculaire totale et de la densité vasculaire totale. Cet index de perfusion témoigne de l’efficacité de l’angiogenèse. La perméabilité vasculaire est aussi au nombre des paramètres fonctionnels étudiés par microscopie intravita-le. Elle est calculée selon la formule suivante : P = (1-Ht)(V/S) (1/[Io – Ib]x[dI/dt] + 1/K) où Ht est l’héma-tocrite moyen dans les vaisseaux tumoraux (19 % en moyenne chez la souris), I est l’intensité moyenne de fluorescence calculée par traitement logiciel des niveaux de gris de l’image totale, Ib et Io, les intensités moyennes de fluorescence de l’image totale respectivement, avant et dans les premiers instants après l’injection de la substance fluorescente dont on teste la perméabilité, K la clairance plasmatique (9,1 x 10 3 s), S la surface totale vasculaire et V le volume vasculaire total [ 10]. Les observations faites par microscopie intravitale L’étude par microscopie intravitale a permis d’établir que la microcirculation intratumorale ne présente pas les mêmes caractéristiques selon le type tumoral et le tissu dans lequel s’implante la tumeur [ 11, 12]. Cependant, un certain nombre d’observations sont communes. Ainsi, la microscopie intravitale montre que les premières étapes de développement de la vascularisation des tumeurs sont caractéristiques d’un phénomène d’angiogenèse. Des dilatations et élongations tortueuses des vaisseaux de l’hôte [ 13] sont tout d’abord observées, suivies de l’interconnexion des vaisseaux entre eux et de l’apparition d’un réseau vasculaire complexe. Autour des vaisseaux se disséminent de petites hémorragies. La tumeur se met à grossir dès que la vascularisation de la masse tumorale dans son ensemble est accomplie. La circulation intratumorale continue à se transformer, devenant de plus en plus anarchique. Les vaisseaux alternent des zones de rétrécissement et des zones de dilatation mais leur diamètre reste en moyenne globalement plus large que celui des vaisseaux du tissu sain environnant [ 14]. Des lacunes et des vaisseaux sinusoïdes peuvent être trouvés au sein du réseau vasculaire intratumoral. Il y a une perte de la hiérarchie vasculaire et il n’est plus possible de différencier artériole, veinule et capillaire. Au fur et à mesure du développement de la tumeur, certaines zones deviennent totalement avasculaires [ 15]. La densité vasculaire et la surface vasculaire sont très élevées dans la périphérie mais diminuent au centre de la tumeur [ 16]. Le débit de perfusion des vaisseaux intratumoraux est hétérogène, un certain nombre de nouveaux vaisseaux ne sont pas perfusés, d’autres le sont de manière intermittente [ 17]. L’index de perfusion, qui est supérieur à 95 % dans un tissu normal, chute dans les tissus tumoraux. Il devient inférieur à 40 % dans le gliome implanté dans la boîte crânienne [ 13]. Une des autres caractéristiques de la circulation intratumorale est la grande perméabilité de la barrière endothéliale. Cette perméabilité dépend du micro-environnement et du type tumoral [ 18, 19] et est variable dans le temps [ 20]. Elle est augmentée pour des molécules comprises entre 25 000 et 160 000 kDa ou de 100 à 600 nm de diamètre [ 10, 21]. Les parois d’un même vaisseau se faisant face n’ont pas toujours la même perméabilité. Le traitement, par logiciel informatique adapté, des images enregistrées par microscopie intravitale permet une extrapolation en trois dimensions (fractal dimensions en anglais) du dessin fait par le réseau vasculaire dans le centre et en périphérie tumorale. Cette extrapolation, ajoutée aux études sur la perméabilité endothéliale et le débit de perfusion des vaisseaux intratumoraux, a conduit à élaborer des hypothèses sur les propriétés hémodynamiques de la circulation intratumorale et ses conséquences sur les apports énergétique et nutritionnel au niveau de la tumeur ou le transport de drogues antitumorales [22]. Ainsi, il semble que les zones de dilatation repérées dans certains tronçons vasculaires apparaissent pour compenser la diminution de perfusion qui s’aggrave au cours du développement dans le centre de la tumeur [12]. D’autres mécanismes de compensation, comme l’augmentation de la vélocité cellulaire et celle du débit de perfusion des vaisseaux restant perfusés, sont aussi envisagés [23]. Il y aurait aussi un lien réciproque entre la perfusion des vaisseaux et la pression interstitielle qui règne dans la masse tumorale et dont on sait qu’elle est plus forte au centre qu’en périphérie de la tumeur. Il a été montré qu’au centre de la tumeur, l’augmentation du débit et de la pression de perfusion intravasculaire engendre une augmentation de la pression interstitielle qui, en retour, détourne le sang vers la périphérie tumorale [24]. L’étude mathématique du développement en trois dimensions du réseau vasculaire intratumoral a aboutit à l’hypothèse que le réseau vasculaire se dessine principalement au hasard, sous l’effet de forces agissant sur le mode « percolateur » (les nouveaux vaisseaux se créant dans des zones de tissus offrant une moins grande résistance), et non uniquement en fonction de gradients de substances angiogéniques. La modélisation mathématique d’un tel réseau confirme que le mode de développement « percolateur » est à l’origine de l’anarchie spatiale du réseau et, par voie de conséquence, à l’origine de l’hétérogénéité du débit sanguin dans la tumeur [25]. |
Étude des phénomènes cellulaires d’adhérence dans les vaisseaux intratumoraux L’étude de l’adhérence des cellules sanguines sur la paroi vasculaire est l’autre grand champ d’application de la microscopie intravitale. Une des toutes premières réactions de défense de l’organisme, lorsqu’il est agressé, consiste à recruter des cellules immunitaires compétentes sur le site de l’agression. C’est essentiellement par voie sanguine que ces cellules compétentes sont recrutées. Cette étape, qu’explore en direct et in situ la microscopie intravitale, est donc un prérequis à toute réaction inflammatoire et/ou immunitaire. De façon générale, ce recrutement se fait selon une cascade d’événements qui débute par la brève interaction ou accrochage des cellules sur la paroi endothéliale suivie de leur roulement le long de celle-ci. Une fraction de ces cellules cesse de rouler à la suite de l’activation de certaines de leurs molécules d’adhérence et adhère fermement à la paroi. L’adhérence ferme est définie par un arrêt supérieur à 30 secondes. Elle est généralement suivie de la diapédèse des cellules dans le tissu extravasculaire (pour revues, voir [26–28]). C’est l’équipe de U. von Andrian aux États-Unis qui a le mieux contribué ces dernières années à élaborer des paramètres fiables de ces phénomènes d’adhérence lorsqu’ils sont étudiés par microscopie intravitale [29–32]. Les paramètres étudiés par microscopie intravitale Ces paramètres sont essentiellement la fraction de roulement qui est le pourcentage de cellules ayant roulé à la surface de l’endothélium d’un vaisseau donné dans un temps donné, rapporté au nombre total de cellules qui sont passées dans ce vaisseau pendant le même temps, et la fraction d’accrochage qui est le pourcentage de cellules qui roulaient et qui se sont accrochées fermement plus de 30 secondes dans un vaisseau donné [ 32]. Les observations faites par microscopie intravitale Le comportement des cellules immunitaires dans les vaisseaux intratumoraux reste mal connu. Il a été montré qu’il y a globalement moins d’interaction des cellules sanguines avec la paroi endothéliale que dans les vaisseaux à distance de la tumeur [ 33– 35] alors que les études immunohistologiques montrent que l’endothélium intratumoral exprime certains récepteurs des molécules d’adhérence des cellules sanguines. Dans certains modèles, l’adhérence est diminuée de plus de la moitié [ 36]. Il a aussi été montré que les phénomènes d’adhérence sont encore plus diminués dans les vaisseaux des zones de nécrose tumorale [ 15]. De nombreuses questions restent donc posées qui pourraient bénéficier de la microscopie intravitale. Elles sont centrées essentiellement autour de l’identification des vaisseaux qui sont le siège de phénomènes d’adhérence (intra- ou extratumoraux, angiogéniques ou non, perfusés ou non), des cellules sanguines qui adhérent dans ces vaisseaux et des molécules d’adhérence qui sont effectivement exprimées et actives dans la lumière de ces vaisseaux. La microscopie intravitale, en répondant à ces questions, pourrait indiquer quelles cellules immunitaires sont recrutées dans les tumeurs, par quels vaisseaux et par quels mécanismes les tumeurs minimisent ce recrutement. Elle favoriserait ainsi la réflexion nécessaire à l’amélioration des protocoles anticancéreux, dits immunothérapeutiques, qui utilisent des cellules immunitaires (lymphocytes activés, macrophages, etc.) comme agent thérapeutique. |
L’étude de l’adhérence des métastases dans les vaisseaux des tissus secondairement envahis Un autre champ d’application de la technique de microscopie intravitale dans la pathologie tumorale dérive de celui décrit précédemment. Il a été plus particulièrement étudié par l’équipe de A. Groom au Canada. Il s’agit de l’étude de la dissémination sanguine des métastases cancéreuses. La microscopie intravitale est capable de visualiser in situ l’étape d’adhérence des cellules métastatiques sur l’endothélium des vaisseaux de tissus qui sont le siège de localisation tumorale secondaire tel que le cerveau, le foie, etc. [37]. La microscopie intravitale a montré que l’arrêt des métastases circulantes, dans les vaisseaux de tissus secondaires, n’obéit pas au paradigme habituel de l’adhérence des neutrophiles, monocytes et lymphocytes sanguins à l’endothélium vasculaire (accrochage, roulement, activation et arrêt ferme). La taille des cellules tumorales étant beaucoup plus importante que celle des cellules sanguines, les métastases sont arrêtées tout d’abord sous l’effet de la contrainte de taille dans les plus petits vaisseaux dont elles bloquent le flux sanguin. Il s’agit des capillaires, des artérioles ou les sinusoïdes hépatiques selon la localisation. Dans ce cas précis, les cellules ne roulent pas à la surface vasculaire avant de s’arrêter. Sous l’effet de la poussée sanguine, elles se déforment [38]. Elles peuvent même éclater en plusieurs fragments de moins de 5 µm de diamètre, chacun possédant une membrane cellulaire entourant du cytoplasme. Plusieurs heures après, les cellules s’allongent un peu plus à la surface vasculaire, émettent des prolongements et débutent leur transmigration à travers la paroi endothéliale. Cette transmigration ne paraît pas endommager la paroi endothéliale. Ce n’est qu’une fois dans le tissu, et non dans le sang comme il avait été supposé, que les cellules tumorales prolifèrent. Cependant, si les cellules tumorales survivent dans la circulation, et transmigrent facilement, très peu donnent des métastases cliniques pathogènes, démontrant que l’habileté des cellules tumorales à former des tumeurs secondaires n’est pas sous la dépendance unique de leur capacité de transmigrer. Une fois dans le tissu, les cellules tumorales migrent préférentiellement autour des artérioles tissulaires [39] et dans des zones particulières selon l’organe envahi. Les mécanismes moléculaires tissulaires et/ou génétiques tumoraux qui règlent la mort, la conservation en un état quiescent ou la prolifération des cellules tumorales ayant transmigré restent entièrement à élucider. La microscopie intravitale pourrait être ici d’une aide certaine. La microscopie intravitale peut aussi visualiser le détachement des cellules tumorales de la masse tumorale et leur passage dans la circulation sanguine. Cette transmigration rétrograde se fait en trois étapes : (1) sécrétion de protéases permettant le détachement de la membrane basale et du stroma ; (2) transport des cellules métastatiques vers les vaisseaux ; (3) transmigration rétrograde dans la circulation des vaisseaux sanguins ou lymphatiques. La visualisation de cette transmigration rétrograde, qui est bien sûr très lente, a été possible dans un travail unique et fascinant réalisé grâce à un microscope multiphotonique à utilisation intravitale [40]. |
Ces 10 dernières années, la technique de microscopie intravitale a complété de façon bénéfique les observations faites par étude histo-pathologique (immunohistochimie, hybridation in situ, etc.) des tumeurs cancéreuses. L’avantage majeur de cette technique par rapport à ces examens classiques est d’ajouter à l’analyse morphologique des tumeurs, des notions de fonctionnalité et de cinétique de développement. Elle n’est cependant pas sans limite. Sa limite principale, lorsqu’elle utilise un simple microscope à fluorescence, est la profondeur du tissu exploré (moins de 40 µm). L’utilisation de microscopes confocaux ou multiphotoniques a sensiblement amélioré ce défaut (400 µm de profondeur sont potentiellement visualisables par de tels appareils) [41]. Ces appareils ont aussi l’avantage de diminuer la toxicité tissulaire et l’affadissement de l’émission fluorescente. L’avenir est donc à l’avènement d’une seconde génération de microscopes utilisables in vivo qui combineront résolution spatiale, temporelle et intracellulaire, à la possibilité d’observer des organes ou des tumeurs dans toute leur profondeur [42–44]. De ces développements technologiques, il est raisonnable de penser que de nouveaux champs d’application s’ouvriront à la microscopie intravitale. Parmi eux, l’étude de la cinétique intratumorale de molécules thérapeutiques (Figure 4). Réalisée in vivo chez l’animal, la microscopie intravitale est une des étapes ultimes dans le transfert des connaissances acquises lors d’études fondamentales vers l’application à la médecine humaine. Les observations qu’elle a permis ou permettra d’acquérir sur les vaisseaux intratumoraux, les mouvements des cellules impliquées dans la défense immunitaire de l’organisme contre la tumeur cancéreuse ou la cinétique de molécules thérapeutiques dans le tissu tumoral font espérer qu’elle sera d’un apport non négligeable en thérapie anticancéreuse traditionnelle ou en voie de développement comme la thérapie antivasculaire ou l’immunothérapie cellulaire anticancéreuse utilisant des cellules dendritiques ou lymphocytaires. |
Une plate-forme de microscopie intravitale (Dr Christine M’Rini, mrini@ipbs.fr) est en fonctionnement depuis mai 2001 à l’IPBS/Cnrs, 205, route de Narbonne, 31077 Toulouse. Les auteurs remercient la Région Midi-Pyrénées, l’Association Contre le Cancer, la Ligue contre le Cancer et le Ministère de la Recherche (Programme national Génopole-exploration fonctionnelle) pour leur soutien à l’implantation de cette plateforme avec laquelle ont été obtenues les images présentées dans cet article. Les auteurs remercient aussi Françoise Viala de son aide pour l’iconographie de ce document. |
1. Menger MD, Lehr HA. Scope and perspectives of intravital microscopybridge over from in vitro to in vivo. Immunol Today 1993; 14 : 519–22. 2. Jain RK, Schlenger K, Hockel M, Yuan F. Quantitative angiogenesis assays : progress and problems. Nat Med 1997; 3 : 1203–8. 3. Sandison JC. A new method for the microscopic study of living tissues by the introduction of a transparent chamber in the rabbit’s ear. Anat Rec 1924; 28 : 281–7. 4. Algire GH. An adaptation of the transparent chamber technique to the mouse. J Natl Cancer Inst 1942; 4 : 1–11. 5. Ide AG, Baker NH, Warren SL. Vascularization of the Brown-Pearce rabbit epithelioma transplant as seen in the transparent ear chamber. Am J Roentgenol 1939; 42 : 891–9. 6. Intaglietta M, Zweifach BW. Microcirculatory basis of fluid exchange. Adv Biol Med Phys 1974; 15 : 111–59. 7. Endrich B, Asaishi K, Goetz A, Messmer K. Technical report. A new chamber technique for microvascular studies in unanesthetized hamsters. Res Exp Med 1980; 177 : 125–34. 8. Manjunath N, Shankar P, Stockton B, Dubey PD, Lieberman J, von Andrian UH. A transgenic mouse model to analyze CD8(+) effector T cell differentiation in vivo. Proc Natl Acad Sci USA 1999; 96 : 13932–7. 9. Borgstrom P, Hillan KJ, Sriramarao P, Ferrara N. Complete inhibition of angiogenesis and growth of microtumors by anti-vascular endothelial growth factor neutralizing antibody : novel concepts of angiostatic therapy from intravital videomicroscopy. Cancer Res 1996; 56 : 4032–9. 10. Yuan F, Leunig M, Huang SK, Berk DA, Papahadjopoulos D, Jain RK. Microvascular permeability and interstitial penetration of sterically stabilized (stealth) liposomes in a human tumor xenograft. Cancer Res 1994; 54 : 3352–6. 11. Fukumura D, Yuan F, Monsky WL, Chen Y, Jain RK. Effect of host microenvironment on the microcirculation of human colon adenocarcinoma. Am J Pathol 1997; 151 : 679–88. 12. Vajkoczy P, Ullrich A, Menger MD. Intravital fluorescence videomicroscopy to study tumor angiogenesis and microcirculation. Neoplasia 2000; 2 : 53–61. 13. Vajkoczy P, Schilling L, Ullrich A, Schmiedek P, Menger MD. Characterization of angiogenesis and microcirculation of high-grade glioma: an intravital multifluorescence microscopic approach in the athymic nude mouse. J Cereb Blood Flow Metab 1998; 18 : 510–20. 14. Schmidt J, Ryschich E, Daniel V, et al. Vascular structure and microcirculation of experimental pancreatic carcinoma in rats. Eur J Surg 2000; 166 : 328–35. 15. Endrich B, Hammersen F, Gotz A, Messmer K. Microcirculatory blood flow, capillary morphology and local oxygen pressure of the hamster amelanotic melanoma A-Mel-3. J Natl Cancer Inst 1982; 68 : 475–85. 16. Vajkoczy P, Menger MD, Goldbrunner R, et al. Targeting angiogenesis inhibits tumor infiltration and expression of the pro-invasive protein SPARC. Int J Cancer 2000; 87 : 261–8. 17. Debbage PL, Griebel J, Ried M, Gneiting T, DeVries A, Hutzler P. Lectin intravital perfusion studies in tumorbearing mice : micrometerresolution, wide-area mapping of microvascular labeling, distinguishing efficiently and inefficiently perfused microregions in the tumor. J Histochem Cytochem 1998; 46 : 627–39. 18. Yuan F, Salehi HA, Boucher Y, Vasthare US, Tuma RF, Jain RK. Vascular permeability and microcirculation of gliomas and mammary carcinomas transplanted in rat and mouse cranial windows. Cancer Res 1994; 54 : 4564–8. 19. Hobbs SK, Monsky WL, Yuan F, et al. Regulation of transport pathways in tumor vessels : role of tumor type and microenvironment. Proc Natl Acad Sci USA 1998; 95 : 4607–12. 20. Monsky WL, Fukumura D, Gohongi T, et al. Augmentation of transvascular tranport of macromolecules and nanoparticles in tumors using vascular endothelial growth factor. Cancer Res 1999; 59 : 4129–35. 21. Yuan Y, Mier RA, Chilian WM, Zawieja DC, Granger HJ. Interaction of neutrophils and endothelium in isolated coronary venules and arterioles. Am J Physiol 1995; 268 : H490–8. 22. Baish JW, Gazit Y, Berk DA, Nozue M, Baxter LT, Jain RK. Role of tumor vasculature architecture in nutrient and drug delivery : an invasion percolation-based network model. Microvasc Res 1996; 51 : 327–46. 23. Vajkoczy P, Goldbrunner R, Farhadi M, et al. Inhibition of tumor growth, angiogenesis, and microcirculation by the novel FlK-1 inhibitor SU5416 as assessed by intravital multi-fluorescence videomicroscopy. Neoplasia 1999; 1 : 31–41. 24. Baish JW, Netti PA, Jain RK. Transmural coupling of fluid flow in microcirculatory network and interstitium in tumors. Microvasc Res 1997; 53 : 128–41. 25. Baish JW, Jain RK. Fractals and cancer. Cancer Res 2000; 60 : 3683–8. 26. Butcher EC. Leukocyteendothelial cell recognition: three (or more) steps to specificity and diversity. Cell 1991; 67 : 1033–6. 27. Springer TA. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell 1994; 76 : 301–14. 28. Butcher EC, Picker LJ. Lymphocyte homing and homeostasis. Science 1996; 272 : 60–6. 29. von Andrian UH, Hasslen SR, Nelson RD, Erlandsen SL, Butcher EC. A central role for microvillous receptor presentation in leukocyte adhesion under flow. Cell 1995; 82 : 989–99. 30. von Andrian UH. Intravital microscopy of the peripheral lymph node microcirculation in mice. Microcirculation 1996; 3 : 287–300. 31. Diacovo TG, Puri KD, Warnock RA, Springer TA, von Andrian UH. Plateletmediated lymphocyte delivery to high endothelial venules. Science 1996; 273 : 252–5. 32. von Andrian UH, M’Rini C. In situ analysis of lymphocyte migration to lymph nodes. Cell Adhes Commun 1998; 6 : 85–96. 33. Fukumura D, Salehi HA, Witwer B, Tuma RF, Melder RJ, Jain RK. Tumor necrosis factor alphainduced leukocyte adhesion in normal and tumor vessels: effect of tumor type, transplantation site and host strain. Cancer Res 1995; 55 : 4824–9. 34. Jain RK, Koenig A, Dellian M, Fukumura D, Munn LL, Melder RJ. Leukocyte-endothelial adhesion and angiogenesis in tumors. Cancer Metastasis Rev 1996; 15 : 195–204. 35. Suzuki T, Yanagi K, Ookawa K, Hatakeyama K, Ohshima N. Flow visualization of microcirculation in solid tumor tissues: intravital microscopic observation of blood circulation by use of a confocal laser scanning microscope. Front Med Biol Eng 1996; 7 : 253–63. 36. Dellian M, Abels C, Kuhnle GE, Goetz AE. Effects of photodynamic therapy on leucocyte-endothelium interaction: differences between normal and tumour tissue. Br J Cancer 1995; 72 : 1125–30. 37. Funakoshi N, Onizuka M, Yanagi K, et al. A new model of lung metastasis for intravital studies. Microvasc Res 2000; 59 : 361–7. 38. Chambers AF, MacDonald IC, Schmidt EE, et al. Steps in tumor metastasis: new concepts from intravital videomicroscopy. Cancer Metastasis Rev 1995; 14 : 279–301. 39. Chambers AF, Naumov GN, Varghese HJ, Nadkarni KV, MacDonald IC, Groom AC. Critical steps in hematogenous metastasis : an overview. Surg Oncol Clin North Am 2001; 10 : 243–55. 40. Farina KL, Wyckoff JB, Rivera J, et al. Cell motility of tumor cells visualized in living intact primary tumors using green fluorescent protein. Cancer Res 1998; 58 : 2528–32. 41. Jain RK. Understanding barriers to drug delivery: high resolution in vivo imaging is key. Clin Cancer Res 1999; 5 : 1605–6. 42. Weissleder R, Tung CH, Mahmood U, Bogdanov A Jr. In vivo imaging of tumors with protease-activated near-infrared fluorescent probes. Nat Biotechnol 1999; 17 : 375–8. 43. Fukumura D, Xavier R, Sugiura T, et al. Tumor induction of VEGF promoter activity in stromal cells. Cell 1998; 94 : 715–725. 44. Becker A, Hessenius C, Licha K, et al. Receptor-targeted optical imaging of tumors with near-infrared fluorescent ligands. Nat Biotechnol 2001;19 : 327–31. 45. M’Rini C, von Andrian UH. Le recrutement des lymphocytes dans les ganglions lymphatiques : apports de la microscopie réalisée in situ sur animal vivant. Hématologie 1998; 4 : 180–9. |