Les différences physiologiques de la pression sanguine et du transport du dioxygène entre les artères et les veines sont connues depuis très longtemps. Mais ce n’est qu’en 1998 que les déterminants moléculaires de cette différence artère-veine ont pu être enfin définis avec les remarquables résultats d’un groupe du California Institute of Technology (USA) qui montrait que, dès les stades précoces de la vasculogenèse, les veinules exprimaient spécifiquement le récepteur éphrine EphB4 (ephb4) tandis que son ligand transmembranaire éphrine B2 (efnb2) était uniquement porté par les artérioles [1]. Cette observation cruciale, qui est vraie quelle que soit la taille du vaisseau, n’était pas que descriptive mais également fonctionnelle puisqu’une mutation de l’éphrine B2 provoque l’arrêt de l’angiogenèse dans le sac vitellin tandis que l’invalidation du gène codant pour l’éphrine B2 induit d’importants défauts de développement de l’arbre vasculaire [1].
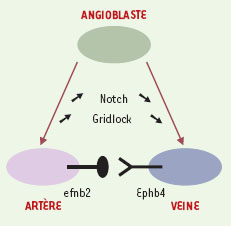
Mais comment, et à quel niveau du développement, la proportion correcte de veines et d’artères est-elle déterminée avec précision ? Les vaisseaux embryonnaires des vertébrés sont dérivés de précurseurs appelés angioblastes, localisés initialement à la périphérie de l’embryon au niveau du mésoderme latéral postérieur. Les angioblastes migrent ensuite vers l’axe longitudinal central de l’embryon pour former l’aorte primitive et les premières veines. Le modèle du poisson-zèbre est très utilisé pour l’étude du développement embryonnaire car les embryons sont transparents, ce qui permet une visualisation rapide des porteurs de défauts anatomiques. Dans le domaine de la vascularisation, cet organisme est d’autant plus intéressant qu’il peut survivre en l’absence de flux sanguin. Fin 1995, un mutant présentant une altération du système cardiovasculaire fut appelé Gridlock (Grl) car dépourvu de vaisseaux principaux [2]. Ce gène Grl code pour un facteur transcriptionnel à motif HLH (helix loop helix) connu chez la drosophile parce qu’il participe au destin des précurseurs neuronaux [3]. En mars 2000, le groupe de Mark Fishman (Harvard Medical School, USA) remarqua que l’expression du gène en question coïncidait avec les régions où les angioblastes étaient détectés, dans la région mésodermique puis dans l’aorte primitive, mais pas dans les veines [4]. Aujourd’hui, à l’aide d’une sonde injectée au stade embryonnaire (1->2 cellules) et couplée à un fluorochrome dont l’émission de lumière est spécifiquement activée par rayonnement laser, la même équipe peut affirmer que le devenir artériel ou veineux d’un vaisseau est prédéterminé dans le mésoderme latéral postérieur dès le stade angioblaste [5]. Une analyse par microangiographie montre que l’injection dans l’embryon d’oligonucléotides anti-sens de Grl provoque, de façon dépendante de la dose, la rupture des structures aortiques jusqu’à leur disparition complète aux doses les plus élevées, avec une augmentation concomitante du nombre de veines. Quant à la surexpression de Grl, elle entraîne une réduction de l’arbre veineux sans affecter le nombre des artères. Ces résultats indiquent que la protéine Grl est requise tout le long de l’arbre artériel, et que l’arbre veineux s’étend aux dépens de ce dernier. Les auteurs proposent donc que Grl soit un répresseur du devenir veineux, et soit nécessaire - mais non suffisant - à la formation des artères. Comme il a été montré que la protéine ephb4 est spécifique des veines, les auteurs indiquent en outre [5] que l’ajout progressif d’anti-sens de Grl s’accompagne d’une expression croissante de ephb4 et d’une répression concomitante du marqueur des artères efnb2. Ce résultat établit ainsi le rôle primordial joué par la protéine Grl dans le déterminisme artère versus veine. Mais quelle signalisation emprunte Grl ? La protéine Grl appartient à la famille des répresseurs transcriptionnels Hrt (hairy-related transcriptional repressor), activés en aval de la voie de signalisation des récepteurs Notch. Les auteurs montrent, toujours dans la même étude [5], que l’injection du domaine intracellulaire de Notch-1, capable de mimer l’activation des récepteurs Notch par leurs ligands, induit l’expression de Gridlock (Figure 1).
A l’inverse, des quantités croissantes de Su(H), gène suppresseur de Notch, réduisent les doses présentes de Grl et provoquent la disparition progressive des structures aortiques au profit des structures veineuses. Cette étude lève ainsi le voile sur le rôle prépondérant de la voie Notch-1 -> Gridlock dans le déterminisme artério-veineux. Il serait passionnant d’étudier à présent le rôle de ces deux protéines dans la reprogrammation cellulaire qui se produit, chez l’adulte, après le remplacement chirurgical d’une artère endommagée par la veine saphène.