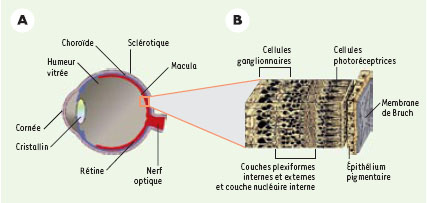
La perte des cellules de l’épithélium pigmentaire de la rétine ou de certaines de leurs fonctions semble jouer un rôle prépondérant dans la progression des diverses formes cliniques de la dégénérescence maculaire liée à l’âge qui sont associées soit à une néovascularisation choroïdienne envahissant la rétine (formes dites humides), soit à une atrophie de la choroïde et de la neurorétine (formes dites sèches). Cette observation a conduit à envisager comme approche thérapeutique le remplacement d’une partie des cellules de l’épithélium pigmentaire de la rétine. De fait, des translocations de neurorétine, d’une zone lésée vers une zone saine, possédant des cellules de l’épithélium pigmentaire de la rétine fonctionnelles, ont permis de bloquer la progression de la maladie chez certains patients, voire d’améliorer leur acuité visuelle, montrant que la neurorétine peut être préservée fonctionnellement si on remplace la monocouche de CEP avec laquelle elle est en contact [2].
Des transplantations de cellules de l’épithélium pigmentaire de rétine humaine fœtale ont déjà été réalisées chez l’homme [3] montrant la faisabilité de cette approche et l’absence d’effets secondaires majeurs. Toutefois, plusieurs contraintes importantes limitent le développement d’une telle approche : (1) les cellules fœtales ne peuvent pas être obtenues en grande quantité, la survenue de la sénescence limitant leur multiplication in vitro ; (2) la reproductibilité et la sécurité sanitaire de ces prélèvements sont difficiles à contrôler. L’utilisation de cellules de l’épithélium pigmentaire humaines immortalisées pourrait constituer une alternative thérapeutique intéressante. En effet, des lignées de cellules immortalisées présentent l’avantage de pouvoir être produites à grande échelle selon des procédures standardisées. C’est cette approche qui a été développée récemment dans le cadre d’une collaboration réunissant des équipes de l’Institut d’Ophtalmologie (University College de Londres, GB), de l’Université de Sheffield (GB) et de la société française Neurotech située à Évry (France) [4].
Deux lignées humaines de cellules de l’épithélium pigmentaire, dont l’absence de potentiel tumoral a été vérifiée chez la souris nude, ont été utilisées dans cette étude. Une de ces lignées est immortalisée de manière spontanée, et le gène T de SV40 a été introduit dans l’autre. Ces cellules ont conservé les propriétés de cellules de l’épithélium pigmentaire : expression de marqueurs cellulaires spécifiques et capacité de phagocytose des segments externes des cellules.
L’efficacité thérapeutique de ces lignées a été testée après leur greffe chez des rats provenant d’une souche particulière, le rat RCS : une mutation génétique prive les cellules de l’épithélium pigmentaire de ces animaux de leur capacité de phagocytose au niveau des segments externes [5]. Ce défaut se traduit par une perte progressive des cellules photoréceptrices (dès l’âge de 3 semaines et jusqu’à 5 mois) entraînant une perte de la vision. Des cellules de l’épithélium pigmentaire ont été injectées dans l’espace sous-rétinien de ces rats (Figure 1), au contact des cellules de l’épithélium pigmentaire de l’hôte, au moment où la dégénérescence des cellules photoréceptrices apparaît. Cinq mois plus tard, l’analyse histologique chez les animaux greffés avec des cellules humaines de l’épithélium pigmentaire, montre que les cellules photoréceptrices persistent autour du site d’injection, ce qui n’est pas le cas chez les animaux témoins. Sur le plan fonctionnel, les résultats sont tout à fait intéressants. En effet, un test de comportement visuel a montré que les animaux greffés répondaient sensiblement mieux que les animaux non injectés ou injectés avec du tampon physiologique seul. Dix semaines après la greffe, la réponse observée était similaire à celle de rats normaux, exempts de l’anomalie des rats RCS. L’analyse électrophysiologique au niveau de l’aire visuelle cérébrale (le colliculus supérieur), en réponse à un stimulus visuel, a également démontré une sauvegarde des fonctions visuelles autour du site d’injection. Ce travail a donc permis de montrer que la greffe de lignées humaines de cellules de l’épithélium pigmentaire permet d’atténuer sensiblement la perte de fonctions visuelles en protégeant les cellules photoréceptrices au niveau du site d’injection. Il faut noter que les cellules immortalisées marquées au BrdU (bromodésoxy-uridine) puis greffées, ont été mises en évidence par immunohistochimie chez l’animal 5 mois après la greffe. Les cellules greffées sont retrouvées intégrées dans la monocouche de cellules de l’épithélium pigmentaire de l’hôte, au niveau de la zone de sauvegarde de cellules photoréceptrices. En outre ces cellules greffées présentent une polarisation de la mélanine similaire à celle des cellules de l’épithélium pigmentaire de l’hôte, reflétant un degré de différenciation élevé.
Ces résultats ouvrent des perspectives tout à fait intéressantes car deslignées humaines immortalisées de cellules de l’épithélium pigmentaire pourraient être utilisées à des fins de thérapie de remplacement, dans le cas de la dégénérescence maculaire liée à l’âge, pour pallier l’absence de cellules de l’épithélium pigmentaire ou leur dysfonctionnement métabolique à la suite de l’exérèse de membrane vasculaire dans les formes humides. Elles pourraient aussi s’avérer utiles dans certaines formes de rétinites pigmentaires et dans l’amaurose congénitale de Leber où le défaut génétique est associé à un déficit fonctionnel des cellules de l’épithélium pigmentaire [6].