La mutation du gène hairless a été découverte chez la souris il y a 75 ans. L’insertion d’un rétrovirus endogène, responsable de cette mutation, a permis en 1994 le clonage de ce gène [1]. En 1998, son orthologue humain, situé en 8p21-22 entre D8S261 et D8S1771, a aussi été cloné et séquencé [2]. Le gène hairless humain comporte, comme celui de la souris, 19 exons ; Il est exprimé dans la plupart des tissus, plus fortement dans la peau et l’intestin grêle, mais aussi dans le cerveau, le testicule et le côlon [2]. Il est intéressant de noter que la peau est le seul tissu qui exprime un variant où l’exon 17 est manquant, à la suite d’un épissage alternatif. Le gène hairless est fortement conservé chez l’homme puisque le pourcentage d’homologie avec le gène du rat et de la souris s’élève à 81,1 % au niveau nucléique et 79,3 % au niveau protéique [2].
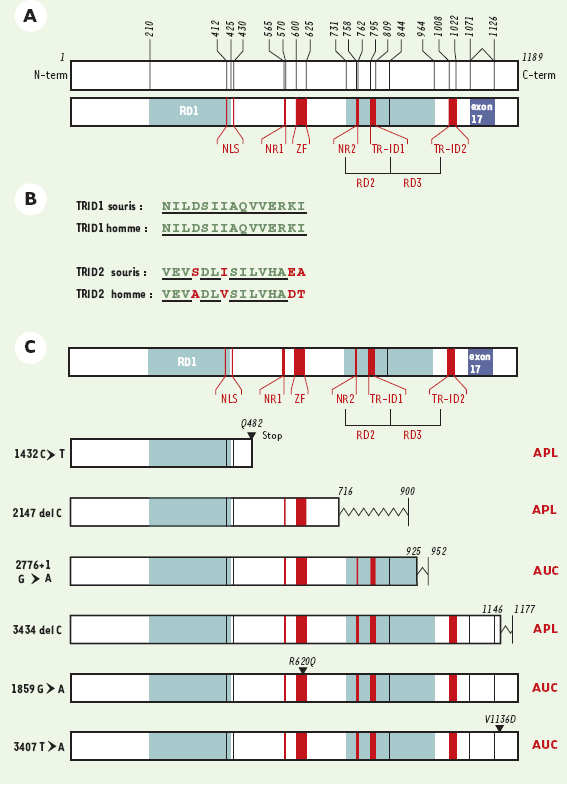
Quelle est la fonction biochimique de ce gène ? Un certain nombre de motifs de la structure primaire de la protéine hairless pourrait lui conférer un rôle de régulateur transcriptionnel. Elle comprend en effet un signal bipartite de localisation nucléaire de séquence Lys-Arg-Ala-(X13)-Pro-Lys-Arg (K-R-A-(X13)-P-K-R), situé entre Lys412 et Arg430 de la séquence du gène humain [3] et la présence d’une structure à doigt de zinc Cys-X-X-Cys-(X17)-Cys-X-X-Cys, située entre Cys600 et Cys625 (séquence du gène humain, Figure 1A). Cela suggère que le produit du gène hairless pourrait être un facteur de transcription avec une homologie structurale avec les gènes de la famille GATA. La présence de boîtes « récepteur nucléaire » de séquence canonique Leu-XX-Leu-Leu (L-XX-L-L), situées entre les acides aminés 565-700 et 758-762, suggère qu’hairless pourrait aussi appartenir à la famille des co-régulateurs transcriptionnels associés aux récepteurs de l’hormone thyroïdienne T3 (TR), de la vitamine D (VDR) ou de l’acide rétinoïque (RAR) [3].
| Figure 1. Caractéristiques structurales du gène hairless. A. Carte physique du gène hairless humain. RD : domaine répresseur ; TR-ID : domaine d’interaction avec TR ; NLS : signal de localisation nucléaire ; NR : boîte récepteur nucléaire ; ZF : structure à doigt de zinc. Les chiffres indiquent les numéros des acides aminés aux bornes des différents domaines fonctionnels.(échelle : 1 cm = 50 acides aminés) B. Comparaison des séquences peptidiques murine et humaine des domaines d’interaction avec TR. Les séquences identiques sont soulignées. C. Représentation schématique de l’effet des mutations identifiées chez l’homme et du phénotype observé. Colonne de gauche : mutation ; colonne centrale : effet sur la protéine ; colonne de droite : phénotype associé. APL : atrichose papilaire ; AUC : alopécie universelle congénitale. |
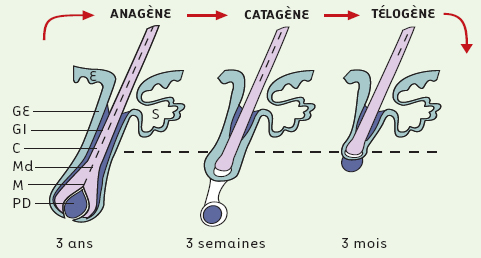
Quelle est la fonction biologique de ce gène ? Le gène hairless est associé à des désordres capillaires congénitaux, comme l’alopecia universalis et l’atrichose papulaire [2, 4–8]. Bien que de nombreux allèles aient été identifiés chez la souris et chez l’homme, un phénotype commun est observé : après une première phase de croissance normale, le poil (le cheveu) ne repousse pas après sa chute. Rappelons que le follicule pileux est formé d’une gaine conjonctive prolongée à sa base par une papille dermique, et d’une partie épithéliale organisée en trois compartiments concentriques, la gaine externe, la gaine interne et la tige pilaire, issus des cellules de la matrice situées à la base du follicule, à la périphérie de la papille dermique. Rappelons aussi que le follicule pileux est une structure dynamique qui subit un processus cyclique de production-dégradation-régénération (Figure 2). Ainsi, le follicule produit de la fibre de façon continue pendant environ trois ans, au rythme de 0,3 mm par jour, c’est la phase anagène. Cette phase est suivie par la phase catagène qui est une phase d’involution, très rapide (3 semaines), durant laquelle le follicule se dégrade à travers une intense activité apoptotique. Cette phase d’involution est suivie par la phase télogène, qui est une phase de repos qui dure environ 3 mois. Enfin, le follicule se régénère à partir de cellules pluripotentes et entre dans une nouvelle phase anagène. Or, durant la phase anagène, le gène hairless est essentiellement exprimé dans les cellules de la matrice et une couche particulière de la gaine interne, la couche de Huxley [9]. Il pourrait alors règler l’équilibre entre apoptose et différenciation de certaines sous-populations kératinocytaires du follicule pileux. Durant la phase d’involution du follicule - phase catagène -, le gène hairless est exprimé dans les cellules épithéliales adjacentes à la papille dermique et pourrait donc être impliqué dans l’ascension de la papille dermique normalement observée à la fin de la phase catagène et nécessaire au redémarrage du cycle lors de la transition entre la phase de repos − phase télogène - et l’induction de la phase anagène du cycle suivant. Cette ascension de la papille dermique ne s’opère plus chez les mutants hairless.
| Figure 2. Schéma du cycle pilaire. Le cycle pilaire : phase anagène ou phase de croissance ; phase catagène ou phase d’involution ; phase télogène ou phase de repos. E : épiderme ; GE : gaine externe ; GI : gaine interne ; C : cortex ; Md : medulla ; M : matrice ; PD : papille dermique ; S : glande sébacée. |
Si la protéine hairless joue un rôle évident dans le contrôle du cycle pilaire, elle joue certainement aussi un rôle important dans le cerveau, puisque des déficits neurologiques et des retards mentaux ont été observés chez des patients porteurs de mutations dans le gène hairless. Malgré l’importance de cette fonction biologique et les quelques motifs structuraux suggérant un rôle transcriptionnel chez hairless, la fonction biochimique de cette protéine restait peu connue et largement spéculative. L’article de G.B. Potter [10] apporte enfin les premiers éléments expérimentaux démontrant que la protéine hairless (du rat) se comporte comme un co-répresseur transcriptionnel des récepteurs TR de la T3.
Par toute une batterie d’élégantes approches biochimiques incluant la méthode du double hybride, la mutagenèse dirigée, le Far Western, la culture cellulaire et la transfection, l’immunoprécipitation et l’immunofluorescence, le groupe de Catherine C. Thompson a abouti aux conclusions suivantes.
- hairless interagit avec TR via deux sites indépendants, intitulés TR-ID1 et TR-ID2, situés entre les acides aminés 816-830 et 1024-1040 de la séquence murine. La comparaison de la séquence de ces deux sites a permis d’établir une séquence minimale consensus Ile/Leu-Ile-XX-Leu/Val-Val (I/LIXXL/VV), probablement impliquée dans des interactions hélice α-hélice α hydrophobes entre TR et hairless. Les homologues humains de ces sites sont situés entre les acides aminés 795-809 et 1008-1022 (Figure 1A). L’homologie entre les sites TR-ID1 murin et humain est de 100 %, tandis qu’elle est de 87 % pour le site TR-ID2, le dipeptide « Glu-Ala (EA) » C-terminal du TR-ID2 murin étant remplacée par « Asp-Thr (DT) » chez l’homme (Figure 1B). Ce point a probablement son importance comme nous le verrons plus loin.
- hairless interagit avec TR au niveau du domaine de fixation de la T3, et joue son rôle de co-répresseur en l’absence de T3. Rappelons à cet égard qu’en l’absence de son ligand T3, TR est un répresseur transcriptionnel. Cet effet est spécifique de TR car hairless n’interagit pas avec le récepteur RAR et ne module pas son activité.
- hairless possède trois domaines indépendants de répression transcriptionnelle (RD 1-3), situés entre les acides aminés 236-450, 750-864 et 864-980 de la séquence murine. Ces domaines sont très conservés et se retrouvent entre les acides aminés 210-425, 731-844 et 844-964 de la séquence humaine (Figure 1A).
- hairless agit comme co-répresseur au sein d’un complexe multiprotéique contenant les histone-désacétylases (HDAC) de type 1, 3 et 5, et localisé dans des régions discrètes du noyau appelées les « corps désacétylase associés à la matrice », ce qui confirme l’association de hairless avec la matrice nucléaire [3].
Il est clair que ce travail apporte des éléments nouveaux et convaincants quant à la fonction biochimique de hairless. Ces résultats ont aussi une signification biologique importante dans la mesure où : (1) à’instar des RAR et de VDR, les récepteurs TRα/β sont exprimés dans l’épiderme et le récepteur TRβ dans le follicule pileux [11] ; et (2) de nombreux symptômes cutanés associés à une insuffisance thyroïdienne – épaississement de l’épiderme et perte des cheveux - sont retrouvés chez les patients porteurs de mutations dans le gène hairless. Toutefois, pour mieux comprendre et analyser le rôle biologique de hairless, il nous a semblé intéressant de localiser les mutations identifiées chez’homme sur la carte fonctionnelle du gène hairless humain, en regard des phénotypes observés (Figure 1C).
Considérons d’abord les mutations caractérisées chez l’homme, et qui affectent les domaines impliqués dans la corépression décrite par le groupe de C.C. Thompson. Une première mutation non sens (nt1432 C→T, exon 4) [4] aboutit à un arrêt prématuré de la traduction à l’acide aminé 481. La protéine hairless, si elle est effectivement synthétisée, ne comprendrait que le domaine RD1 et le signal de localisation nucléaire. Une deuxième mutation (nt2147 del C, exon 6) [5] introduit un décalage de lecture à partir de’acide aminé 716 et un arrêt prématuré de lecture au niveau de l’acide aminé 900. Dans ce cas, les deux domaines RD2 et RD3 sont non fonctionnels, de même que le premier domaine d’interaction TR-ID1. Denouveau, seul RD1 est intact. Une troisième mutation (nt2776+1 G→A, exon 12) [2], en supprimant un site donneur d’épissage, aboutit à l’exclusion de l’exon 13, un décalage de lecture à partir de l’acide aminé 925 et un arrêt prématuré de lecture au niveau de l’acide aminé 952. Dans ce cas, le domaine affecté est RD3. Enfin, une quatrième mutation (nt3066 A→G, exon 15) [6] convertit Thr1022 en Ala, Thr1022 étant le dernier acide aminé du domaine TR-ID2 humain. De façon intéressante, cette mutation augmente l’homologie entre le TR-ID2 humain et murin, puisque chez la souris, l’équivalent de Thr1022 est Ala1040 (Figure 2B). A priori, elle ne devrait donc pas avoir d’effet sur l’activité du domaine TR-ID2. Comme cette mutation est néanmoins associée à un phénotype d’alopécie universelle, il faut en conclure que chez l’homme, cette position 1022 est importante dans l’interaction de hairless avec le TR humain.
A coté de ces mutations affectant directement la fonction « co-répresseur » de hairless, d’autres mutations ont été décrites, associées elles aussi à des phénotypes de type alopécie universelle ou atrichose papulaire. Une mutation faux sens (nt1859 G→A, exon 6) [7] aboutit au remplacement d’Arg620 par une glutamine, à l’intérieur du domaine à doigt de zinc (acides aminés 600-625). Ce domaine, d’abord putatif, pourrait donc être réellement fonctionnel et impliqué dans l’interaction de hairless avec l’ADN, au niveau d’une séquence encore inconnue. Cette interaction pourrait prépositionner hairless par rapport à TR et donc favoriser sa fonction de co-répresseur.
De façon alternative, ce domaine pourrait positionner hairless en amont de gène(s) cible(s) spécifiques, où il jouerait un rôle de facteur transcriptionnel, indépendamment de sa fonction « co-répresseur » vis-à-vis de TR. Cette hypothèse est étayée par l’existence de deux autres mutations dans la partie C-terminale de hairless, qui porterait alors une fonction activatrice de la transcription. L’une (nt3407, T→A, exon 18) [2] aboutit au remplacement de Val1136 par Asp, tandis qu’une autre mutation (nt3434 delC, exon 18) [8] conduit au remplacement de Ser1146 par Leu et à un décalage de lecture à partir de cet acide aminé aboutissant à un arrêt prématuré à l’acide aminé 1177. Comme ces régions ne semblent a priori pas impliquées dans la fonction « corépresseur » d’hairless, et comme les mutations qui les affectent sont néanmoins associées à un phénotype d’alopécie universelle ou d’atrichose papulaire, il faut en conclure qu’hairless, en association ou non avec TR, est impliqué dans la régulation d’une ou plusieurs voies métaboliques importantes pour le contrôle du cycle pilaire. Plus précisément, son expression dans la gaine interne du follicule [10], qui est le premier compartiment affecté lors de la transition anagène-catagène [12], suggère qu’hairless joue un rôle important dans le contrôle de la transition anagène-catagène. L’hypothèse de l’existence de plusieurs voies métaboliques impliquées dans ce processus est d’ailleurs étayée par la caractérisation récente de mutations dans le gène VDR [13] - lui-même exprimé dans le follicule pileux [14] associées à une phénocopie de l’atrichose généralisée induite par les mutations de hairless.