| |
| Med Sci (Paris). 2002 March; 18(3): 280–282. Published online 2002 March 15. doi: 10.1051/medsci/2002183280.Neurodégénérescence et transport du fer cérébral Simone Gigenkrantz 9, rue Basse, 54330 Clerey-sur-Brenon, France |
L’accumulation du fer dans le tissu nerveux est fréquemment observée dans le cerveau de sujets atteints de maladies neurodégénératives, mais il n’existait, jusqu’à présent, aucune preuve directe de son implication dans la pathogénie de ces maladies. De plus, au cours de la sénescence, le fer s’accumule spontanément dans les cellules neuronales, en particulier dans le locus niger, sans entraîner de troubles neurologiques majeurs. Pourtant, l’hypothèse d’un stress oxydatif causé par l’accumulation de fer comme origine des neurodégénérescences était proposée par deux auteurs chinois dans un article bien documenté publié en mars 2001 [1]. Celui-ci était assez prémonitoire, car voici qu’à peu près simultanément, deux groupes de chercheurs viennent de découvrir les gènes de deux maladies neurodégénératives et de démontrer que les troubles du métabolisme du fer sont effectivement responsables des lésions. |
L’ une d’entre elles est connue : décrite en 1922 sous le nom de syndrome d’Hallervorden-Spatz (HSS), elle débute dans l’enfance et se caractérise par une rigidité progressive atteignant d’abord les membres inférieurs. Puis apparaissent des mouvements involontaires avec impossibilité de coordination ainsi qu’une sévère détérioration mentale, des crises d ’épilepsie et des troubles de la vision. A l’IRM, les anomalies du ganglion basal peuvent être évocatrices, mais le diagnostic est habituellement fait post-mortem par l’étude du cerveau. Il existe une atrophie cérébrale généralisée avec d’importants dépôts de fer dans le globus pallidus, le noyau caudé et le locus niger. Le site de cette maladie récessive autosomique fut d’abord localisé en 20p13 puis, grâce à une grande famille amish, des chercheurs américains ont réussi à réduire la région d’intérêt à 1,4 Mb où plus de vingt gènes devaient être analysés [2]. Une délétion fut trouvée dans le quinzième, un gène présentant une forte homologie avec le gène murin codant pour la pantothénate kinase 1, résultat qui fut confirmé par la découverte d’autres mutations chez 32 sur 38 malades atteints d’HSS typique et dans certaines formes atypiques. Le gène en cause est appelé PANK2. Chez l’homme, il existe quatre gènes PANK localisés respectivement en 10q23, 20p13, 5q35 et 1p36, qui s’expriment différemment selon les tissus. PANK2 est ubiquitaire, mais semble s’exprimer préférentiellement dans le cerveau (ganglion basal chez le nouveau-né) et la rétine. Il présente une homologie de séquence avec le gène pank de la drosophile, ce qui est particulièrement intéressant puisque le mutant fumble présente une incoordination motrice avec incapacité à grimper, à voler et à s’accoupler [3]. La pantothénate kinase est une enzyme de régulation essentielle à la biosynthèse du Coenzyme A (CoA). Celui-ci participe à la biosynthèse des membranes. C’est pourquoi une déplétion en CoA entraîne des lésions des tissus qui les régénèrent constamment, comme les bâtonnets, d’où les rétinopathies fréquemment observées dans les HSS classiques. La pantothénate kinase catalyse la phosphorylation du pantothénate (vitamine B5) et de substances voisines pour donner le 4’-pantothénate qui est ensuite converti en 4’-pantothéthéine au cours d’une réaction qui consomme de la cystéine. En cas de mutation avec perte de fonction de PANK2, la cystéine s’accumulerait - ce qui est effectivement le cas dans les régions cérébrales touchées dans le syndrome d’Hallervorden-Spatz. De plus, dans ces régions lésées riches en fer, on peut supposer - en raison du rôle chélateur de la cystéine sur le fer - que le fer lié à la cystéine causerait un stress oxydatif par production de radicaux libres etentraînerait la mort neuronale. La neurodégénérescence qui s’ensuit est-elle limitée à ce seul syndrome ou ne peut-on imaginer que le métabolisme du panto-thénate représente une voie commune impliquée dans d’autres maladies neurodégénératives ? Cette hypothèse a déjà été évoquée pour les maladies de Parkinson et d’Alzheimer [4]. Quoi qu’il en soit, cette découverte aura aussi l’avantage de débaptiser le syndrome d’Hallervorden-Spatz, ce qui paraissait souhaitable à bien des scientifiques en raison de l’active participation de Julius Hallervorden aux coupables activités de l’Allemagne hitlérienne (→). Elle sera désormais la première d’un groupe de maladies appelées PKAN (pantothenate kinase associated neurodegeneration). (→)m/s 1997, n°1, p. 133 |
L’autre maladie dans laquelle le métabolisme du fer est directement impliqué était inconnue avant qu’un groupe anglais ne l’identifie chez des sujets du Cumbria au Nord de l’Angleterre [5]. Bien que cette maladie (autosomique dominante) ressemble cliniquement un peu au syndrome d’Hallervorden-Spatz, son début est plus tardif. Elle se caractérise par des mouvements involontaires apparaissant entre 40 et 50 ans, avec des troubles extrapyramidaux : dystonie, spasticité et rigidité, comme dans le HSS, mais qui ne sont jamais associés à des troubles cognitifs ou cérébelleux. Par analyse de ségrégation, un locus a été trouvé en 19q13.3 dans une région où se trouve le gène codant pour les chaînes légères (L) de la ferritine. La ferritine, qui a pour fonction de stocker et de chélater le fer libre, est une macromolécule constituée de deux sous-unités distinctes, lourdes et légères (H et L), et complémentaires. Elle a la forme d’une sphère creuse qui permet l’entrée d’une quantité variable de fer ferrique, les chaînes H ayant une activité oxydase spécifique et les chaînes L étant impliquées dans la formation et la stabilisation du noyau fer-ferritine. Une même mutation (due à un effetfondateur), a été retrouvée chez tous les malades dans le gène de la ferritine. Quelle peut en être la conséquence sur la ferritine ? Changement de structure ou perte de fonction ? Les chaînes L mutées pourraient modifier la conformation de la ferritine, à moins qu’elles n’acquièrent de nouvelles fonctions. Un modèle murin déficient en chaînes L pourrait répondre à ces interrogations. Comme aucune atteinte du foie, du pancréas ou du cœur n’existe chez ces malades et que les concentrations de ferritine sériques sont anormalement basses, il semble que seuls les tissus nerveux soient touchés. L’étude histopathologique du cerveau montre d’abondantes inclusions de ferritine dans le globus pallidus et, de manière diffuse à travers la substance blanche, des gonflements axonaux immunoréactifs aux neurofilaments, à l’ubiquitine et à tau, images caractéristiques des maladies neurodégénératives. Rappelons que la régulation par le fer de la ferritine et du récepteur de la transferrine a été décrite dans médecine/ sciences (→). On sait qu’en cas de carence en fer intracellulaire, l’IRF (iron regulatory factor) encore appelé IRE-BP (pour iron responsive element binding protein) se lie à des éléments régulateurs communs aux chaînes H et L de la ferritine et du récepteur de la transferrine. Des mutations dans la région 5’ non codante du gène FTL (codant pour IRE) quientraînent un syndrome hyperferritinémie-cataracte (→) ont été rapportées. Toutefois, pour cette première apparition de la ferritinedans la pathologie du système nerveux central, les auteurs proposent que la maladie soit appelée neuroferritinopathie. (→)m/s 1988, n°8, p. 527 et 1993, n°10 p. 1145 (→)m/s 1998, n°1, p. 104 |
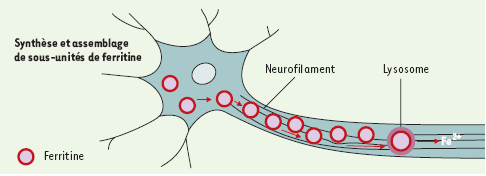
D’autres troubles de la régulation du fer ont déjà été mis en relation avec des lésions des neurones. Ainsi, chez la souris, une perte de la protéine IRP-2 (iron responsive protein) qui provoque une surexpression des chaînes H et L de la ferritine a pour conséquence une neuro-dégénérescence axonale [6]. Les colorations immunohistochimiques des souris Irp2−/−, comparées à des témoins, semblent montrer que la ferritine est transportée de la cellule vers les axones (Figure 1). Elle pourrait être dégradée dans les lysosomes à la partie distale des axones, et dans les terminaisons présynaptiques, libérant du fer ferreux, à moins que les hétéropolymères instables libèrent du fer libre dans l’axone ou dans les synapses.  | Figure 1. Modèle théorique d’un mécanisme lésionnel des neurones par l’accumulation de fer. La production de ferritine et l’assemblage des sous-unités s’effectue dans la cellule. La ferritine migre vers la partie distale de l’axone, et est dégradée dans les lysosomes avec libération de fer ferreux. |
Ajoutons qu’en pathologie humaine, l’acéruloplasminémie, une maladie récessive rare, due à une mutation dans le gène codant pour la céruloplasmine, et caractérisée par une neurodégénérescence associée à un diabète et à une rétinopathie, a été expliquée par une interaction entre la céruloplasmine et la ferritine, et que la protéine responsable de la maladie de Friedreich est, elle aussi, impliquée dans le métabolisme du fer (→). (→)m/s 1999, n°11, p. 1314 Ainsi, peu à peu, se constitue un faisceau d’arguments en faveur de la relation de cause à effet entre les troubles du transport du fer dans le cerveau et les neurodégénérescences. |
1. Qian ZM, Shen X. Brain iron transport and neurodegeneration. Trends Mol Med 2001; 7 : 104–8. 2. Zhou B, Westaway SK, Levinson B, et al. A novel pantothenate kinase gene (PANK) is defective in Hallervorden-Spatz syndrome. Nat Genet 2001; 28 : 345–9. 3. Afshar K, Gonczy P, DiNardo S, Wasserman SA. Fumble encodes a pantothenate kinase homolog required for proper mitosis and meiosis in Drosophila melanogaster. Genetics 2001; 157 : 1267–76. 4. Heafield MT. Plasma cysteine and sulfate levels in patients with motor neurone, Parkinson’s and Alzheimer’s disease. Neuroscience 1990; 110 : 216–20. 5. Curtis AR, Fey C, Morris CM, et al. Mutation in the gene encoding ferritin light polypeptide causes dominant adult-onset basal ganglia disease. Nat Genet 2001; 28 : 350–4. 6. LaVaute T, Smith S, Cooperman S, et al. Targeted deletion of the gene encoding iron regulatory protein-2 causes misregulation of iron metabolism and neuro-degenerative disease in mice. Nat Genet 2001; 27 : 209–14. |