Le prix Nobel de médecine 2001 a été décerné à trois biologistes (Leland Hartwel, Paul Nurse et Tim Hunt)(→), dont les travaux de pionniers chez la levure (L.H et P.N.) et les œufs d’invertébrés marins (T.H.) ont permis d’identifier deux molécules qui sont au cœur de la machinerie moléculaire contrôlant la division des cellules eucaryotes. Ce sont la kinase Cdc2 (connue aussi sous le nom de MPF ou maturation/mitosis-promoting factor) et son régulateur positif, une cycline, protéine instable dont l’abondance varie fortement au cours du cycle cellulaire. Aujourd’hui, il est bien établi que des membres de la famille des kinases apparentées à Cdc2, en s’associant avec différentes cyclines (d’où leur nom, cyclin-dependent kinases ou Cdk), orchestrent non seulement l’entrée et le déroulement de la mitose, mais aussi le déclenchement et la progression de la synthèse d’ADN (entrée en phase S). Il est donc évident que, pour le bon déroulement de la division cellulaire, l’activité des complexes Cdk-cycline doit être étroitement réglée. C’est pourquoi la cellule dispose d’un réseau impressionnant d’enzymes qui assurent l’(in)activation ordonnée des Cdk.
(→) m/s 2001, n°11, p. 1226
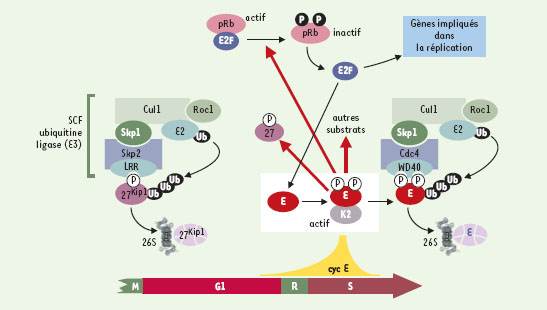
Dans ce contexte, le contrôle des quantités de cyclines est d’une extrême importance et les mécanismes impliqués intriguent un bon nombre de chercheurs depuis une décennie. Le taux cellulaire en cyclines est déterminé d’une part au niveau transcriptionnel, et d’autre part par leur destruction, qui est sous la dépendance du système ubiquitine/protéasome, un complexe multiprotéique jouant un rôle majeur dans la protéolyse intracellulaire. La dégradation par ce système se produit en deux étapes : (a) le substrat (souvent phosphorylé) est « marqué » par conjugaison covalente de chaînes d’ubiquitine, ce qui permet sa reconnaissance et (b) la dégradation des molécules polyubiquitinylées par le pro-téasome 26S [1]. La question suivante se pose alors : comment les protéines destinées à la dégradation sont-elles spécifiquement reconnues et adressées vers cette « machinerie de destruction », et ce à des moments précis ? C’est un sujet de recherche intense. Grâce en particulier aux études réalisées dans la levure Saccharomyces cerevisiae, un organisme bien adapté à la manipulation génétique, on connaît bon nombre des composants des complexes (appelés ubiquitine ligases) jouant un rôle dans la reconnaissance du substrat et son adressage vers la destruction. Parmi les ubiquitine ligases [1], SCF joue un rôle essentiel dans le déclenchement de la phase S. SCF est constitué de quatre sous-unités : un cœur composé de Skp1, Cdc53/Cul1 (Culline) et Rbx1/Roc1, et un membre de la famille des protéines F-box, une sous-unité adaptatrice déterminant la spécificité du substrat (Figure 1). Skp2, une protéine F-box, participe à la dégradation d’un régulateur négatif de la prolifération, p27Kip1, un inhibiteur des Cdk dont la destruction en phase G1 favorise l’entrée en phase S [2] (Figure 1). Pour être reconnu par Skp2, p27Kip1 doit d’abord être phosphorylé par le complexe Cdk2-cycline E, élément clé dans le déclenchement de la réplication d’ADN. Parmi les nombreuses cibles de Cdk2-cycline E figure un suppresseur de tumeur, la protéine du rétinoblastome (pRb) qui, dans son état actif (non phosphorylé), bloque l’expression des gènes requis pour la synthèse d’ADN (Figure 1).
| Figure 1. Adressage de la cycline E vers la destruction par une ubiquitine ligase. Le complexe Cdk2-cycline E est un régulateur positif de la duplication du génome. Il s’accumule dans le noyau en phase G1 et son activité est maximale au début de la phase S (transition G1/S). Ses cibles sont entre autres la protéine du rétinoblastome (pRb), un suppresseur de tumeur et régulateur négatif de la prolifération, et un inhibiteur de Cdk, p27Kip1. Après phosphorylation, pRb est inactivée et libère les facteurs de transcription de la famille E2F qui stimulent l’expression de nombreux gènes (y compris celui de la cycline E) requis pour la réplication. Par ailleurs, p27, une fois phosphorylée, est reconnue par Skp2, une protéine F-box, est ensuite ubiquitinylée par SCF, une ubiquitine ligase (E3), puis rapidement dégradée par le protéasome 26S [1]. En début de phase S, la cycline E est phosphorylée par Cdk2 et adressée à l’ubiquitine ligase en se liant à une autre protéine F box, hCdc4/FbW7/Ago (Cdc4), découverte récemment par trois laboratoires [5–7]. WD40 et LRR sont des domaines des protéines F-box impliqués dans le recrutement spécifique des substrats de SCF. Dans certaines cellules cancéreuses, des mutations dans le domaine WD40 de Cdc4 empêchent la dégradation de la cycline E, provoquant ainsi sa stabilisation. L’accumulation incontrôlée de la cycline E peut perturber l’équilibre existant entre les niveaux de kinase et des inhibiteurs (tels que p27Kip1), ce qui engendre un dérèglement de la réplication du génome et, par conséquent, de la prolifération cellulaire. |
La dégradation de la cycline E en phase S est aussi dépendante d’ubiquitinylation et semble cruciale pour le bon déroulement de la réplication car son expression constitutive provoque une instabilité génomique [3]. Dans plusieurs cancers un taux cellulaire faible de p27Kip1 a été associé à un mauvais pronostic, et la cycline E est surexprimée dans de nombreuses lignées cancéreuses [4] indiquant que la dégradation ordonnée de ces deux régulateurs doit être strictement contrôlée.
La protéine F-box dirigeant la cycline E vers la voie de destruction vient d’être identifiée par trois laboratoires américains. Bien que certaines indications antérieures suggéraient que Skp2 pouvait être impliquée dans cet adressage, ces chercheurs ont réussi à démontrer que c’est, en fait, la protéine Cdc4/Fbw7/Ago qui joue ce rôle, et que la mutation de cette protéine pourrait être à l’origine d’un développement tumoral [5–7]. Pour y parvenir, deux laboratoires, celui de S.I. Reed (Scripps Institute, La Jolla, CA, USA) et celui de S.J. Elledge (Baylor College, Houston, TX, USA), ont utilisé comme modèle la levure S. cerevisiae, dont les voies de protéolyse sont bien caractérisées. De plus, comme la cycline E humaine peut se substituer dans la levure aux cyclines G1 endogènes [8], on pouvait s’attendre à ce que la levure puisse régler l’expression et l’activité de cette cycline. En étudiant des cellules de levure dont les gènes codant pour les divers composants du complexe SCF ont été mutés, ces chercheurs ont découvert que la cycline E était stabilisée dans les cellules ayant une mutation dans le gène Cdc4 [5,6]. Ensuite, ils ont pu montrer in vitro que son orthologue humain, hCdc4 [5] ou Fbw7 [6], en s’associant à la cycline E préalablement phosphorylée (probablement par Cdk2), catalyse son ubiquitinylation et, par conséquent, sa destruction. Des mutations dans le domaine WD40 de hCdc4/Fbw7 (Figure 1) empêchent son association avec la cycline E phosphorylée, indiquant que ce domaine est nécessaire à la reconnaissance du substrat. Ces résultats ont aussi été validés dans des cellules humaines dans lesquelles la surexpression de hCdc4 conduit à une diminution de la demi-vie de la cycline E tandis que la présence d’une forme mutée de cette protéine provoque sa stabilisation.
L’équipe de I.K. Hariharan (MGH Cancer Center, Charlestown, USA), qui, elle, recherchait un environnement génétique favorisant la prolifération de cellules de drosophile, observait au même moment que la cycline E était très stabiisée si on mutait le gène archipelago (ago, un orthologue de Cdc4) dans les cellules [7]. Contrairement aux cellules avoisinantes de type sauvage qui se trouvaient en état de quiescence, les cellules mutantes continuaient à proliférer, démontrant ainsi qu’une dégradation inefficace de la cycline E peut stimuler la division cellulaire. Encore plus intéressants sont les résultats montrant que plusieurs lignées d’origine tumorale exprimant des taux élevés de cycline E présentent justement des mutations dans le domaine WD40 de hCdc4/ Fbw7/Ago. Sachant que l’instabilité du génome provoquée par un dérèglement de la cycline E peut engendrer des changements favorisant la cancérogenèse, il est possible que hCdc4/Fbw7/Ago soit un suppresseur de tumeur, en d’autres termes un régulateur négatif de la prolifération. Enfin, il a été montré que l’orthologue de Cdc4 chez le nématode Caenorhabditis elegans, SEL-10, est impliqué dans la dégradation des présénilines (des protéines codées par les gènes dont les mutations sont à l’origine de la maladie d’Alzheimer) [9], ainsi que des oncogènes de la famille Notch [10], jouant un rôle important dans la signalisation cellulaire. Et ce n’est sûrement pas la fin de l’histoire.