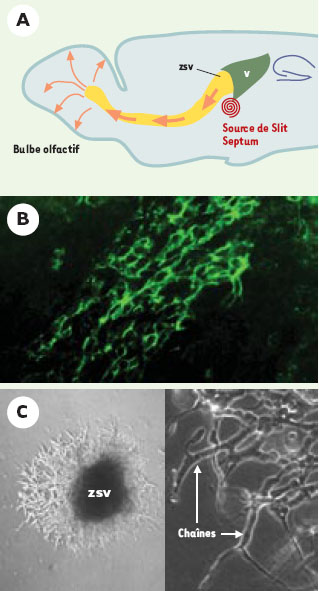
Dans le cerveau des vertébrés, les interneurones du bulbe olfactif se renouvellent tout au long de la vie de l’animal (→). Le maintien chez l’adulte d’une production de neurones revêt un intérêt tout particulier dans le cadre du développement de stratégies de réparation du système nerveux par thérapie cellulaire. Les interneurones naissent dans la zone subventriculaire qui borde les ventricules latéraux, et migrent vers le bulbe olfactif, suivant un trajet appelé «courant rostral de migration » (Figure 1A).
(→) m/s 1998, n°6-7, p. 771
| Figure 1. Migration en chaîne des neurones du bulbe olfactif. A. Coupe sagittale du cerveau de souris adulte. Les interneurones du bulbe olfactif naissent au niveau de la zone sous-ventriculaire (zsv) qui borde le ventricule latéral (v). Ces progéniteurs neuronaux migrent dans le trajet ros-tral de migration (indiqué par les flèches), guidés par le facteur Slit qui est sécrété au niveau du septum caudal. B. Les progéniteurs neuronaux (en vert) qui migrent en chaîne dans le trajet sont visualisés par un marquage immuno-fluorescent réalisé à l’aide d’un anticorps dirigé contre le marqueur PSA-NCAM (document G. Chazal). C. In vitro, on peut reproduire ce mécanisme de migration en chaîne en cultivant des explants de zsv dans un gel tridimensionnel (Matrigel) qui favorise leur migration. Après 48 heures de culture, les progéniteurs neuronaux ont migré hors de l’explant. A plus fort grossissement, on observe la formation de chaînes dans le Matrigel. |
Le mode de migration de ces neurones est très particulier et qualifié de migration en chaîne (Figure 1B) [1]. Les cellules migrent les unes sur les autres sans utiliser apparemment d’autre support, alors que la plupart des précurseurs neuronaux migrent de façon isolée sur les fibres de la glie radiale ou les projections axonales. La migration en chaîne permet de transporter rapidement un nombre important de cellules sur une longue distance (chez la souris, plusieurs millimètres séparent la zone sous-ventriculaire du bulbe olfactif).
Les mécanismes qui contrôlent la migration cellulaire et la croissance axonale sont à de nombreux égards identiques, et mettent en jeu des molécules qui permettent aux cellules et aux axones non seulement de migrer, mais aussi de s’orienter dans la bonne direction. La réponse cellulaire est induite par des molécules de signalisation qui assurent la transduction de ces signaux environnementaux. Plusieurs familles de ces facteurs de « guidage » ont été identifiées, parmi lesquelles les éphrines, les sémaphorines ou encore la famille des protéines Slit (→). Par l’intermédiaire de leurs récepteurs membranaires, ces facteurs règlent l’activité des petites protéines G de la famille des RhoGTPases (avec trois acteurs principaux, RhoA, Rac1 et Cdc42).
(→) m/s 2000, n°6-7, p. 751
L’activité de ces RhoGT-Pases est contrôlée par deux familles de protéines : les GAP (GTPase activating proteins) et les GEF (guanine nucleotide exchange factors) [2] (→). Le recrutement des RhoGTPases permet de moduler la morphologie cellulaire par le biais de la formation d’extensions cytomembranaires (→→). Ces filopodes et ces lamellipodes sont constitués d’un cytosquelette d’actine et contrôlent la motilité cellulaire [2]. Toutefois, les mécanismes qui permettent d’associer sélectivement une RhoGTPase et un signal de guidage donné restent encore très énigmatiques.
(→) m/s 2000, n°2, p. 228
(→→) m/s 2002, n°2, p. 142
Dans le courant rostral de migration, deux types de signaux intervenant dans la migration en chaîne des progéniteurs ont été identifiés. D’une part, des molécules de surface, comme la molécule PSA-NCAM (polysialylated-neural adhesion molecule) [3] (→) qui, en modulant l’adhérence des cellules entre elles, sont déterminantes pour la formation et la cohésion des chaînes ; d’autre part, des signaux de guidage qui permettent l’entrée et l’orientation des progéniteurs dans le courant rostral de migration. Les travaux du groupe de Rao et de Hu [4, 5] ont montré que la famille des facteurs Slit, qui comprend trois membres chez les mammifères, règle l’orientation de la migration en chaîne (→→). Les protéines sécrétées - Slit1 et Slit2 - par le septum caudal constituent un signal répulsif pour les précurseurs neu-ronaux de la zone sous-ventriculaire (Figure 1A).
(→) m/s 1998, n°6-7, p. 771
(→→) m/s 1999, n°6-7, p. 882
Ces facteurs créeraient une barrière empêchant ainsi les cellules de migrer dans le septum (→).
(→) m/s 1999, n°6-7, p. 882
Dans une récente publication, le groupe de Rao [6] lève le voile sur les voies de signalisation déclenchées par les facteurs Slit lors de la migration en chaîne. Elles font intervenir des RhoGTPases et de nouveaux membres de la famille des GAP (srGAP pour slit/robo GAP). Les auteurs ont disséqué par des approches biochimiques les mécanismes d’interaction entre Robo1, le récepteur de Slit1, et srGAP1. L’utilisation dans ces expériences de protéines tronquées, présentant des délétions de divers domaines fonctionnels, indique que les domaines SH3 de srGAP1 et CC3 de Robo1, ainsi que les extrémités C-terminales des deux protéines, sont essentiels à la formation du complexe Robo1-srGAP1. En fait, Slit renforce de manière dépendante de la dose la cohésion d’un complexe formé de srGAP1, Cdc42 et RhoA, complexe qui se forme spontanément lorsque srGAP1, Robo1 et une forme constitutivement active des RhoGT-Pases Cdc42 ou RhoA sont co-exprimés dans une même cellule. L’analyse du niveau d’activation des RhoGTPases dans des cellules d’origine humaine exprimant srGAP1 et Robo1 montre que l’interaction de Slit avec son récepteur Robo1 induit des effets duaux : elle favorise le maintien de Cdc42 sous une forme inactive (GDP) et de RhoA sous une forme active (GTP). Cet effet modulateur implique les domaines SH3 de srGAP1 et CC3 de Robo1. Ces données établissent ainsi une cascade de signalisation permettant de coupler le signal de guidage extracellulaire Slit à une modulation interne du cytosquelette d’actine et, par voie de conséquence, à la motilité cellulaire.
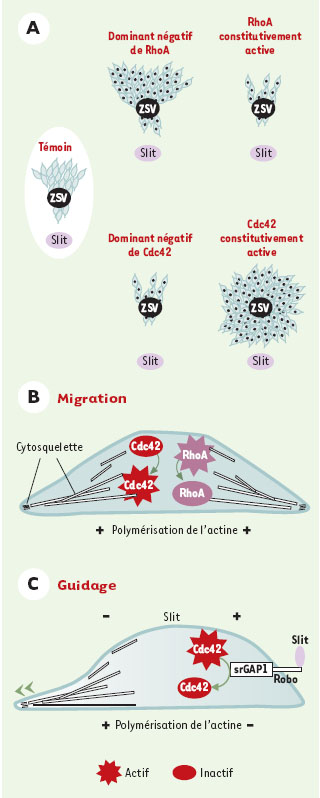
Une analyse expérimentale plus poussée a permis de démontrer que cette voie de couplage au cytosquelette contrôle la migration in vitro des précurseurs neuronaux de la zone sous-ventriculaire (Figure 2A). Mais, si on analyse séparément migration cellulaire et réponse au facteur répulsif Slit grâce à l’utilisation de formes consti-tutivement actives, ou dominantes négatives, des facteurs Cdc42 et RhoA, il s’avère que seule Cdc42 est impliquée dans la réponse au signal répulsif exercé par Slit sur ces progéniteurs neuronaux, même si, in vitro, il y a couplage entre RhoA et Robo1 via srGAP1.
| Figure 2. Voies de signalisation activées lors de la migration neuronale. A. Migration et orientation des progéniteurs neuro-naux. Surexpression des RhoGTPases dans des co-cultures d’explants de zone sous-ventriculaire (zsv) et d’agrégats cellulaires sécrétant le facteur Slit. En condition témoin, les progéniteurs neuronaux migrent du côté opposé à la source de Slit. Lorsque les formes constitutivement active de RhoA et dominante négative de Cdc42 sont introduites dans les progéniteurs neuronaux, la migration est fortement réduite. Toutefois, les cellules qui parviennent à migrer maintiennent leur réponse au facteur de répulsion Slit. L’introduction de la forme dominante négative de RhoA induit une augmentation de la migration, qui reste orientée comme dans la situation témoin. En revanche, lorsque les progéniteurs neuronaux expriment la forme constitutivement active de Cdc42, la migration est augmentée, mais la réponse au facteur Slit est perdue : les cellules migrent indépendamment du gradient de répulsion. Ces expériences permettent d’impliquer Cdc 42 dans la réponse des progéniteurs neuronaux au facteur de guidage Slit. B-C. Modèles de régulation de la migration et de la réponse au facteur Slit par les RhoGTPases. B. La mise en mouvement du progéniteur neuronal nécessite un réarrangement massif du cytosquelette. La polymérisation de l’actine est réglée par le niveau d’activité des RhoGTPases Cdc42 et RhoA. Dans ce modèle, les formes majoritaires sont les formes active de Cdc42 et inactive de RhoA. C. L’orientation du progéniteur neuronal dans le gradient de Slit est due à des réarrangements polarisés du cytosquelette : dans les zones de forte concentration, l’interaction Robo1/Slit est favorisée, l’inactivation de Cdc42 réduit la polymérisation de l’actine. De l’autre côté de la cellule, cette polymérisation est supérieure. Cette dissymétrie explique le mouvement préférentiel de la cellule du côté opposé à la source de Slit. |
Il est donc probable que deux voies de signalisation distinctes, mais utilisant des acteurs moléculaires communs, contrôlent la mise en mouvement des cellules et l’orientation de leur migration. La migration orientée des progéniteurs neuronaux de la zone sous-ven-triculaire serait la résultante de ces deux mécanismes. L’aptitude de la cellule à se mouvoir est conférée par un équilibre entre formes active et inactive de RhoA et Cdc42. Cet équilibre contrôle les extensions du cytosque-lette responsables de la migration (Figure 2B). La concentration extracellulaire de Slit induirait une polarisation de la cellule (Figure 2C). Les récepteurs Robo1 exprimés au pôle qui entre en contact avec la source de Slit sont activés et leur interaction avec srGAP1 induit l’inactivation de Cdc42. La présence majoritaire de Cdc42, inactive à ce pôle de la cellule, se traduit, au niveau du cytosquelette, par une faible polymérisation d’actine. Au pôle opposé, les récepteurs Robo1 sont peu activés et Cdc42 prédomine sous une forme active. Cette activité permet d’augmenter la dynamique de polymérisation de l’actine nécessaire à la formation des filopodes et des lamelli-podes (Figure 2C). Ces extensions polarisées vont ainsi favoriser la migration des neuroblastes dans le sens du gradient décroissant de Slit.
Ce modèle de contrôle de la migration en chaîne est très séduisant. Pour le confirmer, il reste cependant à identifier les intermédiaires moléculaires qui font le lien entre Cdc42, RhoA et le cytosque-lette d’actine. Ces résultats suscitent plusieurs questions : cette voie de signalisation est-elle conservée dans les processus de guidage axonal réglés par Slit ? D’autres processus cellulaires au cours desquels des réarrangements du cytosquelette sont nécessaires pourraient-ils impliquer Slit ? Par exemple, la division cellulaire, puisqu’une caractéristique des progéniteurs neuronaux de la zone sous-ventriculaire est leur potentialité de proliférer pendant leur migration.