ErbB-4 appartient à la famille des récepteurs de l’EGF (epidermal growth factor), impliqués dans la prolifération et la différenciation cellulaires. Le ligand spécifique de ErB-4, la héréguli-ne, encore appelée facteur de différenciation neu (NDF) est un membre de la famille des neurégulines ; c’est une protéine transmembranaire renfermant dans sa partie extracellulaire un domaine EGF-like et un domaine immu-noglobuline séparés par une région riche en sites de glycosylation [1]. La héréguline entraîne l’inhibition spécifique de la prolifération des cellules de carcinome mammaire. L’activation de ces récepteurs de la famille EGF dont la structure comprend un domaine tyrosi-ne kinase et un seul domaine trans-membranaire induit leur dimérisation. Ce mécanisme conduit à l’autophos-phorylation de tyrosines présentes dans le domaine cytoplasmique et catalyse une interaction avec les domaines SH2 de protéines adaptatrices [1].
L’activation d’ErbB-4 par la héréguline conduit à un clivage de l’ectodomaine par une métalloprotéase TACE (tumor necrosis factor α-converting enzyme).
Le groupe de Graham Carpenter vient de montrer que ce premier clivage de ErbB-4 est suivi d’un second, cette fois intramembranaire, lié à une activité γ-sécrétase1 [2]. Le domaine cytoplas-mique issu de ce clivage intramembra-naire migre ensuite dans le noyau (Figure 1). Ce second clivage est nécessaire pour la transmission du signal biologique, puisqu’un inhibiteur des γ-sécrétases abolit l’effet biologique de la héréguline. Ce mode de signalisation est semblable à celui du récepteur de l’EGF. Sous l’action de l’EGF, la partie intracellulaire du récepteur est clivée, puis migre au noyau et se fixe sur les domaines riches en A-T du promoteur de la cycline D1 [3].
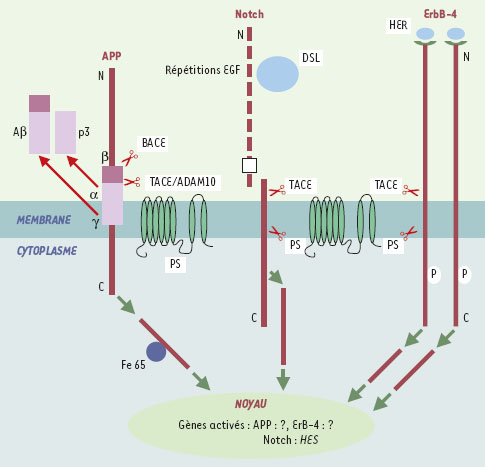
| Figure 1. APP, Notch et ErbB-4 : analogies dans le mécanisme de signalisation. Ces trois protéines transmembranaires vont sous l’action d’un ligand - DSL (Delta, Serrate, Lag2) pour Notch, et pour HER (heréguline) ErbB-4 - subir un premier clivage par une métalloprotéase TACE suivi d’un second, cette fois intramembranaire par une ?-sécrétase, associée aux présénilines (PS). Pour l’APP, la relation entre clivages et ligand reste à définir. Dans tous les cas, ces clivages libènt un fragment cytoplasmique qui est adressé au noyau. Dans le cas de Notch, après migration nucléaire, le domaine cytoplasmique active les gès de la famille HES (hairy/enhancer of split). |
Erb-B4 est le troisième exemple, à ce jour, d’une protéine à un seul domaine transmembranaire, localisée à la surface cellulaire, et clivée par une γ-sécrétase. Les deux autres protéines qui adoptent le même mode de clivage sont le précurseur de la protéine amy-loïde (APP) et les récepteurs Notch. L’APP a été associé à la maladie d’Alz-heimer car le peptide amyloïde Aβ, constituant majeur des plaques séniles, est issu des clivages aux sites β et γ de ce précurseur (Figure 1) [4]. Entre autres, Notch contrôle, au cours de l’embryogenèse, le nombre de précurseurs neuro-ectodermiques qui suivront un destin neuronal. Il joue aussi un rôle important dans l’hématopoïèse - surtout le développement lymphocytaire -tout au long de la vie adulte [5]. Plus récemment, on a mis en évidence un quatrième récepteur (CD44) qui semble utiliser le même mécanisme de signalisation [6].
L’identification de l’activité γ-sécré-tase est venue des études sur les formes familiales de la maladie d’Alz-heimer dans lesquelles des mutations des gènes codant pour les présénilines (PS1 et PS2) sont à l’origine d’une augmentation du taux de peptide Aβ [7].
Les présénilines sont des protéines à 8 domaines transmembranaires, probablement multifonctionnelles, associées à une activité aspartyl protéase [7].
Leur activité protéolytique directe, ou leur participation à la protéolyse comme co-facteur d’une y-sécrétase, est à discuter. L’implication des présénilines dans le clivage intra-membranaire a été démontrée par l’invalidation du gène PSI, qui bloque l’activité y-sécrétase sans modifier le clivage au site p. De plus, les souris dont le gène PSI a été invalidé présentent un phénotype létal embryonnaire semblable à celui des souris dont le récepteur Notch est inactivé. Cette inhibition de la voie Notch en l’absence de présénilines a aussi été observée chez la drosophile et chez C. elegans [5, 7].
Pour Notch comme pour ErbB-4, le clivage intramembranaire par une y-sécrétase ne survient qu’après un premier clivage extracellulaire, à proximité de la membrane, par une métallopro-téase (TACE) (Figurel). Il est intéressant de constater qu’il en est de même pour l’APP dont le clivage intramembranaire n’a lieu qu’une fois effectué le clivage en (3 par une aspartyl protéase (BACE) (p-site APP cleaving enzyme) [4, 7]. Notons que, dans sa voie non amyloïdogénique, l’APP peut aussi être clivé au site OC par deux métallopro-téases, ADAM10 (a disintegrin and a metalloprotease) et TACE (Figure 1).
Ce dernier clivage est suivi d’un clivage en y donnant ainsi naissance au pep-tide p3 (Figure 1). Dans tous les cas, le clivage par une y-sécrétase pose la question du compartiment cellulaire impliqué, les présénilines étant majoritairement présentes au niveau du réti-culum endoplasmique et du Golgi [7] (→). Les mécanismes de protéo-lyse contrôlée intra-membranaire étaient déjà connus pour des systèmes qui règlent la différenciation cellulaire, le métabolisme lipidique ou la réponse aux protéines chaperons. Dans tous les cas connus, le clivage intramembranaire suit celui du domaine N-terminal. Un des exemples est le SREBP (sterol regularory element binding protein), protéine de type 2 (extrémités N- et C-terminales dirigées vers le cytoplasme) qui s’associe à la protéine SCAP (SERBP cleavage-activa-ting protein). En fonction du taux intracellulaire de stérol, SCAP adresse SREBP du réticulum endoplasmique au Golgi cis-médian où prennent place les deux protéolyses successives. Le fragment de SREBP ainsi libéré gagne le noyau où il active la transcription des enzymes contrôlant l’homéostasie du cholestérol. La protéolyse intramem-branaire de SREBP ne requiert pas les présénilines, contrairement à celle de Ire1, protéine impliquée dans la réponse aux protéines mal repliées présentes dans le réticulum endoplas-mique [8].
(→) m/s 2002, n°2, p. 157
Dans tous les exemples connus de pro-téolyse intramembranaire, qu’elles fassent ou non intervenir des présénilines, le domaine cytoplasmique libéré par ce clivage se détache de la membrane et migre dans le noyau. Dans le cas de l’APP, cette migration nécessite une interaction avec la protéine Fe65 [9]. Les gènes activés dans le noyau par le domaine cytoplasmique restent à définir pour l’APP et ErbB-4. Dans le cas de Notch, les gènes de la famille HES (hairy/enhancer of split) ont été identifiés.
Le clivage intramembranaire d’ErbB-4 et de Notch suit l’interaction d’un ligand avec la partie extracellulaire de ces récepteurs. Les ligands de l’hétéro-dimère Notch conduisant à cette cascade d’événements sont connus : ils font partie de la famille DSL, Delta, Serrate (jagged chez l’homme), Lag2 (drosophile). ErbB-4 n’est clivé au site intramembranaire que s’il est stimulé par la héréguline ou par le TPA (tetra-decanoylphorbol acetate), activateur de la PKC qui mime l’action du ligand (Figure 1). Aucun ligand extracellulaire de l’APP n’a été clairement identifié et la relation entre processus de clivage et fixation d’un tel ligand reste à définir.
Il est possible que la réponse du récepteur varie avec la nature du ligand. Ainsi, l’interaction de Notch avec Win-gless, un autre ligand, entraîne l’acti-vation d’autres gènes et implique probablement un mécanisme de signalisation différent [10]. De même, si on mime un ligand potentiel de l’APP par la fixation d’une immunoglobuline reconnaissant le domaine N-terminal, il en résulte l’induction d’une signalisation via Go [4]. Pour tous ces récepteurs, il sera intéressant d’identifier les gènes spécifiquement activés (ou réprimés) par l’adressage nucléaire de leurs domaines cytoplasmiques, ou de fragments dérivés de ces domaines, et de les placer dans la voie de transduction du signal. Ces travaux permettront de mieux comprendre le rôle physiologique de ce mécanisme de signalisation inattendu mais qui pourrait se révéler plus général que prévu.