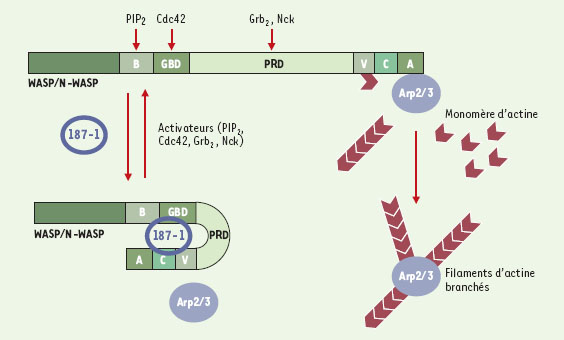
Une cellule n’est jamais immobile, elle se déplace et change de forme. On sait depuis longtemps que le cytosquelette d’actine joue un rôle majeur dans ces processus dynamiques. Ce qui excite maintenant la curiosité des biologistes, c’est de comprendre comment la signalisation contrôle la dynamique du cytosquelette d’actine. Un grand pas a été franchi avec la découverte des protéines de la famille WASP (Wiskott Aldrich syndrome protein). Ces protéines fonctionnent comme des centres d’intégration vers lesquels convergent les signaux activateurs comme le phospho-inositide PIP2, les protéines Grb2 et Nck liées aux récepteurs à activité tyrosine kinase ou la petite protéine G Cdc42. Ces activateurs déplacent l’équilibre confor-mationnel des protéines WASP de la forme fermée inactive vers la forme ouverte active. L’ouverture de la protéine WASP démasque un domaine appelé VCA (Verproline-Cofiline-Acide), qui fixe et active le complexe Arp2/3 dont la fonction est de multiplier les filaments d’actine en créant des branches (Figure 1) (pour revue, voir [1]).
| Figure 1. Mécanisme d’inhibition de N-WASP par le peptide 187-1. PIP2, Cdc42, Grb2 ou Nck se fixent respectivement au domaine basique (B), au domaine de fixation des protéines G (GBD) et au domaine riche en proline (PRD) de N-WASP pour stabiliser sa forme ouverte active. 187-1 stabilise la forme fermée dans laquelle le domaine Verproline-Cofiline-Acide (VCA) de N-WASP ne peut activer le complexe Arp2/3 pour brancher des filaments d’actine. |
Ces récentes découvertes ont accéléré la mise au point de nouvelles approches. Alors que les techniques de vidéo-micro-scopie se développaient à grands pas, on ne voyait pourtant pas apparaître de nouvelles molécules adaptées à l’étude de phénomènes aussi transitoires que le remodelage du cytosquelette d’actine. Les petites molécules sont des outils précieux pour l’étude de phénomènes dynamiques dans des cellules en culture quand elles sont capables de traverser les membranes et d’agir instantanément. Depuis longtemps, des molécules comme la cytocha-lasine D, qui inhibe la polymérisation de l’actine, font merveille pour ce type d’étude. Malheureusement, ces molécules sont rares car ce sont souvent des composés naturels. Aujourd’hui, la synthèse de banques de peptides par chimie combina-toire offre un réservoir illimité de molécules dans lequel les biologistes peuvent puiser pour trouver de nouvelles drogues.
C’est cette approche que le groupe de Kir-schner a utilisé pour rechercher des pep-tides synthétiques capables d’inhiber spécifiquement l’assemblage des filaments d’actine branchés induit par la voie PIP2 [2]. Cette équipe a mis au point un test dans lequel des liposomes sont incubés avec de l’actine marquée à la rhodamine et un extrait d’œuf de xénope qui contient notamment Cdc42, N-WASP et Arp2/3. Ils observent alors l’assemblage de l’actine, induit par la voie PIP2 à la surface des liposomes, grâce à la fluorescence de la rhodamine. Ce test leur a permis de cribler des banques combinatoires de peptides cycliques. Les peptides cycliques sont plus rigides que les peptides linéaires, cela augmente leur affinité pour la cible en diminuant le coût énergétique de leur fixation. Parmi les composés testés, les auteurs ont identifié un peptide appelé 187-1 qui inhibe complètement la polymérisation de l’actine induite par PIP2. L’étude approfondie du mécanisme d’inhibition montre que ce peptide se fixe à N-WASP et stabilise sa conformation inactive (Figure 1). La conformation inactive de N-WASP fait intervenir une interaction intra-moléculaire entre deux domaines de N-WASP pour masquer le domaine VCA qui active Arp2/3. La nature des domaines de N-WASP qui interagissent est actuellement discutée. Il a été proposé que le domaine qui fixe Cdc42 (GBD) interagit avec le domaine acide (A) ou le domaine cofiline (C) de VCA [3–5]. La structure cristalline de N-WASP sous la forme fermée inactive devrait clore le débat. Cependant, il est difficile de cristalliser une protéine en équilibre conformationnel. La structure du complexe N-WASP/187-1 dans lequel N-WASP est bloqué en conformation inactive devrait y remédier.
La caractéristique principale des protéines WASP est de contenir plusieurs domaines cibles pour différentes voies de signalisation. Il serait donc tentant de rechercher des peptides qui inhibent spécifiquement chaque domaine de N-WASP. On disposerait alors d’outils capables de bloquer le branchement des filaments d’actine par une voie de signalisation donnée sans affecter les autres effecteurs de ces voies. Pour cela ,il est nécessaire de prédéfinir la cible d’un peptide. Grâce à des logiciels informatiques, il est actuellement possible de modéliser la structure d’un pep-tide en fonction de sa séquence et de tester son interaction avec un motif structural donné. On peut ainsi obtenir une séquence peptidique où des acides aminés sont déjà déterminés et à partir de laquelle on peut dériver de nombreux pep-tides par synthèse combinatoire. La structure complète de N-WASP n’est pas encore résolue, mais il est possible de s’appuyer sur les structures du domaine GBD de WASP qui forment un complexe avec Cdc42 [6] ou VCA [7].
L’utilisation de peptides en recherche clinique est parfois limitée par la solubilité, la perméabilité aux membranes et la sensibilité à la protéolyse. Cependant, les applications thérapeutiques de peptides inhibiteurs de N-WASP sont réelles. La bactérie Shigella flexneri exprime la protéine IcsA pour recruter la protéine N-WASP de son hôte et se propulser dans la cellule grâce à la polymérisation de l’actine [8]. Un peptide qui inhibe spécifiquement l’interaction entre IcsA et N-WASP pourrait être utilisé pour combattre cette infection. L’inhibition totale de N-WASP par stabilisation de la conformation inactive pourrait fournir une solution à une maladie génétique causée par une mutation dans le domaine GBD qui rend N-WASP constitutivement actif [9](→).
(→) m/s 2001, n°6-7, p. 794