| |
| Med Sci (Paris). 2002 April; 18(4): 448–456. Published online 2002 April 15. doi: 10.1051/medsci/2002184448.Contribution du poisson zèbre à l’étude moléculaire du développement du cœur des vertébrés Didier Y.R. Stainier* and Traduit par Simone Gilgenkrantz Department of Biochemistry andBiophysics, University ofCalifornia, San Francisco,513 Parnassus Avenue, Box 0448,San Francisco, CA 94143-0448,États-Unis |
La biologie du développement a grandement bénéficié de la connaissance des génomes de Drosophila melanoga-ter et de Caenorhabditis elegans. Pourtant, pour étudier le développement de certains organes dont les types cellulaires et les structures n’existent que chez les vertébrés, il fallait trouver un modèle animal appartenant à ce groupe et accessible à des études génétiques. C’est le cas du poisson zèbre (Danio rerio) qui constitue depuis longtemps un excellent modèle en biologie du développement [1] (→) dont l’importance fut décuplée à partir de 1996 grâce à l’utilisation d’une technique extrêmement féconde : la mutagenèse à saturation (exposition de mâles à une mutagenèse chimique), puis croisement sur plusieurs générations suivie d’un criblage des mutants obtenus [2] (→→). Depuis, de nombreux gènes affectés par ces mutations ont été clonés, ce qui a considérablement fait progresser la génétique du développement des vertébrés et par conséquent de l’homme. (→) m/s 2002, n°2, p. 193 (→→) m/s 1997, n°1, p. 132 A partir d’une revue publiée dans Nature Reviews Gene-tics [3], nous proposons ici aux lecteurs de médecine/sciences une synthèse des études génétiques récentes qui ont contribué à une meilleure connaissance du développement du cœur chez le poisson zèbre. Le cœur est le premier organe fonctionnel chez l’embryon. En 1995, C. Grépin et al. présentaient dans médecine/sciences l’ensemble des événements de la morphogenèse cardiaque qui débutepar la formation d’un vaisseau sanguin spontanément contractile pour aboutir à un organe doté de quatre cavités et de valves réglant le flux sanguin. Étaient aussi mentionnées les dernières données connues à l’époque sur les agents moléculaires intervenant dans la différenciation cellulaire et la morphogenèse [4]. Bien que le poisson zèbre soit un nouveau venu parmi les nombreux modèles animaux ayant contribué à la compréhension du développement du cœur, il apporte des données précieuses sur toutes les étapes du développement cardiaque. En effet, la fécondation externe, le développement rapide de l’embryon, sa transparence, permettent une observation précise du développement des organes internes. En outre, du fait de sa petite taille, il n’est pas complètement dépendant de son système cardiovasculaire et peut survivre plusieurs jours en l’absence totale de circulation sanguine grâce à la diffusion passive de l’oxygène. Il est donc loisible d’observer en détail des mutants atteints de malformations cardiovasculaires sévères, impossibles à voir chez des oiseaux ou des mammifères. Pour donner un ordre d’idées de la chronologie comparative du développement, rappelons que les deux premiers jours de vie de l’embryon de poisson zèbre correspondent à 12 jours de vie embryonnaire pour la souris et à 35 jours de l’embryon humain. Durant ce laps de temps, grâce aux moyens d’approche à notre disposition, les cascades d’événements dirigeant la morphogenèse du cœur de ce poisson de 3 cm, bien connu des aquariophiles, ont pu être explorées en détail. |
Différenciation des précurseurs myocardiques (du Magicien d’Oz au Dr Faust) Bien que les cellules cardiaques possèdent de nombreuses caractéristiques phénotypiques analogues à celles du muscle squelettique, elles n’ont pas la même origine. Elles procèdent de la plaque mésodermique latérale antérieure, tandis que les cellules musculaires squelettiques proviennent du mésoderme para-axial. En outre, les gènes de contrôle sont différents : ainsi, les gènes des facteurs de différenciation musculaire tels que MyoD, Myogénine, Myf 5 ou MRF4 ne sont pas exprimés dans les cellules cardiaques. Du reste, la nature spontanément contractile du tube cardiaque primitif le rapproche plus du muscle lisse que du muscle squelettique, ce que sembleraient confirmer des résultats récents. Chez la drosophile, la mutation tinman (par référence au Magicien d’Oz qui est en étain et n’a pas de cœur) a pour conséquence une absence de formation de cœur : le gène tinman code pour un facteur de transcription à homéoboîte appartenant à la famille Nk2. Un autre membre de cette famille, nkx2.5, s’exprime dans les cellules cardiaques des vertébrés de toutes les espèces étudiées jusqu’à présent. Lorsqu’il est muté, il s’ensuit chez l’homme et chez la souris des malformations cardiaques moins sévères que chez la drosophile, probablement parce que d’autres gènes de la famille Nk2 suppléent partiellement l’absence de nkx2.5 (fonctionnel), comme le suggèrent les expériences sur l’embryon de xénope [5]. Du fait de sa conservation et de son rôle essentiel dans la formation du cœur, tinman/nkx2.5 a suscité un grand intérêt, aboutissant à des études très importantes du contrôle de son expression chez la drosophile et l’embryon de poulet. L’ensemble des résultats montre que le DPP (decapentaplegic) et ses homologues chez les vertébrés, les protéines de morphogenèse osseuse (BMP), sont impliqués dans cette régulation [6]. Chez le poisson zèbre, 4 mutations ont permis d’isoler des gènes réglant l’expression de nkx2.5 dans les précurseurs myocardiques : ce sont les mutations swirl (swr) [7], one eyed pinhead (oep) [8] faust (fau) [9] et acerebellar (ace) [10]. swr correspond à bmp2b, oep code pour un membre de la famille EGF-CFC (epidermal growth factor-cripto/FRL1/cryptic), essentiel dans la voie de signalisation Nodal. fau code pour le facteur de transcription à doigt de zinc Gata5, et ace code pour Fgf8. fau/gata5, nous le reverrons par la suite, joue un rôle décisif dans le contrôle de la différenciation myocardique et s’exprime du début de la gastrulation jusqu’à l’apparition des battements cardiaques. On lui doit le déclenchement de l’expression de nkx2.5, alors que ace/fgf8 contribue au maintien de cette expression. Quant à Bmp, sa voie de signalisation intervient dans la formation du mésoderme tandis que celle de Nodal agit à la fois sur le mésoderme et l’endoderme. Agissent-ils directement sur nkx2.5, ou indirectement, par exemple en contrôlant l’expression de gata5 ? L’analyse de mutants swr/bmp2b et oep, ainsi que l’étude de la surexpression de gata5 devraient pouvoir nous fournir une réponse. Ainsi, dans des modèles divers, les facteurs Bmp, Nodal, Fgf et Gata interviennent dans la différenciation myocardique. Les études en cours sur le poisson zèbre devraient nous renseigner sur les interactions existant entre les régulateurs de nkx2.5, ainsi que sur d’autres voies probablement impliquées dans cette différenciation. Car, comme Charles Kimmel l’avait souligné il y a un quart de siècle, le poisson zèbre permet de réaliser des études de gain de fonction (comme la grenouille), et aussi de perte de fonction (comme la souris), et la capacité de combiner ces deux approches dans un même modèle devrait permettre une analyse rapide de la fonction des gènes et de leur place dans la cascade de signalisation. |
Différenciation des précurseurs endocardiques (un son de cloche) Alors que la différenciation myocardique a fait l’objet de nombreux travaux, la différenciation des cellules endothéliales a été moins étudiée. Les cellules endothéliales qui tapissent les parois vasculaires (elles sont appelées cellules endocardiques dans les cavités cardiaques), n’ont pas leur équivalent chez la drosophile ou chez C. elegans, ce qui a peut-être limité initialement les travaux. Chez le poisson zèbre, la mutation cloche, qui bloque la différenciation des cellules endothéliales et des cellules sanguines à un stade très précoce fournit un bon moyen d’étude. Le phénotype cloche est comparable à celui des mutants murins pour vegfR2 (vascular endothelial growth factor receptor 2), connu aussi sous le nom de Flk1 (fetal liver kinase). Celuici code pour le récepteur d’une protéine sécrétée qui joue un rôle essentiel dans la formation du revêtement intimal du système vasculaire [11]. Le gène cloche agit en amont de vegfR2 sur la différenciation endothéliale, et ce, de façon cellule autonome [12, 13]. Malheureusement, les tentatives de clonage positionnel de cloche ont été perturbées par sa localisation très télomérique. Toutefois, des études de gain de fonction chez les mutants cloche ont aidé à déterminer la cascade des gènes intervenant dans la différenciation du système endothélial. cloche semble agir en amont de hhex et de scl, deux gènes codant pour des facteurs de transcription exprimés dans les hémangioblastes, qui sont considérés comme les précurseurs des deux lignages, hématopoïétique et endothélial. Hhex et scl règlent ensuite l’expression de gènes tels que vegfR2 et gata1 dans les cellules endothéliales et sanguines. L’importance des cellules endothéliales dans de nombreux processus pathologiques humains (thromboses vasculaires, croissance tumorale) en font un enjeu d’études considérable [1]. L’angiogenèse vasculaire fait partie du nouveau programme de recherche en cours, fondé sur un second criblage à grande échelle des mutants (Tübingen, Allemagne). |
Migration des cellules précurseurs (l’association de Casanova avec Bonnie and Clyde) La migration des cellules précurseurs se fait en plusieurs étapes, d’abord vers les régions antéro-latérales, à partir desquelles elles convergent vers la ligne médiane pour former le tube cardiaque primitif. Plusieurs mutations affectent cette migration et aboutissent à la formation de deux cœurs bilatéraux. Chez la souris, ce phénomène de cardia bifida peut résulter soit de mutations de Mesp1 qui ralentissent la migration vers les régions antéro-latérales, soit de celles du gène de la fibronectine qui affectent la migration sans toucher à la différenciation. Chez le poisson zèbre, huit mutations - correspondant à des gènes dont six ont été clonés - concernent la migration : hands off (han), casanova (cas), bonnie and clyde (bon), faust (fau), oep, miles apart (mil), two of heart (toh) et natter (nat) (Tableau I).  | Tableau I. Mutations affectant le cœur du poisson zèbre. |
On peut les classer en trois groupes selon leur action. - Le premier contrôle la formation de l’endoderme comme cas [15] et bon qui code pour une protéine à homéodomaine de type Mix [16]. Or, il semble que l’endoderme conditionne la migration des cellules myocardiques vers la ligne médiane, sans qu’on en connaisse encore les modalités. - Le deuxième comprend les gènes contrôlant la différenciation myocardique comme Han qui code pour Hand2, une protéine de type bHLH, exprimée dans les cellules myocardiques en migration. Nous verrons que Han/Hand2 règle aussi la morphogenèse myocardique (→). (→) m/s 1998, n°6-7, p. 802 Le gène fau/gata5, quant à lui, contrôle à la fois les cellules endodermiques et myocardiques et appartient donc aux deux premiers groupes. - La troisième catégorie comporte les gènes contrôlant la migration sans agir sur la différenciation comme miles apart [17]. Ce gène, isolé récemment, représente une des contributions les plus originales du poisson zèbre à la compréhension de la formation du cœur. Il code pour un récepteur couplé à une protéine G qui se lie aux lysosphingolipides. Les lysosphingolipides, comme la sphingosine-1-phosphate (S1P), qui semble être le principal ligand de Miles apart, ont été antérieurement associés à la prolifération, à la différenciation et à la survie cellulaire. En outre, il est certain que la S1P est aussi impliquée dans la migration des cellules. On aurait donc affaire à une molécule agissant comme signal intra- et extracellulaire. Une autre surprise est que miles apart est requis de façon non autonome pour la migration des cellules myocardiques, mais on ignore encore quelles cellules requièrent miles apart. Il a été montré que les lipides sont impliqués dans la migration cellulaire chez la drosophile et, plus généralement, chez les invertébrés. Par exemple, les cellules germinales primordiales ne migrent pas dans les régions où s’exprime le gène Wunen (qui code pour une phosphatase de type 2 de l’acide phosphatidique). On pouvait donc en déduire soit que Wunen produisait une substance qui empêche la migration, soit qu’il dégradait une substance qui la favorise. Mais nos travaux sur le poisson zèbre, et le fait que S1P est un substrat pour la phosphatase Wunen suggèrent une autre hypothèse : pendant la migration des cellules germinales primordiales, Wunen dégraderait S1P qui, sans être elle-même une substance attractive ou répulsive, permettrait la libération d’une substance attractive ou la production d’un environnement facilitant la migration. Si cette hypothèse est correcte, on peut imaginer qu’un récepteur de S1P interviendrait dans la régulation de la migration des cellules germinales primordiales chez les embryons de drosophile. Quant à miles apart, bien des questions subsistent : où et quand apparaît-il pour régler la migration des cellules myocardiques vers la ligne médiane ? Quels sont les agents qui agissent en aval ? Sont-ils transcriptionnels ou posttranscriptionnels ? Ont-ils une action incitative ou permissive ? Une nouvelle mutation, two of hearts, qui provoque un phénotype similaire, aidera peut-être à y répondre. L’intérêt de ces travaux dépasse la simple embryologie du cœur car la S1P est également impliquée dans d’autres types de migration qui conduisent en particulier à la cicatrisation des plaies [18]. D’autres voies existent sans aucun doute dans la migration des cellules cardiaques. La mutation silberblick montre que le produit du gène, une protéine de signalisation cellulaire, Wnt11, entraîne des mouvements convergents pendant la gastrulation. Encore un exemple de l’utilité du poisson zèbre dans la connaissance des voies de migration cellulaire. |
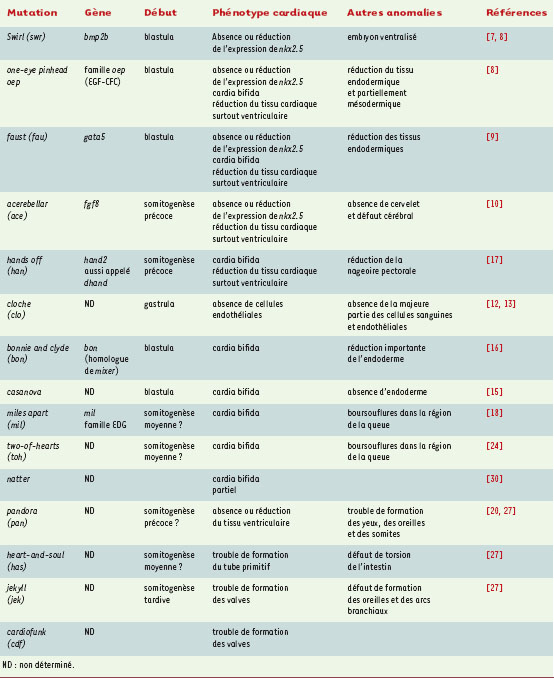
Formation du tube cardiaque primitif (cœur et âme) Une fois réunies sur la ligne médiane, les cellules cardiaques forment le tube cardiaque linéaire. Même si la morphogenèse varie selon les espèces, il y a tout lieu de penser que les principaux gènes morphogénétiques sont les mêmes chez tous les vertébrés [19]. Chez le poisson zèbre, un des événements clés est l’assemblage du cône cardiaque, déjà bien étudié : l’apex deviendra la terminaison artérielle (ventriculaire) et la base la terminaison veineuse (auriculaire). Le cône, d’abord orienté selon un axe dorso-ventral, se réoriente rapidement selon un axe antéro-postérieur (Figure 1). Cette réorientation qui amène la partie veineuse à gauche de la ligne médiane s’effectue sous l’action de forces physiques qui dépendent ou non de l’organe. Dans la mutation heart and soul (has), le cône ne peut se réorienter. Le fait que la mutation has provoque aussi une atteinte de l’épithélium pigmentaire de la rétine, et empêche la rotation de l’intestin, prouve que l’action morphogénétique de ce gène porte sur différents épithéliums. Il reste encore à identifier, toutefois, les autres acteurs intervenant dans ce processus complexe de la rotation du cœur. 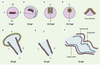 | Figure 1. Développement du cœur du poisson zèbre. 1. Cinq heures après la fécondation (hpf), les cellules progénitrices sont situées dans les régions ventrales et latérales de l’embryon. 2. Elles convergent vers l’axe embryonnaire et atteignent leur destination au stade de 5 somites. 3. Au stade de 13 somites, les précurseurs myocar-diques subissent une ségrégation en deux groupes : pré-ventriculaire et pré-auriculaire. 4. A 19 hpf, les précurseurs myocardiques fusionnent dans la partie postérieure pour former une structure en fer à cheval. Vers 19,5 hpf, le fer à cheval se transforme en un cône avec les cellules ventriculaires au centre et à l’apex (en rouge) et les cellules auriculaires à la base (en jaune). Les cellules endocardiques sont alignées à l’intérieur du cône (en bleu). 5.Le cône se téléscope pour former un tube, en commençant par l’extrémité ventriculaire. 6.Aux alentours de 24 hpf, le tube s’allonge dans l’axe antéro-postérieur avec l’extrémité auriculaire à gauche de la ligne médiane. Puis les deux cavités se forment. 7.Vers 36 hpf, le cœur entreprend sa torsion et vers 48 hpf, les valves fonctionnelles se forment. A : antérieure, AP : pôle animal ; D : région dorsale ; P : région postérieure ; V : région ventrale ; VP : pôle végétatif. R : droit ; L : gauche. |
|
Différenciation terminale des cellules myocardiques (touche pas à mon cœur) Dès la formation du tube primitif, et en même temps qu’elles se contractent, les cellules myocardiques expriment des gènes associés à leur différenciation terminale. En 6 heures, ces cellules sont passées de l’expression de nkx2.5 à celle de gènes codant pour des protéines du sarcomère cardiaque : troponine T, tropomyosine et myosine. Bien que la plupart des travaux proviennent d’études de la transcription chez la souris, l’observation des mutants de poisson zèbre fau/gata5 a révélé l’importance de ce gène dans ce processus. Les mutants ont en effet une expression très réduite de ces gènes sarcomériques. Inversement, la surexpression de fau-gata5 entraîne non seulement une expression ectopique dans d’autres cellules, mais aussi l’apparition de structures contractiles ectopiques. En revanche, les mutants han/hand2 ont très peu de cellules myocar-diques, sans que la quantité des produits exprimés soit diminuée. Il semble donc que fau/Gata5 agisse directement sur les promoteurs des gènes de la myosine cardiaque tandis que han/hand2 intervient sur la genèse et la survie des cellules myocardiques. Les autres gènes de facteurs de transcription exprimés pendant cette période comprennent entre autres mef2, gata4 et gata6, tbx5 et hrt. Beaucoup de ces gènes ont été analysés chez la souris [20], et pour ce qui concerne tbx5, chez le xénope par interférence dominante [21]. Dans les voies moléculaires qui règlent la différenciation des cellules myocardiques, la chronologie de la cascade d’intervention peut être élucidée à l’aide d’animaux transgéniques, mais aussi par des études de gain ou de perte de fonction chez le poisson zèbre ou dans d’autres systèmes appropriés à de telles études. |
Formation des cavités cardiaques (pandore) Les différences morphologiques entre les cavités cardiaques ne deviennent apparentes qu’après la formation du tube primitif alors que les événements moléculaires sous-jacents ont débuté bien avant [22]. Chez le poulet et le poisson zèbre, l’acide rétinoïque a été impliqué dans la formation des cavités, implication retrouvée par la suite chez la souris (→). Dans le modèle murin, l’acide rétinoïque favorise le développement des oreillettes au détriment des ventricules. (→) m/s 1995, n°1, p. 132 Les études génétiques chez le poisson zèbre ont montré combien le ventricule était sensible aux lésions génétiques. Sur 21 mutations répertoriées pour affecter le développement des cavités cardiaques (Encadré 1) (Figure 2), 20 touchent le ventricule, ce qui laisse supposer que le développement auriculaire se fait plus par défaut, alors que celui du ventricule nécessite de nombreux gènes [23]. Parmi les gènes dont les mutations affectent préférentiellement le ventricule, on trouve Oep, fau/gata5, ace/fgf8, han/hand2 et pandora.
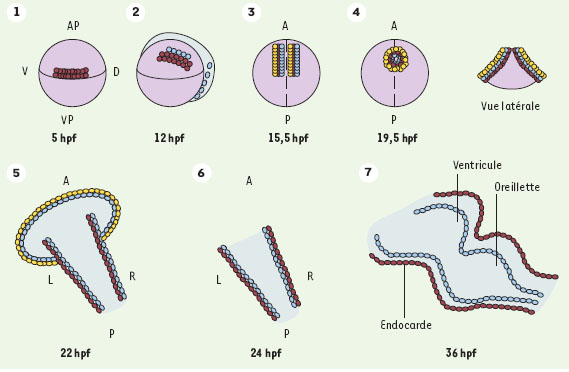
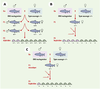 | Figure 2. Criblage des mutations affectant le développement du poisson zèbre. A. Les mâles subissent une mutagenèse (N-éthyl-N-nitroso-urée) et sont croisés avec des femelles sauvages pour donner la génération F1. A partir des ces fondateurs F1, des familles F2 sont élevées et croisées pour mettre en évidence des mutations récessives (en rose) dans 25 % des F3. B.En utilisant du sperme inactivé par les UV, on obtient des embryons haploïdes gynogénétiques des femelles F1 (50 % en F2), et il n’est pas nécessaire d’avoir recours à une nouvelle génération pour obtenir une homozygotie. C. Si les femelles sont en mosaïque (mélange de cellules de type sauvage et de cellules hétérozygotes), on obtient des mutants en proportion variable (ici, 1/8). Les sujets en mosaïque F1 sont produits par fécondation avec du sperme de mâles aussitôt après exposition à ENU. Ils peuvent comporter beaucoup plus de mutations que les hétérozygotes non mosaïques, probablement parce que les cellules sauvages dans chaque tissu compensent la fragilité des cellules hétérozygotes. |
|
Encadré 1.
La boîte à outils du poisson zèbre. |
 L’absence de gène Hand2 fonctionnel aboutit, chez le poisson zèbre, a un cardia bifida alors que, chez la souris, il n’entraîne qu’une hypotrophie du ventricule droit, probablement du fait de l’existence, chez cette espèce, d’un second gène, Hand1, qui doit être au moins partiellement redondant. Cela démontre qu’il faut analyser les fonctions des gènes chez différentes espèces de vertébrés, car la fonction d’un gène dans certaines espèces peut être partiellement masquée par une redondance. Comme celle-ci est souvent différente chez des espèces éloignées, la meilleure façon de tester l’action d’un gène est d’explorer les phénotypes avec perte de fonction dans ces différentes espèces de vertébrés. Il reste encore à trouver chez le poisson zèbre les marqueurs spécifiques des précurseurs ventriculaires et auriculaires. Le grand nombre de mutations affectant le développement des cavités cardiaques devrait nous permettre de mieux connaître le processus. L’étude du gène pandora, dont la mutation entraîne une forte diminution des tissus ventriculaires lorsqu’il est muté, devrait être particulièrement informative [26]. |
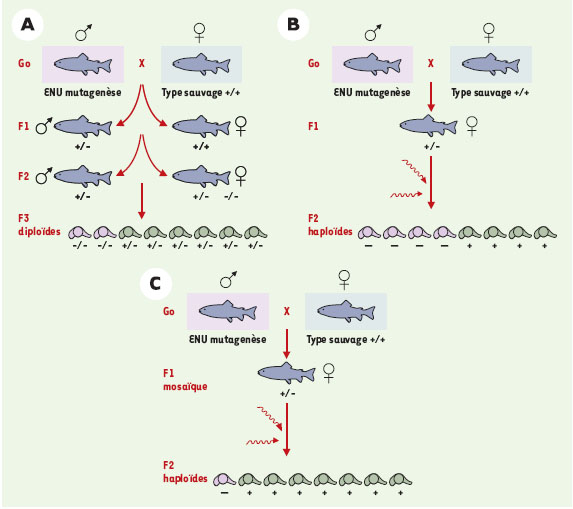
Torsion du tube cardiaque et formation des valves (en attendant jekyll) Le positionnement gauche de la partie veineuse du cœur et la rotation ultérieure du tube cardiaque sont les premières manifestations de l’asymétrie gauche/droite qui se produit pendant l’embryogenèse. La génétique du poisson zèbre a confirmé l’importance de certaines structures de la ligne médiane comme la notochorde, ainsi que celle de diverses voies de signalisation, comme la voie Nodal dans l’asymétrie gauche/droite. Mais en ce qui concerne le cœur lui-même, on ne connaît pas encore les mécanismes spécifiques qui aboutissent à sa rotation. Étant donné que l’axe gauche/droit est probablement mis en place bien avant la gastrulation, le poisson zèbre, si précocement accessible et manipulable, est bien adapté à l’étude de cette organisation axiale. Le développement des valvules entre les cavités cardiaques permet au sang d’être éjecté dans le système artériel plutôt que de refluer dans l’oreillette. Les valvules sont essentielles à la fonction de pompe du cœur, et nombreuses sont les atteintes valvulaires dans la pathologie cardiaque humaine congénitale et acquise. Les études faites chez le poulet, et plus récemment chez la souris, ont mis en évidence des molécules intervenant dans ce processus ainsi que les mécanismes de leurs interactions. εn réponse à un signal endocardique, les cellules endothéliales situées à la jonction auriculo-ventriculaire prennent un caractère mésenchymateux, se délaminent et migrent dans la gelée cardiaque. Là, elles forment un coussin endocardique qui est ensuite remodelé en valve (Figure 3). Chez la souris, plusieurs mutations affectent la formation des valves, en particulier dans les gènes codant pour des protéines de jonction cellulaire : versicane, synthase-2 de l’acide hyaluronique et vinculine. Dans le criblage initial à grande échelle, de nombreux candidats ont été pressentis mais peu ont été isolés. Jekyll et cardiofunk sont dès maintenant en cours d’analyse.  | Figure 3. Torsion du tube cardiaque et formation des valves. |
Les dernières étapes du développement du cœur comportent la formation des septums des cavités cardiaques, la formation et la constitution des septums du système artériel, la différenciation d’un système de conduction spécifique, la différenciation de l’épicarde et la formation des artères coronaires. Le cœur du poisson zèbre n’est pas pourvu de septums. Ce n’est donc pas un bon modèle pour l’étude des dernières étapes du développement cardiaque, quoiqu’il serait intéressant de comprendre par quel mécanisme il diffère du cœur humain. Il pourrait cependant servir à l’étude du système de conduction dont les anomalies sont cause de mort subite. Des études descriptives récentes sur les étapes terminales de la maturation du cœur du poisson zèbre viennent d’être publiées [25]. Elles mettent en lumière les questions auxquelles ce puissant système génétique devrait permettre de répondre. |
Notre connaissance de l’organogenèse repose sur un ensemble d’études de différents modèles animaux. Le poisson zèbre, avec ses nombreux gènes de développement déjà identifiés et avec sa fabuleuse réserve de mutants, devrait susciter de nombreux travaux de recherche. Grâce aux morpholinos (Encadré 2), le passage de l’identification des gènes à leur analyse fonctionnelle devrait s’avérer encore plus rapide. En y ajoutant les analyses de perte et de gain de fonction,l’ensemble des voies de signalisation pourra être traduit en comportement cellulaire et en morphogenèse. Et dans cette finalisation de l’embryogenèse, le poisson zèbre aura joué un rôle mémorable. D’ores et déjà, l’étude de la cardiogenèse nous a apporté deux éléments essentiels : la capacité de contrôler le devenir des cellules souches en cellules myocardiques et endocardiques et la connaissance moléculaire des mécanismes de formation des cardiopathies congénitales. Désormais, l’espoir de pouvoir un jour les corriger n’est plus une utopie.
| Encadré 2. Technologies émergentes. |

|
1. Ekker M, Akimenkko M. Le poisson zèbre (danio rerio), un modèle en biologie du développement. Med Sci 1991; 7 : 553–60. 2. L’ensemble du numéro. Development 1996; 123 : 1–460. 3. Stainier DY. Zebrafish genetics and vertebrate heart formation. Nat Rev 2001; 2 : 39–48. 4. Grépin C, Durocher D, Nemer M. Le cœur : un programme unique de transcription et de différenciation musculaire. Med Sci 1995; 11 : 395–405. 5. Grow MW, Krieg PA. Tinman function is essential for vertebrate heart development: elimination of cardiac differentiation by dominant inhibitory mutants of the tinman related genes, XNkx2-3 and XNkx2-5. Dev Biol 1998; 204 : 187–96. 6. Schlange T, Andree B, Arnold HH, Brand T. BMP2 is required for early heart development during a distinct time period. Mech Dev 2000; 91 : 259–70. 7. Nguyen VH. Ventral and lateral regions of the zebrafish gastrula, including the neural crest progenitors are established by a bmp2b/swirl pathway of genes. Dev Biol 1998; 199 : 93–110. 8. Schier AF, Neuhauss SC, Helde KA, Talbot WS, Driever W. The one-eyed pinhead gene functions in mesoderm and endoderm formation in zebrafish and interacts with no tail. Development 1997; 124 : 327–42. 9. Zhang J, Talbot WS, Schier AF. Positional cloning identifies zebrafish One-eyed pinhead as a permissive EGF-related ligand required during gastrulation. Cell 1998; 92 : 241–51. 10. Gritsman K, Zhang J, Cheng S, et al. The EGF-CFC protein One eyed pinhead is essential for Nodal signaling. Cell 1999; 97 : 121–32. 11. Sjhalaby F, Rossant J, Yamaguchi T P, et al. Failure of blood island formation and vasculogenesis in Flk-1 deficient mice. Nature 1995; 376 : 62–6. 12. Liao W, Bisgrove BW, Sawyer H, et al. The zebrafish gene cloche acts upstream of a flk-1 homologue to regulate endothelial cell differentiation. Development 1997; 124 : 381–9. 13. Stainier DYR, Weinstein BM, Detrich HW, Zon LI, Fishman MC. Cloche, an early acting zebrafish gene is required by both endothelial and hematopoietic lineages. Development 1995; 121 : 3141–50. 14. Vandenbunder B, Fafeur V, Wernert N, Stehelin D. Analyse moléculaire de l’angiogenèse tumorale. Med Sci 1994; 10 : 516–27. 15. Alexander J, Rothenberg M, Henry GL, Stainier DYR. Casanova plays an early and essential role in endoderm formation in zebrafish. Dev Biol 1999; 215 : 343–57. 16. Kikuchi Y, Trinh L, Reiter JF, Alexander A, Yelon D, Stainier DYR. The zebrafish bonnie and clyde gene encodes a Mix family homeodomain protein that regulates the generation of endodermal precursors. Genes Dev 2000; 14 : 1279–89. 17. Yelon D, Ticho B, Halpern M, et al. The bHLH transcription factor hand2 plays parallel role in zebrafish heart and in pectoral fin development. Development 2000; 127 : 2573–82. 18. Peyrieras N, Strähle U, Rosa F. Conversion of zebrafish blastomere to an endodermal fate by TGFbeta-related signaling. Curr Biol 1998; 8 : 783–6. 19. Pyne S, Pyne NJ. Sphingosine 1-phosphate signalling in mammalian cells. Biochem J 2000; 349 : 385–402. 20. Yelon D, Horne SA, Stainier DY. Restricted expression of cardiac myosin genes reveales regulated aspects of heart tube assembly in zebrafish. Dev Biol 1999; 214 : 23–37. 21. Lin Q, Schwartz J, Bucana C, Olson EN. Control of mouse cardiac morphogenesis and myogenesis by transcription factor MEF2C. Science 1997; 276 : 1404–7. 22. Hob ME, Thomsen GH. Tbx5 is essential for heart development. Development 1999; 126 : 1739–51. 23. Yutzey KE, Rhee JT, Bader D. Expession of atrial specific myosin heavy chain AMHC1 and the etablishment of anterior polarity in the developing chicken heart. Development 1994; 120 : 171–83. 24. Alexander J, Stainier DY, Yelon D. Screening mosaic F1 females for mutations affecting zebrafish heart and induction and patterning. Dev Genet 1998; 33 : 288–99. 25. Xavier-Nato J, Shapiro MD, Houghton L, Rosenthal N. Sequential program of retinoic acid synthesis in the myocardial and the epicardial layers of the developing avian heart. Dev Biol 2000; 219 : 129–41. 26. Hu N, Sedmera D, Yost HJ, Clark EB. Structure and function of the developing zebrafish heart. Anat Rec 0; 260 : 148–57. 27. Stainier DY, Fouquet B, Chen JN, et al. Mutations affecting the formation and the function of the cardiovascular system in zebrafish embryo. Development 1996; 102 : 285–92. 28. Nasevicius A, Ekker SC. Effective targeted gene « knockdown » in zebrafish. Nat Genet 2000; 26 : 216–20. 29. Scheer N, Campos-Ortega JA. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mech Dev 1999; 80 : 153–8. 30. Chen JN, Haffter P, Odenthal J, et al. Mutations affecting the cardiovascular system and other organs in zebrafish. Development 1996; 123 : 293–302. 31. Halloran MC, Sato-Maeda M, Warren JT, et al. Laser-induced gene expression in specific cells of transgenic zebrafish. Development 2000; 127 : 1953–60. |