| |
| Med Sci (Paris). 2002 April; 18(4): 474–480. Published online 2002 April 15. doi: 10.1051/medsci/2002184474.Aurora-A, -B et -C : À l’aube d’une nouvelle connexion entre l’amplification des centrosomes, l’aneuploïdie et le cancer ? Simon Descamps and Claude Prigent* Groupe Cycle Cellulaire, UMR 6061 Génétique et Développement, Cnrs - Université de Rennes 1,IFR 97 Génomique Fonctionnelle et Santé, Faculté de Médecine, 2, avenue du Professeur Léon Bernard, CS 34317, 35043 Rennes Cedex, France |
Les cellules cancéreuses présentent très souvent des anomalies chromosomiques qui portent sur leur structure ou sur leur nombre. L’anomalie de nombre, que l’on appelle aneuploïdie, est, dans de très nombreux cas, un facteur de mauvais pronostic. Il peut s’agir soit d’un événement très précoce, et donc un acteur de la tumorigenèse, soit d’un événement tardif en relation avec l’agressivité de la tumeur. L’exemple du cancer de la vessie a permis de montrer que la présence de cellules aneuploïdes dans l’urine indique, certes, la présence de carcinomes [1], mais ne peut être utilisée comme seul critère diagnostique. Les cellules aneuploïdes sont en effet caractéristiques des tumeurs de grade III, mais ne sont présentes que dans deux tiers des tumeurs de grade II et ne sont pas détecées dans celles degrade I [2]1. Les cancers du sein et de la vessie ont été les premiers pour lesquels des mesures de corrélation entre la ploïdie des cellules et la tumorigenèse ont été effectuées [3]. L’aneuploïdie est associée à un mauvais pronostic dans les cancers du sein et les cancers colorectaux [4]. Des données récentes ont révélé qu’une famille de protéine kinases, les protéines aurora, sont surexprimées dans ces mêmes pathologies cancéreuses. Ces protéines, dont deux sont associées aux centrosomes, semblent jouer un rôle important dans le contrôle de la ploïdie. |
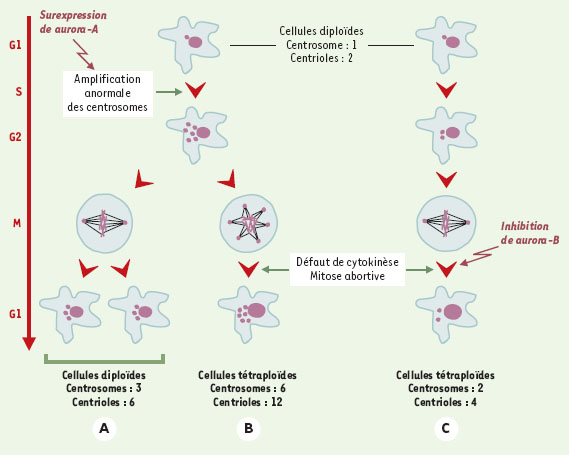
Aneuploïdie et centrosomes La cellule dispose de plusieurs voies pour devenir aneu-ploïde. D’une manière très simpliste, elle peut répliquer son ADN sans effectuer de mitose. Elle peut également effectuer des mitoses anormales du fait soit d’une ségrégation inégale des chromosomes, soit d’un défaut de cytokinèse, c’est-à-dire de séparation des deux cellules filles. Si la cellule ne possède plus le contrôle lui signalant que la mitose est anormale, elle poursuit alors sa division pour produire des cellules aneuploïdes. Le centrosome semble jouer un rôle important dans le contrôle de la ploïdie des cellules filles : comme l’ADN, il est dupliqué une seule fois par cycle cellulaire, un processus qui est, comme pour l’ADN, sous la dépendance du point de restriction G1/S [5, 6]. Avant son entrée en mitose, la cellule doit donc contenir deux lots d’ADN et deux centrosomes (soit quatre centrioles). Les deux centrosomes mitotiques sont connus depuis longtemps pour être les centres organisateurs des microtu-bules permettant la mise en place du fuseau bipolaire de microtubules qui assure la ségrégation des chromosomes (→). Des travaux récents ont révélé une nouvelle fonction du centrosome qui est sous la dépendance d’un seul des deux centrioles et se situe en fin de mitose [7]. Un des centrioles se déplace vers le fuseau intermédiaire en télophase pour provoquer la cytokinèse (séparation des deux cellules filles par rupture du pont cytoplasmique). La présence d’anomalies des centrosomes peut donc, soit par un défaut de formation du fuseau mitotique, soit par un défaut de cytokinèse, provoquer une aneuploïdie (Figure 1). Une aneuploïdie associée à un nombre anormal de centrosomes est très souvent rencontrée dans les cellules tumorales. Ainsi, dans les cancers du pancréas et du sein, des anomalies de taille, de forme ou de nombre des centrosomes sont fréquemment observées [8, 9]. Elles conduisent à la formation de fuseaux multipolaires, à des mitoses abortives ou à une mauvaise ségrégation des chromosomes (Figure 1). (→) m/s 1999, n°1, p. 122
 | Figure 1. Anomalies des centrosomes et aneuploïdie. A et B. Duplication anormale des centrosomes avant l’entrée en mitose (sont représentés ici six centrosomes). A. Si les centrosomes s’organisent pour former un fuseau bipolaire de microtubules fonctionnels, la ségrégation des chromosomes est normale et donne naissance à deux cellules filles parfaitement diploïdes mais contenant plus d’un centrosome (donc plus de deux centrioles). B. Les centrosomes ne s’assemblent plus en fuseau bipolaire, les fuseaux sont multipolaires, incapables d’assurer la cytokinèse, et la cellule obtenue après une mitose avortée est tétraploïde et contient plus de deux centrosomes (plus de quatre centrioles). C. En l’absence d’anomalie du nombre de centrosomes, un défaut de cytokinèse entraîne la formation d’une cellule tétraploïde contenant deux centrosomes (quatre centrioles). Les données récentes montrent que la surexpression de aurora A provoque une amplification des centrosomes et que l’inhibition de aurora B provoque une inhibition directe de la cytokinèse. |
Il existe une corrélation positive significative entre le nombre d’anomalies des centrosomes et le niveau du déséquilibre chromosomique. En outre, il a été montré qu’une activité anormale (surexpression ou absence) des protéine kinases aurora provoque l’apparition d’anomalies de type aneuploïdie et une amplification des centrosomes [10]. |
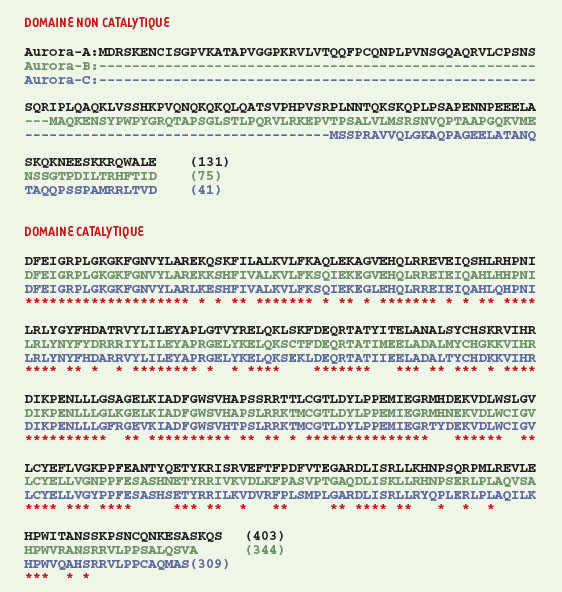
Les trois kinases aurora humaines La famille des protéine kinases aurora doit son nom à un gène de drosophile dont certains mutants présentent un défaut de séparation des centrosomes [11]. Trois gènes différents et un pseudogène ont été identifiés dans le génome humain [12]. Ces trois gènes codent pour des protéine kinases possédant un domaine catalytique très conservé (jusqu’à 80 % d’identité) et un domaine non catalytique situé dans la région N-terminale et très variable en taille et en séquence (Figure 2). Les trois kinases aurora humaines différent par leurs localisations subcellulaires et leurs fonctions [13].  | Figure 2. Alignement des séquences en acides aminés des trois kinases humaines aurora. Aurora-A en noir, aurora-B en vert et aurora-C en bleu. Les acides aminés conservés dans les trois domaines catalytiques sont indiqués par des astérisques rouges. |
|
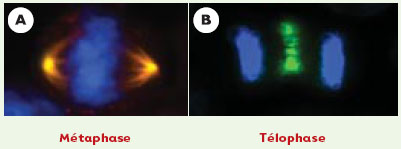
Aurora A est codée par le gène STK15, localisé en 20q13, région correspondant à un amplicon fréquemment rencontré dans les cancers du sein et les cancers colorectaux [14, 15]. La présence de cet amplicon est corrélée à une augmentation de l’expression de l’ARNm, de la protéine aurora-A et de son activité catalytique. Par ailleurs, certaines cellules tumorales, dont l’activité kinase de aurora-A est accrue, ne possèdent pas l’amplicon 20q13, ce qui suggère l’existence d’anomalies du contrôle de la transcription, de la traduction ou des modifications post-traductionnelles. La surexpression ectopique de la protéine kinase humaine aurora-A dans des cellules humaines MCF10A conduit à un phénotype transformé stable [15], s’accompagnant d’une amplification des centrosomes et d’une aneuploïdie. L’inhibition de son expression entraîne quant à elle la formation de fuseaux monopolaires anormaux. Aurora-A est localisée au niveau des centrosomes et aux pôles du fuseau mitotique, elle contrôle la mise en place et la stabilité de ce fuseau et donc la ségrégation des chromosomes [12] (Figure 3A).  | Figure 3. Localisation des kinases aurora-A et aurora-B. La détection est effectuée par immunofluorescence indirecte sur des cellules de cancer du sein MCF-7. A. Aurora A (jaune) en métaphase. B. Aurora B (vert) en télophase. L’ADN est coloré en bleu. |
L’amplicon 20q13 est commun à de nombreuses tumeurs malignes, dont les cancers colorectaux, du sein et de la vessie [14]. Dans le cas des cancers du sein, il a été détecté dans 12 à 18 % des tumeurs primaires et dans 40 % des lignées cellulaires tumorales. L’incidence augmente à 60 % dans les cancers du sein à prédisposition héréditaire par mutation du gène BRCA2. En outre, une amplification de la région 20q13 a été associée à un mauvais pronostic dans les cancers du sein sans adénopathie [16]. La protéine est surexprimée dans 94 % (31/33) des carcinomes mammaires invasifs primaires, et ceci indépendamment du type histopathologique (marquage cytoplasmique). Aucun marquage n’est observé dans les tissus mammaires normaux ni dans les cellules cancéreuses nécrotiques. Il faut souligner que moins de la moitié des cellules cancéreuses qui expriment aurora-A expriment aussi la protéine PCNA (proliferating cell nuclear antigen) [17]. Ainsi, aurora-A ne serait pas un marqueur de prolifération mais, plus spécifiquement, de transformation maligne. L’amplification 20q13 est aussi détectée dans 52 % (41/79) des tumeurs colorectales primaires et, dans 54 % (22/41) des cas examinés, on observe une augmentation de 4 à 28 fois de l’expression de l’ARNm [14]. De manière intéressante, la surexpression de aurora-A est significati-vement associée à l’invasion tumorale et à une accumulation de p53, même si on ne sait pas si ces protéines accumulées sont normales ou mutées [18]. Comme dans les cancers du sein, il n’existe pas de relation entre l’expression de aurora-A et celle de PCNA, indiquant à nouveau que l’expression de la kinase serait plus liée à la tumorige-nèse qu’à la prolifération. Dans les cancers gastriques, la technique de Southern blot ne détecte l’amplicon 20q13 que dans 5 % (4/72) des cas avec une amplification qui atteint 3,5 à 6,3 fois la normale. En revanche, près de la moitié des cas sont positifs par FISH, avec une amplification forte dans 4 cas (5 %), modérée dans 11 cas (15 %) et faible dans 19 cas (28 %). Enfin, la surexpression du transcrit aurora-A a également été observée dans les lignées cancéreuses gastriques et dans des cellules dérivées de cancers gastriques primaires [19]. Aurora-B Aurora-B est codée par le gène STK12, localisé en 17p13 [ 20] à proximité du gène p53. Une expression anormalement élevée de l’ARNm aurora-B a également été décrite dans plusieurs tumeurs [ 21], mais aucun effet oncogé-nique associé à un gain ou à une perte d’activité de cette kinase n’a été retrouvé. Aurora-B est directement impliquée dans la formation du mégacaryocyte, cellule héma-topoïétique précurseur des plaquettes. Un arrêt de l’expression de aurora-B dans une cellule souche provoque sa différenciation en mégacaryocytes, cellules normales polyploïdes, contenant un nombre élevé de centrosomes (→). Quant à l’expression ectopique de aurora-B dans un mégacaryocyte, elle entraîne la réapparition de mitoses complètes [ 22]. Ceci suggère que la dédifférenciation liée à la cancérisation puisse être aidée par une réactivation de l’expression de aurora-B. (→) m/s 1998, n°10, p. 1137 Aurora-B est impliquée dans la cytokinèse et doit interagir avec de nombreux partenaires pour assurer cette fonction [23]. Elle fait partie de ce que l’on appelle les chromosome passenger proteins : localisée sur les kinétochores dès le début de la mitose par la protéine INCENP (inner centromer protein), elle migre ensuite au niveau de la région intermédiaire du fuseau mitotique (Figure 3B). Aurora-B interagit également avec la survivine (protéine de la famille des IAP - inhibitor of apoptosis) impliquée dans l’inhibition de l’apoptose et la cytokinèse, et avec une kinésine (protéine « motrice » impliquée dans le trafic intracellulaire) [23]. Dans des cellules de cancers colorectaux [24], une surexpression de INCENP, qui assure la localisation subcellulaire de aurora-B, s’accompagne d’une surexpression de la kinase. Ceci pourrait refléter une activation de la cytokinèse impliquant tout le programme transcriptionnel assurant la division cellulaire. Ainsi, l’augmentation de l’activité de aurora-B et de ses partenaires favoriserait la prolifération cellulaire et la dédifférenciation. Cependant, en l’absence de démonstration claire d’un effet oncogénique de la surexpression de la kinase, on ne peut exclure qu’elle n’ait, comme bon nombre de protéines surexprimées dans les tumeurs, aucun lien avec les processus de cancérisation. Aurora-C Aurora-C est codée par le gène STK13, localisé en 19q13.3-qter, région fréquemment délétée ou réarrangée dans les cellules tumorales. Il n’existe que peu de données concernant l’expression de aurora-C dans les cellules cancéreuses. Une étude mentionne l’expression de la protéine dans 78 cancers colorectaux, 36 adénomes colorectaux et 15 échantillons normaux ; aurora-C était anormalement élevée dans 40 cancers et 7 adénomes. En revanche, dans les tissus coliques normaux, une expression très faible de aurora-C n’est observée que dans quelques cellules de la muqueuse et des cryptes [ 18]. Son expression est très faible et, dans des lignées cellulaires la surexprimant (cellules HeLa, HepG2, HuH7), elle est associée aux centrosomes en anaphase et en télophase mais, dans d’autres lignées, elle est difficilement détectable [ 25]. En revanche, aurora-C est fortement exprimée au cours de la spermatogenèse et plus particulièrement au cours de la formation des deux fuseaux méiotiques [26]. Ni le génome de C. elegans ni celui de la drosophile ne semblent contenir de gène codant pour cette troisième kinase, ce qui suggère qu’elle assure une fonction spécifique au cours de la spermatogenèse chez les mammifères. Cette fonction est pour le moment totalement inconnue, aucun partenaire ni substrat n’ayant encore été identifié. Le fait que les kinases aurora soient impliquées dans le contrôle de la ploïdie des cellules et qu’elles soient également surexprimées dans de nombreuses tumeurs est tout à fait intéressant. L’augmentation du pourcentage de cellules aneuploïdes dans les tumeurs de grades élevés pourrait indiquer que la surexpression des kinases aurora est un événement tardif dans la genèse du cancer. En outre, comme une forte augmentation de la ploïdie est également associée à une forte agressivité de la tumeur, il est possible que si une inhibition de l’expression ou de l’activité des kinases aurora n’entraîne pas une inversion du phénotype cancéreux, elle puisse toutefois contribuer à combattre l’agressivité de la tumeur. |
Aurora, amplification des centrosomes et cancer Quelles relations existe-t-il entre les défauts de ploïdie, l’amplification des centrosomes, les kinases aurora et le cancer ? Plusieurs hypothèses peuvent être émises quant à l’apparition de cellules aneuploïdes avec des centrosomes multiples. Un défaut d’activité de aurora-B provoquerait des mitoses infructueuses dues à une absence de cytokinèse. Mais ceci est une situation normale pour les mégacaryocytes, et la raison pour laquelle la kinase aurora-B est surexprimée dans certaines cellules cancéreuses n’est pas encore clairement établie. Il est possible que, de façon analogue à celle des marqueurs de prolifération (PCNA), les marqueurs de la cytokinèse soient surexprimés dans les cellules dédifférenciées qui se divisent rapidement. Une activité anormalement élevée de aurora-A est à l’origine d’une amplification des centrosomes, qui ne semble pas due à une mitose anormale car les centrosomes surnuméraires apparaissent avant l’entrée en mitose (Figure 1). L’hypothèse serait plutôt que le gain d’activitéaurora-A entraîne un découplage du cycle de réplication du centrosome de celui du noyau. C’est le nombre anormal de centrosomes qui serait alors à l’origine de mitoses anormales et de l’aneuploïdie. Mais le cycle cellulaire qui présenterait ce genre de défaut devrait être arrêté grâce aux mécanismes de contrôle. Il a en effet été montré qu’il existait, dans la phase G1 suivante, un point de contrôle permettant de stopper la progression du cycle. Cet arrêt dépendant de p53, un défaut ou une absence de ce suppresseur de tumeur autoriserait donc une prolifération incontrôlée et une accumulation d’aberrations chromosomiques dues à des mitoses anormales. |
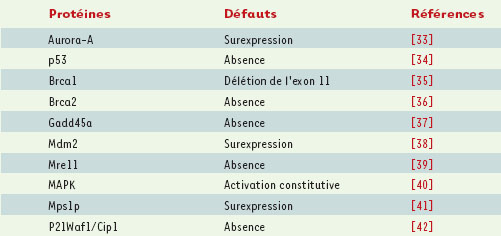
Les anomalies des centrosomes observées en présence de promoteurs de tumeurs [27], l’implication de p53 et de sa localisation au niveau du centrosome dans l’arrêt de la synthèse d’ADN en présence de nocodazole [28], ainsi que les expériences impliquant p53 dans la régulation de la dynamique des centrosomes (amplification des centrosomes en l’absence de p53 ou en présence de p53 mutée) [29], mettent en évidence un lien entre les anomalies des centrosomes et la progression tumorale. Plusieurs protéines, par leur absence ou leur surexpression, conduisent à des phénotypes similaires (Tableau I). Ce sont pour la plupart des protéines présentes dans le centrosome et/ou impliquées dans le contrôle du cycle cellulaire.  | Tableau I. Protéines impliquées dans l’amplification des centrosomes. L’absence ou la surexpression de quelques protéines entraîne une augmentation du nombre et de la taille des centrosomes. La grande majorité de ces protéines est déjà impliquée dans les mécanismes de surveillance de l’intégrité du génome et dans les cancers mais leurs mécanismes d’action dans l’amplification des centrosomes sont encore inconnus. Gadd45a : growth arrest and DNA damage inducible gene 45a. |
Les partenaires et les substrats connus des protéine kinases aurora sont encore peu nombreux. Chez le xénope, aurora-A interagit avec une kinésine (XlEg5) impliquée dans la dynamique des microtubules [12]. Chez l’homme, elle phosphoryle la protéine HsTACC-3 [30], également surexprimée dans de nombreuses lignées de cellules cancéreuses [31]. Ces partenaires et leurs liens avec les kinases aurora sont encore mal définis mais leur importance paraît évidente : des anomalies cellulaires comme l’amplification du nombre des centrosomes augmentent le risque de formation de fuseaux multipolaires qui conduisent à l’aneuploïdie, l’instabilité génétique la plus fréquemment observée dans de nombreux cancers chez l’homme et d’autres mammifères comme le chien [32]. La transformation néoplasique comprend plusieurs étapes bien comprises : activation d’un proto-oncogène, inactivation d’un gène suppresseur de tumeur et dysfonctionnement d’un point de contrôle du cycle cellulaire. En perturbant la ségrégation des chromosomes, les défauts des centrosomes pourraient donc conduire à une augmentation des anomalies génétiques, induisant un dérèglement cellulaire menant à la néoplasie et au développement de métastases. |
Nous tenons à remercier le Dr Marie-Dominique Galibert-Anne, le Pr Jean-Yves Legal et le Pr Michel Philippe pour leur lecture critique de ce manuscrit. Le travail personnel des auteurs a bénéficié des financements du Cnrs, de l’ARC et de la Ligue Nationale Contre le Cancer.
|
Footnotes |
1. Klein FA, Herr HW, Sogani PC, Whitmore WPF, Melamed MR. Detection and followup of carcinoma of the urinary bladder by flow cytometry. Cancer 1982; 50 : 389–95. 2. Blomjous CE, Schipper NW, Baak J P, van Galen EM, de Voogt HJ, Meyer CJ. Retrospective study of prognostic importance of DNA flow cytometry of urinary bladder carcinoma. J Clin Pathol 1988; 41 : 21–5. 3. Auer GU, Caspersson TO, Wallgren AS. DNA content and survival in mammary carcinoma. Anal Quant Cytol 1980; 2 : 161–5. 4. Bottger TC, Potratz D, Stockle M, Wellek S, Klupp J, Junginger T. Prognostic value of DNA analysis in colorectal carcinoma. Cancer 1993; 72 : 3579–87. 5. Meraldi P, Lukas J, Fry AM, Bartek J, Nigg EA. Centrosome duplication in mammalian somatic cells requires E2F and Cdk2-cyclin A. Nat Cell Biol 1999; 1 : 88–93. 6. Hinchcliffe EH, Li C, Thompson EA, Maller JL, Sluder G. Requirement of Cdk2-cyclin E activity for repeated centrosome reproduction in Xenopus egg extracts. Science 1999; 283 : 851–4. 7. Piel M, Nordberg J, Euteneuer U, Bornens M. Centrosome-dependent exit of cytokinesis in animal cells. Science 2001; 291 : 1550–3. 8. Lingle WL, Lutz WH, Ingle JN, Maihle NJ, Salisbury JL. Centrosome hypertrophy in human breast tumors: implications for genomic stability and cell polarity. Proc Natl Acad Sci USA1998; 95 : 22950–5. 9. Sato N, Mizumoto K, Nakamura M, et al. Centrosome abnormalities in pancreatic ductal carcinoma. Clin Cancer Res 1999; 5 : 963–70. 10. Goepfert TM, Brinkley BR. The centrosome-associated Aurora/Ipl-like kinase family. Curr Top Dev Biol2000; 49 : 331–42. 11. Glover DM. Leibowitz MH, McLean DA, Parry H. Mutations in aurora prevent centrosome separation leading to the formation of monopolar spindles. Cell 1995; 81 : 95–105. 12. Giet R, Prigent C. Aurora/Ipl1p-related kinases, a new oncogenic family of mitotic serinethreonine kinases. J Cell Sci 1999; 112 : 3591–601. 13. Giet R, Prigent C. The noncatalytic domain of the Xenopus laevis aurora/Ipl1p-related kinase pEg2 localizes the protein to the centrosome. J Cell Sci 2001; 114 : 2095–104. 14. Bischoff JR, Anderson L, Zhu Y, et al. A homologue of Drosophila aurora kinase is oncogenic and amplified in human colorectal cancers. EMBO J 1998; 17 : 3052–65. 15. Zhou H, Kuang J, Zhong L, et al. Tumour amplified kinase STK15/BTAK induces centrosome amplification, aneuploidy and transformation. Nat Genet 1998; 20 : 189–93. 16. Isola JJ, Kallioniemi O P, Chu LW, et al. Genetic aberrations detected by comparative genomic hybridization predict outcome in node-negative breast cancer. Am J Pathol 1995; 147 : 905–11. 17. Tanaka T, Kimura M, Matsunaga K, Fukada D, Mori H, Okano Y. Centrosomal kinase AIK1 is overexpressed in invasive ductal carcinoma of the breast. Cancer Res 1999; 59 : 2041–4. 18. Takahashi T, Futamura M, Yoshimi N, et al. Centrosomal kinases, HsAIRK1 and HsAIRK3, are overexpressed in primary colorectal cancers. Jpn J Cancer Res 2000; 91 : 1007–14. 19. Sakakura C, Hagiwara A, Yasuoka R, et al. Tumouramplified kinase BTAK is amplified and overexpressed in gastric cancers with possible involvement in aneuploid formation. Br J Cancer 2001; 84 : 824–31. 20. Prigent C, Gill R, Trower M, Sanseau P. In silico cloning of a new protein kinase, Aik2, related to Drosophila aurora using the new tool: EST blast. In Silico Biol 1999; 1 : 123–8. 21. Tatsuka M, Katayama H, Ota T, et al. Multinuclearity and increased ploidy caused by overexpression of the aurora- and Ipl1-like midbody-associated protein mitotic kinase in human cancer cells. Cancer Res 1998; 58 : 4811–6. 22. Kawasaki A, Matsumura I, Miyagawa J, et al. Downregulation of an AIM-1 kinase couples with megakaryocytic polyploidization of human hematopoietic cells. J Cell Biol 2001; 152 : 275–87. 23. Adams RR, Carmena M, Earnshaw WC. Chromosomal passengers and the (aurora) ABCs of mitosis. Trends Cell Biol 2001; 11 : 49–54. 24. Adams RR, Eckley DM, Vagnarelli P, et al. Human INCENP colocalizes with the Aurora-B/AIRK2 kinase on chromosomes and is overexpressed in tumour cells. Chromosoma 2001; 110 : 65–74. 25. Kimura M, Matsuda Y, Yoshioka T, Okano Y. Cell cycle-dependent expression and centrosome localization of a third human aurora/Ipl1-related protein kinase, AIK3. J Biol Chem 1999; 274 : 7334–40. 26. Yanai A, Arama E, Kilfin G, Motro B. ayk1, a novel mammalian gene related to Drosophila aurora centrosome separation kinase, is specifically expressed during meiosis. Oncogene 1997; 14 : 2943–50. 27. Mascardo RN, Sherline P. Tumor promoters stimulate hyperplasia of microtubule organizing center and inhibit DNA synthesis in cultured cells. J Clin Invest 1984; 74 : 1186–92. 28. Ciciarello M, Mangiacasale R, Casenghi M, et al. p53 displacement from centrosomes and p53-mediated G1 arrest following transient inhibition of the mitotic spindle. J Biol Chem 2001; 276 : 19205–13. 29. Winey M. Keeping the centrosome cycle on track: genome stability. Curr Biol 1996; 6 : 962–4. 30. Giet R, McLean D, Descamps S, et al. Drosophila aurora-A kinase is required to localise DTACC to centrosomes and to regulate astral microtubules. J Cell Biol 2002; 156 : 437–51. 31. Still LH, Vince P, Cowell JK. The third member of the transforming acidic coiled coil-containing gene family, TACC3, maps in 4p16, close to translocation breakpoints in multiple myeloma, and is upregulated in various cancer cell lines. Genomics 1999; 58 : 165–70. 32. Setoguchi A, Okuda M, Nishida E, et al. Results of hyperamplification of centrosomes in naturally developing tumors of dogs.Am J Vet Res 2001; 62 : 1134–41. 33. Zhou H, Kuang J, Zhong L, et al. Tumour amplified kinase STK15/BTAK induces centrosome amplification, aneuploidy and transformation. Nat Genet 1998; 20 : 104–6. 34. Fukasawa K, Choi T, Kuriyama R, Rulong S, Vande Woude GF. Abnormal centrosome amplification in the absence of p53. Science 1996; 271 : 1744–7. 35. Xu X, Weaver Z, Linke S P, et al. Centrosome amplification and a defective G2-M cell cycle checkpoint induce genetic instability in BRCA1 exon 11 isoform-deficient cells. Mol Cell 1999; 3 : 389–95. 36. Tutt A, Gabriel A, Bertwistle D, et al. Absence of Brca2 causes genome instability by chromosome breakage and loss associated with centrosome amplification. Curr Biol 1999; 9 : 1107–10. 37. Hollander MC, Sheikh MS, Bulavin DV, et al. Genomic instability in Gadd45a-deficient mice. Nat Genet 1999; 23 : 176–84. 38. Carroll PE, Okuda M, Horn HF, et al. Centrosome hyperamplification in human cancer: chromosome instability induced by p53 mutation and/or Mdm2 overexpression. Oncogene 1999; 18 : 1935–44. 39. Yamaguchi-Iwai Y, Sonoda E, Sasaki MS, et al. Mre11 is essential for the maintenance of chromosomal DNA in vertebrate cells. EMBO J 1999; 18 : 6619–29. 40. Saavedra HI, Knauf JA, Shirokawa JM, et al. The RAS oncogene induces genomic instability in thyroid PCCL3 cells via the MAPK pathway. Oncogene 2000 : 19 : 3948–54. 41. Fish HA, Winey M. The mouse Mps1p-like kinase regulates centrosome duplication. Cell 2001; 106 : 95–104. 42. Tarapore P, Tokuyama Y, Horn HF, Fukasawa K. Difference in the centrosome duplication regulatory activity among p53 «hot spot » mutants: potential role of Ser 315 phosphorylationdependent centrosome binding of p53. Oncogene 2001; 20 : 6851–63. |