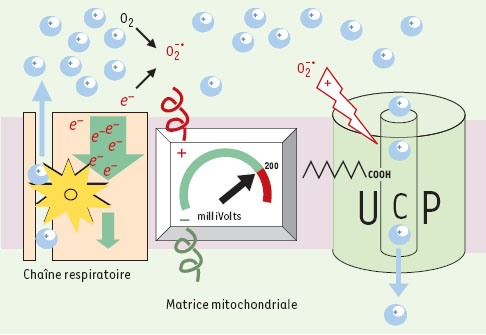
L’essentiel de l’énergie dont disposent les animaux provient de l’oxydation des substrats alimentaires. L’oxydation des substrats correspond à leur combustion en présence d’oxygène. Les molécules carbonées (essentiellement glucose et acides gras) sont alors converties en gaz carbonique et en eau. Le processus d’oxydation des substrats porte un autre nom : la respiration cellulaire. D’un point de vue thermodynamique, une oxydation de molécules carbonées est spontanée et dite « exergonique » car elle dégage de l’énergie. Dans un tube à essai, l’oxydation de substrats libère de l’énergie sous forme de chaleur (comme toute combustion). Dans les cellules, la respiration cellulaire se déroule dans les mitochondries. Cette respiration produit de la chaleur, mais environ la moitié de l’énergie des oxydations est conservée sous forme chimique au sein de molécules d’ATP produites dans les mitochondries à partir de l’ADP (réaction consommant de l’ énergie et dite « endergonique »). Il y a donc une relation entre oxydation et phosphorylation, désignée sous le terme d’oxydation phosphorylante ou de couplage respiratoire. Le mécanisme du couplage est dû au fait que la respiration établit un gradient de protons, et que la phosphorylation de l’ADP consomme ce gradient. Ce gradient provient de la chaîne respiratoire lors du transfert des électrons du NADH vers l’oxygène. En fait, les complexes protéiques formant les chaînes respiratoires fonctionnent comme des pompes à protons et expulsent les protons vers l’espace intermembranaire (Figure 1). L’ATP-synthase utilise l’énergie du gradient en catalysant la rentrée des protons de l’espace intermembranaire vers la matrice mitochondriale. Au cours dece retour des protons, l’ATP-synthase transforme l’ADP en ATP.
| Figure 1. L’ion superoxyde active le transport de protons par les UCP.La chaîne respiratoire, à gauche, oxyde les substrats : le transfert d’électrons induit un pompage des protons (boules bleues) vers l’extérieur de la mitochondrie. Cela crée un gradient électrochimique de protons, qui s’oppose au pompage et donc à l’oxydation. Quand ce gradient devient trop élevé, les électrons sont bloqués dans la chaîne respiratoire et certains peuvent réagir avec l’oxygène moléculaire pour former l’ion superoxyde
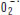 . Cet ion superoxyde interagit avec l’UCP et augmente le transport de protons par l’UCP. Ce transport permet le retour des protons dans la matrice, diminue le gradient électrochimique, et facilite alors le transfert d’électrons et l’oxydation des coenzymes. Ce phénomène, qui conduit à une perte d’énergie pour la cellule, ne serait vraiment utile, et actif, que lorsque la mitochondrie n’est pas recrutée pour produire de l’ATP. Si une production d’ATP a lieu, elle se produit avec un potentiel électrochimique plus bas, de l’ordre de 130-150 milliVolts. . Cet ion superoxyde interagit avec l’UCP et augmente le transport de protons par l’UCP. Ce transport permet le retour des protons dans la matrice, diminue le gradient électrochimique, et facilite alors le transfert d’électrons et l’oxydation des coenzymes. Ce phénomène, qui conduit à une perte d’énergie pour la cellule, ne serait vraiment utile, et actif, que lorsque la mitochondrie n’est pas recrutée pour produire de l’ATP. Si une production d’ATP a lieu, elle se produit avec un potentiel électrochimique plus bas, de l’ordre de 130-150 milliVolts. |
Les mitochondries du tissu adipeux brun constituent un cas particulier [1]. Ce tissu a une fonction thermogénique adaptative essentielle chez les rongeurs pouvant vivre dans des conditions de basse température, les nouveau-nés et les hibernants lors de leur réveil. Lors de l’activation des adipocytes bruns qui se fait via leur innervation orthosympathique, la respiration de ces cellules s’élève rapidement, les acides gras provenant de la lipolyse intracellulaire sont oxydés, mais, curieusement, l’énergie des oxydations des acides gras n’est pas utilisée pour synthétiser de l’ATP et est totalement dissipée sous forme de chaleur. Dans ces cellules, qui gaspillent l’énergie, il n’y a donc pas de couplage entre oxydation et synthèse d’ATP : la respiration y est totalement découplée de la phosphorylation de l’ADP. L’identification du mécanisme de découplage de la respiration des mitochondries du tissu adipeux brun fut résolue avec l’identification d’une protéine découplante respiratoire nommée UCP (pour uncoupling protein). UCP est une protéine insérée dans la membrane interne mitochondriale des adipocytes bruns qui catalyse la rentrée des protons dans la matrice en court-circuitant l’ATP-synthase. La rentrée des protons via UCP n’est aucunement couplée à une réaction consommant de l’énergie. Ce transporteur mitochondrial de protons est spécifique de la membrane interne des mitochondries des adipocytes bruns. Les souris génétiquement modifiées ayant perdu le gène UCP ne peuvent pas survivre au froid. C’est donc bien le découplage respiratoire induit par l’UCP qui contrôle la thermogenèse adaptative [1]. En 1997, plusieurs laboratoires identifièrent de nouveaux transporteurs mitochondriaux nommés UCP2 et UCP3, l’UCP de la graisse brune devenant UCP1 [1]. Le gène UCP2 est exprimé dans de nombreux organes (système immunitaire, rate, tube digestif, poumon), alors que l’expression d’UCP3 est restreinte au muscle squelettique et au tissu adipeux brun. Si l’homologie des trois UCP suggère que les trois protéines ont la capacité de découpler la respiration, les résultats provenant de travaux de biochimie ou d’observations physiologiques sont contradictoires. Si UCP2 et UCP3 sont de véritables protéines découplantes de la respiration, leur activation ou leur induction accroît l’oxydation des substrats car - la rentrée des protons étant stimulée - le potentiel membranaire mitochondrial diminue, ce qui stimule en retour les chaînes respiratoires. Les UCP activant l’oxydation des acides gras devraient donc avoir un rôle métabolique facilitant la dépense énergétique et la résistance à l’obésité. En fait, cette hypothèse est infirmée par l’examen des mutants de souris ayant perdu les gènes UCP2 ou UCP3 par recombinaison homologue. Le phénotype décrit chez les souris UCP2−/− est une stimulation de l’immunité innée liée à une augmentation du taux de radicaux libres dans les macrophages [2]. En accord avec un rôle d’UCP2 dans le contrôle des espèces radicalaires de l’oxygène (ERO), l’induction de stress oxydants chez des souris stimule la synthèse d’UCP2 dans plusieurs organes [3]. Ces résultats indiquent qu’UCP2 est un gène de réponse au stress oxydant. UCP2 s’oppose à l’élévation intracellulaire des ERO.
Les mitochondries produisent une fraction importante des ERO cellulaires. Cette production est contrôlée par le potentiel membranaire mitochondrial, qui, lorsqu’il est élevé, accroît la demivie du radical ubi-semiquinone producteur d’ion superoxyde. Si les protons peuvent rentrer dans la matrice via l’ATPase ou par une autre voie, le potentiel transmembranaire diminue et la production d’ions superoxyde est diminuée. Une protéine de type UCP pourrait donc constituer cette autre voie indépendante de la phosphorylation de l’ADP. En revanche, sa présence induit une perte d’énergie qui se manifeste par un découplage partiel de la respiration. In vitro, il a été démontré qu’un découplage respiratoire modéré diminue la production mitochondriale des ERO et, à l’inverse, on observe une augmentation des ERO lors de l’inhibition d’une UCP dans des mitochondries isolées [4, 5]. Le travail qui vient d’être publié par Echtay et al. [6] décrit une régulation commune aux trois UCP. Ces auteurs proposent que l’activité de découplage de la respiration (inhibée par le GDP et activée par les acides gras libres comme cela était connu pour UCP1) de ces trois transporteurs ne s’exerce que si l’ion superoxyde 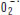 est présent. Ainsi, la présence de
est présent. Ainsi, la présence de 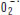 stimulerait les UCP, activerait le découplage respiratoire et, en conséquence, diminuerait letaux d’ERO. L’intérêt de ce travail est d’unifier les relations entre niveau de couplage de la respiration et production d’ERO : ce serait l’activation des UCP par les ERO eux-mêmes (en fait l’ion superoxyde spécifiquement) qui provoquerait un découplage respiratoire diminuant la production d’ERO. À cette boucle de régulation immédiate de la production d’ERO s’ajouterait une induction de l’expression des UCP (UCP2) dans les conditions où la synthèse des ERO est accrue [3]. Des protéines identiques à certaines UCP de mammifères existent dans de nombreuses espèces animales ancestrales et chez les plantes. Il est donc possible que les UCP représentent un système archaïque d’adaptation à la vie aérobie et à la production de radicaux libres oxygénés. Cela n’exclut cependant pas une autre fonction pour les UCP animales, UCP1 étant un transporteur mitochondrial essentiel à la thermogenèse, et UCP2 étant un régulateur de la sécrétion d’insuline [7]. Par ailleurs, les conclusions d’Echtay et al., quant à la forte dépendance des 3 UCP vis-à-visde l’ion superoxyde, doivent certainement être nuancées puisque la mise en évidence de l’activité découplante respiratoire d’UCP1 (dans des mitochondries de graisse brune ou dans des systèmes recombinants) ne nécessite pas l’ajout d’un système producteur d’ions superoxyde. De plus, la démonstration directe d’une véritable régulation des UCP par l’ion superoxyde in vivo reste à faire. Le cas d’UCP2, en particulier, nécessite des études plus approfondies dans la mesure où l’effet des ions superoxyde n’a pas été étudié à l’aide des souris UCP2−/−. Si le concept d’activation des UCP, directement par les ions superoxyde, est séduisant, de nombreuses questions restent en suspens concernant les mécanismes moléculaires. L’ion superoxyde pourrait agir soit en modifiant la protéine elle-même, soit en participant au transport des protons par UCP2 ou encore en étant transporté par UCP2 à l’extérieur de la mitochondrie.
stimulerait les UCP, activerait le découplage respiratoire et, en conséquence, diminuerait letaux d’ERO. L’intérêt de ce travail est d’unifier les relations entre niveau de couplage de la respiration et production d’ERO : ce serait l’activation des UCP par les ERO eux-mêmes (en fait l’ion superoxyde spécifiquement) qui provoquerait un découplage respiratoire diminuant la production d’ERO. À cette boucle de régulation immédiate de la production d’ERO s’ajouterait une induction de l’expression des UCP (UCP2) dans les conditions où la synthèse des ERO est accrue [3]. Des protéines identiques à certaines UCP de mammifères existent dans de nombreuses espèces animales ancestrales et chez les plantes. Il est donc possible que les UCP représentent un système archaïque d’adaptation à la vie aérobie et à la production de radicaux libres oxygénés. Cela n’exclut cependant pas une autre fonction pour les UCP animales, UCP1 étant un transporteur mitochondrial essentiel à la thermogenèse, et UCP2 étant un régulateur de la sécrétion d’insuline [7]. Par ailleurs, les conclusions d’Echtay et al., quant à la forte dépendance des 3 UCP vis-à-visde l’ion superoxyde, doivent certainement être nuancées puisque la mise en évidence de l’activité découplante respiratoire d’UCP1 (dans des mitochondries de graisse brune ou dans des systèmes recombinants) ne nécessite pas l’ajout d’un système producteur d’ions superoxyde. De plus, la démonstration directe d’une véritable régulation des UCP par l’ion superoxyde in vivo reste à faire. Le cas d’UCP2, en particulier, nécessite des études plus approfondies dans la mesure où l’effet des ions superoxyde n’a pas été étudié à l’aide des souris UCP2−/−. Si le concept d’activation des UCP, directement par les ions superoxyde, est séduisant, de nombreuses questions restent en suspens concernant les mécanismes moléculaires. L’ion superoxyde pourrait agir soit en modifiant la protéine elle-même, soit en participant au transport des protons par UCP2 ou encore en étant transporté par UCP2 à l’extérieur de la mitochondrie.