| |
| Med Sci (Paris). 2002 May; 18(5): 565–575. Published online 2002 May 15. doi: 10.1051/medsci/2002185565.Les métalloprotéases matricielles et leurs inhibiteurs synthétiques dans la progression tumorale Christophe Chantrain and Yves A. DeClerck* Département de pédiatrie, biochimie et biologie moléculaire, Division of hematology-oncology, Childrens Hospital Los Angeles, Keck School of Medicine, MS 54, University of Southern California, 4650, Sunset Boulevard, Los Angeles, Californie, CA 90027, États-Unis |
Les recherches en biologie du cancer ont montré que le développement tumoral ne se réduit pas à une simple multiplication anarchique et incontrôlée de cellules néoplasiques mais qu’il dépend également de nombreuses interactions entre ces cellules et les éléments tissulaires de l’hôte. La modification de la matrice extracellulaire est ainsi une étape importante, non seulement nécessaire à l’invasion par les cellules tumorales mais aussi à leur prolifération. Elle permet aussi la formation de néo-vaisseaux qui favorisent la croissance tumorale et, par la suite, représentent le point de départ des cellules cancéreuses migrant à travers leur paroi pour donner naissance à des sites métastatiques. Parallèlement au développement de drogues cytotoxiques de plus en plus performantes, l’invasion, l’angiogenèse et la dissémination métastatique sont devenues de nouvelles cibles thérapeutiques. Les métalloprotéases matricielles (MMP pour matrix metalloproteinase) sont, comme leur nom l’indique, activement impliquées dans la protéolyse de la matrice extracellulaire et ont fait l’objet de nombreux travaux débouchant récemment sur la production par l’industrie pharmaceutique d’inhibiteurs synthétiques. Cet article se propose de revoir les principales caractéristiques des MMP, leur structure, leurs substrats et leur classification. Les rôles de ces enzymes dans les différentes étapes de la progression tumorale seront ensuite résumés. Enfin, à partir des résultats des premiers essais cliniques, l’accent sera mis sur les bénéfices thérapeutiques potentiels de l’inhibition des MMP et sur les nouvelles questions que pose le développement de leurs inhibiteurs synthétiques dans le traitement anti-cancéreux. |
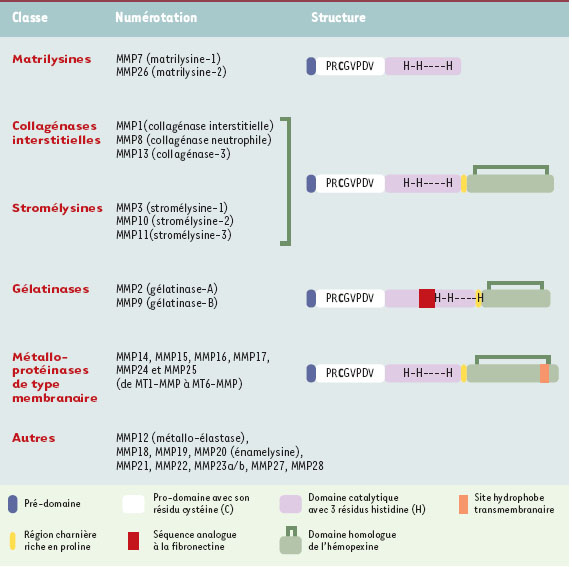
Classification et structure des MMP La famille des MMP est composée de plus de 20 endopeptidases, dénommées soit par un nom descriptif soit par un numéro [1] (Figure 1). Malgré une certaine spécificité des substrats, les spectres protéolytiques des différentes MMP sont assez larges et se recouvrent, ce qui permet la dégradation de l’ensemble des composants de la matrice extracellulaire. Toutes les MMP sont constituées de trois domaines : le pré-domaine, nécessaire à leur acheminement intracellulaire jusqu’à la surface cellulaire, le pro-domaine et le domaine catalytique proprement dit. Le pré-domaine est rapidement éliminé après la sécrétion et est absent de la forme enzymatique mûre. Le pro-domaine maintient l’activité enzymatique sous forme latente et est classiquement constitué d’une séquence peptidique comprenant un résidu cystéine qui interagit avec le site catalytique. Ce dernier contient un atome de zinc maintenu par trois résidus histidine au fond d’une structure peptidique tridimensionnelle en forme de poche. Le résidu cystéine du pro-domaine agit comme le quatrième ligand de cet ion métallique. Le clivage protéolytique du pro-domaine, libérant ainsi l’atome de zinc du résidu cystéine, entraîne l’activation du site catalytique qui peut alors se lier à son substrat par pénétration d’une molécule d’H2O. La plupart des MMP ont un quatrième domaine en position carboxy-terminale. Cette chaîne polypeptidique est homologue de la vitronectine ou de l’hémopexine et intervient dans la reconnaissance du substrat des MMP. Elle est rattachée au domaine catalytique par une région charnière riche en résidus proline. Les MMP peuvent être classées en six groupes d’après leurs différences structurales (Figure 1).  | Figure 1. Classification des MMP. Les MMP sont groupées en six classes en fonction de leur structure. Chaque MMP est dénommée par un numéro ou par un nom descriptif en rapport avec ces différentes classes. |
Les matrilysines La MMP-7 (matrilysine-1) et la MMP-26 (matrilysine-2) constituent la classe des matrilysines. Ce sont les MMP structurellement les plus simples car elles ne contiennent pas de domaine homologue de l’hémopexine. Ces protéases sont spécifiquement exprimées par les cellules cancéreuses d’origine épithéliale [ 1, 2]. Leurs spectres protéolytiques sont partiellement divergents mais incluent la fibronectine et la gélatine [ 1, 2]. Les collagénases interstitielles Les collagénases interstitielles (MMP-1, MMP-8, MMP-13) forment un second groupe de MMP qui interviennent dans la dégradation du collagène fibrillaire, incluant les collagènes de type I, II, III et VII. Le clivage protéolytique du collagène fibrillaire par ces enzymes entraîne la formation de collagène dénaturé (gélatine) qui peut ensuite être dégradé par les gélatinases. La MMP-13 (collagénase-3) est caractérisée par un spectre enzymatique plus large et est essentiellement exprimée dans des zones nécessitant un remaniement rapide de la matrice extracellulaire telles que le tissu osseux fœtal en développement ou les sites d’inflammation chronique. Plusieurs carcinomes et sarcomes ont aussi été associés à une hyperactivité de la MMP-13 [ 3]. Les stromélysines Le troisième groupe de MMP est composé des stromélysines. MMP-3 (stromélysine-1) et MMP-10 (stromélysine-2) sont principalement produites par les cellules épithéliales normales mais ont aussi été décrites dans certains carcinomes. Elles ont un spectre protéolytique étendu qui inclut de nombreuses glycoprotéines et des protéoglycanes. La MMP-11 (stromélysine-3), exprimée par les cellules mésenchymateuses, intervient dans le clivage des inhibiteurs des sérine protéases et semble jouer un rôle mineur dans la dégradation de la matrice extracellulaire. Les gélatinases Les gélatinases (MMP-2, MMP-9) forment la quatrième classe de MMP dont l’activité protéolytique est dirigée contre le collagène interstitiel dénaturé (gélatine) et les collagènes de type IV et V de la membrane basale. Une caractéristique structurelle de ces gélatinases est la présence, au sein du domaine catalytique, de trois séquences peptidiques répétitives analogues aux motifs de la fibronectine de type II [ 4]. Ces dernières permettent la liaison à la gélatine. La MMP-2 (gélatinase-A) est physiologiquement exprimée par les cellules du stroma de la plupart des tissus. L’expression de la MMP-9 (gélatinase-B) est faible ou absente dans les tissus normaux et limitée aux monocytes et aux macrophages (→). Elle peut cependant être induite en cas de remaniement tissulaire comme dans le développement embryonnaire, la cicatrisation de plaies ou l’invasion tumorale. Elle est alors produite par les cellules stromales ou par les cellules malignes (→→)[ 4]. (→) m/s 2000, n°4, p. 567 (→→) m/s 2001, n°2, p. 260 Les métalloprotéases transmembranaires Les métalloprotéases transmembranaires (MMP-14, -15, -16, -17, -24, -25 aussi dénommées de MT1-MMP à MT6-MMP) forment un cinquième groupe dont la caractéristique essentielle est de pouvoir se lier à la membrane cellulaire soit par l’intermédiaire d’un site hydrophobe transmembranaire présent dans leur domaine homologue de l’hémopexine, soit par un pont inositolphosphate. Outre un rôle dans la dégradation directe de la matrice extracellulaire, ces enzymes interviennent dans l’activation protéolytique des autres MMP [ 5]. Un dernier groupe hétérogène Enfin, plusieurs MMP (MMP-12, MMP-18, MMP-19, MMP-20, MMP-21, MMP-22, MMP-23A/B, MMP-27, MMP -28), récemment découvertes, forment un sixième groupe hétérogène et leurs rôles sont encore imprécis. Ainsi, la MMP-12 (métallo-élastase), dont le substrat principal est l’élastine, est essentiellement sécrétée par les macrophages alors que la MMP-20 (énamélysine) interviendrait dans la formation de l’émail dentaire [ 6, 7]. L’implication de ces dernières MMP dans le cancer reste encore à déterminer. |
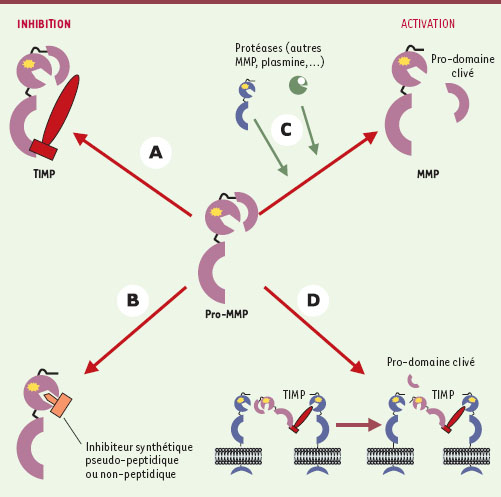
Régulation de l’activité des MMP L’activité des MMP dans l’espace extracellulaire dépend de l’équilibre entre leur inhibition et leur activation (Figure 2). En effet, outre les inhibiteurs synthétiques dont nous parlerons par la suite, l’activité des MMP est contrôlée par des inhibiteurs endogènes. Ces inhibiteurs, connus sous le nom de TIMP (tissue inhibitors of matrix metalloproteinases) forment un complexe équimoléculaire avec les formes actives des MMP. Dans ces complexes, le domaine amino-terminal des TIMP se lie au domaine catalytique des MMP et, de ce fait, bloque l’accès à la poche contenant l’atome de zinc [8]. Ces complexes sont stables et irréversibles. Quatre TIMP (TIMP-1, TIMP-2, TIMP-3 et TIMP-4) ont été identifiés et tous sont capables d’inhiber l’activité des MMP avec un certain degré de spécificité (par exemple, TIMP-2, mais pas TIMP-1, inhibe la MT1-MMP). La régulation des MMP par les TIMP est donc un facteur important contrôlant le catabolisme de la matrice extracellulaire et des modifications de cette régulation ont été à l’origine de plusieurs états pathologiques comme l’arthrite, le cancer, la réparation tissulaire et la cirrhose [9]. Par ailleurs, pour être douées d’activité protéolytique, les MMP doivent être activées par clivage du pro-domaine. Cette activation peut se faire soit dans le milieu extracellulaire, soit à la surface cellulaire ou encore dans le cytoplasme. Plusieurs protéases comme la plasmine et les MMP elles-mêmes sont capables d’éliminer le pro-peptide et d’activer les MMP. Les MMP peuvent donc activer un membre d’une autre classe. Par exemple, la MMP-1 est activée par la plasmine ou la stromélysine-1 [10]. Un mécanisme unique de régulation de la gélatinase-A (MMP-2) a été décrit au niveau de la surface cellulaire. La forme inactive de cette MMP peut se lier à la MMP transmembranaire, MT1-MMP, en formant un complexe trimoléculaire avec TIMP-2. La formation de ce complexe à la surface de la cellule permet à une seconde molécule de MT1-MMP de couper le peptide N-terminal de la pro-MMP-2 et d’activer ainsi la protéase. Dans ce mécanisme d’activation, TIMP-2 joue un rôle d’activateur et non d’inhibiteur (agissant comme une molécule adaptatrice) et MT-1 MMP joue un double rôle de molécule réceptrice et activatrice [5]. Certaines MMP peuvent aussi être activées à l’intérieur de la cellule, avant leur sécrétion. C’est en particulier le cas de plusieurs MT-MMP qui ont une séquence spécifique (RRKR) dans leur pro-domaine, reconnue par les furines, une famille de sérine protéases. 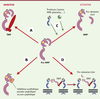 | Figure 2. Mécanismes de régulation de l’activité des MMP. Les MMP sont inhibées par la formation d’un complexe équimolaire avec le TIMP (A) ou par des inhibiteurs synthétiques pseudo-peptidiques ou non-peptidiques qui entrent en compétition au niveau du site catalytique avec le substrat naturel (B). Les MMP sont aussi sécrétées sous forme de pro-enzyme et doivent être activées par clivage protéolytique du pro-domaine. Ce clivage se produit soit dans le milieu extracellulaire par l’action d’une autre MMP ou de la plasmine (C), soit à la surface cellulaire comme c’est le cas pour la pro-MMP2 (violet) qui est activée par la MT1-MMP (bleu) à laquelle elle se lie après avoir formé un complexe avec le TIMP-2 (rouge) (D). |
|
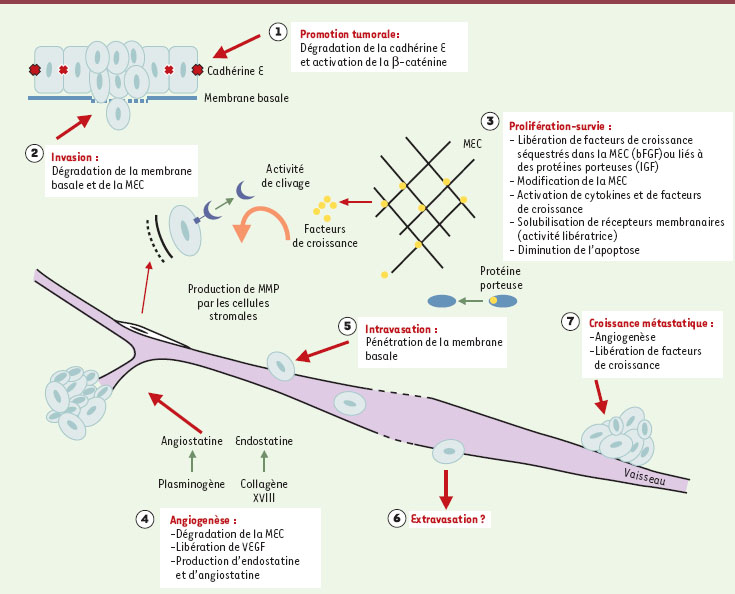
Rôles des MMP dans le cancer Le rôle des MMP dans la progression cancéreuse a fait l’objet de recherches intensives depuis plus de deux décennies. Un rôle important fut initialement attribué à la capacité des MMP de dégrader la matrice extracellulaire, favorisant ainsi l’invasion tumorale. Il est maintenant clair que parce que les MMP ont une activité protéolytique également dirigée contre des protéines non matricielles, ces protéases jouent un rôle complexe dans plusieurs autres étapes de la progression tumorale [1]. Les contributions des MMP dans ces différentes étapes sont illustrées sur la Figure 3.  | Figure 3. Rôles des MMP dans la progression tumorale. Les effets des MMP sont indiqués à chaque étape de la progression tumorale. 1. promotion tumorale ; 2. invasion locale ; 3. prolifération ; 4. angiogenèse ; 5. intravasation ; 6. extravasation ; 7. croissance métastatique. |
Perte d’adhérence Certaines MMP, en particulier la MMP-3 et la MMP-7, ont tout d’abord été impliquées dans la perte d’adhérence cellulaire et la modification phénotypique des cellules épithéliales qui se produisent durant les premiers stades du développement d’une tumeur carcinomateuse. Ces enzymes peuvent en effet digérer la cadhérine E et, de ce fait, rompre les adhérences intercellulaires des épithéliums et stimuler l’expression de gènes promoteurs du cancer en favorisant le transfert de la β-caténine à partir de la cadhérine E vers le noyau cellulaire [ 11, 12]. Invasion L’invasion locale est la seconde étape de la progression tumorale dans laquelle ces protéases sont impliquées. Plusieurs MMP, en particulier les gélatinases (MMP-2 et MMP-9) ont une activité protéolytique dirigée contre les protéines de la membrane basale (collagènes de type IV et V) et d’autres MMP, comme la MMP-1 et la MT1-MMP, contre le collagène interstitiel (collagènes de type I, II ou III) présent dans le tissu conjonctif qui encercle les cancers invasifs. Ce rôle des MMP dans l’invasion tumorale a été parmi les mieux étudiés [ 13]. Il a été démontré que les MMP présentes au niveau du front invasif sont souvent produites non pas par les cellules tumorales mais par les cellules stromales (fibroblastes, cellules endothéliales, macrophages) stimulées spécifiquement par les cellules cancéreuses [ 14]. Prolifération Une troisième étape de la progression tumorale dans laquelle les MMP ont été impliquées est la prolifération des cellules tumorales. Ce rôle inattendu fut initialement suspecté par l’observation de l’effet négatif que les inhibiteurs de MMP peuvent avoir sur la croissance tumorale [ 15]. Les mécanismes à l’origine de cet effet sont multiples et complexes. Ils impliquent tout d’abord les facteurs de croissance, les cytokines et leurs récepteurs. Plusieurs MMP comme la stromélysine sont capables de digérer des protéines extracellulaires qui séquestrent les facteurs de croissance comme c’est le cas de l’IGFBP-3 ( insulin-like growth factor binding protein 3) qui se lie à l’IGF II ( insulin-like growth factor II) ou du perlécan qui séquestre le bFGF ( basic fibroblast growth factor) [ 16, 17] . D’autres MMP peuvent aussi augmenter l’activité biologique de cytokines et de facteurs de croissance comme cela a été démontré pour l’interleukine-8 dont l’activité augmente 10 fois après digestion par la MMP-9 [ 18]. Enfin, par leur capacité de solubiliser des récepteurs membranaires de cytokines (activité « libératrice ») et de ce fait diminuer leur effet biologique, plusieurs MMP ont paradoxalement un effet anti-prolifératif [ 19] . Les MMP agissent encore sur la prolifération des cellules tumorales par les modifications structurales qu’elles induisent dans les protéines de la matrice extracellulaire. Notre laboratoire a par exemple démontré que la dégradation du collagène fibrillaire par les MMP permet aux cellules de mélanome d’activer l’intégrine α2β1, de diminuer l’expression de la protéine p27 et de stimuler ainsi la prolifération cellulaire [ 20]. De la même manière, l’exposition de cellules de mélanome à du collagène protéolysé leur permet de se protéger de l’apoptose [ 21]. Enfin, il a récemment été mis en évidence que la MMP-11 diminuait l’apoptose des cellules tumorales par un mécanisme encore indéterminé [ 22, 23]. Angiogenèse L’angiogenèse est la quatrième étape de la progression tumorale dans laquelle les MMP sont impliquées et où elles peuvent avoir un effet stimulateur ou inhibiteur. Plusieurs MMP sont exprimées par les cellules endothéliales qui répondent à un stimulus angiogénique et ces enzymes jouent un rôle important dans la dégradation de la matrice extracellulaire qui accompagne l’invasion du tissu tumoral par les vaisseaux sanguins. Certaines MMP augmentent aussi la libération de facteurs angiogéniques comme le VEGF ( vascular endothelial growth factor) [ 24] (→). En revanche, les MMP peuvent aussi avoir un effet négatif sur l’angiogenèse en produisant des facteurs anti-angiogéniques à partir de molécules précurseurs. C’est le cas de l’angiostatine et de l’endostatine qui sont produites par les MMP-2, -7 et -9 ou la MMP-12 à partir de précurseurs comme le plasminogène et le collagène XVIII [ 25– 28]. (→) m/s 1997, n°12, p. 1428 Intravasation, extravasation et croissance de tumeurs métastatiques Les MMP sont aussi actives dans le processus d’intravasation (pénétration d’un vaisseau par des cellules tumorales). Il est postulé que cet effet provient de la capacité des MMP de détruire la membrane basale qui entoure l’endothélium capillaire. L’implication des MMP à ce titre est cependant tirée d’observations indirectes démontrant que des inhibiteurs de MMP réduisent la formation de métastases spontanées à partir d’une tumeur primaire ou l’invasion d’une membrane basale reconstituée in vitro [ 29]. Le rôle des MMP dans l’extravasation (sortie des cellules tumorales d’un vaisseau sanguin) est moins évident et controversé. Un groupe de chercheurs a notamment démontré que des inhibiteurs de MMP étaient incapables d’inhiber la colonisation des poumons par des cellules tumorales injectées dans la circulation veineuse [ 30]. Enfin, les MMP pourraient aussi intervenir dans la croissance de tumeurs métastatiques. Cet effet des MMP est complexe car il implique un effet sur l’angiogenèse et sur la prolifération cellulaire. |
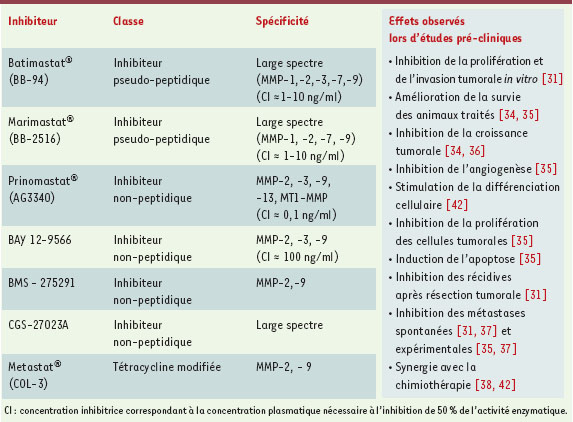
Les inhibiteurs synthétiques des MMP dans le traitement anti-cancéreux Le rôle de ces MMP dans la progression tumorale en a fait une cible thérapeutique importante. En outre, le fait que, dans de nombreux cancers, les MMP sont produites par les cellules du stroma plutôt que par les cellules tumorales suggère que l’inhibition des MMP pourrait échapper au développement de résistances principalement dues à l’instabilité génétique des cellules tumorales. Différentes approches ont ainsi été développées pour interférer avec l’expression ou l’activation des MMP [31]. La méthode principale réside dans l’emploi d’inhibiteurs synthétiques qui interagissent directement avec le site catalytique des MMP pour bloquer de façon réversible leur activité protéolytique [31]. Plusieurs molécules ayant une grande affinité pour les MMP ont été synthétisées et peuvent être classées en trois catégories. Inhibiteurs pseudo-peptidiques Ces composés présentent une structure pseudo-peptidique mimant le site de clivage du substrat. Ces inhibiteurs entrent donc en compétition avec le substrat des MMP et se lient au site catalytique par chélation de l’atome de zinc (Figure 2). La majorité des inhibiteurs étudiés in vitro et in vivo dans cette catégorie sont des dérivés hydroxamates dont les plus connus sont le Batimastat ® et le Marimastat ® ( British Biotech). Ces deux molécules sont relativement non sélectives. Le Marimastat ® se distingue du Batimastat ® par une meilleure biodisponibilité orale et une faible inhibition de la MMP-3 [ 31]. Inhibiteurs non peptidiques La faible biodisponibilité orale des inhibiteurs pseudo-peptidiques (à l’exception du Marimastat ®), ainsi que leur manque de sélectivité, ont conduit à la synthèse d’inhibiteurs non peptidiques. La structure de ces composés est fondée sur l’analyse tridimensionelle du site catalytique par radio-cristallographie. Le mode d’inhibition est similaire à celui des agents pseudo-peptidiques avec toutefois une plus grande spécificité pour le type de MMP inhibée. Leur spectre est donc plus sélectif avec une faible activité vis-à-vis de la MMP-1 et une plus forte activité vis-à-vis des MMP-2 et -9. Les principales molécules de cette catégorie sont le Prinomastat ® (AG3340) (Agouron-Pfizer), le BAY 12-9566 ® (Bayer), le BMS-275291 ® (Bristol-Myers Squibb) et le CGS-27023 ® (Novartis) [ 31, 32]. Dérivés des tétracyclines Cette classe de médicaments comprend des antibiotiques classiques tels que la tétracycline, la doxycycline et la minocycline, mais aussi de nouveaux composés analogues tels que le Metastat ® (Col-3), une tétracycline chimiquement modifiée pour éliminer l’activité antimicrobienne et la toxicité gastro-intestinale. Ces composés inhibent les collagénases et les gélatinases par divers mécanismes. Ils bloquent l’activité des MMP par chélation de l’atome de zinc du site catalytique, interfèrent avec l’activation protéolytique des proenzymes, réduisent l’expression des MMP et diminuent leur dégradation [ 31, 33]. D’autres molécules sont encore capables d’inhiber les MMP. Ainsi, les biphosphonates, utilisés dans les désordres de l’équilibre calcique et plus récemment dans le traitement palliatif des métastases osseuses de certains cancers, semblent diminuer l’activité protéolytique et réduisent aussi la sécrétion de MMP-2 et MT1-MMP [31]. De nombreuses expériences in vitro et in vivo utilisant des modèles animaux ont permis le développement de ces molécules par l’industrie pharmaceutique. Le Tableau I reprend les caractéristiques des principaux inhibiteurs synthétiques ainsi que les effets observés lors des différentes études précliniques. Le Batimastat® a été initialement testé sur des tumeurs ovariennes greffées dans la cavité péritonéale de souris nude. Une diminution significative du volume tumoral a été démontrée, prolongeant ainsi de 5 à 6 fois la survie des animaux traités [34]. Par la suite, les études menées avec d’autres inhibiteurs ont confirmé cet effet sur la croissance de la tumeur primaire, permettant une amélioration de la survie des animaux traités, ainsi qu’une inhibition de l’angiogenèse et une réduction de l’invasion locale ou de la dissémination métastatique dans différents modèles de cancer humain ou animal (côlon, pancréas, sein, prostate, ovaire, foie, poumon, gliome, mélanome). En outre, les inhibiteurs des MMP se sont avérés d’autant plus efficaces qu’ils sont administrés à un stade précoce de la progression tumorale [35–37]. Par ailleurs, plusieurs études récentes ont montré que les inhibiteurs des MMP pouvaient agir en synergie avec la chimiothérapie. Giavazzi et al. ont ainsi obtenu une inhibition complète de la croissance de tumeurs ovariennes traitées par une combinaison de Batimastat® et de cisplatine [38]  | Tableau I. Propriétés des principaux inhibiteurs synthétiques des MMP. |
Plusieurs essais cliniques ont ensuite été réalisés avec ces inhibiteurs de MMP chez des patients porteurs de cancers avancés (Tableau II). Lors des études de toxicité (phase I/II), les principaux effets secondaires rapportés ont consisté en des douleurs musculo-articulaires de type inflammatoire, réversibles à l’arrêt du traitement [39]. Cette toxicité a été initialement décrite lors de l’administration prolongée de Marimastat® [40]. L’inhibition de la MMP-1 par cet inhibiteur à large spectre a d’abord été invoquée pour expliquer ces douleurs. Cependant, les premiers essais de phase I réalisés avec le Prinomastat® (AG3340), qui a peu d’activité vis-à-vis de la MMP-1, ont montré ce même type de toxicité [41]. L’administration de BAY 12-9566, dont la structure moléculaire est différente de celle des autres inhibiteurs, s’accompagne d’autres effets secondaires. Si on ne note aucune toxicité articulaire, des élévations asymptomatiques des enzymes hépatiques ainsi que des thrombocytopénies ont été observées [42]. De même, le BMS-275291 ne semble pas associé à des douleurs musculo-articulaires [43]. Ces observations suggèrent que la toxicité articulaire des inhibiteurs des MMP pourrait être produite par l’activité « libératrice » des MMP et particulièrement par une inhibition de la libération du récepteur extracellulaire du TNF (tumor necrosis factor). Le BMS-275291 est en effet le seul composé qui n’inhibe pas la libération de ce récepteur de la surface cellulaire [43]. Outre ces douleurs musculosquelettiques, le CGS-27023 entraîne une toxicité cutanée sous forme d’éruption cutanée, réversible à l’arrêt du traitement [44]. Enfin, les effets secondaires décrits pour le Metastat® (Col-3) incluent phototoxicité cutanée, anémie, induction de lupus érythémateux disséminé, nausées, élévation des enzymes hépatiques, fièvre et neurotoxicité [33].  | Tableau II. Principales études cliniques réalisées avec les inhibiteurs synthétiques des MMP. |
Plus récemment, des essais thérapeutiques cliniques (phase III) ont complété ces études de toxicité. Malgré des premiers résultats prometteurs, tels que la diminution du nombre de thoracentèses après administration intrapleurale de Batimastat® chez des patients atteints d’épanchement pleural carcinomateux [45], les études de groupes plus importants n’ont actuellement pas mis en évidence d’avantage clinique significatif. Le Marimastat® administré à des patients ayant un cancer pancréatique inopérable n’a pas montré de supériorité thérapeutique par rapport à la gemcitabine. De même, chez des patients atteints d’un cancer gastrique avancé, le Marimastat®, bien que retardant la progression de la maladie, n’a pas permis une amélioration significative de la survie par rapport à un placebo. Enfin, ce même inhibiteur combiné à la gemcitabine ne prolonge pas plus la survie de patients ayant un cancer pancréatique étendu que la gemcitabine associée à un placebo [1]. D’autres études réalisées avec le Marimastat® chez des patients atteints de glioblastome, de cancers pulmonaires et mammaires, et avec le Prinomastat® (AG3340) dans des cancers pulmonaires et prostatiques devraient également être rapportées prochainement. La firme Bayer a, quant à elle, suspendu ses essais cliniques avec le BAY 12-9566, préférant approfondir les recherches sur des modèles précliniques [1]. Le problème de ces études thérapeutiques cliniques est qu’elles ont été réalisées chez des patients atteints de cancers avancés. Les expériences sur des modèles animaux ont très clairement démontré que l’inhibition des MMP était d’autant plus efficace sur la progression tumorale qu’elle était réalisée précocement. Chez ces patients atteints de tumeurs étendues, les principaux effets ciblés par les inhibiteurs de MMP tels que l’invasion tumorale, l’angiogenèse ou la dissémination métastatique se sont déjà produits, expliquant que le rôle des MMP ne peut être que mineur à ce stade. Ces expériences ne permettent donc pas de conclure sur le rôle des inhibiteurs des MMP dans le traitement anti-cancéreux. De nouveaux essais cliniques doivent être réalisés chez des patients porteurs de cancers à un stade précoce ou, mieux encore, en rémission, comme traitement préventif de la dissémination métastatique [46]. Ces inhibiteurs pourraient être testés seuls ou, comme cela est suggéré par plusieurs études pré-cliniques, en combinaison avec la chimiothérapie. L’évaluation de telles études repose cependant sur la disponibilité de marqueurs biologiques capables d’identifier précocement et spécifiquement l’activité des inhibiteurs de MMP. La concentration plasmatique de facteurs de croissance angiogéniques (VEGF et bFGF), ou encore l’excrétion urinaire de produits de dégradation du collagène ont ainsi été mesurées chez des patients traités par le BAY12-9566 ou le Metastat® (Col-3), mais ces essais ne se sont pas avérés concluants [33, 42]. De façon similaire, le Marimastat® ne semble pas modifier significativement les taux sériques de MMP [40]. Bremer a toutefois rapporté récemment l’utilisation d’un substrat synthétique fluorogénique permettant de quantifier de façon sélective l’activité protéolytique de la MMP-2 [47]. Cette technique est prometteuse car elle permet de détecter in vivo, et de façon non invasive, les tumeurs possédant une activité protéolytique importante et de vérifier par la suite l’efficacité des inhibiteurs synthétiques sur ce tissu tumoral. |
L’implication active des MMP lors des différentes étapes de la progression tumorale s’appuie sur de nombreuses observations cliniques décrivant l’expression importante des MMP dans différents cancers métastatiques humains. Elle est aussi fondée sur le large spectre de protéines matricielles et non matricielles qui sont modifiées par les MMP et sur les conséquences de ces modifications dans le domaine de la croissance et de l’invasion tumorale. Ces faits prouvés ont conduit au développement d’inhibiteurs synthétiques des MMP. Plusieurs études pré-cliniques réalisées avec des modèles animaux utilisant ces composés ont ainsi démontré l’intérêt de l’inhibition des MMP dans le traitement du cancer. Même si les premiers essais cliniques réalisés chez des patients atteints de cancers avancés n’ont pas apporté de bénéfices thérapeutiques significatifs, ces inhibiteurs lancent de nouveaux défis. Des essais cliniques, introduisant les inhibiteurs des MMP précocement ou à des stades où l’extension de la maladie est limitée doivent être mis en route pour réellement apprécier les avantages potentiels de ces molécules. Le développement de marqueurs biologiques permettant de suivre et de vérifier spécifiquement l’action de ces composés est une autre priorité dans ce domaine. Enfin, une compréhension plus approfondie des mécanismes moléculaires à la base du rôle des MMP dans la physiopathologie du cancer est aussi nécessaire. Ce point est notamment illustré par l’observation récente de l’effet protecteur du Batimastat® sur des souris porteuses de mélanome-B16, traitées par le TNF et l’interféron γ [48]. L’activité protéolytique des MMP sur un nombre sans cesse grandissant de substrats non matriciels démontre que leur contribution dans la progression cancéreuse est complexe et peut parfois résulter en une stimulation ou en une inhibition du développement tumoral. Face à ces effets paradoxaux, l’inhibition thérapeutique des MMP pourrait être optimisée par la production de composés interférant de façon sélective et non toxique avec les mécanismes promouvant la progression tumorale. Telles sont donc les futures directions de la recherche, tant clinique que fondamentale, dans un domaine qui est loin d’être clos. |
La vignette de la page 565 a été grâcieusement fournie par Pfizer Global Research and Development, La Jolla/Agouro Pharmaceuticals Inc.
|
1. Nelson AR, Fingleton B, Rothenberg ML, Matrisian LM. Matrix metalloproteinases: biologic activity and clinical implications. J Clin Oncol 2000; 18 : 1135–49. 2. Marchenko GN, Ratnikov BI, Rozanov DV, Godzik A, Deryugina EI, Strongin AY. Characterization of matrix metalloproteinase-26, a novel metalloproteinase widely expressed in cancer cells of epithelial origin. Biochem J 2001; 356 : 705–18. 3. Stamenkovic I. Matrix metalloproteinases in tumor invasion and metastasis. Semin Cancer Biol 2000; 10 : 415–33. 4. DeClerck YA. Interactions between tumour cells and stromal cells and proteolytic modification of the extracellular matrix by metalloproteinases in cancer. Eur J Cancer 2000; 36 :1258–68. 5. Shofuda K, Moriyama K, Nishihashi A, et al. Role of tissue inhibitor of metalloproteinases-2 (TIMP-2) in regulation of pro-gelatinase A activation catalyzed by membranetype matrix metalloproteinase-1 (MT1-MRP) in human cancer cells. J Biochem (Tokyo) 1998; 124 : 462–70. 6. Shapiro SD, Kobayashi DK, Ley TJ. Cloning and characterization of a unique elastolytic metalloproteinase produced by human alveolar macrophages. J Biol Chem 1993; 268 : 23824–9. 7. Llano E, Pendas AM, Knauper V, et al. Identification and structural and functional characterization of human enamelysin (MMP-20). Biochemistry 1997; 36 : 15101–8. 8. Bode W, Fernandez-Catalan C, Grams F, et al. Insights into MMP-TIMP interactions. Ann NY Acad Sci 1999; 878 : 73–91. 9. Birkedal Hansen H. Proteolytic remodeling of extracellular matrix. Curr Opin Cell Biol 1995; 7 : 728–35. 10. Nagase H. Activation mechanisms of matrix metalloproteinases. Biol Chem Hoppe Seyler 1997; 378 : 151–60. 11. Lochter A, Galosy S, Muschler J, Freedman N, Werb Z, Bissell MJ. Matrix metalloproteinase stromelysin-1 triggers a cascade of molecular alterations that leads to stable epithelial-to-mesenchymal conversion and a premalignant phenotype in mammary epithelial cells. J Cell Biol 1997; 139 : 1861–72. 12. Crawford HC, Fingleton BM, Rudolph-Owen LA, et al. The metalloproteinase matrilysin is a target of b-catenin transactivation in intestinal tumors. Oncogene 1999; 18 : 2883–91. 13. Stetler Stevenson WG, Liotta LA, Kleiner DE Jr. Extracellular matrix 6: role of matrix metalloproteinases in tumor invasion and metastasis. FASEB J 1993; 7 : 1434–41. 14. Basset P, Okada A, Chenard MP, et al. Matrix metalloproteinases as stromal effectors of human carcinoma progression: therapeutic implications. Matrix Biol 1997; 15 : 535–41. 15. DeClerck YA, Perez N, Shimada H, Boone TC, Langley KE, Taylor SM. Inhibition of invasion and metastasis in cells transfected with an inhibitor of metalloproteinases. Cancer Res 1992; 52 : 701–8. 16. Martin DC, Fowlkes JL, Babic B, Khokha R. Insulin like growth factor II signaling in neoplastic proliferation is blocked by transgenic expression of the metalloproteinase inhibitor TIMP-1. J Cell Biol 1999; 146 : 881–92. 17. Whitelock JM, Murdoch AD, Iozzo RV, Underwood PA. The degradation of human endothelial cell-derived perlecan and release of bound basic fibroblast growth factor by stromelysin, collagenase, plasmin, and heparanases. J Biol Chem 1996; 271 : 10079–86. 18. Van den Steen PE, Proost P, Wuyts A, Van Damme J, Opdenakker G. Neutrophil gelatinase B potentiates interleukin-8 tenfold by aminoterminal processing, whereas it degrades CTAP-III, PF-4, and GRO- alpha and leaves RANTES and MCP-2 intact. Blood 2000; 96 : 2673–81. 19. Lombard MA, Wallace TL, Kubicek MF, et al. Synthetic matrix metalloproteinase inhibitors and tissue inhibitor of metalloproteinase (TIMP)-2, but not TIMP-1, inhibit shedding of tumor necrosis factor-α receptors in a human colon adenocarcinoma (Colo 205) cell line. Cancer Res 1998; 58 : 4001–7. 20. Henriet P, Zhong ZD, Brooks PC, Weinberg KI, DeClerck YA. Contact with fibrillar collagen inhibits melanoma cell proliferation by upregulating p27KIP1. Proc Natl Acad Sci USA 2000; 97 : 1026–31. 21. Petitclerc E, Stromblad S, von Schalscha TL, et al. Integrin alpha(v)beta3 promotes M21 melanoma growth in human skin by regulating tumor cell survival. Cancer Res 1999; 59 : 2724–30. 22. Boulay A, Masson R, Chenard MP, et al. High cancer cell death in syngeneic tumors developed in host mice deficient for the stromelysin-3 matrix metalloproteinase. Cancer Res 2001; 61 : 2189–93. 23. Wu E, Mari BP, Wang F, Anderson IC, Sunday ME, Shipp MA. Stromelysin-3 suppresses tumor cell apoptosis in a murine model. J Cell Biochem 2001; 82 : 549–55. 24. Bergers G, Javaherian K, Lo KM, Folkman J, Hanahan D. Effects of angiogenesis inhibitors on multistage carcinogenesis in mice. Science 1999; 284 : 808–12. 25. Cornelius LA, Nehring LC, Harding E, et al. Matrix metalloproteinases generate angiostatin: effects on neovascularization. J Immunol 1998; 161 : 6845–52. 26. Patterson BC, Sang QA. Angiostatin-converting enzyme activities of human matrilysin (MMP-7) and gelatinase B/type IV collagenase (MMP-9). J Biol Chem 1997; 272 : 28823–5. 27. O’Reilly MS, Wiederschain D, Stetler-Stevenson WG, Folkman J, Moses MA. Regulation of angiostatin production by matrix metalloproteinase-2 in a model of concomitant resistance. J Biol Chem 1999; 274 : 29568–71. 28. Wen W, Moses MA, Wiederschain D, Arbiser JL, Folkman J. The generation of endostatin is mediated by elastase. Cancer Res 1999; 59 : 6052–6. 29. Mignatti P, Robbins E, Rifkin DB. Tumor invasion through the human amniotic membrane: requirement for a proteinase cascade. Cell 1986; 47 : 487–98. 30. Koop S, Khokha R, Schmidt EE, et al. Overexpression of metalloproteinase inhibitor in B16F10 cells does not affect extravasation but reduces tumor growth. Cancer Res 1994; 54 : 4791–7. 31. Hidalgo M, Eckhardt SG. Development of matrix metalloproteinase inhibitors in cancer therapy. J Natl Cancer Inst 2001; 93 : 178–93. 32. Brown PD. Clinical studies with matrix metalloproteinase inhibitors. APMIS (Copenhagen) 1999; 107 : 174–80. 33. Rudek MA, Figg WD, Dyer V, et al. Phase I clinical trial of oral COL-3, a matrix metalloproteinase inhibitor, in patients with refractory metastatic cancer. J Clin Oncol 2001; 19 : 584–92. 34. Davies B, Brown PD, East N, Crimmin MJ, Balkwill FR. A synthetic matrix metalloproteinase inhibitor decreases tumor burden and prolongs survival of mice bearing human ovarian carcinoma xenografts. Cancer Res 1993; 53 : 2087–91. 35. Shalinsky DR, Brekken J, Zou H, et al. Broad antitumor and antiangiogenic activities of AG3340, a potent and selective MMP inhibitor undergoing advanced oncology clinical trials. Ann NY Acad Sci 1999; 878 : 236–70. 36. Chirivi RG, Garofalo A, Crimmin MJ, et al. Inhibition of the metastatic spread and growth of B16-BL6 murine melanoma by a synthetic matrix metalloproteinase inhibitor. Int J Cancer 1994; 58 : 460–4. 37. Eccles SA, Box GM, Court WJ, Bone EA, Thomas W, Brown PD. Control of lymphatic and hematogenous metastasis of a rat mammary carcinoma by the matrix metalloproteinase inhibitor batimastat (BB-94). Cancer Res 1996; 56 : 2815–22. 38. Giavazzi R, Garofalo A, Ferri C, et al. Batimastat, a synthetic inhibitor of matrix metalloproteinases, potentiates the antitumor activity of cisplatin in ovarian carcinoma xenografts. Clin Cancer Res 1998; 4 : 985–92. 39. Parsons SL, Watson SA, Steele RJ. Phase I/II trial of batimastat, a matrix metalloproteinase inhibitor, in patients with malignant ascites. Eur J Surg Oncol 1997; 23 : 526–31. 40. Wojtowicz-Praga S, Torri J, Johnson M, et al. Phase I trial of Marimastat, a novel matrix metalloproteinase inhibitor, administered orally to patients with advanced lung cancer. J Clin Oncol 1998; 16 : 2150–6. 41. Hande K, Wilding G, Ripple G, et al. A phase I study of AG3340, a matrix metalloprotease inhibitor, in patients having advanced cancer. Ann Oncol 1998; 9 : 74 (abstract). 42. Erlichman C, Adjei AA, Alberts SR, et al. Phase I study of the matrix metalloproteinase inhibitor, BAY 12-9566. Ann Oncol 2001; 12 : 389–95. 43. Ferrante K, Winograd B, Canetta R. Promising new developments in cancer chemotherapy. Cancer Chemother Pharmacol 1999; 43 (suppl) : S61–8. 44. Levitt NC, Eskens FA, O’Byrne KJ, et al. Phase I and pharmacological study of the oral matrix metalloproteinase inhibitor, MMI270 (CGS27023a), in patients with advanced solid cancer. Clin Cancer Res 2001; 7 : 1912–22. 45. Macaulay VM, O’Byrne KJ, Saunders MP, et al. Phase I study of intrapleural batimastat (BB-94), a matrix metalloproteinase inhibitor, in the treatment of malignant pleural effusions. Clin Cancer Res 1999; 5 : 513–20. 46. Zucker S, Cao J, Chen WT. Critical appraisal of the use of matrix metalloproteinase inhibitors in cancer treatment. Oncogene 2000; 19 : 6642–66. 47. Bremer C, Tung CH, Weissleder R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nat Med 2001; 7 : 743–8. 48. Wielockx B, Lannoy K, Shapiro SD, et al. Inhibition of matrix metalloproteinases blocks lethal hepatitis and apoptosis induced by tumor necrosis factor and allows safe antitumor therapy. Nat Med 2001; 7 : 1202–8. |