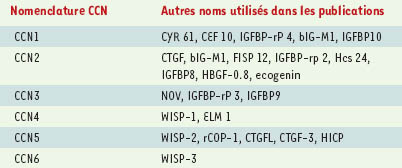
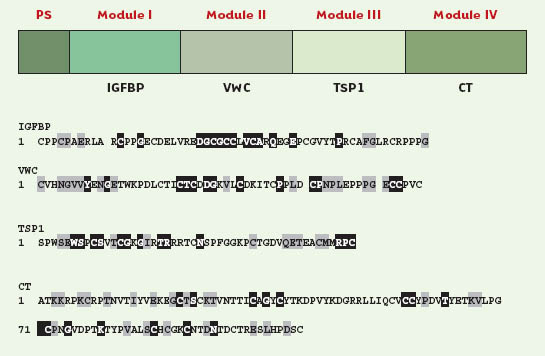
1.
Bork P. The modular architecture of a new family of growth regulators related to connective tissue growth factor. FEBS Lett 1993; 327 : 125–30.
2.
Lau LF, Nathans D Expression of a set of growth-related immediate early genes in BALB :c 3T3 cells :coordinate regulation with c-fos or c-myc. Proc Natl Acad Sci USA 1987; 84 :1182–6.
3.
Simmons D, Levy D, Yannoni Y, Erikson RL. Identification of a phorbol esterrepressible v-src inducible gene. Proc Natl Acad Sci USA 1989; 86 : 1178–82.
4.
Almendral J, Sommer D, Mac Donald-Bravo H, Burckhardt J, Perera J, Bravo R. Complexity of the early genetic response to growth factors in mouse fibroblasts. Mol Cell Biol 1998; 8 : 2140–8.
5.
Ryseck RP, Macdonald-Bravo H, Mattei MG, Bravo R. Structure, mapping, and expression of fisp-12, a growth factor- inducible gene encoding a secreted cysteine-rich protein. Cell Growth Differ 1991; 2 : 225–33.
6.
Bradham DM, Igarashi A, Potter RL, Grotendorst GR. Connective tissue growth factor: a cysteine-rich mitogen secreted by human vascular endothelial cells is related to the SRC-induced immediate early gene product CEF-10. J Cell Biol 1991; 114 : 1285–94.
7.
Joliot V, Martinerie C, Dambrine G, et al. Proviral rearrangements and overexpression of a new cellular gene (nov) in myeloblastosis-associated virus type 1-induced nephroblastomas. Mol Cell Biol 1992; 12 : 10–21.
8.
Perbal B. Contribution of MAV-1-induced nephroblastoma to the study of genes involved in human Wilms’ tumor development.Crit Rev Oncog 1994; 5 : 589–613.
9.
Pennica D, Swanson TA, Welsh JW, et al. WISP genes are members of the connective tissue growth factor family that are up-regulated in Wnt-1-transformed cells and aberrantly expressed in human colon tumors. Proc Natl Acad Sci USA 1998; 95 : 14717–22.
10.
Zhang R, Averboukh L, Zhu W, et al. Identification of rCop-1, a new member of the CCN protein family, as a negative regulator for cell transformation. Mol Cell Biol 1998; 18 : 6131–41.
11.
Hashimoto BY, Shindo-Okada N, Tani M, et al. Expression of the ELM1 gene, a novel gene of the CCN (connective tissue growth factor, Cyr61/Cef10, and nephroblastoma overexpressed gene) family, suppresses in vivo tumor growth and metastasis of K- 1735 murine melanoma cells.J Exp Med 1998; 187 : 289–96.
12.
Perbal B. Nov (nephroblastoma overexpressed) and the CCN family of genes: structural and functional issues. Mol Pathol 2001; 54 : 57–79.
13.
Brigstock DR. The connective tissue growth factor/cysteine-rich 61/nephroblastoma overexpressed (CCN) family. Endocrinol Rev 1999; 20 : 189–206.
14.
Lau LF, Lam SC. The CCN family of angiogenic regulators: the connection. Exp Cell Res 1999; 248 : 44–57.
15.
Essam ED, Moussad A, Brigstock D. Connective tissue growth factor: What’s in a name. Mol Genet Metab 2000; 71 : 276–92.
16.
Kireeva M, Latinkic B, Kolesnikova T, et al. Cyr61 and Fisp12 are both ECM-associated signaling molecules: activities, metabolism, and localization during development. Exp Cell Res 1997; 233 : 63–77.
17.
Yang GP, Lau LF. Cyr61, product of a growth factor-inducible immediate early gene, is associated with the extracellular matrix and the cell surface.Cell Growth Differ 1991; 2 : 351–7.
18.
O’Brien TP, Yang GP, Sanders L, Lau LF. Expression of cyr61, a growth factor-inducible immediate-early gene.Mol Cell Biol 1990; 10 : 3569–77.
19.
Perbal B. Caractérisation et expression du protooncogène nov humain dans les tumeurs de Wilms.Bull Cancer (Paris) 1994; 81 : 957–61.
20.
Thomopoulos G, Kyurkchiev S, Perbal B Immunocytochemical localization of NOVH and ultrastructural characteristics of NCIH295R cells. J Submicrosc Cytol Pathol 2001; 33 : 251–60.
21.
Perbal B. Nuclear localization of NOV protein: a potential role for nov in the regulation of gene expression. Mol Pahol 1999; 52 : 84–91.
22.
Hwa V, Oh Y, Rosenfeld R. The insulin-like growth factor-binding protein (IGFBP) superfamily. Endocrinol Rev 1999; 20 : 761–87.
23.
Chou PY, Fasman GD. Prediction of protein conformation. Biochemistry 1974; 13 : 222–45.
24.
Burren C, Wilson E, Hwa V, Oh Y, Rosenfeld R. Binding properties and distribution of insulin-like growth factor binding protein-related protein 3 (IGFBPrP3/NovH), an additional member of the IGFBP superfamily. J Clin Endocrinol Metab 1999; 84 : 1096–103.
25.
Kim HS, Nagalla SR, Oh Y, Wilson E, Roberts CT Jr, Rosenfeld RG. Identification of a family of low-affinity insulin-like growth factor binding proteins (IGFBPs): characterisation of connective tissue growth factor as a member of the IGFBP super family.Proc Natl Acad Sci USA 1997; 94 : 12981–6.
26.
Chevalier G, Yeger H, Martinerie C, et al. NovH: differential expression in developing kidney and Wilms’ tumors. Am J Pathol 1998; 152 : 1563–75.
27.
Perbal B, Martinerie C, Sainson R, Werner M, He B, Roizman B. The C-terminal domain of the regulatory proteinNOVH is sufficient to promote interaction with fibulin 1C: a clue for a role of NOVH in celladhesion signaling.Proc Natl Acad Sci USA 1999; 96 : 869–74.
28.
Ayer-Lelievre C, Brigstock D, Lau L, Pennica D, Perbal B, Yeger H. Report on the first international workshop on the CCN family of genes. Mol Pathol 2001; 54 : 105–7.
29.
O’Brien TP, Lau LF. Expression of the growth factor-inducible immediate early gene cyr61 correlates with chondrogenesis during mouse embryonic development. Cell Growth Differ 1992; 3 : 645–54.
30.
Babic A, Kireeva M, Kolesnikova T, Lau L. CYR61, a product of a growth factor-inducible immediate early gene, promotes angiogenesis and tumor growth. Proc Natl Acad Sci USA 1998; 95 : 6355–60.
31.
Nakanishi T, Kimura Y, Tamura T, et al. Cloning of a mRNA preferentially expressed in chondrocytes by differential display-PCR from a human chondrocytic cell line that is identical with connective tissue growth factor (CTGF) mRNA. Biochem Biophys Res Commun 1997; 234 : 206–10.
32.
Wong M, Kireeva M, Kolesnikova T, Lau L. Cyr61, Product of a growth factor-inducible immediate-early gene, regulates chondrogenesis in mouse limb bud mesenchymal cells. Dev Biol 1997; 192 : 492–508.
33.
Kocialkowski S, Yeger H, Kingdom J, Perbal B, Schofield P. Expression of the human nov gene in first trimester fetal tissues. Anat Embryol 2001; 203 : 417–27.
34.
Katsube KI, Chuai ML, Liu YC, et al. The expression of chicken nov, a member of the CCN gene family in early stage development. Gene expression pattern. Brain Res 2002; 1 : 61–5.
35.
Blom IE, van Dijk AJ, Wieten L, et al. In vitro evidence for differential involvement of CTGF, TGFbeta, and PDGF-BB in mesangial response to injury. Nephrol Dial Transplant 2001; 16 : 1139–48.
36.
Tsai MS, Hornby AE, Lakins J, Lupu R. Expression and function of CYR61, an angiogenic factor, in breast cancer cell lines and tumor biopsies. Cancer Res 2000; 60 : 5603–7.
37.
Glukhova L, Angevin E, Lavialle C, et al. Specific genomic alterations associated with poor prognosis in high grade renal cell carcinomas. Cancer Genet Cytogenet 2001; 130 : 105-10.
38.
Maillard M, Cadot B, Ball RY, et al. Differential expression of novH proto-oncogene in human prostate cell lines and tissues. Mol Pathol 2001; 54 : 275–80.
39.
Frazier K, Grotendorst G. Expression of connective tissue growth factor mRNA in the fibrous stroma of mammary tumors. Int J Biochem Cell Biol 1997; 29 : 153–61.
40.
Kireeva ML, Latinkic BV, Kolesnikova TV, et al. Cyr61 and Fisp12 are both ECM-associated signaling molecules: activities, metabolism, and localization during development. Exp Cell Res 1997; 233 : 63–77.
41.
Scholz G, Martinerie C, Perbal B, Hanafusa H. Transcriptional down regulation of the nov proto-oncogene in fibroblasts transformed by p60v-src.Mol Cell Biol 1996; 16 : 481–6.
42.
Liu C, Liu XJ, Crowe PD, et al. Nephroblastoma overexpressed gene (NOV) codes for a growth factor that induces protein tyrosine phosphorylation. Gene 1999; 238 : 471–8.
43.
Kireeva ML, MO FE, Yang GP, Lau LF. Cyr61, a product of a growth factor-inducible immediate-early gene, promotes cell proliferation, migration, and adhesion. Mol Cell Biol 1996; 16 : 1326–34.
44.
Grzeszkiewicz TM, Kirschling DJ, Chen N, Lau LF. CYR61 Stimulates human skin fibroblast migration through integrin alpha vbeta 5 and enhances mitogenesis through integrin alpha vbeta 3, independent of its carboxyl-terminal domain. J Biol Chem 2001; 276 : 1943-50.45.
45.
Chen N, Chen CC, Lau LF. Adhesion of human skin fibroblasts to Cyr61 is mediated through integrin alpha 6beta 1 and cell surface heparan sulfate proteoglycans. J Biol Chem 2000; 275 : 24953–61.
46.
Chen CC, Chen N, Lau LF. The angiogenic factors Cyr61 and connective tissue growth factor induce adhesive signaling in primary human skin fibroblasts. J Biol Chem 2001; 276 : 10443–52.
47.
Manara MC, Perbal B, Benini S, et al. The expression of ccn3(nov) gene in musculoskeletal tumors. Am J Pathol 2002; 160 : 849–59.
48.
Gupta N, Wang, H, McLeod TL, et al. Inhibition of glioma cell growth and tumorigenic potential by CCN3(NOV). Mol Pathol 2001; 54 : 293–9.
49.
Koliopanos A, Friess H, Di Mola FF, et al. Connective tissue growth factor gene expression alters tumor progression in esophageal cancer. World J Surg 2002; 26 : 420–7.
50.
Shimo T, Nakanishi T, Nishida T, et al. Involvement of CTGF, a hypertrophic chondrocyte specific gene product in tumor angiogenesis. Oncology 2001; 61 : 315–22.
51.
Saxena N, Banerjee S, Sengupta K, Zoubine MN, Banerjee SK. Differential expression of WISP-1 and WISP-2 genes in normal and transformed human breast cell lines. Mol Cell Biochem 20011; 228 : 99–104.
52.
Tsai MS, Bogart DF, Li P, Mehmi L, Lupu R. Expression and regulation of cyr61 in human breast cancer cell lines. Oncogene 2002; 21 : 964–73.
53.
Xie D, Nakachi K, Wang H, Elashoff R, Koeffer HP. Elevated levels of connective tissue growth factor, WISP1 and CYR61 in primary breast cancers associated with more advanced features. Cancer Res 2001; 15 : 8917–23.
54.
Kleer C, Zhang Y, Pan Q, et al. Wisp3 is a novel tumor suppressor gene of inflammatory breast cancer. Oncogene 2002 (sous presse).
55.
Leng E, Malcom T, Tai G, Estable M, Sadowski I. Organization and expression of the cyr61 gene in normal human fibroblasts. J Biomed Sci 2002; 9 : 59–67.
56.
Tanaka S, Sugimachi K, Saeki H, et al. A novel variant of WISP1 lacking a von Willebrand type C module overexpressed in scirrhous gastric carcinoma. Oncogene 2001; 20 : 5525–32.