| |
| Med Sci (Paris). 2002 August; 18(8-9): 804–805. Published online 2002 August 15. doi: 10.1051/medsci/20021889804.Trois surdités, deux modèles murins, un seul gène, TMC1 Simone Gilgenkrantz 9, rue Basse, 54330 Clerey-sur-Brenon, France |
Les nombreux gènes identifiés dans les surdités héréditaires permettent d’entrevoir à présent les molécules essentielles pour le développement, la structure et le fonctionnement des cellules ciliées de l’oreille interne. Le nouveau gène qui vient d’être découvert et qui est impliqué à la fois dans une surdité dominante et dans une surdité récessive fait partie des gènes essentiels au fonctionnement des cellules ciliées de la cochlée. |
Deux formes de surdités au locus 9q13-21 Dans une grande famille nord-américaine a été observée une surdité de transmission dominante, dont les premières manifestations apparaissent vers l’âge de 5 à 10 ans pour aboutir à une surdité profonde vers 10-15 ans. Le locus a pu être situé en 9q13-21 et la maladie classée comme DFNA36 [1]. Dans la même région chromosomique, se trouve aussi le locus d’une surdité récessive congénitale profonde observée dans des familles consanguines. Elle est appelée DFNB7/B11 car deux types, DFNB7 [2] et DFNB11 [3], avaient été initialement décrits. Mais la similitude clinique, ainsi que celle du locus, ont finalement fait conclure à une seule et même entité. Cette forme de surdité non syndromique est fréquente en Inde et au Pakistan. |
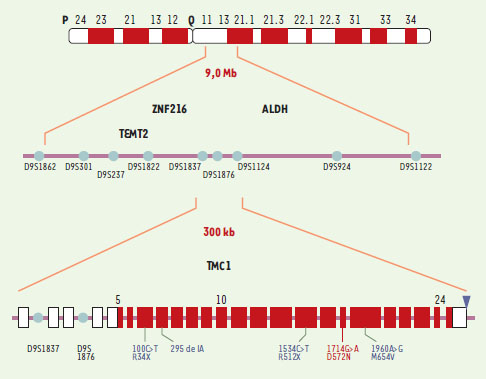
Clonage positionnel du gène TMC1Pour parvenir à trouver un ou plusieurs gènes sur ce locus, un groupe de chercheurs américains a d’abord réduit la région candidate puis analysé les gènes qui s’y trouvaient : TMEM2 codant pour la protéine transmembranaire 2, ZNF216 pour une protéine en doigt de zinc, ALDH1A1 pour une aldéhyde déshydrogénase, et TMC1, entre autres. Seul, le gène TMC1 (transmembrane cochlear-expressed gene) s’est révélé porteur de mutations dans les deux maladies [1]. Dans la famille DFNA36, il s’agit d’une transition G➝A avec remplacement d’une asparagine par un acide aspartique en position 572 (très conservée au cours de l’évolution). Dans 11 familles consanguines atteintes de surdité récessive correspondant à DFNB7/B11, ce sont d’autres mutations (délétion non-sens dans un site d’épissage) qui ont été découvertes, dont la mutation R34X qui semble assez répandue dans les familles originaires du Pakistan. Plusieurs centaines de familles témoins ont été analysées, (dont 283 de la même origine ethnique) pour distinguer les mutations des polymorphismes (Figure 1).  | Figure 1. Carte physique de la région DFNA36/B7/B11 et structure de TMC1 (le triangle indique une séquence signal de polyadénylation). La mutation dominante (en rouge) et quelques-unes des mutations récessives (en bleu) sont indiquées. TEMT2 : protéine transmembranaire 2 ; ALDH : aldéhyde déshydrogénase. |
|
Les modèles murins dn et BthUn modèle animal, la souris dn, avait été proposé pour DFNB7/B11 par l’équipe américaine qui vient d’isoler le gène TMC1. Après avoir trouvé que dn était bien dû à l’orthologue murin de TCM1, les chercheurs ont montré que les transcrits Tcm1 étaient absents chez les souris dn/dn. Puis, par amplification et séquençage, ils ont pu voir que la mutation dn correspondait à une délétion de Tmc1 ayant emporté tout l’exon 14 et les régions adjacentes des introns 13 et 14 [1]. Mais les recoupements ne s’arrêtent pas là, car, dans un programme de mutagenèse par ENU (N-éthyl-N-nitroso-urée), un autre mutant, appelé Beethoven (Bth), avait été observé, avec surdité progressive et transmise en dominance. Là encore, c’est bien Tmc1 qui est en cause, avec transversion T➝A dans l’exon 13 devant entraîner le remplacement d’une méthionine par une lysine (M412K) [4]. L’étude des mutants Bth-/+ montre que la cochlée est normale à la naissance, mais qu’à 30 jours de vie, il apparaît une dégénérescence des cellules ciliées internes. Les mutants homozygotes Bth/Bth ont, quant à eux, une dégénérescence complète des cellules ciliées internes et externes dès les jours qui suivent la naissance, semblable à celle qui se produit chez les mutants dn/dn. |
Quelle est la nature et la fonction de la protéine TMC1 ? En l’absence de similitude avec d’autres protéines connues, il est difficile de s’en faire une idée précise. On peut prédire six domaines transmembranaires, avec une orientation cytoplasmique pour les extrémités C- et N-terminales. Chez l’homme, comme chez la souris, selon les mutations, la surdité est dominante ou récessive. L’hypothèse d’une perte de fonction pour les mutations de DFNB7/B11 peut être proposée, alors que, dans la forme dominante, des mutations comme D572N chez l’homme et M412K chez la souris peuvent peut-être produire un polypeptide capable de s’assembler avec l’allèle normal et d’exercer un effet dominant négatif sur l’activité du complexe formé. |
En recherchant dans les banques de données par homologie de séquence, un autre gène localisé en 20p13 a été retrouvé et baptisé TMC2. L’orthologue murin a aussi été identifié. TMC2 et Tmc2 ne présentent de divergences avec TMC1 et Tmc1 que dans les extrémités Cet N-terminales. L’étude des ARNm de Tmc1 et de Tmc2 au cours du développement embryonnaire et dans les jours qui suivent la naissance chez des souris C27BL/6J montre que ceux-ci sont présents dans la cochlée. Leur concentration s’élève entre 5 et 20 jours après la naissance (P), suivant une courbe qui correspond à celle des gènes Pre et Myo15a (codant pour la prestine et pour la myosine) spécifiquement exprimés dans les cellules ciliées, avec un pic à P12. Bien qu’aucune surdité humaine ne puisse à présent être rapportée au locus de TMC2, chez la souris, le mutant Tailchaser (Tlc) qui présente à la fois une perte de l’audition et des troubles vestibulaires [5] est peut-être dû à une mutation de Tmc2 (localisé sur le chromosome 2 murin). Il conviendra de le vérifier et de rechercher s’il n’existe pas d’autres gènes de cette famille TMC. |
Conclusions et hypothèses Les phénotypes distincts des mutants dn et Bth, l’expression spécifique du transcrit Tmc1 dans les cellules ciliées, le pic à P12, qui correspond au début de la fonction auditive chez la souris, et la prédiction de six domaines transmembranaires, font supposer que TMC1 code pour une protéine transmembranaire indispensable à la fonction cochléaire. L’hypothèse d’un canal ionique est séduisante. Grâce aux deux modèles murins, par immunolocalisation et études électrophysiologiques, il sera peut-être possible de le démontrer. La compréhension des mécanismes physiopathologiques de Tmc1 pourrait apporter des renseignements sur la perte progressive de l’audition au cours du vieillissement, à type de presbyacousie, que l’on suppose être liée à une dégénérescence des cellules ciliées. |
1. Kurima K, Peters LM, Yang Y, et al. Dominant and recessive deafness caused by mutations of a novel gene, TMC1, required for cochlear hair-cell function. Nat Genet 2002; 30 : 277–83. 2. Jain PK, Fukushima K, Deshmukh D, et al. A human recessive neurosensory non syndromic hearing impairement locus is a potential homologue of the murine deafness (dn) locus. Hum Mol Genet 1995; 4 : 2391–4. 3. Van Camp G, Willems PJ, Smith RJH. Nonsyndromic hearing impairment : unparalleled heterogeneity. Am J Hum Genet 1997; 60 : 758–64. 4. Vreugde S, Erven A, Kros CJ, et al. Beethoven, a mouse model for dominant progessive hearing loss DFNA36. Nat Genet 2002; 30 : 257–8. 5. Kiernan AE, Zalzman M, Fuchs H, et al. Tailchaser (Tlc) : a new mouse mutation affecting bundle differenciation and hair survival. J Neurocytol 1999; 28 : 969–85. |