| |
| Med Sci (Paris). 2002 August; 18(8-9): 853–860. Published online 2002 August 15. doi: 10.1051/medsci/20021889853.L’élimination des cellules apoptotiques : une phagocytose particulière Mélanie Alibert and Giovanna Chimini* Centre d’Immunologie Inserm-Cnrs de Marseille Luminy, Case 906, Parc Scientifique de Luminy, 13288, Marseille Cedex 09, France |
Le programme de mort cellulaire par apoptose est en charge de l’homéostasie cellulaire au cours du développement, dans les situations physiologiques et pathologiques. Deux volets le composent. Une première phase effectrice, d’induction et de mise en place de la mort cellulaire proprement dite, conduit au démantèlement cellulaire. Elle est contre-balancée par une phase d’élimination de la cellule mourante qui débute le plus souvent avant le démantèlement complet de celle-ci, via une phagocytose spécialisée, l’engulfment selon les auteurs anglais. Engloutir une cellule en apoptose est un acte particulier dans l’univers de la phagocytose. Tout d’abord, les proies à engloutir sont des cellules du soi et non pas des pathogènes. De plus, le système doit être constamment et constitutivement actif du fait de la production continue de cadavres dans l’organisme et, enfin, contrairement aux formes classiques de phagocytose, engloutir une proie apoptotique déclenche une réponse antiinflammatoire de la part du phagocyte. Cela est étroitement lié à la précocité du processus : l’ingestion ayant lieu bien avant la lyse de la cellule, sa membrane cellulaire est encore parfaitement intègre. Un autre trait original de cette forme de phagocytose est le fait que ses acteurs peuvent être des phagocytes professionnels, tels que les macrophages, mais aussi des amateurs tels que les cellules dendritiques, les fibroblastes ou les hépatocytes. Plusieurs étapes se succèdent pour permettre une clairance efficace des cellules en apoptose. Le recrutement de phagocytes est bien évidemment requis dans les lieux où se produit la mort cellulaire. Celui-ci résulte probablement d’un chimiotactisme positif, bien qu’aucun médiateur spécifique n’ait pu être mis en évidence à ce jour. Une fois sur place, le phagocyte doit être en mesure de reconnaître la cellule condamnée à mourir dans une population de cellules saines. Cette reconnaissance requiert la participation des deux partenaires : d’une part, la cellule en apoptose, qui doit exhiber des signaux de mort et, d’autre part, le phagocyte, le plus souvent un macrophage, qui doit être en mesure de les interpréter efficacement. L’ingestion proprement dite, amorcée par l’activation d’une cascade de signalisation, intervient après la reconnaissance. Elle conduit, in fine, à une réponse cellulaire complexe, capable de moduler la réponse immune. |
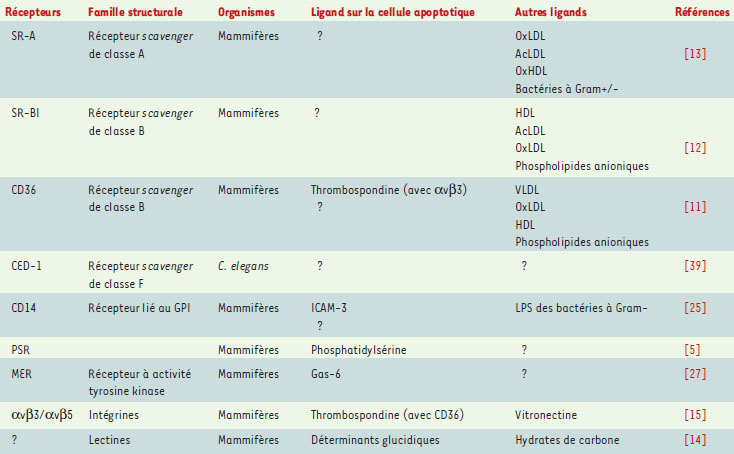
La reconnaissance : un phénomène de surface La membrane de la cellule apoptotique L’exécution de la mort cellulaire programmée engendre des modifications morphologiques bien connues : condensation nucléaire et cytoplasmique, bourgeonnement de la membrane plasmique [ 1]. Ce démantèlement cellulaire est essentiellement dépendant de l’activation d’une famille de cystéine protéases, les caspases [ 1] (→). Des modifications de la surface cellulaire interviennent également au cours de l’apoptose et constituent le fondement de la reconnaissance de la cellule mourante par le phagocyte. La seule qui soit clairement étudiée est l’exposition de résidus phosphatidylsérine à la surface cellulaire, leur localisation normale étant restreinte au feuillet interne de la membrane [ 2, 3]. L’externalisation des résidus phosphatidylsérine au cours de l’apoptose résulte de la régulation croisée de plusieurs activités enzymatiques [ 4]. D’une part, l’aminophospholipide translocase, responsable de la distribution asymétrique des résidus phosphatidylsérine en faveur du feuillet interne, est ici inhibée. D’autre part, la scramblase - enzyme capable d’homogénéiser la distribution des phospholipides entre les feuillets membranaires - est ici activée, d’une façon dépendante du calcium [ 2]. Bien que le phénomène d’externalisation des résidus phosphatidylsérine ait été corrélé à l’activité des caspases, le débat demeure ouvert. En fait, aucune étude n’a montré que les molécules définies aujourd’hui comme translocase et scramblase étaient des cibles directes des caspases et, par ailleurs, des inducteurs de mort dont l’action est indépendante des caspases peuvent provoquer l’externalisation de résidus phosphatidylsérine [ 5]. D’autres mécanismes, indirects, pourraient participer à l’externalisation des résidus phosphatidylsérine. Dans des conditions physiologiques normales, les résidus phospha-tidylsérine seraient associés à des protéines du cytosquelette telles que la fodrine. Or, durant l’apoptose, le clivage précoce de la fodrine pourrait libérer les résidus phospha-tidylsérine de leur association mécanique au feuillet interne de la membrane [ 2]. On notera aussi que l’exposition anormale de résidus phosphatidylsérine à la membrane peut être observée lors du processus de mort cellulaire non apoptotique et que les autres mécanismes de mort n’altèrent pas de façon significative la mise en place du système d’élimination des cadavres [ 6– 8]. L’exposition de résidus phosphatidylsérine à la surface de la cellule est un signal reconnu de manière très efficace par le phagocyte professionnel. En effet, il est établi que les macrophages perçoivent aisément les cellules présentant une perte de l’asymétrie phospholipidique membranaire et peuvent notamment reconnaître spécifiquement les résidus phosphatidylsérine [ 2, 3]. En dépit de nombreux efforts expérimentaux, les mécanismes de reconnaissance des résidus phosphatidylsérine par le phagocyte sont restés longtemps spéculatifs et ce n’est que récemment qu’un récepteur stéréospécifique de la phosphatidylsé-rine a été identifié (→→) [ 9]. (→) m/s 1998, n°1, p. 9 (→→) m/s 2001, n°3, p. 385 L’externalisation des résidus phosphatidylsérine sur le feuillet externe de la membrane de la cellule apoptotique n’est probablement qu’un témoignage très partiel des modifications membranaires profondes survenant dans la cellule mourante. En effet, à titre d’exemple, on rappellera que la mobilisation de phospholipides anioniques sur le feuillet externe n’est pas un événement isolé, mais induit un mouvement en sens opposé de la sphingomyéline, normalement localisée sur le feuillet externe de la membrane [10]. Cette translocation la rend accessible à la sphingomyélinase et sa dégradation enzymatique secondaire libère et redistribue en cascade le cholestérol membranaire. Il en résulte donc une réorganisation complète de la distribution inter-feuillets des lipides membranaires. D’autres modifications concernent les hydrates de carbone exposés à la surface. Cela a été suggéré par l’identification des lectines comme récepteur de l’engulfment à la surface du phagocyte [11, 12], mais aussi par l’altération des charges électriques observée à la surface de la cellule en apoptose [12, 13]. Ces hydrates de carbone modifiés pourraient résulter, en fait, de glycosylations incomplètes à la suite d’un dérèglement des événements de fusion entre la membrane plasmique et les compartiments membranaires intracellulaires dans la cellule mourante. Les modifications de la distribution lipidique de la membrane pourraient provoquer la redistribution, voire l’agrégation, des glycoprotéines et, par conséquent, engendrer de nouveaux déterminants glucidiques. L’appareil membranaire du phagocyte De nombreuses molécules de surface ont été impliquées dans la reconnaissance des cellules apoptotiques. Ces récepteurs, identifiés en règle générale grâce à des tests d’inhibition ou de reconstitutions fonctionnelles in vitro, s’avèrent être pour la plupart des molécules dites à ligands multiples [ 14]. Cette particularité les rend multifonctionnels d’où leur implication - outre l’ engulfment -dans diverses situations physiologiques sans rapport avec celui-ci, telles que l’immunité innée, le métabolisme des lipides ou l’adhérence cellulaire. Comme cela est souligné dans le Tableau I, beaucoup parmi les récepteurs de l’ engulfment sont capables d’interagir avec des structures anioniques dont les résidus phosphatidylsérine. Cependant, aucun ne présente la spécificité d’interaction requise pour être considéré comme le récepteur propre des résidus phosphatidylsérine.  | Tableau I. Récepteurs impliqués dans la reconnaissance de la cellule apoptotique. LDL : low density lipoproteins ; HDL : high density lipoproteins ; LPS : lipopolysaccharide ; AcLDL : acetylated low density lipoprotein ; OxLDL : oxidized low density lipoprotein ; VLDL : very low density lipoproteins. |
Dans ce contexte, il est intéressant de remarquer que l’expression des récepteurs « multiligands » est en général assez large et comprend, au-delà des macrophages, les types cellulaires capables d’agir en tant que phagocytes amateurs au cours de la mort cellulaire programmée [15–17]. On trouve parmi les récepteurs de l’engulfment des protéines de la famille des lectines qui interviennent dans la reconnaissance de lymphocytes apoptotiques par les macrophages ou encore des hépatocytes apoptotiques par leurs congénères viables [18]. On trouve aussi les intégrines [19] αvβ3 [20] ou αvβ5[21] qui sont utilisées préférentiellement par les phagocytes amateurs (→). Au cours de la reconnaissance de la proie, les intégrines peuvent agir seules ou de concert avec un autre récepteur multiligand, le récepteur scavenger de classe B, CD36 [15, 21, 22]. La coopération moléculaire αvβ3/CD36, qui intervient lors de l’ingestion de neutrophiles par les macrophages, permettrait la formation de sites de liaison de haute affinité pour la thrombospondine. Cette dernière servirait de pont entre les deux partenaires cellulaires en reconnaissant des déterminants RGDS (Arg-Gly-Asp-Ser) à la surface de la cellule apoptotique et les intégrines couplées à CD 36 sur les phagocytes [22]. CD36 interviendrait également dans l’élimination par l’épithélium pigmentaire de la rétine des fragments du segment externe des bâtonnets (ROS, retine outer segments), un processus conceptuellement très proche de l’engulfment [23]. L’expression de CD36 est assez large et inclut notamment les endothéliums microvasculaires, les adipocytes, les cellules dendritiques, l’épithélium de la rétine, les cellules musculaires lisses ou encore les macrophages [15]. (→) m/s 2001, n°1, p. 111 CD36 n’est pas le seul récepteur scavenger impliqué dans l’engulfment, SR-BI [16] et les récepteurs scavenger de classe A [17, 24] entrent aussi en jeu mais seulement dans des situations particulières comme l’ingestion des thymocytes apoptotiques [24] et celle des cellules de Sertoli [25]. La pertinence de ces observations en situation physiologique n’est toutefois pas très claire et aucun défaut de phagocytose n’a été observé, à ce jour, dans les modèles animaux d’inactivation de ces récepteurs [26–28]. Une autre molécule multiligand, CD14, principalement connue comme récepteur du lipopolysaccharide des bactéries à Gram négatif [29], joue le rôle de récepteur dans l’engulfment [30]. CD14, ancré à la membrane par un groupement glycosyl phosphatidyl inositol (GPI) existe à la surface des macrophages, des monocytes et des granulocytes [29]. CD14 a la capacité d’interagir avec des phospholipides, mais sans préférence particulière pour les résidus phosphatidylsérine, et également avec la molécule d’adhérence ICAM-3 (intercellular adhesion molecule 3) [29], présente à la surface des leucocytes apoptotiques. Outre cette interaction apparemment limitée à un couple précis phagocyte-proie, l’activité lectine-like de CD14 pourrait l’impliquer dans un mécanisme plus général de reconnaissance de sucres à la surface de cellules mourantes. De façon surprenante, aucune réponse proinflammatoire n’est déclenchée par l’engagement de CD14 en tant que récepteur de l’engulfment [29]. Plus récemment, deux récepteurs spécifiques ont été identifiés. Il s’agit du récepteur des phosphatidylsérines [9] et du récepteur tyrosine kinase Mer [31]. Le récepteur des phosphatidylsérines [9] est une protéine transmembranaire de type II dépourvue d’homologie évidente avec d’autres récepteurs participant à l’ingestion des cellules apoptotiques. Elle est cependant extrêmement conservée au cours de l’évolution et des orthologues potentiels ont été identifiés chez le nématode et la drosophile. On connaît peu de choses pour l’instant de sa fonction moléculaire ou de son interaction avec d’autres récepteurs de surface. Une interaction avec CD36 est cependant envisageable. Le rôle de Mer, un membre de la famille des récepteurs à activité tyrosine kinase Mer-Axl-Tyro 3, a été déduit de l’observation d’une élimination réduite des cellules en apoptose chez les souris déficientes (merkd) [31]. Mer pourrait fonctionner comme récepteur de gas-6 (le produit du growth arrest-specific gene 6), une protéine soluble précédemment impliquée comme médiateur de la reconnaissance des résidus phosphatidylsérine [2]. Les animaux merkd présentent également une prédisposition à développer des maladies autoimmunes de type lupus érythémateux disséminé, confortant l’hypothèse selon laquelle un défaut de l’élimination des cellules apoptotiques peut conduire à un dérèglement de la réponse immunitaire [31]. La même prédisposition a été observée chez des souris déficientes en C1q. Celles-ci présentent à la fois une élimination défectueuse des corps apoptotiques au niveau rénal et l’apparition d’une glomérulonéphrite lupoïde [32]. C1q a la capacité de se lier aux cellules apopto-tiques [33] et, par l’intermédiaire de la calréticuline et de CD91, le récepteur de l’α2-macroglobuline, pourrait créer un pontage avec la surface du macrophage [34]. |
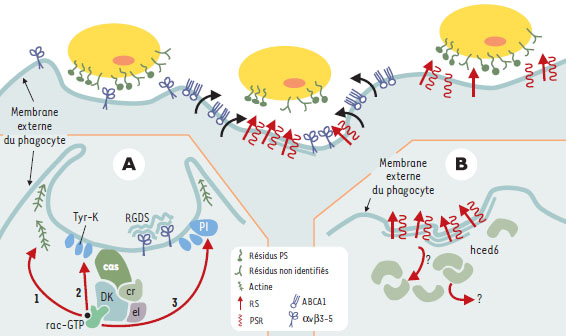
Les événements sous-membranaires Chez le nématode C. elegans, outil extrêmement précieux dans le domaine de la mort cellulaire programmée, deux voies sont à l’œuvre pour permettre l’ingestion de la proie par le phagocyte [35]. Elles ont été initialement définies par une analyse génétique, mais à l’heure actuelle les molécules impliquées ainsi que les interactions physiques qui les caractérisent ont été largement décryptées (Figure 1).  | Figure 1. Représentation schématique des différentes étapes de la phagocytose des cellules apoptotiques. La phase de reconnaissance est représentée dans la partie supérieure de la figure. La cellule apoptotique (en jaune) expose des signaux de surface (les résidus phosphatidylsérine [PS] et d’autres non identifiés) et le phagocyte (seule la membrane externe est figurée) utilise un jeu très complexe de récepteurs (sontreprésentés ici les intégrines ανβ3(33 et ανβ5(35, le récepteur de la phosphatidylsérine [PSR] [flèches rouges] et les récepteurs scavenger [RS] [serpentin rouge]. L’engagement initial des récepteurs conduit à leur redistribution autour de la proie (ce que figurent les flèches noires), favorisée par ABCA1 (en bleu). Les deux voies de signalisation sousmembranaires sont représentées dans la partie inférieure de la figure (encarts A et B). La voie dépendante des ntégrines (à gauche, A) (les intégrines sont liées au ligand RGDS) implique , chez les mammifères, p130Cas -as, CrkII – c (CED-2 chez C. elegans), DOCK180, DK (CED-5), Rac1 – rac (CED-10), ELMO – el (CED-12). L’activation de Rac-GTP conduit à la redistribution de l’actine (1), et au recrutement à la membrane des tyrosine kinases (Tyr-K) (2) et à l’activation de la PI-3 kinase (PI) (3). La deuxième voie (à droite, B) pourrait être déclenchée par l’engagement de récepteurs scavenger (RS) (CED-1) et du récepteur de la phosphatidylsérine (PSR). Les événements conduisant à la dimérisation de hced6 (CED-6) ainsi que les molécules effectrices en aval demeurent inconnues (les sigles en rouge [RS, PSR] indiquent l’activation des molécules représentées). |
La mieux définie de ces deux voies consiste en une cascade de signalisation aboutissant à la polymérisation de l’actine et aux modifications de la forme cellulaire requises pour un événement aussi dynamique que la phagocytose. Ces mêmes gènes semblent également impliqués dans la migration cellulaire [36, 37]. En effet, chez les nématodes comportant des mutations de ces gènes - outre la persistance des corps apoptotiques, phénotype associé à une clairance sub-optimale - on observe un défaut de migration d’une population particulière des cellules de la gonade, les cellules terminales distales (DTC) [36, 37]. Quatre protéines définissent la cascade, il s’agit de CED-2 [36], CED-5 [37], CED-10 [36] et CED-12 [7, 38, 39] et de leurs correspondants chez les mammifères CrkII, DOCK180, Rac1 et ELMO [40, 41] (→). Trois de ces éléments (CrkII, DOCK180 et ELMO) sont des protéines cytosoliques recrutées dans un complexe dont la localisation est sous-membranaire. Ce complexe est à son tour capable d’activer la GTPase Rac1. Chez les mammifères, le recrutement à la membrane de DOCK180 est consécutif à l’occupation des intégrines de surface, et requiert la participation de p130Cas [41]. Chez C. elegans, le récepteur de surface impliqué n’est pas connu et aucun homologue de p130cas n’a, à ce jour, été décrit [39, 40]. La deuxième voie est bien moins comprise. Elle requiert la participation d’au moins trois partenaires (CED-1, CED-6 et CED-7) [35] mais aucune interaction moléculaire n’a pu être décelée. Chez le nématode, le récepteur membra-naire CED-1 serait l’élément déclenchant [42]. CED-1 appartient à la famille des récepteurs scavenger au sens large et est exprimé dans la membrane plasmique de la plupart des cellules du nématode, toutes pouvant jouer un rôle de phagocyte. Au cours de la phagocytose, on assiste à une redistribution de CED-1 qui vient s’accumuler autour de la proie à ingérer. D’une manière remarquable, la redistribution de CED-1 dépend de la fonction de CED-7 [42], un transporteur de la famille ABC (ATP binding cassette) homologue de ABCA1 chez les mammifères [43, 44] (→→). Rien n’est encore connu de la signalisation consécutive à l’activation de CED-1. Elle implique néanmoins CED-6, une protéine adaptatrice conservée chez les mammifères [45], capable de dimérisation et susceptible d’interagir avec des tyrosine kinases [46]. (→) m/s 1997, n°11, p. 1342 (→→) m/s 2000, n°3, p. 386 Bien que, chez le nématode, aucune donnée expérimentale n’ait directement caractérisé le rôle crucial joué par CED-7 lors de la redistribution membranaire du récepteur CED-1, des éléments de réponse peuvent être déduits des travaux concernant ABCA1, son homologue chez les mammifères. Le transporteur ABCA1 est exprimé préférentiellement par le phagocyte professionnel. Son inactivation chez la souris engendre un phénotype d’engulfment suboptimal, secondaire à la participation de ABCA1 au contrôle de l’architecture lipidique des feuillets membranaires [47]. Plus précisément, la présence ou l’absence du transporteur, étudiées dans des systèmes de reconstitution fonctionnelle par transfection ou d’inactivation, induisent respectivement une augmentation et une réduction de la quantité de résidus phosphatidylsérine présents sur le feuillet externe de la membrane cellulaire. Ces observations ne reflètent probablement que de façon incomplète l’activité translocatrice de lipides d’ABCA1 ; elles l’impliquent néanmoins assez clairement dans le système de maintien des caractéristiques biophysiques de la membrane. Les modifications de ces dernières, induites par ABCA1, peuvent aisément se traduire par une modulation de la mobilité latérale des récepteurs de surface et ainsi faciliter leur recrutement autour de la proie. Malgré l’absence de données sur l’interférence d’ABCA1 avec la formation, la dimension ou la coalescence de domaines membranaires particuliers, nous possédons d’ores et déjà des éléments suffisants pour envisager qu’ABCA1 exerce son rôle de facilitateur de la fluidité membranaire. Si on intègre en outre la notion de redondance des récepteurs de l’engulfment ainsi que leur faible affinité pour le ligand, à titre individuel, la facilitation de la mobilité latérale induite par ABCA1/CED-7 devient un élément déterminant de la rapidité avec laquelle on peut atteindre une condensation topographique des récepteurs. Cette condensation topographique serait en fait l’élément nécessaire au déclenchement de l’ingestion proprement dite. On pourrait de même imaginer que l’enrichissement en récepteurs autour de la proie se déroule plus efficacement chez les phagocytes professionnels, qui, contrairement aux amateurs, expriment le transporteur ABCA1. De fait, une des différences principales entre phagocytes amateurs et professionnels, décelée en vidéo-microscopie est la rapidité des ces derniers à reconnaître des cellules mourantes et à démarrer leur ingestion [48]. Un dernier point de discussion concerne la mise en évidence d’un rôle effecteur de mort cellulaire joué par les phagocytes chez C. elegans. Cela ne s’observe seulement qu’en situation de fonction partielle du gène pro-apoptotique CED-3 et pourrait résulter d’une signalisation rétroactive émise par le phagocyte, ou tout simplement signifier l’existence d’un seuil de non retour, une fois la reconnaissance engagée [49, 50]. Il est à remarquer que des observations semblables, suggérant une fonction effectrice du macrophage dans la mort cellulaire, avaient été rapportées dans le modèle de mort associé à la formation de la pupille chez la souris [51]. |
L’élimination des cellules apoptotiques se doit de prendre place avant que la proie ne soit lysée, cela afin d’empêcher le relargage du contenu cellulaire potentiellement proimmunogène et pro-inflammatoire [52, 53]. En règle générale, les macrophages engagés dans l’engulfment inhibent de manière active les réponses inflammatoires et sécrètent de fait des médiateurs suppresseurs de type TGFβ ou IL-10 [54]. Cependant, des observations en désaccord avec l’axiome « engulfment = suppression de la réponse inflammatoire » ont été rapportées. Cela concerne la capacité des cellules apoptotiques d’induire la transcription d’ARNm de cytokines inflammatoires ou encore la présence d’infiltrats inflammatoires en situation d’apoptose massive [55]. Il est tout à fait envisageable que, dans cette dernière situation, les capacités phagocytaires immédiatement disponibles du macrophage soient dépassées par le nombre trop élevé de proies potentielles. Le retard de clairance qui en résulte provoquerait l’apparition de nécrose secondaire associée à la libération du contenu cellulaire pro-inflammatoire. Si la réponse du macrophage - prototype du phagocyte professionnel - est de type suppressive, qu’en est-il pour les phagocytes amateurs et en particulier comment la phagocytose des cellules apoptotiques affecte-t-elle la capacité des cellules dendritiques d’induire une réponse immunitaire ? Les données produites par les différents laboratoires sont pour l’instant contradictoires et une action, tantôt stimulatrice, tantôt neutre, sur la maturation des cellules dendritiques a été observée [21, 56, 57]. Il est toutefois possible qu’une simple variabilité méthodologique explique ces différences. Il faut en effet rappeler que la cellule dendritique n’est pas un phagocyte très efficace dans le contexte apoptotique ; elle pourrait, par conséquent, être très sensible à la surcharge en proies. La présence de cellules nécrotiques - et non pas véritablement en apoptose - parmi les proies pourrait expliquer les observations d’un effet de maturation consécutif à la phagocytose. Il est néanmoins important de considérer la possibilité d’une relation directe entre la nature du récepteur engagé dans l’engulfment et une réponse cellulaire de type inhibitrice ou stimulatrice. Récemment, V. Fadok a suggéré par exemple que la phosphatidylsérine serait nécessaire au déclenchement d’une réponse suppressive [58, 59]. De surcroît, il est envisageable que des signalisations conflictuelles coexistent dans le phagocyte, à la suite de la stimulation concomitante de multiples récepteurs de surface à vocation pro- ou antiinflammatoire. À titre d’exemple, lors de la phagocytose de cellules apoptotiques en présence d’un pathogène, deux voies de signalisation peuvent être engagées simultanément : d’une part, une voie pro-inflammatoire consécutive à l’activation des récepteurs Toll-like en réponse à l’attaque bactérienne [60] (→) et, d’autre part, une voie antiinflammatoire induite par la stimulation des récepteurs de la phagocytose des corps apoptotiques [58]. La réponse cellulaire pourrait donc être variable et conditionnée à la fois par la configuration hiérarchique des voies de signalisation et la puissance de leur induction relative. Ce n’est qu’au prix d’une meilleure compréhension des voies individuellement associées à chaque récepteur et de leurs plates-formes d’intercommunication qu’apparaîtra de manière cohérente la panoplie des phénomènes déclenchés, au niveau cellulaire, par l’ingestion d’une cellule en apoptose. (→) m/s 2000, n°11, p. 1342 |
Footnotes |
1. Hengartner MO. The biochemistry of apoptosis. Nature 2000; 407 : 770–6. 2. Fadok VA, Bratton DL, Frasch SC, Warner ML, Henson PM. The role of phosphatidylserine in recognition of apoptotic cells by phagocytes. Cell Death Differ 1998; 5 : 551–62. 3. Schlegel RA, Williamson P. Phosphatidylserine, a death knell. Cell Death Differ 2001; 8 : 551–3. 4. Zwaal RFA, Schroit AJ. Pathophysiologic implications of membrane phospholipid asymmetry in blood cells. Blood 1997; 89 : 1121–32. 5. Susin SA, Lorenzo HK, Zamzami N, et al. Molecular characterization of mitochondrial apoptosisinducing factor. Nature 1999; 397 : 441–6. 6. Leist M, Jaattela M. Four deaths and a funeral: from caspases to alternative mechanisms. Nat Rev Mol Cell Biol 2001; 2 : 589–98. 7. Chung S, Gumienny TL, Hengartner MO, Driscoll M. A common set of engulfment genes mediates removal of both apoptotic and necrotic cell corpses in C. elegans. Nat Cell Biol 2000; 2 : 931–7. 8. Moynault A, Luciani MF, Chimini G. ABCI, the mammalian homologue of the engulfment gene ced-7, is required during phagocy-tosis of both necrotic and apoptotic cells. Trends Biochem Sci 1998; 26 : 629–35. 9. Fadok VA, Bratton DL, Rose DM, Pearson A, Ezekewitz RA, Henson PM. A receptor for phosphatidylserine-specific clearance of apoptotic cells. Nature 2000; 405 : 85–90. 10. Tepper AD, Ruurs P, Wiedmer T, Sims PJ, Borst J, van Blitterswijk WJ. Sphingomyelin hydrolysis to ceramide during the execution phase of apoptosis results from phospholipid scrambling and alters cell-surface morphology. J Cell Biol 2000; 150 : 155–64. 11. Duvall E, Wyllie AH, Morris RG. Macrophage recognition of cells undergoing programmed cell death (apoptosis). Immunology 1985; 56 : 351–8. 12. Morris RG, Hargreaves AD, Duvall E, Wyllie AH. Hormone-induced cell death. 2. Surface changes in thymocytes undergoing apoptosis. Am J Pathol 1984; 115 : 426–36. 13. Savill JS, Henson PM, Haslett C. Phagocytosis of aged human neutrophils by macrophages is mediated by a novel «chargesensitive» recognition mechanism. J Clin Invest 1989; 84 : 1518–27. 14. Krieger M, Stern DM. Series introduction: multiligand receptors and human disease. J Clin Invest 2001; 108 : 645–7. 15. Febbraio M, Hajjar D P, Silverstein RL. CD36: a class B scavenger receptor involved in angiogenesis, atherosclerosis, inflammation, and lipid metabolism. J Clin Invest 2001; 108 : 785–91. 16. Krieger M. Scavenger receptor class B type I is a multiligand HDL receptor that influences diverse physiologic systems. J Clin Invest 2001; 108 : 793–7. 17. Platt N, Gordon S. Is the class A macrophage scavenger receptor (SR-A) multifunctional? The mouse’s tale. J Clin Invest 2001; 108 : 649–54. 18. Dini L, Lentini A, Diez GD, et al. Phagocytosis of apoptotic bodies by liver endothelial cells. J Cell Sci 1995; 108 : 967–73. 19. Van der Flier A, Sonnenberg A. Function and interactions of integrins. Cell Tissue Res 2001; 305 : 285–98. 20. Savill J, Dransfield I, Hogg N, Haslett C. Vitronectin receptor-mediated phagocytosis of cells undergoing apoptosis. Nature 1990; 343 : 170–3. 21. Albert ML, Pearce SF, Francisco LM, et al. Immature dendritic cells phagocytose apoptotic cells via αvβ5 and CD36, and crosspresent antigens to cytotoxic T lymphocytes. J Exp Med 1998; 188 : 1359–68. 22. Savill J, Hogg N, Ren Y, Haslett C. Thrombospondin cooperates with CD36 and the vitronectin receptor in macrophage recognition of neutrophils undergoing apoptosis. J Clin Invest 1992; 90 : 1513–22. 23. Finnemann SC, Rodriguez-Boulan E. Macrophage and retinal pigment epithelium phagocytosis: apoptotic cells and photoreceptors compete for αvβ3 and αvβ5 integrins, and protein kinase C regulates αvβ5 binding and cytoskeletal linkage. J Exp Med 1999; 190 : 861–74. 24. Platt N, Suzuki H, Kurihara Y, Kodama T, Gordon S. Role for the class A macrophage scavenger receptor in the phagocytosis of apoptotic thymocytes in vitro. Proc Natl Acad Sci USA 1996; 93 : 12456–60. 25. Shiratsuchi A, Kawasaki Y, Ikemoto M, Arai H, Nakanishi Y. Role of class B scavenger receptor type I in phagocytosis of apoptotic rat spermatogenic cells by Sertoli cells. J Biol Chem 1999; 274 : 5901–8. 26. Platt N, Suzuki H, Kodama T, Gordon S. Apoptotic thymocyte clearance in scavenger receptor class Adeficient mice is apparently normal. J Immunol 2000; 164 : 4861–7. 27. Trigatti B, Rayburn H, Vinals M, et al. Influence of the high density lipoprotein receptor SR-BI on reproductive and cardiovascular pathophysiology. Proc Natl Acad Sci USA 1999; 96 : 9322–7. 28. Febbraio M, Podrez EA, Smith JD, et al. Targeted disruption of the class B scavenger re— ceptor CD36 protects against atherosclerotic lesion development in mice. J Clin Invest 2000; 105 : 1049–56. 29. Gregory CD. CD14-dependent clearance of apoptotic cells: relevance to the immune system. Curr Opin Immunol 2000; 12 : 27–34. 30. Devitt A, Moffatt OD, Raykundalia C, Capra JD, Simmons DL, Gregory CD. Human CD14 mediates recognition and phagocytosis of apoptotic cells. Nature 1998; 329 : 505–9. 31. Scott RS, McMahon EJ, Pop SM, et al. Phagocytosis and clearance of apoptotic cells is mediated by MER. Nature 2001; 411 : 207–11. 32. Botto M, Dell’Agnola C, Bygrave AE, et al. Homozygous C1q deficiency causes glomerulonephritis associated with multiple apoptotic bodies. Nat Genet 1998; 19 : 56–9. 33. Korb LC, Ahearn JM. C1q binds directly and specifically to surface blebs of apoptotic human keratinocytes: complement deficiency and systemic lupus erythematosus revisited. J Immunol 1997; 158 : 4525–8. 34. Ogden CA, de Cathelineau A, Hoffmann PR, et al. C1q and mannose binding lectin engagement of cell surface calreticulin and CD91 initiates macropinocytosis and uptake of apoptotic cells. J Exp Med 2001; 194 : 781–95. 35. Ellis RE, Jacobson DM, Horvitz HR. Genes required for the engulfment of cell corpses during programmed cell death in Caenorhabditis elegans? Genetics 1991; 129 : 79–94. 36. Reddien PW, Horvitz HR. CED-2/CrkII and CED-10/Rac control phagocytosis and cell migration in Caenorhabditis elegans. Nat Cell Biol 2000; 2 : 131–6. 37. Wu Y, Horvitz HR. C. elegans phagocytosis and cellmigration protein CED-5 is similar to human DOCK180. Nature 1998; 329 : 501–4. 38. Zhou Z, Caron E, Hartwieg E, Hall A, Horvitz HR. The C. elegans PH domain protein CED-12 regulates cytoskeletal reorganization via a Rho/Rac GTPase signaling pathway. Dev Cell 2001; 1 : 477–89. 39. Wu Y, Tsai M, Cheng L, Chou C, Nei-Yin W. C. elegans CED-12 acts in the conserved CrkII/DOCK180/Rac pathway to control cell migration and cell corpse engulfment. Dev Cell 2001; 1 : 491–502. 40. Gumienny TL, Brugnera E, Tosello-Trampont AC, et al. Ced-12/elmo, a novel member of the crkii/dock-180/rac pathway, is required for phagocytosis and cell migration. Cell 2001; 107 : 27–41. 41. Albert M, Kim J, Birge RB. avb5 integrin recruits the CrkII-Dock180-Rac1 complex for phagocytosis of apoptotic cells. Nat Cell Biol 2000; 2 : 899–906. 42. Zhou Z, Hartwieg E, Horvitz HR. CED-1 is a transmembrane receptor that mediates cell corpse engulfment in C. elegans. Cell 2001; 104 : 43–56. 43. Luciani MF, Chimini G. The ATP binding cassette transporter ABC1 is required for the engulfment of corpses generated by apoptoic cell death. EMBO J 1996; 15 : 226–35. 44. Wu Y, Horvitz RH. The C. elegans cell corpse engulfment gene ced-7 encodes a protein similar to ABC transporters. Cell 1998; 93 : 951–60. 45. Liu QA, Hengartner MO. Human CED-6 encodes a functional homologue of the Caenorhabditis elegans engulfment protein CED-6. Curr Biol 1999; 9 : 1347–50. 46. Su H P, Brugnera E, Van Criekinge W, et al. Identification and characterization of a dimerization domain in CED-6, an adapter protein involved in engulfment of apoptotic cells. J Biol Chem 2000; 275 : 9542–9. 47. Hamon Y, Broccardo C, Chambenoit O, et al. ABC1 promotes engulfment of apoptotic cells and transbilayer redistribution of phosphatidylserine. Nat Cell Biol 2000; 2 : 399–406. 48. Parnaik R, Raff MC, Scholes J. Differences between the clearance of apoptotic cells by professional and nonprofessional phagocytes. Curr Biol 2000; 10 : 857–60. 49. Reddien PW, Cameron S, Horvitz HR. Phagocytosis promotes programmed cell death in C. elegans. Nature 1; 412 : 198–202. 50. Hoeppner DJ, Hengartner MO, Schnabel R. Engulfment genes cooperate with ced-3 to promote cell death in Caenorhabditis elegans. Nature 2001; 412 : 202–6. 51. Diez-Roux G, Lang RA. Macrophages induce apoptosis in normal cells in vivo. Development 1997; 124 : 3633–8. 52. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature 2000; 407 : 784–8. 53. Ren Y, Savill J. Apoptosis: the importance of being eaten. Cell Death Differ 1998; 5 : 563–8. 54. Fadok VA, Bratton DL, Konowal A, Freed PW, Westcott JY, Henson PM. Macrophages that have ingested apoptotic cells in vitro inhibit proinflammatory cytokine production through autocrine/paracrine mechanisms involving TGF-β PGE2 and PAF. J Clin Invest 1998; 101 : 890–8. 55. Kurosaka K, Watanabe N, Kobayashi Y. Production of proinflammatory cytokines by resident tissue macrophages after phagocytosis of apoptotic cells. Cell Immunol 2001; 211 : 1–7. 56. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature 1998; 392 : 86–9. 57. Steinman RM, Turley S, Mellman I, Inaba K. The induction of tolerance by dendritic cells that have captured apoptotic cells. J Exp Med 2000; 191 : 411–6. 58. Henson PM, Bratton DL, Fadok VA. The phosphatidylserine receptor: a crucial molecular switch? Nat Rev Mol Cell Biol 2001; 2 : 627–33. 59. Fadok VA, Xue D, Henson P. If phosphatidylserine is the death knell, a new phosphatidylserine-specific receptor is the bellringer. Cell Death Differ 2001; 8 : 582–7. 60. Schnare M, Barton GM, Holt AC, Takeda K, Akira S, Medzhitov R. Toll-like receptors control activation of adaptive immune responses. Nat Immunol 2001; 2 : 947–50. |