La phagocytose est un mécanisme qui permet à certaines cellules spécialisées (polynucléaires neutrophiles, macrophages), et à certains organismes unicellulaires, l’ingestion d’éléments figurés de grande taille. Ce processus, que décrivit dès la fin du XIXe siècle le zoologiste Elie Metchnikoff en observant des larves d’étoile de mer, représente, chez les organismes complexes, une des réponses du système immunitaire non spécifique. Il assure la défense de l’organisme, en permettant notamment l’élimination de pathogènes d’origine bactérienne ou fongique [1]. Pour ce faire, les neutrophiles, des phagocytes professionnels, peuvent traverser par diapédèse l’endothélium vasculaire et gagner le foyer d’infection. Là, ces cellules adhèrent aux pathogènes, une interaction favorisée lorsque ces derniers sont recouverts par des molécules de la fraction C3b du complément [2]. L’invagination de la membrane plasmique des neutrophiles conduit alors à la formation d’une vésicule membranaire intracellulaire (vacuole de phagocytose) englobant l’élément étranger [3]. Cette phagocytose s’accompagne de la libération dans la vacuole du contenu enzymatique de granules présents dans le cytoplasme des neutrophiles, et déclenche une réaction violente connue sous le nom d’ « explosion respiratoire ». Cette réponse est le résultat de l’activation d’un complexe NADPH-oxydase [4]. Elle se traduit par la formation de radicaux oxygénés dont la toxicité provoque la mort des bactéries contenues dans la vacuole de phagocytose, selon un schéma établi depuis une trentaine d’années [5, 6]. De fait, chez les patients atteints de granulomatose chronique, une maladie héréditaire causée par des mutations dans le complexe NADPH-oxydase et caractérisée par une diminution de la résistance aux infections, les neutrophiles sont incapables de produire des radicaux oxygénés, et ont perdu leurs capacités bactéricides [7]. Néanmoins, certains pathogènes sont beaucoup plus virulents chez la souris déficiente en élastase et en cathepsine G (deux protéases présentes dans les granules des neutrophiles) que chez la souris normale. C’est le cas notamment de Staphylococcus aureus, une cause courante d’infection chez les patients souffrant de granulomatose chronique, ou Candida albicans, un pathogène que l’on croyait être détruit par la seule intervention des radicaux oxygénés [8]. Cette perte de capacité microbicide peut être reproduite à partir de neutrophiles normaux en culture, exposés à des inhibiteurs de protéases. Ces observations, qui attribuent donc aux protéases un rôle important dans les mécanismes microbicides, sont à l’origine d’une étude qui remet en cause l’activité toxique des radicaux oxygénés. Un ré-examen minutieux des différents événements se déroulant dans la vacuole de phagocytose apporte en effet un éclairage bien différent sur ce mécanisme [9].
Pendant l’explosion respiratoire, de très grosses quantités d’ions superoxydes vont être effectivement produites dans la vacuole, environ 4 moles par litre, et maintenir des concentrations à l’équilibre élevées d’O2.-et de H2O2. Ces concentrations importantes changent les conditions physico-chimiques (notamment électrostatiques) du compartiment vacuolaire. Le passage d’e- à travers la membrane vacuolaire, dû à l’activité du complexe NADPH-oxydase, est également électrogénique, et l’ensemble de ces phénomènes s’accompagne d’un processus de compensation de charges (Figure 1). La compensation d’un électron e- par le transfert d’un proton H+ pourrait être effective, mais ne rend pas compte de l’augmentation du pH intravacuolaire, qui passe de 6 à 8, et ce, malgré la libération dans la vacuole du contenu acide des granules cytoplasmiques. De fait, en réponse à l’explosion respiratoire, c’est la concentration intravacuolaire d’ions potassium qui augmente, pour atteindre des valeurs comprises entre 200 et 300 mM (la compensation d’un e- par un ion K+ engendre un OH-, compatible avec l’augmentation de pH observée).
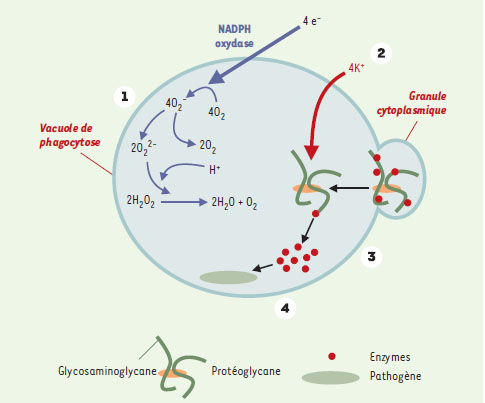
| Figure 1. Importance de l’entrée de potassium dans la vacuole de phagocytose pour l’acitvité microbicide. En réponse à l’activité du complexe NADPH-oxydase (1 : explosion respiratoire), un flux important d’ions potassium traverse la membrane vacuolaire (2). La force ionique qui en résulte provoque la solubilisation de protéases immobilisées par les protéoglycanes des granules cytoplasmiques, dont le contenu est déversé dans la vacuole de phagocytose (3). C’est l’activité protéolytique de ces enzymes qui permettra la destruction du micro-organisme phagocyté (4). |
L’activité du complexe oxydase crée donc un flux massif de potassium à travers la membrane vacuolaire, un transfert effectivement inhibé par les inhibiteurs de l’activité oxydase. L’hypertonicité intravacuolaire qui en résulte devrait normalement entraîner un mouvement d’eau et un gonflement de la vacuole.
C’est ici qu’interviennent des protéines du cytosquelette, notamment la vinculine et la paxilline, qui forment, dans les premiers instants de la phagocytose, un réseau autour de la vacuole, contraignant son volume, et par conséquent maintenant dans la vacuole une force ionique élevée. Plus tard dans le processus, une fois détruites les bactéries phagocytées, ce réseau de protéines du cytosquelette disparaîtra, entraînant effectivement un gonflement des vacuoles de phagocytose, et un retour à des forces ioniques normales. Quel rôle peut avoir le potassium intravacuolaire ? Les derniers éléments du processus qui conduira finalement à la mort des microorganismes vont intervenir ici, et requièrent pour leur activité une force ionique élevée. Le contenu des granules cytoplasmiques qui a été déversé dans la vacuole de phagocytose est constitué de protéoglycanes auxquels sont associées différentes enzymes, en particulier l’élastase et la cathepsine G. Rappelons que les protéoglycanes constituent une famille de molécules particulières, composées de diverses protéines sur lesquelles sont attachés des polysaccharides de type glycosaminoglycane [10]. Les glycosaminoglycanes sont constitués d’un motif disaccharidique (acide glucuronique-hexosamine) répété, et substitué de façon variable par de nombreux groupements sulfates. Les glycosaminoglycanes sont particulièrement anioniques. Ils ont la capacité de lier un nombre considérable de protéines par le biais de ponts salins entre leurs groupements sulfates et des acides aminés basiques situés sur la surface des protéines qu’ils reconnaissent [11, 12]. En particulier, l’ensemble des enzymes contenues dans les granules cytoplasmiques des neutrophiles (élastase, cathepsine G, myéloperoxydase, lactoferrine) a la capacité de se fixer aux glycosaminoglycanes, avec des affinités souvent importantes. Lorsque ces enzymes sont déversées dans la vacuole de phagocytose, c’est sous une forme inactive, complexée aux glycosaminoglycanes. Le potassium, qui y est présent en concentration élevée, va fournir la force ionique nécessaire à la dissociation des complexes enzymes-glycosaminoglycanes, permettant aux protéines ainsi libérées, d’exercer sur le pathogène leurs activités protéolytiques. De fait, la co-incubation de granules purifiés avec Staphylococcus aureus n’a aucun effet sur la viabilité du micro-organisme, et l’ajout d’H2O2 ne modifie en rien cela. En revanche, l’ajout de potassium à des concentrations allant de 200 à 400 mM permet la destruction du pathogène, un effet abrogé par les inhibiteurs de protéases. Ces concentrations sont celles effectivement mesurées dans la vacuole de phagocytose, et correspondent précisément aux concentrations nécessaires pour dissocier un complexe enzymes-glycosaminoglycanes. Rappelons finalement que l’entrée de K+ dans la vacuole a aussi pour effet d’élever le pH de 6 à 8, qui est précisément le pH optimal des activités élastase et cathepsine G.
Ainsi, l’explosion respiratoire ne représente que l’étape initiale d’un processus complexe qui va entraîner l’entrée d’ions potassium dans la vacuole de phagocytose, créant ainsi les conditions nécessaires à la solubilisation de protéases immobilisées par des protéoglycanes, et inactives sous cette forme. C’est l’activité protéolytique de ces enzymes libérées qui portera le coup fatal aux micro-organismes phagocytés. Probablement, un tel système permet d’éviter les dommages collatéraux que provoqueraient, sur les tissus de l’hôte, les enzymes des neutrophiles s’ils étaient en permanence libres et sous forme active. Les protéoglycanes permettent ici, comme c’est souvent le cas, de localiser et d’activer « à la demande » un processus particulier.