| |
| Med Sci (Paris). 2002 November; 18(11): 1113–1119. Published online 2002 November 15. doi: 10.1051/medsci/200218111113.Mécanisme de la fusion membranaire Thierry Galli,1*** Sonia Martinez-Arca,1 and Fabienne Paumet2 1Trafic membranaire et plasticité neuronale, Inserm U.536, Institut du Fer-à-Moulin, 17, rue du Fer-à-Moulin, 75005 Paris, France 2Cellular Biochemistry and Biophysics Program, Memorial Sloan Kettering Cancer Center, 1275 York Avenue, Box 251, New York, NY 10021, États-Unis |
Le trafic membranaire dépend de trois mécanismes clés: le bourgeonnement de vésicules à partir d’un compartiment donneur, le déplacement de ces vésicules vers un compartiment accepteur, et leur fusion avec ce dernier. La fusion membranaire entraîne la réunion de deux structures membranaires en une seule et le mélange du contenu des compartiments que délimitaient les deux structures membranaires. Il en est ainsi au cours de l’exocytose lorsque la membrane de la vésicule de sécrétion fusionne avec la membrane plasmique et libère son contenu dans le milieu extracellulaire. |
Les protéines SNARE, composants de la « machinerie minimale » de la fusion membranaire La mise en évidence des protéines SNARE La mise en évidence du rôle des protéines SNARE résulte du travail de James Rothman et de ses collaborateurs, dans les années 1980, sur le trafic membranaire dans l’appareil de Golgi. L’observation princeps était que le transport de diverses molécules, au sein de l’appareil de Golgi reconstitué in vitro, était sensible au N-éthyl-maléimide, agent oxydant et puissant inhibiteur d’une classe d’ATPases. Ces travaux ont permis d’identifier la N-ethylmaleimide sensitive factor (NSF) comme une protéine cytosolique ayant un rôle clé dans la fusion membranaire. L’attachement de NSF aux membranes dépend d’autres protéines cytosoliques : les soluble NSF attachment proteins (SNAP). La recherche des récepteurs membranaires du complexe NSF-SNAP, effectuée à partir d’un extrait de cerveau, a conduit à isoler des SNAP receptors ou SNARE (Figure 1). Le cerveau est en effet le siège de très nombreux processus mettant en jeu des fusions membranaires: au cours de la libération de neurotransmetteurs, les vésicules synaptiques fusionnent avec la membrane plasmique. Cela a fait des neurones un modèle de choix pour l’étude des protéines SNARE [ 1] (→). Plusieurs membres de cette famille ont été identifiés (Figure 1) dont les principaux sont la synaptobrévine ou VAMP ( vesicle associated membrane protein), ainsi que la syntaxine et SNAP-25 ( synaptosomal associated protein of 25 kDa), des protéines de la membrane plasmique neuronale. Les SNARE vésiculaires comme la synaptobrévine sont appelées v-SNARE et les SNARE cibles comme la syntaxine et SNAP-25 sont appelées t-SNARE (t pour target) [ 2]. (→) m/s 2001, n° 5, p. 669
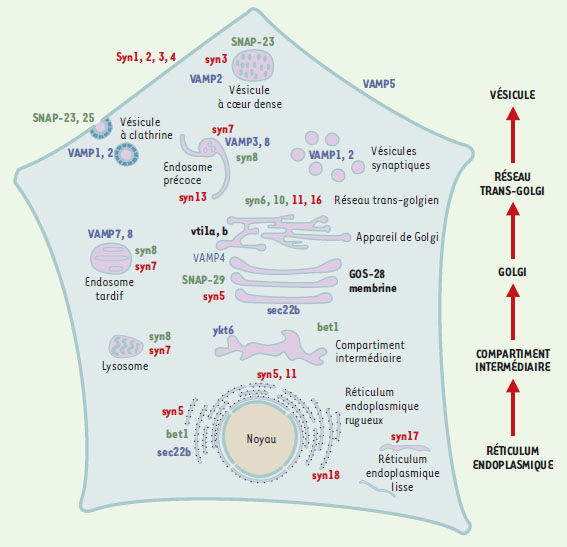
 | Figure 1.Cartographie cellulaire des protéines SNARE. Localisation des protéines SNARE dans les différents compartiments membranaires d’une cellule type de mammifère. Les membres des quatre familles de SNARE figurent en 4 couleurs. En bleu: les v-SNARE de la famille de la synaptobrévine ou VAMP2, encore appelés R-SNARE à cause du résidu arginine (R) au centre de leur motif SNARE. En rouge: les t-SNARE de la famille de la syntaxine-1, encore appelés Qa-SNARE à cause du résidu glutamine (Q) au centre de leur motif SNARE. En noir: les t-SNARE de la famille de SNAP-25 (dont le motif SNARE ressemble au motif SNARE N-terminal de SNAP-25), encore appelés Qb-SNARE à cause du résidu glutamine (Q) au centre de leur motif SNARE. En vert: les t-SNARE de la famille de SNAP-25 (dont le motif SNARE ressemble au motif SNARE C-terminal de SNAP-25) encore appelés Qc-SNARE à cause du résidu glutamine (Q) au centre de leur motif SNARE et les t-SNARE qui ont à la fois un domaine Qb et Qc (cas de SNAP-23, 25, 29) (adapté de [ 16]). |
La structure du complexe SNARE La synaptobrévine et la syntaxine sont des petites protéines transmembranaires de type II insérées par leur extrémité C-terminale alors que SNAP-25 est associée à la membrane par des palmitoylations sur des cystéines situées en position centrale dans la molécule. Les protéines SNARE sont définies par une séquence très conservée (appelée motif SNARE) située dans la région C-terminale de leur domaine cytoplasmique. Le complexe SNARE synaptique est une tresse composée de quatre hélices α: une provient de la synaptobrévine, une de la syntaxine et deux de SNAP-25 (→). Les extrémités N-terminales des quatre hélices étant du même côté dans le cristal du complexe SNARE synaptique [ 3], la formation du complexe devrait donc rapprocher les surfaces de la vésicule et de la membrane plasmique jusqu’à induire la fusion des deux membranes (→). Cette observation suggère que la formation du complexe SNARE libère une partie de l’énergie nécessaire pour franchir la barrière de potentiel correspondant à la fusion de deux bicouches lipidiques. D’ailleurs, les propriétés thermodynamiques de la formation et de la dissociation du complexe SNARE démontrent sa très grande stabilité [ 4]. Au centre du complexe SNARE (couche dite 0), les interactions entre les différentes chaînes ne sont pas dues à des liaisons hydrophobes, mais à des liaisons hydrogène entre une arginine de la synaptobrévine et trois glutamines: une provient de la syntaxine et deux de SNAP-25 [ 3]. Cette propriété semble être commune à tous les complexes SNARE [ 5]. Elle a permis de proposer une nouvelle classification des protéines SNARE selon qu’elles ont une arginine (R-SNARE) ou une glutamine (Q-SNARE) au centre de leur motif SNARE [ 6]. Il apparaît que la famille des R-SNARE coïncide avec celle des v-SNARE, et celle des Q-SNARE avec celle des t-SNARE. (→) m/s 2001, n° 5, p. 669 Les SNARE sont nécessaires à la fusion membranaire Les données essentielles qui placent les SNARE au cœur de la machinerie de la fusion membranaire proviennent de deux approches expérimentales complémentaires: l’étude des effets des neurotoxines clostridiales et la génétique. Les neurotoxines clostridiales produites par Clostridium botulinii, l’agent responsable du botulisme, et par Clostridium tetanii, celui qui provoque le tétanos, sont les plus puissants inhibiteurs de la libération de neurotransmetteurs. L’intoxication des neurones par ces toxines entraîne l’hydrolyse des protéines SNARE (synaptobrévine, syntaxine ou SNAP-25, selon la toxine), ce qui se traduit par le blocage de la libération de neurotransmetteurs [7, 8]. Ces résultats, obtenus dans les neurones, ont été étendus à d’autres types cellulaires en introduisant expérimentalement les chaînes légères de ces toxines dans des cellules fibroblastiques [9] ou épithéliales [10]. L’ensemble de ces résultats a permis de placer les protéines SNARE à une position centrale dans la machinerie de fusion des membranes. La génétique de la levure a depuis longtemps montré que des déficits de la voie de sécrétion ou d’autres voies du trafic membranaire intracellulaire résultaient de mutations dans un des gènes codant pour des protéines SNARE [11]. L’analyse de mutants d’organismes invertébrés a permis de généraliser cette observation [12]. L’approche inverse a consisté à invalider le gène codant pour la synaptobrévine [13] ou pour SNAP-25 [14] chez la souris. Dans les deux cas, la libération de neurotransmetteurs est gravement affectée, confirmant ainsi la nécessité de protéines SNARE spécifiques pour assurer la fusion des vésicules d’exocytose. Le transport de molécules du réticulum endoplasmique vers l’appareil de Golgi ou vers les lysosomes, et la fusion homotypique des endosomes sont deux événements qui dépendent aussi de l’activité de protéines SNARE spécifiques. Le trafic membranaire dépendant de protéines SNARE spécifiques est aussi important pour établir la forme neuronale [15]. Par conséquent, le modèle SNARE représente certainement un modèle général qui s’applique à toutes les voies intervenant dans le trafic membranaire. Il est d’ailleurs possible de dessiner une cartographie cellulaire en localisant les différentes v- et t-SNARE dans chaque compartiment cellulaire [16] (Figure 1). Les protéines SNARE sont suffisantes pour la fusion membranaire et leur reconnaissance mutuelle est spécifique Les protéines SNARE par elles-mêmes sont capables d’induire la fusion de liposomes artificiels dans lesquels elles sont insérées [ 17]. Des v-liposomes portant des v-SNARE fusionnent avec des t-liposomes portant des t-SNARE selon un catalogue de possibilités compatible avec les données obtenues à partir des cellules. Cela a été particulièrement bien étudié en utilisant les protéines SNARE de la levure qui sont toutes connues. Par exemple, la protéine v-SNARE impliquée dans la voie d’exocytose permet la fusion avec un complexe t-SNARE de la membrane plasmique mais pas avec un complexe t-SNARE du réticulum endoplasmique [ 18]. Ces résultats montrent que les protéines SNARE sont suffisantes pour induire, de manière spécifique, la fusion de bicouches lipidiques dans un système in vitro. De la nature du pore de fusion Une communication (sous la forme d’un pore) s’établit entre les deux compartiments membranaires à l’endroit où la fusion membranaire est déclenchée (Figure 2). Le pore de fusion peut être transitoire et se refermer ou s’étendre de sorte que la fusion entre les deux compartiments devient complète.
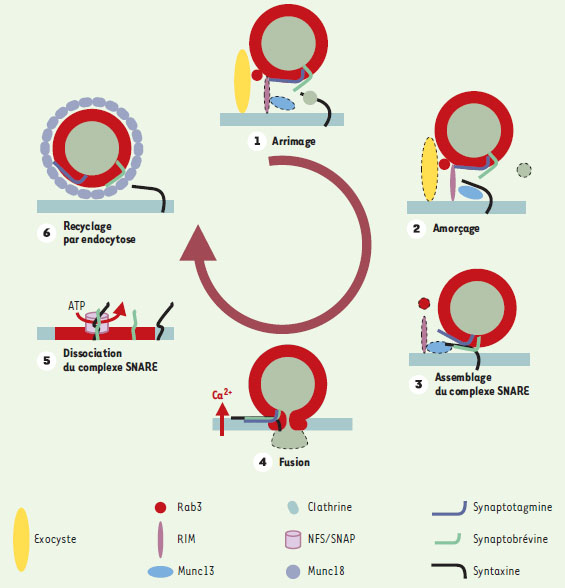
 | Figure 2. Modèle du cycle de fusion des vésicules synaptiques. L’arrimage des vésicules synaptiques à la membrane pré-synaptique pourrait dépendre du complexe de protéines exocyste (étape 1). Au cours de l’amorçage, Munc18 se dissocie de la syntaxine-1, permettant à cette dernière d’interagir avec Munc13 et d’acquérir une conformation fusiogénique (étape 2). Rab3 et Rim interviendraient aussi dans cette étape. La syntaxine ainsi activée interagit avec ses partenaires SNAP25 et synaptobrévine pour former un complexe SNARE bloqué dans un état d’assemblage incomplet (étape 3: assemblage du complexe). À la suite d’une stimulation, l’entrée de calcium active la synaptotagmine qui s’associe au complexe SNARE et à la membrane plasmique, permettant ainsi la fusion des membranes et la libération des neurotransmetteurs dans l’espace synaptique (étape 4). Le complexe SNARE, désormais en cis sur la membrane plasmique, devient alors le récepteur des protéines NSF et SNAP qui, à la suite de l’hydrolyse de molécules d’ATP, vont dissocier le complexe et permettre à chacun des partenaires d’être de nouveau disponibles (étape 5). Finalement, la machinerie d’endocytose intervient pour recycler les vésicules synaptiques ainsi que leurs constituants membranaires (étape 6). À la suite de ce recyclage, les vésicules subissent une maturation qui leur permet d’être rechargées en neurotransmetteurs. Elles sont alors de nouveau prêtes à effectuer un cycle de fusion. Un schéma analogue s’applique certainement à toutes les fusions membranaires. Les protéines actives sont représentées avec un contour net, celles qui sont inactivées en pointillé. |
Une des questions les plus brûlantes dans le domaine de la fusion membranaire concerne la nature du pore de fusion. S’agit-il d’un complexe de protéines formant un canal ou bien résulte-t-il directement de la fusion des bicouches lipidiques et est-il alors de nature lipidique? Les expériences de reconstitution de la fusion membranaire in vitro à partir de liposomes suggèrent que les lipides peuvent constituer le pore de fusion [19]. Cependant, le modèle du pore de fusion protéique reste d’actualité car le segment membranaire V0 de l’ATPase vacuolaire est impliqué dans la fusion des vacuoles de levure in vitro [20]. Cette observation a remis sur le devant de la scène un des composants de V0, appelé sous-unité c, « ductine » ou encore « médiatophore » (→) à travers lequel l’acétylcholine peut être libérée [21]. L’implication du V0 comme pore de fusion n’est, en fait, pas incompatible avec le rôle des protéines SNARE. En effet, in vivo, la sous-unité c forme un complexe avec la synaptobrévine [22]. De plus, les données obtenues en étudiant la fusion homotypique des vacuoles de levure in vitro suggèrent que les SNARE rapprochent les membranes jusqu’à la formation d’un complexe de secteurs V0 en trans; ces secteurs accolent les membranes, ouvrent un pore de communication entre les deux compartiments permettant la communication des contenus. Ils pourraient aussi entraîner la fusion complète par ouverture radiale du pore [20]. (→) m/s 2002, n° 11, p. 1121 |
Les étapes de la fusion membranaire et leur régulation La fusion membranaire comprend plusieurs étapes (Figure 2) : les vésicules chargées de molécules migrent vers le compartiment accepteur; elles s’arriment à la membrane et acquièrent des propriétés nécessaires à la fusion membranaire; un pore se forme, les molécules transportées sont libérées puis les protéines de la vésicule sont recyclées. L’arrimage des vésicules L’une des étapes précédant la fusion membranaire consiste en l’arrimage des vésicules avec leur membrane cible (Figure 2). Il est peu probable que les SNARE jouent un rôle important dans cette phase précoce. D’autres protéines, appelées facteurs d’arrimage ( tethering factor, de to tether : attacher) ont été impliquées dans cette étape. Par exemple, le complexe protéique appelé exocyste (Sec3p, Sec5p, Sec6p, Sec8p, Sec10, Sec15p, Exo70p, Exo84p) est impliqué dans l’arrimage des vésicules d’exocytose à la membrane plasmique chez la levure, notamment en marquant des domaines spécifiques de la membrane plasmique où se produit l’exocytose [ 23]. L’importance de ce complexe est illustrée par le déficit de la voie de sécrétion qu’entraîne la mutationd’un seul de ses composants. Par ailleurs, plusieurs sous-unités de l’exocyste interagissent avec des petites GTPases impliquées dans le trafic membra-naire. Sec3p définit le site d’exocytose sur la membrane plasmique et a besoin des GTPases Rho1p et Cdc42p pour être correctement localisée. Sec15p est associée aux vésicules de sécrétion et se lie à la GTPase Sec4p. Dans les cellules des mammifères, la forme active (liée au GTP) de la GTPase Ral interagit avec Sec5p et permet l’assemblage de l’exocyste [24, 25]. Dans le cerveau, une interaction a été observée entre l’exocyste et la syntaxine-1 [26], suggérant un lien entre la machinerie d’arrimage et celle de la fusion mais le rôle exact de l’exocyste n’est pas bien élucidé [27]. Par ailleurs, dans les cellules épithéliales, polarisées, l’exocyste est impliqué dans le transport vers la membrane plasmique basolatérale [28]. D’autres complexes protéiques du même type que l’exocyste ont été identifiés: Vps52/53/54 appelé VFT pour Vps fifty three, qui est impliqué dans le transport des endosomes vers l’appareil de Golgi, Sec34/35, qui joue un rôle dans le transport rétrograde au sein de l’appareil de Golgi [29], ou encore TRAPP (pour transport protein particle) qui est impliqué dans le transport de l’appareil de Golgi vers le réticulum endoplasmique et fonctionne comme un facteur d’échange des petites GTPases Ypt1 et Ypt31/32 [30]. La fusion homotypique d’endosomes implique la petite GTPase rab5, son facteur d’échange rabex5, son effecteur la rabaptine-5, une protéine des endo-somes EEA1 et la syntaxine-13, une t-SNARE des endosomes qui serait activée localement par EEA1 [31]. Le transport du réticulum endoplasmique vers le cis-Golgi est contrôlé par la GTPase rab1 qui recrute la protéine d’arrimage GM130, elle-même agissant dans un complexe avec la giantine et p115 [32]. L’ensemble de ces données suggère que l’arrimage pourrait mettre en jeu des complexes de protéines, recrutées séquentiellement sous la dépendance d’un signal contrôlé par des petites GTPases. Ces complexes pourraient définir les sites de fusion membranaire, probablement en activant localement la machinerie SNARE. L’amorçage de la fusion membranaire L’amorçage, autre étape importante dans la préparation de la fusion membranaire, est particulièrement bien connu dans le cas de l’exocytose. Les mutations des gènes codant pour les protéines Sec1/Munc18 et Munc13 induisent des phénotypes de défaut de sécrétion chez la levure (mutant Sec), le nématode (mutant unc pour uncoordinated, des mutants dont la nage n’est pas bien coordonnée) et la souris. La protéine n-Sec1/Munc18 est le prototype d’une famille de protéines qui interagissent avec l’extension N-terminale des syntaxines et les maintiennent dans une conformation fermée [ 33]. En effet, le domaine N-terminal de la syntaxine se replie sur son motif SNARE, empêchant ainsi la formation des complexes avec les v-SNARE et inhibant la fusion membranaire. Bien que n-Sec1/Munc18 semble de prime abord correspondre à un facteur inhibiteur, sa suppression chez la levure comme chez les mammifères, entraîne un phénotype sévère de blocage de la sécrétion [ 34]. L’activation de la syntaxine se fait si n-Sec1/Munc18 est déplacée par Munc13, un autre partenaire du domaine N-terminal de la syntaxine. Munc13 a été particulièrement bien étudié dans les neurones dans lesquels cette protéine joue un rôle primordial dans l’amorçage de la libération de neurotransmetteurs en activant la syntaxine-1 [ 35]. Munc13 interagit avec RIM, un partenaire de la GTPase Rab3, et fait partie de la « cytomatrice présynaptique », un assemblage moléculaire complexe qui contrôle l’exocytose et l’endocytose au niveau de la zone active (Figure 2), notamment en modulant la probabilité de libération de neurotransmetteurs [ 36]. Alors que des homologues de n-Sec1/Munc-18 contrôlent les autres voies de trafic membranaire, les homologues de Munc13 ne sont pas encore identifiés. La régulation de la fusion membranaire La fusion membranaire est un phénomène finement contrôlé. Dans le cas de l’exocytose conduisant à la libération de neurotransmetteurs ou d’hormones, la fusion est déclenchée par une augmentation de la concentration intracellulaire de calcium. La synaptotagmine, protéine membranaire des vésicules synaptiques, semble être l’une des protéines sensibles au calcium ( Ca2+ sensor) impliquées dans cette régulation. En effet, la synaptotagmine possède deux domaines C2 homologues au domaine C2 de la protéine kinase C. L’augmentation de calcium stimule l’interaction de la synaptotagmine avec le complexe SNARE, les phospholipides et également avec les canaux Ca 2+ dépendants du potentiel, et diminue son affinité pour SV2, une protéine des vésicules synaptiques [ 37– 39]. La sensibilité de la libération de neurotransmetteurs au calcium est directement liée à l’affinité de la synaptotagmine pour cet ion [ 40]. Ces données suggèrent que la synaptotagmine est responsable de la dépendance au calcium de la libération de neurotransmetteurs. Il est possible que la synaptotagmine participe à la genèse du pore de fusion [ 41]: avant l’entrée du calcium, elle bloquerait la fusion, le complexe SNARE étant partiellement assemblé; après l’entrée de calcium, elle se lierait au complexe SNARE et permettrait ainsi la fusion (Figure 2). |
Dissociation du complexe SNARE Initialement, la protéine NSF avait été isolée comme un facteur essentiel pour la fusion membranaire. On sait maintenant que ni NSF ni les SNAP ne sont nécessaires à la fusion des v- et t-liposomes in vitro. En réalité, NSF et les SNAP dissocient les différents complexes SNARE. Dans le modèle de fusion des vacuoles de levure tel qu’il est reconstitué in vitro, la dissociation des complexes SNARE est une étape précoce importante. En effet, chaque vacuole porte à la fois des v- et des t-SNARE qui s’associent en complexes en cis. La fusion des vacuoles est dite homotypique car elle se fait avec deux organites de même composition. NSF et les SNAP agissent sur chaque vacuole pour dissocier les complexes SNARE en cis et permettre ainsi de libérer les v- et les t-SNARE qui peuvent alors former des complexes en trans et induire la fusion des deux vacuoles [ 42]. Dans le cas de la terminaison nerveuse, NSF et les SNAP dissocient le complexe synaptique qui s’est formé au cours de la fusion des vésicules avec la membrane plasmique [ 43]. Au cours de cet événement, le complexe SNARE, initialement formé en trans, devient un complexe en cis, et la synaptobrévine et les autres protéines vésiculaires se retrouvent dans la membrane plasmique. La dissociation du complexe SNARE par NSF et les SNAP libère la synaptobrévine de sa forte interaction avec la syntaxine et SNAP25 et permet son recyclage (Figure 2). Retour des v-SNARE vers le compartiment donneur Une fois que le complexe SNARE est dissocié, la v-SNARE est renvoyée vers son compartiment donneur d’origine. Dans la synapse, la synaptobrévine est recyclée par endocytose d’une manière dépendante du calcium, dans de nouvelles vésicules synaptiques qui participeront aux prochaines vagues de libération de neurotransmetteurs [ 44] (Figure 2). L’homéostasie cellulaire est ainsi maintenue à chaque instant par un perpétuel recyclage des protéines SNARE laissant apparaître, à l’état d’équilibre, la spécificité de localisation précédemment décrite. |
La fusion membranaire est un événement cellulaire fondamental de la biologie de la cellule eucaryote. Elle peut être reconstituée in vitro, à partir de liposomes contenant les protéines SNARE, autour desquelles des partenaires essentiels sont impliqués dans les étapes d’arrimage et d’amorçage, ainsi que dans la régulation de la fusion. L’un des enjeux majeurs est maintenant de comprendre les liens entre la fusion membranaire et les cascades de signalisation qui contrôlent les différentes voies de trafic membranaire au cours du développement et dans les situations pathologiques. |
1. Galli T, Haucke V. Cycling of synaptic vesicles: how far? How fast! Sci STKE 2001; 88: RE1. 2. Söllner T, Whiteheart SW, Brunner M, et al. SNAP receptors implicated in vesicle targeting and fusion. Nature 1993; 362: 318–24. 3. Sutton RB, Fasshauer D, Jahn R, Brunger AT. Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 angstrom resolution. Nature 1998; 395: 347–53. 4. Hayashi T, McMahon H, Yamasaki S, et al. Synaptic vesicle membrane fusion complex: action of clostridial neurotoxins on assembly. EMBO J 1994; 13: 5051–61. 5. Antonin W, Fasshauer D, Becker S, Jahn R, Schneider TR. Crystal structure of the endosomal SNARE complex reveals common structural principles of all SNAREs. Nat Struct Biol 2002; 9: 107–11. 6. Jahn R, Sudhof TC. Membrane fusion and exocytosis. Annu Rev Biochem 1999; 68: 863–911. 7. Niemann H, Blasi J, Jahn R. Clostridial neurotoxins: new tools for dissecting exocytosis. Trends Cell Biol 1994; 4: 179–85. 8. Montecucco C, Schiavo G. Mechanism of action of tetanus and botulinum neurotoxins. Mol Microbiol 1994; 13 : 1–8. 9. Galli T, Chilcote T, Mundigl O, Binz T, Niemann H, De Camilli P. Tetanus toxin-mediated cleavage of cellubrevin impairs exocytosis of transferrin receptor-containing vesicles in CHO cells. J Cell Biol 1994; 125: 1015–24. 10. Leung SM, Chen D, DasGupta BR, Whiteheart SW, Apodaca G. SNAP-23 requirement for transferrin recycling in streptolysin-O-permeabilized Madin-Darby canine kidney cells. J Biol Chem 1998; 273: 17732–41. 11. Ferro-Novick S, Jahn R. Vesicle fusion from yeast to man. Nature 1994; 370: 191–3. 12. Littleton JT. A genomic analysis of membrane trafficking and neurotransmitter release in Drosophila.J Cell Biol 2000; 150: F77–82. 13. Schoch S, Deak F, Konigstorfer A, et al. SNARE function analyzed in synaptobrevin/VAMP knockout mice. Science 2001; 294: 1117–22. 14. Washbourne P, Thompson PM, Carta M, et al. Genetic ablation of the t-SNARE SNAP-25 distinguishes mechanisms of neuroexocytosis. Nat Neurosci 2002; 5 : 19–26. 15. Martinez-Arca S, Coco S, Mainguy G, et al. A common exocytotic mechanism mediates axonal and dendritic outgrowth. J Neurosci 2001; 21: 3830–8. 16. Bock JB, Matern HT, Peden AA, Scheller RH. A genomic perspective on membrane compartment organization. Nature 2001; 409: 839–41. 17. Weber T, Zemelman BV, McNew JA, et al. SNAREpins: minimal machinery for membrane fusion. Cell 1998; 92: 759–72. 18. McNew JA, Parlati F, Fukuda R, et al. Compartmental specificity of cellular membrane fusion encoded in SNARE proteins. Nature 2000; 407: 153–9. 19. Nickel W, Weber T, McNew JA, Parlati F, Sollner TH, Rothman JE. Content mixing and membrane integrity during membrane fusion driven by pairing of isolated v-SNAREs and t-SNAREs. Proc Natl Acad Sci USA 1999; 96: 12571–6. 20. Peters C, Bayer MJ, Buhler S, Andersen JS, Mann M, Mayer A. Trans-complex formation by proteolipid channels in the terminal phase of membrane fusion. Nature 2001; 409: 581–8. 21. Israel M, Morel N. Mediatophore: a nerve terminal membrane protein supporting the final step of the acetylcholine release process. Prog Brain Res 1990; 84: 101–10. 22. Galli T, McPherson PS, De Camilli P. The V0 sector of the V-ATPase, synaptobrevin and synaptophysin are associated on synaptic vesicles in a triton X-100 resistant, freeze-thawing sensitive complex. J Biol Chem 1996; 271: 2193–9. 23. Finger FP, Novick P. Spatial regulation of exocytosis: lessons from yeast. J Cell Biol 1998; 142: 609–12. 24. Moskalenko S, Henry DO, Rosse C, Mirey G, Camonis JH, White MA. The exocyst is a Ral effector complex. Nat Cell Biol 2002; 4: 66–72. 25. Brymora A, Valova VA, Larsen MR, Roufogalis BD, Robinson PJ. The brain exocyst complex interacts with RalA in a GTP-dependent manner: identification of a novel mammalian Sec3 gene and a second Sec15 gene. J Biol Chem 2001; 276: 29792–7. 26. Hsu SC, Ting AE, Hazuka CD, et al. The mammalian brain rsec6/8 complex. Neuron 1996; 17: 1209–19. 27. Hazuka CD, Foletti DL, Hsu SC, Kee Y, Hopf FW, Scheller RH. The sec6/8 complex is located at neurite out growth and axonal synapse-assembly domains. J Neurosci 1999; 19: 1324–34. 28. Grindstaff KK, Yeaman C, Anandasabapathy N, et al. Sec6/8 complex is recruited to cell-cell contacts and specifies transport vesicle delivery to the basal-lateral membrane in epithelial cells. Cell 1998; 93: 731–40. 29. Whyte JR, Munro S. The Sec34/35 Golgi transport complex is related to the exocyst, defining a family of complexes involved in multiple steps of membrane traffic. Dev Cell 2001; 1: 527–37. 30. Sacher M, Barrowman J, Wang W, et al. TRAPP I implicated in the specificity of tethering in ER- to-Golgi transport. Mol Cell 2001; 7: 433–42. 31. Christoforidis S, McBride HM, Burgoyne RD, Zerial M. The Rab5 effector EEA1 is a core component of endosome docking. Nature 1999; 397: 621–5. 32. Seemann J, Jokitalo EJ, Warren G. The role of the tethering proteins p115 and GM130 in transport through the Golgi apparatus in vivo. Mol Biol Cell 2000; 11: 635–45. 33. Misura KMS, Scheller RH, Weis WI. Three-dimensional structure of the neuronal-Sec1-syntaxin 1a complex. Nature 2000; 404: 355–62. 34. Verhage M, Maia AS, Plomp JJ, et al. Synaptic assembly of the brain in the absence of neurotransmitter secretion. Science 2000; 287: 864–9. 35. Ashery U, Varoqueaux F, Voets T, et al. Munc13-1 acts as a priming factor for large dense-core vesicles in bovine chromaffin cells. EMBO J 2000; 19: 3586–96. 36. Schoch S, Castillo PE, Jo T, et al. RIM1alpha forms a protein scaffold for regulating neurotransmitter release at the active zone. Nature 2002; 415: 321–6. 37. Davis AF, Bai JH, Fasshauer D, Wolowick MJ, Lewis JL, Chapman ER. Kinetics of synaptotagmin responses to Ca2+ and assembly with the core SNARE complex onto membranes. Neuron 1999; 24: 363–76. 38. Charvin N, Leveque C, Walker D, et al. Direct interaction of the calcium sensor protein synaptotagmin I with a cytoplasmic domain of the alpha (1) A subunit of the P/Q-type calcium channel. EMBO J 1997; 16: 4591–6. 39. Schivell AE, Batchelor RH, Bajjalieh SM. Isoform-spe-cific, calcium-regulated interaction of the synaptic vesicle proteins SV2 and synaptotagmin. J Biol Chem 1996; 271: 27770–5. 40. Fernandez-Chacon R, Konigstorfer A, Gerber SH, et al. Synaptotagmin I functions as a calcium regulator of release probability. Nature 2001; 410: 41–9. 41. Wang CT, Grishanin R, Earles CA, et al. Synaptotagmin modulation of fusion pore kinetics in regulated exocytosis of dense-core vesicles. Science 2001; 294: 1111–5. 42. Mayer A, Wickner W, Haas A. Sec18p (NSF)-driven release of sec17p (alpha-SNAP) can precede docking and fusion of yeast vacuoles. Cell 1996; 85: 83–94. 43. Littleton JT, Barnard RJO, Titus SA, Slind J, Chapman ER, Ganetzky B. Snarecomplex disassembly by nsf follows synaptic vesicle fusion. Proc Nat Acad Sci USA 2001; 98: 12233–8. 44. Sankaranarayanan S, Ryan TA. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci 2001; 4: 129–36. |