Les mutations naturelles responsables d’une altération de la fonction ovarienne chez la femme et les mammifères sont très rares et, jusqu’en 1999, seules avaient été décrites des mutations « perte de fonction », aboutissant à une stérilité ou à une insuffisance ovarienne précoce. Récemment, trois mutations « gain de fonction », se traduisant par une augmentation du nombre d’ovulations, ont été décrites chez la brebis. Dans cette espèce, le cycle sexuel dure de 17 à 19 jours, et aboutit dans la plupart des races à l’ovulation d’un ovocyte unique. Deux des mutations décrites affectent le gène de la cytokine BMP15 (bone morphogenetic protein), et la troisième le récepteur de type IB des BMP. Dans ce dernier cas, la mutation, Glu249Arg, entraîne une augmentation du nombre d’ovulations et donc du nombre de nouveau-nés, chez les brebis Mérinos Booroola [1–3]. Chez les brebis Mérinos, dites mono-ovulantes (une seule ovulation à chaque cycle), l’introduction de cette mutation aboutit à une augmentation du nombre d’ovulations: 3 ovulations par cycle chez les animaux porteurs de la mutation à l’état hétérozygote, et 5 ovulations par cycle chez les animaux porteurs de la mutation à l’état homozygote. Les mutations Val31Asp et Glu23STOP dans le gène codant pour la cytokine BMP15 ont été identifiées respectivement chez les brebis Inverdale et Hanna [4]. Lorsqu’elles sont présentes à l’état hétérozygote, ces deux mutations sont responsables d’une augmentation du nombre d’ovulations, et, à l’état homozygote, elles entraînent une stérilité. L’identification récente de ces trois mutations au sein d’une même famille, celle des bone morphogenetic proteins, suggère un rôle pour ces protéines dans la fonction ovarienne chez les mammifères et chez la femme en particulier.
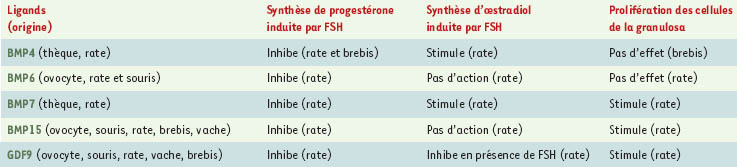
Les BMP appartiennent à la superfamille du TGFβ (transforming growth factor β) qui comprend également l’activine, l’inhibine et l’hormone anti-müllérienne. À ce jour, une vingtaine de molécules BMP ont été identifiées [5]. Elles sont sécrétées sous forme d’homodimères ou d’hétérodimères, et se fixent sur des récepteurs hétérodimériques ayant une activité sérine-thréonine kinase. On distingue les récepteurs de type I (BMPR-IA/ALK3, BMPR-IB/ALK6, ActR-I/ALK2) et les récepteurs de type II (BMPR-II, ActR-II, ActR-IIB). Chacun de ces récepteurs peut, individuellement, se lier à la cytokine correspondante, mais la formation d’un complexe hétéromérique entre un récepteur de type I et un récepteur de type II, induite par la fixation du ligand correspondant, est nécessaire au déclenchement du signal de transduction. Un grand nombre de facteurs de la famille des BMP ont été identifiés dans les follicules ovariens de différentes espèces comme la souris, la rate, la brebis, la vache et également la femme. In vitro, dans des cultures de cellules de granulosa issues d’ovaires de rates et de brebis, si certaines BMP stimulent la prolifération des cellules de la granulosa et la sécrétion d’œstradiol, toutes exercent un effet inhibiteur puissant sur la sécrétion de progestérone (pour revue, voir [6]) (Tableau I).
| Tableau I. Effets des principaux éléments de la famille BMP sur la prolifération et la stéroïdogenèse des cellules folliculaires chez les mammifères. |
Chez la brebis en particulier, nous avons récemment observé une diminution de la sécrétion de progestérone, en présence comme en l’absence de l’hormone folliculostimulante (FSH), lorsque les cellules sont stimulées par BMP4 ou GDF5, deux ligands de BMPR-IB [1]. Cette inhibition est nettement moins marquée sur des cellules de granulosa provenant de brebis Booroola porteuses de la mutation Glu249Arg [1], ce qui suggère que cette mutation est associée à une perte de fonction partielle du récepteur BMPR-IB. L’hypothèse actuelle est donc que les éléments du système BMP, BMPR-IB en particulier, en bloquant la sécrétion de progestérone, empêchent la lutéinisation prématurée du follicule, c’est-à-dire sa capacité de se transformer en corps jaune après l’ovulation. Chez les brebis Booroola porteuses de la mutation, le frein exercé sur la lutéinisation en réponse à l’activation de BMPR-IB serait partiellement levé. Chez les brebis Inverdale et Hanna, porteuses hétérozygotes des mutations « perte de fonction » de BMP15, la perte d’un allèle de BMP15, aboutissant théoriquement à la division par deux de sa concentration dans le follicule ovarien, aboutirait également à une levée de ce frein. Le lien de cause à effet entre cette levée partielle du frein à la lutéinisation du follicule et l’augmentation du nombre d’ovulations reste cependant à établir.
De façon tout à fait paradoxale, alors que la perte de fonction partielle d’un des deux gènes BMP15 et BMPR-IB (chez les hétérozygotes Inverdale ainsi que chez les homozygotes et hétérozygotes Booroola) aboutit à une augmentation du nombre d’ovulations, leur inactivation complète aboutit à une stérilité des femelles. C’est le cas des brebis porteuses de la mutation Inverdale à l’état homozygote, chez lesquelles les follicules sont bloqués au stade de follicule primaire, ce qui suggère que la présence de BMP15, à une concentration bien définie, est nécessaire au bon déroulement de la folliculogenèse, et participe à la détermination du nombre de follicules aptes à ovuler [4]. De même, les souris pour lesquelles le gène bmpr1b a été invalidé (souris bmpr1b−/−) sont stériles. Ces souris présentent des cycles irréguliers et un défaut d’expansion du cumulus (complexe cellulaire qui entoure l’ovocyte) qui rend les ovocytes impropres à la fécondation in vivo [7]. L’invalidation du gène gdf9, facteur structurellement très proche de BMP15 et, comme lui, spécifiquement exprimé par l’ovocyte au démarrage de la croissance folliculaire, conduit également à la stérilité, la folliculogenèse étant bloquée au stade de follicules primaires chez les souris gdf9−/− [8]. En outre, l’injection de GDF9 in vivo chez la rate stimule le passage du stade de follicule primordial à celui de follicule primaire et secondaire (follicules sans antrum), suggérant directement la responsabilité de ce facteur dans le démarrage de la croissance folliculaire [9]. L’importance relative de chaque élément de la famille des BMP dans la fonction ovarienne diffère cependant d’une espèce à l’autre: ainsi, les souris bmp15−/−, à la différence des brebis homozygotes pour la mutation Inverdale, sont fertiles et ne présentent qu’une légère diminution du nombre de petits par portée, sans altération claire de la folliculogenèse [10]. De plus, alors que les souris gdf9+/- ne présentent aucune altération visible de la fertilité, des souris double-mutantes bmp15−/−x gdf9+/-, ont une fertilité très réduite, une réduction importante du nombre de follicules, une folliculogenèse anormale, en particulier dans les stades terminaux, et un défaut d’expansion du cumulus in vivo [10]. L’extrapolation à la femme des données obtenues dans ces espèces modèles devra donc être réalisée avec la plus grande prudence.
L’ensemble de ces résultats montre que les BMP sont indispensables à la folliculogenèse. Bien que les actions et l’importance des différents ligands semblent varier d’une espèce à l’autre, les BMP, en inhibant la synthèse de progestérone des follicules en fin de croissance, freineraient la lutéinisation du follicule. Un déficit en BMP provoquerait alors une lutéinisation précoce et un enkystement du follicule non ovulé. Il est donc possible d’envisager la responsabilité d’anomalies du système BMP dans la pathogénie du syndrome des ovaires polykystiques chez la femme. Un travail récent vient d’ailleurs de mettre en évidence une réduction de l’expression de GDF9 dans les ovocytes de femme souffrant de ce syndrome [11]. En revanche, les mécanismes expliquant l’augmentation du nombre d’ovulations chez les brebis Booroola et Inverdale, respectivement porteuses de mutations dans BMPR-IB et dans BMP15, restent à découvrir.