| |
| Med Sci (Paris). 2004 January; 20(1): 98–104. Published online 2004 January 15. doi: 10.1051/medsci/200420198.Prévention des resténoses intrastent : vers un traitement in situ
Mikaël Mazighi, Yann Gouëffic, Aliocha Scheuble, and Laurent J. Feldman* Service de Cardiologie et Inserm U.460, Hôpital Bichat, 46, rue Henri Huchard, 75018 Paris, France |
L’introduction des stents à la fin des années 80 a constitué une étape décisive dans le développement des techniques de cardiologie interventionnelle [
1] (voir Encadré). En France, 75 % à 90 % des procédures d’angioplastie coronaire s’accompagnent de l’implantation d’un ou plusieurs stents (environ 120000 stents ont ainsi été implantés en 2000). Cette « stentomanie » s’explique autant par l’efficacité des stents dans le traitement des occlusions coronaires aiguës survenant en cours d’angioplastie que par leur simplicité d’emploi ou encore par la diminution sensible de la fréquence des resténoses par rapport à la seule angioplastie au ballonnet [
2,
3]. Dans les études cliniques les plus récentes, l’incidence des resténoses intra-stent varie entre 10 % et 20 % [
4]. Ces chiffres doivent néanmoins être considérés avec précaution, car les critères d’inclusion très stricts aboutissent dans ces grandes études à une sélection de « cas idéaux » (typiquement, des sténoses focales touchant des artères coronaires natives de plus de 3 mm de diamètre) et donc à une très probable sous-évaluation de l’incidence réelle des resténoses intrastent. En cas de resténose, une nouvelle angioplastie est quasiment toujours possible, mais le risque de resténose récurrente peut alors atteindre 50 % [
5]. |
Physiopathologie de l’hyperplasie intimale intrastent L’effet protecteur des stents contre les resténoses résulte essentiellement d’un meilleur gain luminal immédiatement après le déploiement du stent (par inhibition du rappel élastique de la paroi artérielle) et d’une prévention du remodelage constrictif chronique (principal mécanisme des resténoses après angioplastie au ballonnet). En revanche, l’hyperplasie intimale est plus marquée qu’après une angioplastie au ballonnet et constitue le mécanisme presque exclusif des resténoses intrastent [
6]. Le traumatisme artériel provoqué par l’implantation d’un stent est très différent de celui qui suit une angioplastie au ballonnet [
7] : les barreaux métalliques dilacèrent profondément la paroi artérielle, non seulement au niveau de la plaque d’athérosclérose et de son centre lipidique, mais aussi de la média sous-jacente, avec une relation quasi linéaire entre la sévérité du traumatisme et l’épaississement intimal qu’il engendre (voir Encadré). L’examen de prélèvements post-mortem montre une réaction inflammatoire riche en macrophages et en lymphocytes T, présente à tous les stades de développement de la néointima et prédominant dans les premières semaines [7]. Chez le lapin hypercholestérolémique, le recrutement des cellules inflammatoires (polynucléaires neutrophiles et monocytes) est particulièrement marqué après l’implantation d’un stent (Figure 1) par rapport à la situation observée après angioplastie au ballonnet ; par ailleurs, l’inhibition de la réaction inflammatoire par un anticorps dirigé contre l’intégrine Mac-1 [
8] ou par l’interleukine-10 [
9] prévient l’hyperplasie intimale intrastent. Dans le même modèle, l’expression et l’activité des métalloprotéases MMP-2 et MMP-9 sont bien plus importantes et prolongées après l’implantation d’un stent qu’après une angioplastie au ballonnet [
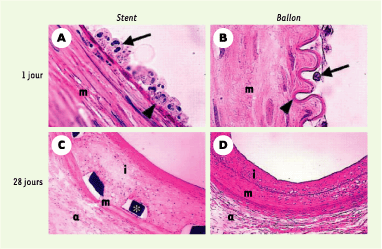
10], ce qui facilite probablement la migration des cellules musculaires lisses et des cellules inflammatoires dans l’intima.  | Figure 1.
Coupes histologiques transversales d’artères iliaques de lapins hypercholestérolémiques colorées par un mélange hématoxyline-phloxine-safran. Les animaux ont été sacrifiés 24 heures ou 28 jours après l’implantation d’un stent métallique ou une angioplastie au ballonnet. Noter l’importance du recrutement des polynucléaires neutrophiles (flèche) 24 heures après l’implantation du stent, alors qu’après une angioplastie au ballonnet la réaction inflammatoire est plus discrète. La limitante élastique interne (tête de flèche) est typiquement étirée par le stent alors qu’elle apparaît « festonnée » après une angioplastie au ballonnet. À 28 jours, noter que l’épaississement intimal est plus important après implantation d’un stent qu’après une angioplastie au ballonnet. |
L’échec des traitements préventifs « traditionnels » [
11,
12] et le caractère éminemment focal des resténoses ont orienté les recherches vers le développement de stratégies de prévention in situ. En théorie, ce type de traitement offre le double avantage de concentrer l’effet des médicaments au site d’implantation du stent (efficacité maximale) tout en réduisant leurs effets délétères systémiques (anticoagulation, immunosuppression, cytotoxicité). Les stents recouverts (imprégnés) de médicaments, qui sont l’objet de cet article, constituent une approche de prévention des resténoses sur le point de révolutionner la pratique de la cardiologie interventionnelle. |
Stents imprégnés « passifs » La principale limite à la mise au point de stents délivrant localement des médicaments a longtemps été l’effet pro-inflammatoire des polymères utilisés pour retenir le médicament à la surface du stent et faciliter ensuite son élution progressive dans la paroi artérielle : par exemple, l’implantation, dans des coronaires de porcs, de stents recouverts de bandes de polymères biodégradables ou non entraîne la formation de thromboses, parfois occlusives, au contact des bandes polymériques, associées à une hyperplasie intimale riche en cellules géantes multinucléées et en macrophages [
13]. Une première approche a consisté à enrober les stents métalliques de revêtements ayant une biocompatibilité plus grande que les métaux habituellement utilisés (acier inoxydable 316L, nitinol et tantale). Les revêtements en or aggravent plutôt les lésions de resténose, alors que le titane, sous forme d’alliage (TiNOX), diminue l’adhérence plaquettaire et l’épaississement intimal. D’autres stents recouverts de carbone, de carbure de silicium (semi-conducteur) ou de phosphorylcholine (un composant naturel de la membrane cellulaire qui peut également servir de réservoir pour délivrer localement un médicament) ont été utilisés, mais n’ont pas démontré de réelle supériorité par rapport aux stents « classiques ». Enfin, des stents totalement polymériques et biorésorbables, en acide poly-l-lactique, ont été mis au point et implantés avec succès chez l’homme [
14]. Ils pourraient être utilisés pour délivrer localement des substances antiproliférantes [
15] ou des vecteurs de thérapie génique [
16]. |
Stents imprégnés « actifs » La première expérience clinique testant un stent imprégné « actif » a été réalisée avec un stent en acier inoxydable auquel étaient liées de façon covalente (procédé Carmeda AB) des molécules d’héparine [
17] : en se liant à l’antithrombine III circulante, l’héparine fixée au stent inhibe la formation de thrombine dans l’environnement du stent. Dans l’étude multicentrique Benestent-II, la proportion de cas avec thrombose subaiguë intrastent était très faible (0,4 %), et le risque de resténose plus faible que dans le groupe témoin traité par une angioplastie au ballonnet seul (16 % contre 31 %). Toutefois, l’absence de groupe témoin recevant un stent classique ne permettait pas de conclure à l’efficacité spécifique du stent recouvert d’héparine. Ce n’est que récemment que des stents imprégnés libérant réellement des molécules antiprolifératives dans la paroi artérielle ont prouvé leur effet préventif sur l’hyperplasie intimale expérimentale, et ont pu être utilisés chez l’homme. Rapamycine La rapamycine (sirolimus) est un antibiotique naturel de la classe des macrolides, produit par Streptomyces hygroscopicus, un micro-organisme découvert dans le sol de l’Île de Pâques (rapa nui en polynésien). R. Gallo et al. [
18] ont montré que des injections systémiques de rapamycine diminuent d’environ 50 % l’hyperplasie intimale des coronaires de porc après une angioplastie au ballonnet ; cet effet intervient via une augmentation de l’expression de p27 (un inhibiteur des kinases dépendantes des cyclines) et une diminution de la phosphorylation de la protéine du rétinoblastome (Rb) [
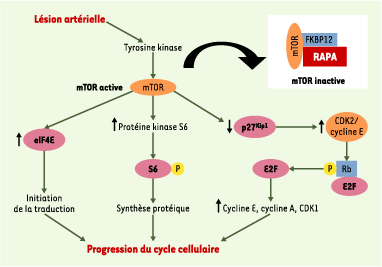
26] (Figure 2). Il résulte de cette chaîne d’événements moléculaires une inhibition de la prolifération des cellules musculaires lisses (arrêt en phase G1, effet cytostatique), mais aussi de leur migration, ce qui fait de la rapamycine un candidat potentiel pour la prévention des resténoses.  | Figure 2.
Inhibition de la prolifération des cellules musculaires lisses par la rapamycine. La voie de signalisation kinase mTOR ( mammalian target of rapamycin)-p70S6 (protéine kinase S6 de 70 kDa) est impliquée dans la progression du cycle cellulaire : effets sur les CDK ( cyclin dependent kinases) de la phase G1 (réduction de la protéine p 27Kip1 entraînant une augmentation de l’activité du complexe CDK2/cycline E et de la phosphorylation de Rb, à l’origine de la libération du facteur de transcription E2F et de l’activation subséquente des gènes codant pour les cyclines E et A, ainsi que pour CDK1) ; activation de la protéine kinase S6, une enzyme impliquée dans la régulation du niveau de phosphorylation de la protéine ribosomique S6 ; augmentation de l’activité du facteur d’initiation eucaryote 4E (eIF4E), par l’intermédiaire de la phosphorylation et de l’inactivation de son inhibiteur, l’eIF4E-binding protein. La protéine kinase S6 comme l’eIF4E sont très importants dans l’initiation de la traduction, car ils sont nécessaires pour accélérer le taux de synthèse protéique en préparation de la division cellulaire. La rapamycine (RAPA) forme un complexe avec la FK-binding protein 12 (FKBP12), membre du groupe des protéines intracellulaires de liaison spécifique appelées immunophilines. Ce complexe rapamycine-immunophiline inhibe la protéine mTOR, et donc l’ensemble des événements qui dépendent de son activation. C’est l’inhibition de l’initiation de la traduction protéique par mTOR qui est supposée être le mécanisme principal de l’effet antiprolifératif de la rapamycine, qui se traduit par une réduction de la synthèse protéique et un arrêt simultané du cycle cellulaire en phase S (d’après [
32]). |
T. Suzuki et al. [
19] ont testé l’effet d’un stent recouvert de rapamycine dans un modèle de resténose coronaire chez le porc. Le copolymère (non biodégradable) utilisé dans cette étude était une association de poly-n-butyl méthacrylate et de polyéthylène-vinyl acétate contenant environ 185 µg de rapamycine. L’activité proliférante à 7 jours et la surface néointimale à 4 semaines étaient diminuées de 50 % dans le groupe recevant le stent recouvert de rapamycine, par rapport au groupe recevant le stent métallique sans polymère. La rapamycine ne retardait pas la réendothélialisation du stent et l’infiltration inflammatoire semblait réduite. En revanche, la néointima était plus riche en fibrine et plus pauvre en cellules musculaires lisses, témoignant d’un certain « retard » de cicatrisation de la lésion. Enfin, le polymère utilisé n’engendrait pas de toxicité tissulaire spécifique et n’aggravait pas l’épaississement intimal. Ces résultats expérimentaux encourageants ont ouvert la voie à des essais cliniques dont le retentissement a été planétaire. Dans l’étude pilote FIM (first in man), 45 patients présentant une sténose focale ont reçu un stent recouvert d’un polymère non biodégradable libérant de la rapamycine de façon rapide (moins de 15 jours) ou prolongée (adjonction d’une couche polymérique de surface, ou topcoat). L’hyperplasie intimale était évaluée lors de contrôles coronarographiques itératifs par angiographie quantitative et échographie endocoronaire. Aucune resténose n’a été observée au cours des suivis à 4, 6 et 12 mois [
20,
21]. Par ailleurs, aucun cas de thrombose tardive n’a été rapporté, et il ne semblait pas y avoir d’aggravation de la sténose aux berges du stent. Les résultats de l’étude randomisée RAVEL ont confirmé ces résultats : après un suivi de 6 mois, 26 % des patients du groupe témoin avaient une resténose angiographique, contre 0 % dans le groupe « rapamycine ». À 210 jours, 72,9 % des patients étaient indemnes d’événements cliniques (décès, infarctus ou resténose nécessitant une nouvelle procédure de revascularisation) dans le groupe témoin, contre 96,7 % dans le groupe « rapamycine » [
22]. Dans l’étude SIRIUS [20, 21,
23], de plus grande taille et réalisée dans une population de patients plus sévèrement atteints, les stents au sirolimus diminuent (mais n’abolissent pas) la survenue à 9 mois du critère principal de jugement de l’étude (décès d’origine cardiaque, infarctus du myocarde ou resténose nécessitant une nouvelle procédure de revascularisation), qui est retrouvée chez 8,6 % des patients ayant reçu un stent au sirolimus contre 21 % chez les patients témoins. Paclitaxel et dérivés Le paclitaxel (Taxol ®), agent naturel présent dans l’écorce de l’if du Pacifique ( Taxus brevifolia), est une molécule cytotoxique utilisée dans le traitement des cancers de l’ovaire. Responsable d’une polymérisation et d’une stabilisation de la tubuline, principale protéine impliquée dans la formation des microtubules du fuseau mitotique, le paclitaxel bloque la mitose en interphase et entraîne la mort cellulaire [
24]. Administré par voie systémique, le paclitaxel inhibe l’hyperplasie intimale de la carotide de rat [
25]. A.W. Heldman et al. [ 26] ont implanté dans des artères coronaires de porcs un stent métallique de Palmaz-Schatz (Cordis) recouvert d’un film de paclitaxel (0 à 187 µg/stent) dilué dans de l’éthanol, sans adjonction de polymère. Après 4 semaines de suivi, on observe une réduction de l’hyperplasie intimale intrastent dépendante de la dose utilisée, mais aussi la présence d’une hémorragie intra-intimale dont l’importance semble également liée à la dose de paclitaxel utilisée. A. Farb et al. [
27] ont utilisé un stent Multilink (Guidant) recouvert de paclitaxel (0 à 42 µg/stent) stabilisé par une couche de gélatine et de sulfate de chondroïtine. Une diminution de 35 % à 50 % de l’hyperplasie intimale de l’artère iliaque de lapin est observée après 4 semaines de suivi, mais l’effet protecteur n’est plus observé à 90 jours. Par ailleurs, on note un excès, dépendant de la dose de paclitaxel, d’hémorragies intimales, de dépôts de fibrine et d’inflammation vasculaire. Dans le même modèle, D.E. Drachman et al. [
28] ont utilisé un stent NIR (Boston Scientific) recouvert du copolymère poly(lactide-co-S-caprolactone) (pLA/pCL) contenant 200 µg de paclitaxel : l’épaississement intimal est diminué de 50 % à 60 % à 1 mois, 2 mois et 6 mois, mais on observe un excès de fibrine et d’infiltrat inflammatoire, un défaut de matrice extracellulaire (collagène et hyaluronane) et un retard net de réendothélialisation persistant à 6 mois. Plusieurs études randomisées ont été réalisées avec des stents recouverts de paclitaxel. Dans l’étude TAXUS II [
29], les patients ayant reçu un stent libérant du Taxol® avec une cinétique lente et modérée ont une obstruction luminale, mesurée par échographie endocoronaire, de seulement 8 % contre 20 % dans les groupes témoins, aboutissant à une diminution nette du risque de resténose angiographique (2 % à 5 % contre 20 % à 24 % pour les sujets témoins). Autres candidats : des stents actifs à la thérapie génique… De nombreuses autres molécules ont été testées chez le porc et font déjà l’objet d’essais cliniques. Les résultats obtenus avec l’actinomycine D (un agent antimitotique inhibant la transcription de l’ADN en ARN messager) ou le batimastat (un inhibiteur non spécifique des métalloprotéases) sont décevants. Des résultats plus encourageants ont été rapportés avec la dexaméthasone. Le tacrolimus, un analogue du sirolimus, est en cours d’investigation clinique dans des études pilotes. L’efficacité de nouveaux stents imprégnés libérant de l’angiopeptine, du 17-β-œstradiol, des statines, des facteurs de croissance angiogéniques (VEGF, vascular endothelial growth factor) voire des oligonucléotides antisens inhibiteurs de c- myc reste à préciser. Des stents actifs pourraient également être développés dans l’avenir comme supports de thérapie génique ; des « gènes médicaments » pourraient ainsi être incorporés dans une matrice polymérique recouvrant le stent [
30] ou être incorporés, in vitro, dans des cellules vasculaires autologues secondairement transplantées dans le stent in vivo. Une liste non exhaustive des gènes candidats ayant un effet protecteur potentiel sur les resténoses expérimentales est présentée dans le Tableau I. Si les adénovirus ont été considérés comme des vecteurs de choix dans cette dernière approche, on sait qu’ils engendrent une réponse inflammatoire qui rend improbable leur utilisation en clinique. Nous avons mis au point une méthode permettant d’implanter dans un stent métallique classique des cellules vasculaires autologues modifiées génétiquement par des rétrovirus, qui expriment de façon prolongée un gène thérapeutique [
31] ; l’efficacité de cette thérapie cellulaire doit maintenant être démontrée.  | Tableau I.
Gènes candidats pour une thérapie génique des resténoses intrastent. eNOS : endothelial nitric oxide synthase ; PCNA : proliferating cell nuclear antigen ; TIMP : tissue inhibitor of metalloproteinase ; TFPI : tissue factor pathway inhibitor ; VEGF : vascular endothelial growth factor. |
|
Il ne fait pas de doute que la promesse d’une quasi-éradication des resténoses par les stents « actifs » va inciter à réaliser encore plus de revascularisations myocardiques, en particulier dans les cas les plus complexes pour lesquels la cardiologie interventionnelle a pour l’instant été tenue en échec ou n’a pas donné de meilleurs résultats que la revascularisation chirurgicale. Même si certaines questions concernant ces nouveaux stents restent en suspens - efficacité à long terme, risque de thrombose tardive par défaut de réendothélialisation, supériorité de l’une des stratégies sur les autres, surcoût… - tout porte à croire qu’ils représentent bien la « troisième révolution » de la cardiologie interventionnelle, après l’introduction de l’angioplastie au ballonnet puis celle des stents métalliques « classiques ».
|
1. Ruygrok PN, Serruys PW. Intracoronary stenting. From concept to custom. Circulation 1996; 94 : 882–90. 2. Serruys PW, de Jaegere P, Kiemeneij F, et al. A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease. Benestent Study Group. N Engl J Med 1994; 331 : 489–95. 3. Fischman DL, Leon MB, Baim DS, et al. A randomized comparison of coronary-stent placement and balloon angioplasty in the treatment of coronary artery disease. Stent Restenosis Study Investigators. N Engl J Med 1994; 331 : 496–501. 4. Lincoff AM, Califf RM, Moliterno DJ, et al. Complementary clinical benefits of coronary-artery stenting and blockade of platelet glycoprotein IIb/IIIa receptors. Evaluation of platelet IIb/IIIa inhibition in stenting investigators. N Engl J Med 1999; 341 : 319–27. 5. Eltchaninoff H, Koning R, Tron C, et al. Balloon angioplasty for the treatment of coronary in-stent restenosis : Immediate results and 6-month angiographic recurrent restenosis rate. J Am Coll Cardiol 1998; 32 : 980–4. 6. Hoffmann R, Mintz GS, Dussaillant GR, et al. Patterns and mechanisms of in-stent restenosis. A serial intravascular ultrasound study. Circulation 1996; 94 : 1247–54. 7. Farb A, Sangiorgi G, Carter AJ, et al. Pathology of acute and chronic coronary stenting in humans. Circulation 1999; 99 : 44–52. 8. Rogers C, Edelman ER, Simon DI. A mAb to the beta2-leukocyte integrin Mac-1 (CD11b/CD18) reduces intimal thickening after angioplasty or stent implantation in rabbits. Proc Natl Acad Sci USA 1998; 95 : 10134–9. 9. Feldman LJ, Aguirre L, Ziol M, et al. Interleukin-10 inhibits intimal hyperplasia after angioplasty or stent implantation in hypercholesterolemic rabbits. Circulation 2000; 101 : 908–16. 10. Feldman LJ, Mazighi M, Scheuble A, et al. Differential expression of matrix metalloproteinases after stent implantation and balloon angioplasty in the hypercholesterolemic rabbit. Circulation 2001; 103 : 3117–22. 11. The ERASER investigators. Acute platelet inhibition with abciximab does not reduce in-stent restenosis (ERASER study). Circulation 1999; 100 : 799–806. 12. Meurice T, Bauters C, Hermant X, et al. Effect of ACE inhibitors on angiographic restenosis after coronary stenting (PARIS) : A randomised, double-blind, placebo-controlled trial. Lancet 2001; 357 : 1321–4. 13. van der Giessen WJ, Lincoff AM, Schwartz RS, et al. Marked inflammatory sequelae to implantation of biodegradable and nonbiodegradable polymers in porcine coronary arteries. Circulation 1996; 94 : 1690–7. 14. Tamai H, Igaki K, Kyo E, et al. Initial and 6-month results of biodegradable poly-l-lactic acid coronary stents in humans. Circulation 2000; 102 : 399–404. 15. Yamawaki T, Shimokawa H, Kozai T, et al. Intramural delivery of a specific tyrosine kinase inhibitor with biodegradable stent suppresses the restenotic changes of the coronary artery in pigs in vivo. J Am Coll Cardiol 1998; 32 : 780–6. 16. Ye YW, Landau C, Willard JE, et al. Bioresorbable microporous stents deliver recombinant adenovirus gene transfer vectors to the arterial wall. Ann Biomed Eng 1998; 26 : 398–408. 17. Serruys PW, van Hout B, Bonnier H, et al. Randomised comparison of implantation of heparin-coated stents with balloon angioplasty in selected patients with coronary artery disease (Benestent II). Lancet 1998; 352 : 673–81. 18. Gallo R, Padurean A, Jayaraman T, et al. Inhibition of intimal thickening after balloon angioplasty in porcine coronary arteries by targeting regulators of the cell cycle. Circulation 1999; 99 : 2164–70. 19. Suzuki T, Kopia G, Hayashi S, et al. Stent-based delivery of sirolimus reduces neointimal formation in a porcine coronary model. Circulation 2001; 104 : 1188–93. 20. Sousa JE, Costa MA, Abizaid A, et al. Lack of neointimal proliferation after implantation of sirolimus-coated stents in human coronary arteries : a quantitative coronary angiography and three-dimensional intravascular ultrasound study. Circulation 2001; 103 : 192–5. 21. Sousa JE, Costa MA, Abizaid AC, et al. Sustained suppression of neointimal proliferation by sirolimus-eluting stents : one-year angiographic and intravascular ultrasound follow-up. Circulation 2001; 104 : 2007–11. 22. Morice MC, Serruys PW, Sousa JE, et al. A randomized comparison of a sirolimus-eluting stent with a standard stent for coronary revascularization. N Engl J Med 2002; 346 : 1773–80. 23. Moses JW, Leon MB, Popma JJ, et al. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery. N Engl J Med 2003; 349 : 1315–23. 24. Jordan MA, Toso RJ, Thrower D, et al. Mechanism of mitotic block and inhibition of cell proliferation by taxol at low concentrations. Proc Natl Acad Sci USA 1993; 90 : 9552–6. 25. Sollott SJ, Cheng L, Pauly RR, et al. Taxol inhibits neointimal smooth muscle cell accumulation after angioplasty in the rat. J Clin Invest 1995, 95 : 1869–76. 26. Heldman AW, Cheng L, Jenkins GM, et al. Paclitaxel stent coating inhibits neointimal hyperplasia at 4 weeks in a porcine model of coronary restenosis. Circulation 2001; 103 : 2289–95. 27. Farb A, Heller PF, Shroff S, et al. Pathological analysis of local delivery of paclitaxel via a polymer-coated stent. Circulation 2001; 104 : 473–9. 28. Drachman DE, Edelman ER, Seifert P, et al. Neointimal thickening after stent delivery of paclitaxel. Change in composition and arrest of growth over six months. J Am Coll Cardiol 2000; 36 : 2325–32. 29. Colombo A, Drzewiecki J, Banning A, et al. Randomized study to assess the effectiveness of slow- and moderate-release polymer-based paclitaxel-eluting stents for coronary artery lesions. Circulation 2003; 108 : 788–94. 30. Klugherz BD, Jones PL, Cui X, et al. Gene delivery from a DNA controlled-release stent in porcine coronary arteries. Nat Biotechnol 2000; 18 : 1181–4. 31. Goueffic Y, Meddahi A, Mezzina M, Mazighi M, Feldman L. Smooth muscle cell seeding after arterial injury. Eur Heart J 2001; 22 : 429. 32. Dzau VJ, Braun-Dullaeus RC, Sedding DG. Vascular proliferation and atherosclerosis : new perspectives and therapeutic strategies. Nat Med 2002; 8 : 1249–56. |