Nous assistons, depuis l’avènement du marquage en bandes des chromosomes, à une véritable révolution technologique en cytogénétique humaine et animale. Après l’introduction en 1969 par M.L. Pardue et J.G. Gall [ 1] de l’hybridation in situ isotopique, il est devenu possible d’analyser des séquences d’ADN à l’intérieur des cellules sans altérer leur morphologie. En 1986, Pinkel et al. [ 2] puis Cremer et al. [ 3] ont introduit l’hybridation in situ fluorescente ou FISH (fluorescence in situ hybridization) avec des sondes non radioactives combinant les principes d’hybridation de l’ADN aux techniques d’immunofluorescence. En 1989, la technique de marquage non radioactif par synthèse in situ amorcée ou PRINS (primed in situ labelling) décrite par Koch et al. [ 4] va alors représenter un outil de recherche et de diagnostic en cytogénétique moléculaire (Figure 1). Comparée à la technique FISH, cette méthode offre de multiples avantages, notamment la simplicité de son protocole, la spécificité du marquage obtenu et son faible coût (Tableau I).
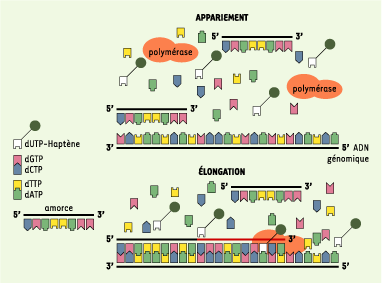
| Figure 1.
Schéma illustrant les deux étapes de la technique PRINS (marquage non isotopique par synthèse in situ amorcée) et ses principales applications. Un volume d’environ 45 μl d’un mélange réactionnel constitué entre autre d’une amorce (courte séquence oligonucléotidique de 18 à 35 nucléotides), de trois nucléotides non marqués et d’un nucléotide marqué (soit avec un haptène non fluorescent comme la biotine ou la digoxigénine, soit avec un fluorochrome) et de la Taq ADN polymérase est ajouté sur la lame. La première étape consiste en l’appariement des amorces non marquées à leur séquence d’ADN génomique complémentaire. La deuxième étape est une polymérisation à partir de l’extrémité 3’ du segment apparié par l’intermédiaire de la Taq ADN polymérase dont la fonction est de catalyser la réaction d’élongation. La présence du nucléotide marqué (dUTP sur la figure) permet la détection du fragment d’élongation nouvellement synthétisé. Dans le cas d’un couplage avec un haptène, la détection est faite à l’aide de différents systèmes de révélation (avidine-biotine, anticorps antidigoxigénine…). Dans le cas d’un marquage par un fluorochrome, la détection est directe. La durée de réalisation de la technique incluant la dénaturation des lames, la préparation des réactifs, les lavages et la révélation est d’environ 60 à 120 minutes. Les échantillons classiques d’exploitation du PRINS sont des préparations cytogénétiques, mais il est possible de réaliser ce type de réaction sur des coupes histologiques effectuées sous cryostat et sur des préparations de fibres d’ADN. |
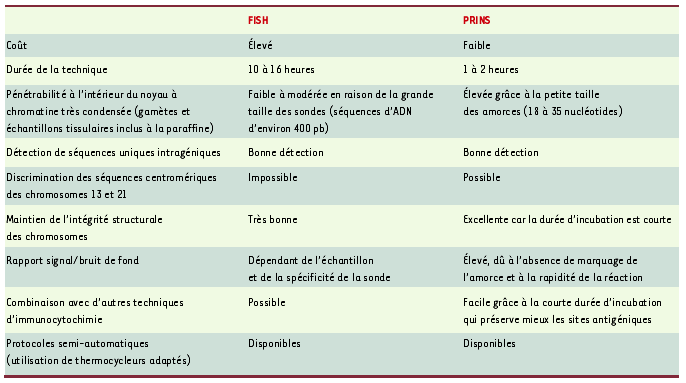
| Tableau I.
Comparaison des techniques FISH et PRINS.
|
Le développement de cette méthode a permis de multiplier et de diversifier ses applications [ 5, 6]. Elle permet l’analyse des différentes familles de séquences d’ADN répétées telles que : (1) les séquences de type satellite α particulières aux centromères, les séquences satellites I, II, III et les séquences β-satellites spécifiques des régions péricentromériques et hétérochromatiques [ 7] ; (2) les séquences répétées Alu dispersées et préférentiellement localisées dans les bandes R (reverse) des chromosomes [ 8] ; (3) l’ADN minisatellite des séquences télomériques [ 9]. La spécificité chromosomique des séquences α-satellites qui ont été décrites pour tous les chromosomes humains a été mise à profit pour développer un marquage centromérique spécifique de la plupart des chromosomes [ 10]. Ces données ont été utilisées pour définir des amorces oligonucléotidiques spécifiques à chacun des chromosomes en les choisissant dans la région présentant le plus de polymorphisme nucléotidique. Ainsi, chaque amorce porte un nucléotide spécifique d’un chromosome à son extrémité 3’. Parallèlement, des améliorations techniques ont porté sur l’automatisation de la technique PRINS et le marquage simultané de plusieurs chromosomes [ 11]. Dans le domaine de la biologie humaine, elle a principalement servi au diagnostic cytopathologique [ 12] et cytogénétique [ 13]. De récents développements techniques ont permis la détection in situ de séquences uniques [ 14– 20], ouvrant ainsi de nouvelles perspectives pour cette technique.
Initialement, la technique PRINS était utilisée pour détecter un seul chromosome qui était révélé à l’aide d’un seul fluorochrome. Puis, divers protocoles PRINS polychromes (multicouleurs) ont été mis au point pour révéler simultanément plusieurs chromosomes. Le protocole le plus simple est réalisé en un seul cycle [20]. Il consiste à utiliser deux amorces oligonucléotidiques spécifiques de deux chromosomes donnés, dont l’une est marquée en 5’ avec un fluorochrome et l’autre non marquée. La couleur du fluorochrome utilisé pour l’élongation est différente de celle marquant l’amorce. La cible reconnue par cette amorce marquée aura une couleur composite provenant à la fois de l’hybridation de l’amorce et de l’élongation. Cette méthode permet ainsi de faire la discrimination entre les deux cibles. D’autres procédés permettent de détecter simultanément et spécifiquement plusieurs chromosomes avec des couleurs différentes sur la même cellule en interphase ou en division. Le marquage in situ de plusieurs chromosomes se fait de manière séquentielle, en utilisant plusieurs fluorochromes et en intercalant entre chaque réaction PRINS une phase de blocage au niveau de l’extrémité 3’ libre du fragment d’élongation synthétisé au cours de la réaction PRINS précédente. Une nouvelle approche plus simple et plus rapide a été récemment introduite par Yan et al. [ 21]. Ces auteurs ont démontré qu’à l’aide de trois amorces distinctes utilisées en trois réactions PRINS consécutives incorporant deux formes de dUTP (couplés à la biotine et à la digoxigénine) et de seulement deux fluorochromes (rhodamine et fluorescéine), il était possible de produire in situ trois marquages chromosomiques spécifiques révélés par trois couleurs différentes en omettant simplement l’étape de blocage en 3’ du segment d’élongation (Figure 2). L’obtention de trois couleurs distinctes (rouge, vert et jaune) est directement fonction de l’insertion des nucléotides marqués par un fluorochrome dans le fragment d’élongation produit au cours des trois réactions PRINS consécutives. Cette approche présente l’avantage d’éliminer l’étape de blocage qui rallonge la durée de la réaction globale. La succession de ces réactions peut être entièrement réalisée en l’espace de 90 minutes, diminuant le temps et le coût de la technique. En théorie, la combinaison Booléenne 2N- 1, où N représente le nombre de fluorochromes différents, peut être appliquée pour couvrir l’ensemble du génome humain. Cette nouvelle approche montre qu’il est possible de multiplier le nombre de couleurs et par conséquent le nombre de cibles autant de fois qu’on le souhaite.
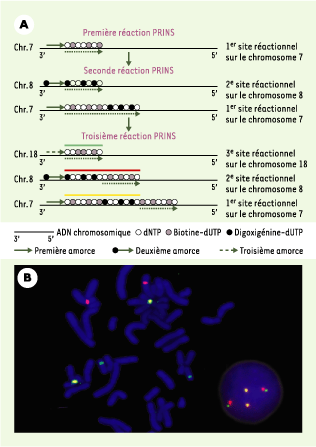
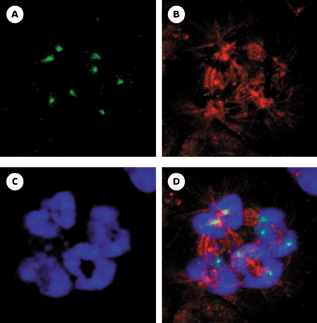
| Figure 2.
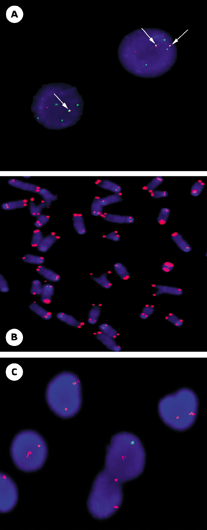
Technique PRINS triple-couleurs. A. Schéma de la technique PRINS triple-couleurs développée par Yan et al. [21]. Après trois réactions PRINS consécutives, les cibles des chromosomes 7, 8 et 18 sont identifiées respectivement par les couleurs jaune, rouge et vert. Les flèches en pointillés situées sous l’ADN chromosomique indiquent les sites d’extension sur chaque brin du début à la fin de chaque réaction PRINS. La méthode illustrée ici correspond au marquage séquentiel (trois réactions successives) utilisant la biotine, la digoxigénine et la biotine. La détection est réalisée avec l’avidine-fluorescéine et l’anti-digoxigénine-rhodamine qui se lient respectivement à la biotine et à la digoxigénine. Les meilleurs résultats, pour la création de la couleur jaune, sont obtenus avec un rapport 2 : 1 de fluorescence verte par rapport à la fluorescence rouge. Cela est dû aux intensités d’excitation et d’émission supérieures du fluorochrome rouge par rapport à celles du fluorochrome vert. B. Détection simultanée de trois chromosomes par réaction PRINS triple-couleurs sur une métaphase et un noyau interphasique. Les deux signaux jaunes correspondent aux centromères des chromosomes 7 (première cible) et sont facilement reconnaissables. Les deux signaux rouges correspondent aux centromères des chromosomes 8 (deuxième cible) et les deux signaux purement verts représentent les centromères des chromosomes 18 (troisième cible). |