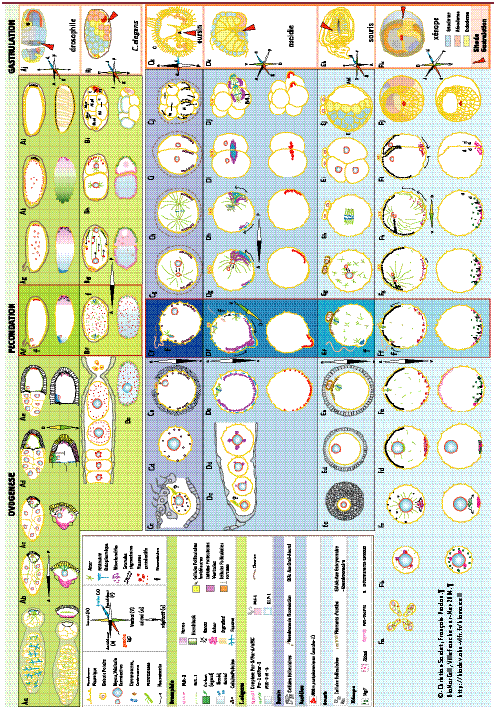
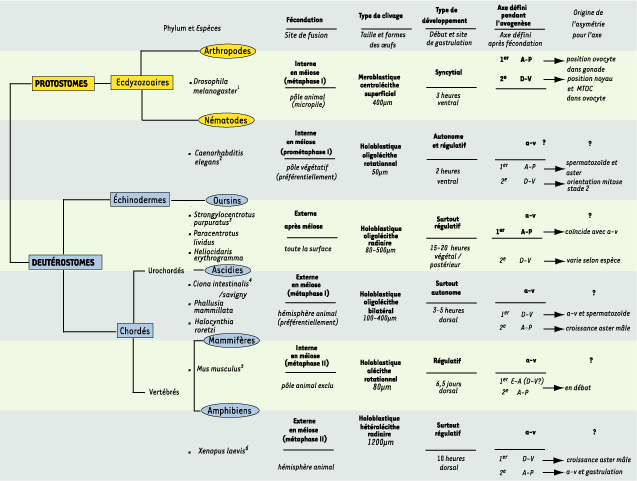
Détermination de l’axe primaire animal-végétatif Dans la majorité des organismes deutérostomiens et protostomiens, une première polarité correspondant à l’axe a-v (animal-végétatif) est établie durant l’ovogenèse [6, 7]. Le pôle animal (a) est clairement défini avant la fécondation par la position des chromosomes méiotiques et le site d’extrusion des globules polaires. Le pôle végétatif (v) est, par définition, situé à l’opposé. L’axe primaire a-v participe généralement à la spécification des axes embryonnaires antéro-postérieur (A-P) et dorso-ventral (D-V) (Tableau I et Poster).

L’origine de la polarité a-v reste mal définie et suscite peu de travaux à l’heure actuelle. On sait seulement que, chez les céphalochordés et certains échinodermes comme le concombre de mer, l’ovocyte dérive d’une cellule épithéliale dotée d’un cil primaire dont le corps basal préfigure le centrosome au site de méiose (pôle animal) [
14]. Dans les cas de la drosophile et de C. elegans, le terme axe a-v n’est presque jamais employé : l’ovocyte de C. elegans ne semble pas posséder d’asymétrie à l’issue de l’ovogenèse, la position légèrement excentrée de la vésicule germinative ne jouant apparemment aucun rôle déterminant pour le développement d’un premier axe A-P, qui dépend du spermatozoïde fécondant (Poster, Be-f). Chez la drosophile, le positionnement de l’ovocyte dans la gonade conditionne l’établissement d’un premier axe qui correspond directement au futur axe embryonnaire A-P, sans que l’on puisse à proprement parler d’un axe a-v (Poster, Ab-e). Selon l’espèce considérée, l’axe primaire a-v devient perceptible à différents stades de l’ovogenèse. Cette polarisation lente se manifeste par des différenciations cytoplasmiques et corticales visibles le long de l’axe (granules, vésicules pigmentaires, déformations de surface), qui sont intimement liées aux périodes de croissance de l’ovocyte (vitellogenèse) et dépendent des interactions et échanges avec les cellules folliculaires et nourricières environnantes. La plus significative et souvent la première de ces différenciations cytoplasmiques axiales des ovocytes est la formation de domaines cytoplasmiques particuliers, appelés plasmes germinatifs, qui sont transmis par la mère via les cellules germinales [
15,
16]. Les caractéristiques conservées des plasmes germinatifs (agrégations spécifiques de granules et d’organites et, au niveau moléculaire, d’ARNm ou de protéines telles que Vasa) constituent les meilleurs marqueurs cellulaires des pôles végétatif ou postérieur des œufs et embryons d’un grand nombre d’organismes [
17,
18]. Établissement de l’axe a-v avant la maturation : le cas du xénope L’élaboration d’un axe primaire a-v est particulièrement bien connue chez le xénope ( Poster, ligne F). Dans les cellules germinales regroupées en cystes de 16 cellules (stade 0), les noyaux (vésicules germinatives) et les centrosomes sont polarisés, et il est possible que leur position indique déjà la future polarité a-v de l’ovocyte [
19] ( Poster, Fa-b). Cette polarité est manifeste dès le stade II de l’ovogenèse, lorsque l’un des nuages mitochondriaux situés autour de la vésicule germinative arrive dans le cortex végétatif ( Poster, Fb-c). Ces nuages mitochondriaux sont des domaines cytoplasmiques globulaires contenant une grande densité de mitochondries, mais également du réticulum endoplasmique et des granules denses caractéristiques des plasmes germinatifs. Le nuage mitochondrial véhicule également une grande famille d’ARNm dont Xcat2 (homologue de Nanos, un déterminant maternel du pôle postérieur chez la drosophile) et Xdazl, un déterminant des cellules germinales [
20,
21]. Lorsque le nuage mitochondrial atteint le cortex végétatif, il se disperse sous forme d’îlots de plasmes germinatifs associés à des mitochondries, les ARNm apparaissant alors plaqués contre le cortex végétatif ( Poster, Fc-d) [
22]. Entre les stades II et IV de l’ovogenèse, une autre classe d’ARNm parvient au cortex : elle comprend en particulier Vg1 (codant pour un facteur de croissance) et VegT (codant pour un facteur de transcription), ces facteurs jouant par la suite un rôle essentiel dans la formation des tissus endomésodermiques [
23]. À ces stades, l’ovocyte se remplit de vitellus par endocytose et grossit considérablement ( Poster, Fd-e). Au stade IV, des granules pigmentaires se positionnent sous le pôle animal, la vésicule germinative se déplace vers le cortex animal et des plaquettes vitellines emplissent l’hémisphère végétatif ( Poster, Fe). Entre les stades IV et VI, cette mise en place d’une polarité a-v est accompagnée d’une organisation différentielle des réseaux de microtubules et des filaments intermédiaires composés de kératines, apparemment ancrés dans un réseau de microfilaments corticaux [ 19,
24]. Côté animal, les réseaux de microtubules et de filaments intermédiaires composés de kératines sont organisés de façon radiale autour de la vésicule germinale tandis que, du côté végétatif, les microtubules sont moins organisés et le réseau de filaments intermédiaires moins épais, avec une maille moins serrée. Établissement de l’axe primaire a-v pendant la maturation : le cas des oursins, ascidies, xénope et souris Chez les oursins, les ascidies et la souris ( Poster, lignes C, D, E), la polarité de l’ovocyte devient visible lors de la maturation méiotique, en raison de la distribution des organites vis-à-vis de l’axe primaire a-v ( Poster, Ce, De, Ee). En réponse à des signaux environnementaux qui stimulent l’ovulation, l’ovocyte bloqué au stade de vésicule germinative (4 n chromosomes) atteint le stade de méiose à partir duquel il est compétent pour être fécondé. Ce stade varie suivant l’espèce considérée, sans relation phylogénétique apparente ( Tableau I, colonne 1). Pendant la maturation, de nombreux changements préparent l’ovocyte pour la fécondation. Chez les oursins, les amphibiens et les mammifères, des vésicules golgiennes connues sous le nom de granules corticaux migrent vers la périphérie et accostent sous la membrane plasmique en prévision de l’exocytose massive ou des réorganisations corticales déclenchées par le spermatozoïde fécondant. D’autres éléments du cortex (réticulum endoplasmique, microfilaments, microtubules, filaments intermédiaires) subissent également des réorganisations sous l’effet de variations des facteurs du cycle cellulaire méiotique [ 12]. Chez le xénope, les filaments intermédiaires constitués de kératines disparaissent, et la longueur comme la densité des microtubules diminuent ( Poster, Fe) [ 19]. Des microdomaines riches en réticulum endoplasmique cortical s’établissent sous la membrane plasmique dans l’hémisphère végétatif [
25]. Ces microdomaines se mettent également en place dans l’hémisphère végétatif des ovocytes de souris. À l’opposé, la région animale de l’ovocyte de souris est caractérisée par une zone de surface différenciée dépourvue de microvilli, riche en microfilaments corticaux ( Poster, Ee) [
26]. Dans l’ovocyte d’ascidie, on note également l’établissement d’un gradient a-v de réticulum endoplasmique cortical dans le cortex et d’un panier végétatif sous-cortical riche en mitochondries, appelé myoplasme ( Poster, De) [
27,
28]. Ces changements d’organisation des réseaux de réticulum, de microtubules et de microfilaments associés à la maturation contribuent au repositionnement des macromolécules impliquées dans les processus de polarisation et de différenciation. Chez l’ascidie, une catégorie d’ARNm (appelés ARN postplasmiques, ou Pem) est associée au réticulum endoplasmique cortical et positionnée « en sandwich » entre la membrane plasmique et le myoplasme dans le cortex végétatif [
29,
30]. Dans l’ovocyte du xénope, les ARNm de type Vg1/VegT s’éloignent de la membrane plasmique et s’étalent contre le cortex et le cytoplasme végétatif, tandis que les îlots de plasmes germinatifs contenant Xcat2 s’agrègent dans la région sous-corticale, sous forme d’une calotte (Poster, Fe) [
31]. Simultanément, les protéines de polarité PAR-3 et aPKC (protéine kinase C atypique), ainsi que les ARNm PAR-1 [
32] et PAR-6 [
33], se localisent progressivement dans le cortex animal (Poster, Fe). On ne sait pas pour l’instant quelle signification donner au positionnement de ces facteurs PAR, qui sont des acteurs majeurs de la polarité des ovocytes, zygotes, cellules épithéliales et nerveuses chez C. elegans et chez la drosophile, ainsi que des cellules épithéliales et polarisées des mammifères [9,
34] Détermination des axes embryonnaires A-P et D-V Nous avons examiné dans le premier article (→) les mécanismes présidant à la mise en place des axes embryonnaires antéropostérieur (A-P) et dorso-ventral (D-V) chez la drosophile, C. elegans, le xénope et les ascidies [ 3]. Les représentations graphiques discutées dans cet article sont visibles sur le Poster, de même que les Figures 1, 2, 3 et 4 du premier article (→) qui sont incorporées sur le Poster en Ab-d, Bf-i, De-h, et Fb-h. Nous rappelons ici les grands principes de la mise en place des axes A-P et D-V (symboles A↔P et D↔V, Poster) pour guider le lecteur à travers ces représentations. (→) m/s 2004, n° 4, p. 414 Établissement des axes A-P et D-V avant la fécondation : le cas de la drosophile D’excellentes revues détaillées peuvent être consultées sur ce sujet [
35–
38]. Sélection et positionnement de l’ovocyte La sélection de l’ovocyte s’opère dans le germarium, à partir d’un cyste constitué de 16 cellules issues des 4 divisions avec cytocinèse incomplète d’une cellule germinale primaire. Les 16 cellules se retrouvent reliées entre elles par 1 à 4 ponts cytoplasmiques, le futur ovocyte étant sélectionné parmi les 2 cellules dotées de 4 ponts cytoplasmiques. L’ovocyte correspond à la cellule qui hérite de la majeure partie d’une structure cytosquelettique membranaire, le fusome. Les 15 cellules restantes deviennent polyploïdes et nourricières : elles synthétisent des macromolécules, parmi lesquelles les ARNm déterminants comme Bicoid et Oskar, qui sont acheminés dans l’ovocyte à travers les ponts cytoplasmiques ( Poster Aa-b). De façon intéressante, la stabilisation de la destinée de l’ovocyte requiert des homologues des protéines PAR identifiées comme des déterminants de la polarité chez le zygote de C. elegans [
8,
39], ce qui suggère déjà que des mécanismes de polarisation ont été conservés au cours de l’évolution ( voir « Principes communs de polarisation » dans [ 3]). Établissement des axes A-P puis D-V pendant l’ovogenèse Une fois que l’ovocyte a quitté le germarium pour la chambre ovarienne, dans laquelle il est encapsulé par les cellules folliculaires, l’ovocyte acquiert ses axes embryonnaires A-P puis D-V par deux événements de signalisation qui font intervenir le réseau de microtubules et la protéine Gurken, un homologue de l’EGF ( epidermal growth factor) (stades 6-7 ; Poster, Ab). Les ARNm déterminants et leurs partenaires (comme les protéines de liaison à l’ARN Vasa, Staufen…) sont ensuite tranportés et ancrés respectivement aux pôles antérieur (ARN Bicoid) puis postérieur (ARN Oskar puis Nanos) de l’ovocyte. La localisation des déterminants dans les différents domaines corticaux fixe l’axe embryonnaire A-P ( Poster, Ae) [
40,
41]. Le relais de cette polarisation A-P initiale est pris dès la fécondation par la traduction des ARNm localisés aux pôles (Poster, Af-h). Les localisations corticales distinctes des ARNm déterminants maternels Bicoid, ainsi que Oskar et Nanos, sont ainsi converties en gradients cytoplasmiques complémentaires de protéines aux propriétés de morphogènes (tels que les facteurs de transcription Nanos et Bicoid lorsque ce dernier est associé à Hunchback) à l’intérieur d’une cellule syncytiale multinucléée [
42] (voir Encadré 2, modes de développement). Dès la migration des noyaux à la périphérie, puis la cellularisation du blastoderme syncytial, on perçoit plusieurs domaines cellulaires qui expriment différents gènes le long de l’axe A-P, reflétant en cela la distribution réciproque des morphogènes en gradients [
43]. L’axe dorso-ventral est mis en place au stade 10 de l’ovogenèse grâce au deuxième événement de signalisation assuré par le facteur sécrété Gurken (Poster, Ad). Les centrosomes sont désormais situés dans la région antérodorsale, avec pour conséquence la relocalisation de la vésicule germinative vers ce côté de l’ovocyte. La sécrétion localisée de Gurken confère l’identité dorsale aux cellules folliculaires voisines et réprime l’expression de la protéine Pipe du côté dorsal de l’ovocyte, induisant la destinée ventrale des cellules folliculaires situées à l’opposé de la sécrétion de Gurken [
44]. Après la fécondation et la cellularisation (13e cycle mitotique après fécondation ; Poster, Ah-i), une cascade d’activités protéolytiques intervenant à la surface des cellules ventrales aboutit à une localisation nucléaire asymétrique du facteur de transcription Dorsal [
45,
46] (homologue de NF-κB). Après la cellularisation du blastoderme, Dorsal est exclu des noyaux des cellules dorsales et concentré dans les noyaux des cellules ventrales. Cela aura pour conséquence l’expression de gènes (Twist, Snail) nécessaires à la gastrulation et à la spécification du mésoderme du côté ventral (Poster, Aj), tandis que, du côté dorsal, la faible concentration nucléaire de Dorsal se traduit par la spécification de l’ectoderme [44].

Établissement des axes après fécondation : ascidie, xénope, C. elegans
Rôle déterminant de la fécondation et du spermatozoïde Chez la plupart des espèces examinées, l’entrée du spermatozoïde est restreinte à une région particulière de l’ovocyte, et/ou s’effectue près de l’un des pôles [ 12] ( Tableau I, 1e colonne). Cela définit une polarité dans le positionnement du pronoyau mâle par rapport au noyau maternel femelle et a des conséquences au niveau des facteurs transmis par le gamète mâle. Ces facteurs participent à la fois au positionnement des axes et à l’activation/initiation du développement. Pour notre propos, le spermatozoïde transmet principalement à l’œuf un « facteur spermatique » activateur, ainsi qu’un corps basal servant de centre organisateur des microtubules (centrosome) [ 12,
47]. L’augmentation de la concentration en Ca2+ par le facteur spermatique se propage alors jusqu’à l’antipode, sous la forme de vagues se succédant et bouleversant l’organisation du cortex et des réseaux de microtubules, de microfilaments et de réticulum endoplasmique [ 11,
48]. Cette vague de Ca2+ module un nombre considérable de réactions enzymatiques et d’interactions entre les macromolécules, les éléments du cytosquelette et les organites [ 12,
49]. Chez l’ascidie, le point d’entrée du spermatozoïde, situé généralement dans l’hémisphère animal, comme chez le xénope, joue un rôle prépondérant dans l’établissement des axes. La vague calcique d’activation déclenchée par le facteur spermatique à cet endroit se propage en direction de l’hémisphère végétatif. Elle donne naissance à une vague de contraction d’actomyosine corticale qui aboutit à la formation d’un pôle de contraction fixant le futur site de gastrulation en cet endroit [
50] (Poster, Df). La position exacte de ce pôle de contraction dans l’hémisphère végétatif dépend à la fois du site d’entrée du spermatozoïde, d’où part la contraction corticale initiée par la vague calcique, et du panier d’actine sous-membranaire, polarisé selon l’axe a-v établi lors de l’ovogenèse [50]. Cette position constitue la première indication du futur côté dorsal (axe D-V) de l’embryon, puis du têtard. La contraction corticale concentre vers l’hémisphère végétatif la calotte sous-corticale riche en mitochondries (le myoplasme) ainsi qu’un domaine cortical riche en réticulum endoplasmique ; le centrosome mâle est lui aussi déplacé par cette contraction [
51]. Le point d’entrée du spermatozoïde et la position du centrosome mâle acquise à l’issue de la contraction définissent le plan méridien dans lequel sera fixé le pôle postérieur et l’axe A-P de l’embryon [
52] (Poster, Df-h). La situation est comparable chez le xénope, en ceci que le spermatozoïde féconde l’œuf dans l’hémisphère animal et que la vague calcique résultante déclenche la reprise de la méiose (méiose II au lieu de méiose I ; Tableau I) et une contraction corticale (Poster, Ff). La contraction est apparemment symétrique par rapport à l’axe a-v et ne semble pas participer à l’établissement des futurs axes de l’embryon. La vague calcique de fécondation est suivie dans la même direction générale par des vagues d’exocytose, d’endocytose et d’érection de microvillosités, dont la longueur et l’organisation varient le long de l’axe a-v [12,
53]. Ces différences axiales amplifiées lors de la fécondation jouent un rôle dans la mise en place des trois futurs feuillets embryonnaires (Poster, Fj). L’axe A-P est déterminé par des réorganisations de ces feuillets pendant la gastrulation et semble dépendre d’interactions entre la voie de Wnt et VegT [53,
54]. Chez C. elegans, nous savons depuis peu que, comme pour les autres espèces, la fécondation se manifeste par une vague calcique débutant au point d’entrée du spermatozoïde [
55]. Les conséquences immédiates de cette vague calcique ne sont pas connues dans le détail, mais il est probable qu’elle participe à l’élaboration d’un chorion et aux vibrations corticales à la surface du zygote [
56]. La fécondation s’effectue généralement à l’opposé du futur site d’émission des globules polaires, et la position des microtubules du spermatozoïde fécondant, organisés en aster spermatique, définit le pôle postérieur du zygote et de l’embryon (Poster, Bf-g) [3, 8,
57,
58]. Des réorganisations axiales dirigées par les asters Chez le zygote de C. elegans, les interactions entre les microtubules astraux et le cortex initient un flux cortical d’acto-myosine du pôle postérieur vers le pôle antérieur ( Poster, Bg). Le flux cortical qui se propage vers le pôle antérieur donne naissance à un flux intracytoplasmique d’organites et de granules de sens opposé, médié par le cytosquelette qui propulse le pronoyau femelle ( Poster, Bg) [ 56]. Ce flux nécessite probablement un mécanisme d’endocytose au pôle antérieur conjugué à une exocytose accrue au pôle postérieur [ 56,
59]. La mise en place de domaines corticaux est suivie de la translocation des granules polaires (granules P) qui contiennent les marqueurs caractéristiques des plasmes germinatifs (Vasa et Nos-1 et Nos-2, qui sont des analogues de Nanos) vers le pôle postérieur ( Poster, Bg-h). À la suite de ces translocations, les deux pronoyaux se rencontrent. Les deux asters, initialement alignés sur l’axe court de l’œuf, subissent une rotation de 90°, ce qui oriente le fuseau mitotique selon l’axe A-P ( Poster, Bh). Cette rotation et le positionnement légèrement postérieur du fuseau résultent de forces différentielles exercées sur les microtubules astraux par les cortex antérieur et postérieur, forces régulées par la kinase PAR-1 et le complexe PAR-3 ( Poster, Bg-h) [ 8,
60]. Le clivage asymétrique qui s’ensuit produit une cellule postérieure (P1) plus petite que la cellule antérieure (AB) ( Poster, Bh). La formation de domaines PAR antérieurs et postérieurs dans le cortex entraîne des ségrégations d’autres protéines vers les pôles antérieur ou postérieur (Poster, Bi). Ainsi, la protéine membranaire GLP-1 (homologue de Notch) et les protéines cytoplasmiques liant l’ARN (MEX-5/6) sont localisées dans la cellule antérieure AB et ses descendants, alors que la protéine PIE-1, déterminant des cellules germinales, est principalement localisée dans les noyaux et les granules P de la cellule postérieure P1 et de ses descendants (Poster, Bj). Chez l’ascidie et le xénope, les réorganisations du cytosquelette suivent l’évolution des facteurs contrôlant le cycle cellulaire [13, 22, 52]. La méiose s’achève dans la demi-heure qui suit la fécondation. Au début de l’interphase, les microtubules atteignent une longueur extrême, ce qui permet la migration puis la rencontre des pronoyaux (Poster, Dg et Fg). Les forces de traction exercées sur les noyaux et celles des microtubules astraux sur le cortex se traduisent par des translocations massives d’organites et de domaines cytoplasmiques. Chez le zygote du xénope, une traînée de granules pigmentaires laisse une trace visible de ces mouvements en formant une comète derrière l’aster mâle (Poster, Fg). Les glissements actifs des microtubules prennent la forme d’une « rotation corticale », mouvement qui déplace de 30° la calotte pigmentaire et une zone corticale de 5 microns d’épaisseur par rapport au cytoplasme sous-jacent [
61]. Cette rotation est dirigée en direction de l’hémisphère animal, vers le point d’entrée du spermatozoïde. Elle est amplifiée par un abondant réseau de microtubules périphériques situés dans la région végétative (Poster, Fh). La polarité D-V de l’embryon du xénope s’établit comme conséquence de ce basculement cortical et de la translocation de domaines cytoplasmiques et de macromolécules (telles que la protéine Dishevelled) qu’elle entraîne (Poster, Fh) [
62–
64] Mitose, clivages et polarisation des embryons La mitose met une touche finale aux translocations déclenchées par le spermatozoïde, puis poursuivies par le jeu des interactions entre asters et cortex. L’œuf de xénope est parcouru entre la fin de la mitose et le début de clivage par des vagues de contraction de surface (SCW) qui partent du pôle animal proche du site de résidence du fuseau mitotique [
65]. Ces SCW sont sous-tendues par des modifications des facteurs du cycle cellulaire et reposent sur une régulation localisée du MPF (mitosis promoting factor) dont l’effet se propage du pôle animal vers le pôle végétatif. Les réorganisations corticales ont pour conséquence de rassembler les îlots de plasmes germinatifs en de plus larges agrégats lorsque les vagues de contractions de surface atteignent le cortex végétatif ( Poster, Fi) [
66]. Le plan de premier clivage répartit les plasmes germinatifs également entre les blastomères. Ce plan passe près du site de fécondation et des globules polaires (pôle animal) et délimite la position du futur organisateur dorsal (centre de Niewkoop) (Poster, Fi) [54]. Le deuxième plan de clivage est orthogonal au premier et sépare la partie dorsale de la partie ventrale de l’embryon de xénope, tandis que, chez l’ascidie, ce sont les côtés antérieur et postérieur qui sont séparés par ce deuxième clivage. Une analogie supplémentaire existe entre les embryons précoces d’ascidie et de xénope, du fait de la matérialisation de « centres de signalisation » dans les régions postérieures ou dorsales respectivement. Chez le xénope, il s’agit du centre de Niewkoop, qui devient opérationnel dans la blastula et induit la formation du blastopore et des structures dorsales de l’embryon [53]. Un acteur majeur de la voie de Wnt, la β-caténine, est concentré dès le stade 16 cellules dans les noyaux des cellules dorsales et est clairement impliqué dans les effets dorsalisants du centre de Niewkoop, lui-même précurseur de l’organisateur de Spemann (pour des discussions récente des modes d’action de ces organisateurs dorsaux, voir [53, 54]). On ne sait pas encore avec certitude quels facteurs déterminants, transportés par la rotation corticale, permettent de contrôler le flux nucléaire de β-caténine dans les cellules du côté dorsal [64,
67]. Chez l’ascidie, une vague de relaxation corticale partant du pôle végétatif achève le mouvement vers l’équateur des domaines corticaux (réticulum endoplasmique cortical) et sous-corticaux (myoplasme) amorcés en interphase [52]. La première division démarre à l’issue de la mitose, et le premier plan de clivage passe près du point d’entrée du spermatozoïde et du pôle de contraction végétatif (Poster, Dh). Cet événement répartit de façon égale les domaines cytoplasmiques et corticaux et les ARNm de type Pem tels Macho-1 dans la région postérieure de l’embryon (Poster, Di). En conséquence, les potentialités de développement sont également réparties entre les blastomères gauche et droit, selon un plan de symétrie bilatérale [
68]. Le deuxième plan de clivage sépare les parties antérieure et postérieure de l’embryon, tandis que le troisième clivage sépare les parties animale (futur côté ventral) et végétative (futur côté dorsal) et produit en particulier deux blastomères postérieur-végétatif B4.1 (Poster, Dj) [28]. Ces blastomères sont des précurseurs des cellules musculaires et héritent de la majeure partie du myoplasme et du réticulum endoplasmique cortical. L’organisateur de cette région de l’embryon est une structure corticale particulière, appelée CAB (centrosome attracting body), localisée au pôle postérieur par les translocations corticales décrites plus haut (Poster, Dj). Il est possible que le CAB agisse comme une source localisée de protéines issues d’ARNm déterminants tels que Macho-1, un facteur de transcription de la famille Zic [
69]. Il est à noter que les petites cellules issues des trois divisions inégales successives au pôle postérieur de l’embryon d’ascidie sont dotées de propriétés particulières, caractéristiques des propriétés des cellules germinales. Elles cessent de se diviser, leurs capacités traductionnelles sont réduites et elles contiennent l’ARNm Vasa, marqueur quasi universel des cellules germinales [
70]. Cette ségrégation polarisée des cellules germinales est bien détaillée pour l’embryon de C. elegans, dans lequel la cellule postérieure P1 produit les cellules de la lignée germinale P contenant les déterminants (PIE-1) et plasmes germinatifs (Poster, Bh-i). Dans ces cellules, la traduction est inhibée et les divisions sont restreintes [
71]. Dans l’embryon de C. elegans, les mitoses et clivages assument un rôle essentiel dans l’acquisition du deuxième axe embryonnaire (Poster, Bi). Cet axe (D-V) est en effet établi pendant le deuxième clivage. L’orientation du fuseau mitotique de la cellule antérieure AB permet de définir une cellule fille antérieure (ABa) et une cellule fille postérieure (ABp) ayant des cellules adjacentes différentes (EMS et ABp pour Aba, EMS, P2 et ABa pour ABp). L’axe D-V est spécifié par une signalisation intercellulaire utilisant la voie de Notch. Le blastomère postérieur P2 (exprimant APX-1, homologue de Delta) contacte l’un des deux blastomères descendant de AB (exprimant GPL-1, homologue de Notch, récepteur de Delta), spécifiant ainsi sa destinée en ABp. La cellule P2 envoie également un signal vers la cellule EMS, qui active la voie de Wnt. Au final, la polarité corticale initiale des complexes de protéines PAR est convertie en un jeu complexe d’interactions entre facteurs maternels orchestré par le gène spn-4 [
72]. Ce gène code pour une protéine de liaison à l’ARN qui pourrait réguler la traduction de plusieurs ARNm maternels dans les différentes cellules fondatrices des lignées somatiques et germinales. Une fois spécifiées, les cellules ABa et ABb se différencient en épiderme, neurones et cellules mésodermales. La cellule EMS donne naissance à l’endoderme et à des cellules mésodermales. La cellule postérieure P2 produit quant à elle les cellules germinales P3 et P4, ainsi que des cellules musculaires et épidermales (Poster, Bj) [
73]. Un axe avant et un axe après la fécondation : l’exemple de l’oursin On sait depuis un siècle que l’axe primaire animal-végétatif (a-v) préfigure, chez les oursins, l’axe A-P de la gastrula et de la larve plutéus ( Poster, Ce-k) [
74,
75]. Le deuxième axe oral-aboral (correspondant à l’axe V-D) n’est perceptible dans la gastrula que lorsque l’archentéron (intestin primitif mis en place lors des mouvements gastruléens) et les cellules du mésenchyme primaire qui l’entourent contactent un côté de la paroi de la gastrula (future bouche du côté ventral de la larve) ( Poster, Ck). Une des premières manifestations de l’axe oral-aboral est une asymétrie dans la respiration mitochondriale, le côté oral exprimant une activité cytochrome oxydase plus intense que le côté aboral [
76]. Il n’y a pas pour l’instant de consensus quant au moment auquel cet axe oral-aboral est défini, ni sur les mécanismes qui sous tendent l’acquisition de cet axe chez divers oursins à développement direct ou indirect [
77,
78]. L’axe a-v des œufs matures d’oursins n’est pas visible au moment de la fécondation [
79], excepté dans l’espèce européenne Paracentrotus lividus, choisie pour notre illustration (Poster, ligne C). Dans cette espèce, cette polarité a-v/A-P peut être suivie pendant tout le développement précoce grâce à la présence, dans le cortex, de vésicules pigmentaires oranges exclues du pôle végétatif. Ces vésicules pigmentées acquièrent leur distribution polarisée en fin de méiose (Poster, De), formant une bande sous-équatoriale qui peut être isolée avec le cortex [
80]. Cette bande pigmentée a été exploitée par S. Horstadius pour mener des expériences de mérogonie (séparation de régions des œufs et des embryons) [74], démontrant qu’il existait dans l’œuf avant la fécondation, puis dans l’embryon, un gradient morphogénétique disposé selon l’axe a-v. Chez d’autres espèces d’oursins, l’acquisition d’une bande de vésicules délimitant le pôle végétatif n’est atteinte qu’entre les stades 8-16 cellules, moment où la première division asymétrique produit quatre petits micromères dépourvus de vésicules pigmentaires ou vésicules acides [79] (Poster, Cj). Contrairement aux zygotes du xénope, de C. elegans et d’ascidies, il ne semble pas que le point d’entrée du spermatozoïde ait une localisation particulière et joue un rôle majeur dans l’établissement des axes. Chez les oursins, les réorganisations cytoplasmiques qui suivent la fécondation sont de faible amplitude, et l’asymétrie a-v n’est pas amplifiée [48]. On assiste à une contraction corticale déclenchée par une vague calcique d’activation qui précède une spectaculaire vague d’exocytose, à l’origine de la sécrétion de macromolécules se combinant à la membrane vitelline pour former une membrane de fécondation protégeant l’embryon (Poster, Cf). Pour des raisons encore mal comprises, les fuseaux mitotiques des deux premières divisions s’orientent dans le plan de la bande pigmentée, avec comme conséquence le fait que les deux premiers plans de division contiennent l’axe primaire a-v (Poster, Ch). Le plan de division suivant est équatorial et isole les parties animale (un anneau de mésomères, Me) (Poster, Cj) et végétative (macromères, M et micromères, m) (Poster, Cj). L’événement fondamental pour la suite du développement selon l’axe a-v est la production des micromères au pôle végétatif, lors du 4e clivage. Ce clivage inégal résulte de l’attraction des centrosomes et des noyaux des quatre blastomères végétatifs vers le cortex végétatif caractérisé par l’absence de vésicules pigmentaires (ou vésicules acides) et de microvillosités [79]. Les micromères, qu’ils soient dans leur position naturelle au pôle végétatif ou qu’ils soient transplantés ailleurs sur la surface l’embryon, agissent comme de véritables organisateurs, entraînant les cellules voisines de la blastula à s’engager dans une voie de différenciation endomésodermique et à s’invaginer pour former un archentéron [
81,
82] (Encadré 1). Si la plupart des cellules de l’embryon précoce manifestent des capacités régulatrices et une grande plasticité, les micromères se divisent en petits et gros micromères qui suivent des voies de différenciation radicalement différentes. Les petits micromères se divisent une ou deux fois, puis sont mis de côté et aboutissent dans les poches cœlomiques (cavités constituées d’épithélium dérivé du mésoderme) contenant les cellules souches qui donneront naissance au jeune oursin après métamorphose. Les micromères les plus gros continuent à se diviser et se différencient en cellules du mésenchyme squelettogénique, de façon autonome, à l’intérieur de la blastula ou en culture (Poster, Ck). La nature des facteurs cytoplasmiques maternels (probablement corticaux) hérités par les micromères et leur conférant cette autonomie reste mystérieuse [81]. La seule chose qui soit claire est que les déterminants maternels des micromères ont la capacité de réguler le flux de β-caténine dans le noyau des micromères et de leurs descendants, et d’activer par ce biais la voie canonique de Wnt [54, 81,
83]. La β-caténine présente dans les noyaux des cellules végétatives de la blastula semble en effet nécessaire pour la spécification de la frontière endoderme-mésoderme. La voie de Wnt/BMP4 constitue l’élément clé de cette signalisation micromérique : elle spécifie la différenciation des descendants des micromères en mésenchyme primaire, puis les interactions cellulaires qui, entre les 8e et 9e clivages, utilisent la voie Delta/Notch pour induire les descendants des cellules végétatives (veg2) à devenir les cellules mésodermiques [
84,
85]. Établissement des axes en débat : le cas de la souris Les œufs de souris se caractérisent par une absence de réserves d’origine maternelle (œufs alécithes) et un développement plus lent que ceux des autres embryons considérés dans cette revue. Les œufs de souris nécessitent une structure nourricière, le tropho-ectoderme, qui assure la subsistance de l’embryon après l’implantation et au cours du développement [
86–
88] ( Tableau I). L’embryon de souris résulte de la mise en place de cellules internes et externes formant une boule de cellules (morula) au cours d’un processus de compaction. La majeure partie des cellules de la masse de cellules internes formeront l’embryon, alors que les cellules de l’épithélium externe sont à l’origine de tissus extra-embryonnaires, dont le placenta. Une polarité axiale, appelée abembryonnaire-embryonnaire (A-E) ou axe trophoectodeme-blastocyste ( Poster, Ej), apparaît en quelques jours avec l’émergence du blastocyste. L’axe A-E prédit dans ses grandes lignes l’orientation dorsoventrale de l’embryon, les parties ventrales se situant dans l’emplacement de la cavité blastocœlique et les parties dorsales vers la masse de cellules internes (Poster, Ej-k). Au stade blastocyste, on distingue la couche ectodermale, formant le trophoblaste autour de la cavité blastocœlique, et deux types cellulaires dans la masse des cellules internes (Poster, Ej). Une population de 600 cellules formant l’épiblaste (en bleu, Poster, Ej) est située contre le trophectoderme. Ces cellules produisent l’embryon proprement dit et le mésoderme extra-embryonnaire, alors que les cellules situées à la frontière entre le blastocœle et l’épiblaste (en jaune, Poster, E-j) sont à l’origine d’une population de cellules endodermales primitives. La polarité A-E du blastocyste (4,5 jours) évolue en polarité proximo-distale dans l’embryon postimplantatoire précoce de 5,5 jours (Poster, Ek) [86,
87]. Celle-ci se transforme en polarité antéro-postérieure au cours du 6e jour (Poster, Ek). Cette évolution axiale met en jeu un système complexe de migrations et de positionnements de clones de cellules endodermales primitives, ainsi que la formation d’une ligne primitive amorçant la gastrulation dans la région postérieure [
89] (Encadré 1). La polarité embryonnaire n’étant clairement visible qu’après la gastrulation, et les axes d’une souris n’étant fixés que plusieurs jours après la gastrulation, il semblait raisonnable de penser que les mammifères ne déterminaient leurs axes de développement que tardivement, et sans tenir compte de la polarité initiale de l’ovocyte ou de l’embryon précoce. Ces dernières années, plusieurs équipes ont cherché à savoir si ces polarités tardives étaient déjà perceptibles dans l’embryon, ou même dans l’ovocyte [88,
90]. La polarité a-v initiale de l’ovocyte semble en effet avoir une importance décisive sur le positionnement et le devenir des cellules de l’endoderme viscéral d’origine extraembryonnaire. Les expériences de lignages montrent que les cellules les plus proches des globules polaires (pôle animal) produisent l’endoderme viscéral distal surmontant l’épiblaste embryonnaire au pôle ventral, alors que les cellules à l’opposé du globule polaire migrent en position proximale et deviennent les cellules endodermiques viscérales qui couvrent l’ectoderme extra-embryonnaire [88, 89]. L’importance fonctionnelle de ces différences axiales est sujette à débat en raison des capacités régulatrices manifestées par les embryons des mammifères. En effet, il est possible d’obtenir des embryons normaux à partir de fragments ou d’agrégats recomposés de cellules internes ou externes. De plus, l’obtention d’embryons normaux après l’ablation des régions polaires de l’embryon précoce ou du zygote semble exclure a priori que des facteurs maternels polarisés spécifient les axes de développement [
91,
92]. Les choses sont peut être en train de changer, et un débat a vu le jour concernant l’acquisition précoce des axes de développement dans la situation naturelle par rapport à l’axe a-v et à la position d’entrée du spermatozoïde (SEP, sperm entry position) [88, 90,
93]. Ce débat est d’importance pour ce qui est des manipulations de clonage, de parthénogenèse ou d’ICSI (insémination artificielle par injection intracytoplasmique d’un spermatozoïde dans l’ovocyte), manipulations pour lesquelles la notion de SEP à la surface de l’œuf perd son sens. Ces expériences démontrent que, au moins dans certaines souches de souris, il existe une relation entre la position des globules polaires (c’est-à-dire la polarité initiale a-v de l’ovocyte), la SEP et l’établissement des axes du blastocyste [
94,
95]. L’œuf de souris manifeste une polarité a-v en raison de la distribution polarisée de macromolécules, telles que la leptine ou Stat3, ou de structures corticales, telles que la zone différenciée riche en microfilaments située autour du pôle animal (Poster, Ee) [93]. La fécondation s’effectue hors de cette zone. Elle déclenche une série de vagues calciques et de microcontractions polarisées (en direction v-a comme chez l’ascidie) qui durent jusqu’en fin de méiose (5 à 6 heures) [
96]. Ces signaux périodiques sont nécessaires à l’accomplissement du cycle cellulaire méiotique, et il a été démontré chez le lapin qu’elles participent aussi au développement postimplantatoire de l’embryon [
97]. Après la rencontre entre les pronoyaux mâle et femelle, puis la mitose, le côté du zygote contenant le site d’entrée du spermatozoïde est le premier à se diviser (Poster, Eg-i). Les expériences en débat montrent que, dans 80 % des cas, ce site de fécondation est proche du premier plan de clivage, qui lui-même prédit la position de l’axe embryonnaire-abembryonnaire (et donc de l’axe D-V) [94]. Les recherches actuelles tentent de répondre à une série de questions soulevées par cette remise en cause récente du caractère aléatoire de la mise en place des axes chez la souris : quelles sont les informations de position transmises par l’ovocyte, et par le spermatozoïde ? Pourquoi le blastomère contenant la SEP se divise-t-il précocement ? Quelles en sont les conséquences pour l’arrangement des cellules au moment de la compaction, ainsi que pour l’élaboration des couches cellulaires constituant le blastocyste et pour leur destinée dans l’embryon implanté ? Au final, tout cela souligne que les embryons de mammifères ne sont peut-être pas si différents de ceux d’autres organismes que nous traitons ici, et qu’ils partagent peut-être avec eux des mécanismes communs d’acquisition des axes. Poster : http://biodev.obsvlfr.fr/biomarcell). |
1. Wilson EB. The cell in development and inheritance. New York : Macmillan, 1896. 2. Child CM. Patterns and problems of development. Chicago, 1941. 3. Sardet C, Prodon, F, Pruliere, G, Chenevert J. Polarisation des œufs et des embryons : principes communs. Med Sci (Paris) 2004; 20 : 414–23. 4. Goldstein B, Freeman G. Axis specification in animal development. BioEssays 1997; 19 : 105–16. 5. Goldstein B, Frisse LM, Thomas WK. Embryonic axis specification in nematodes: Evolution of the first step in development. Curr Biol 1998; 8 : 157–60. 6. Gilbert SF. developmental biology. Sunderland, Massachusetts: Sinauer Associates Inc., 2000 : 749 7. Wolpert L. Principles of development. New York: Oxford University Press Inc., 2002 : 542 8. Pellettieri J, Seydoux G. Anterior-posterior polarity in C. elegans and Drosophila. PARallels and differences. Science 2002; 298 : 1946–50. 9. Wodarz A. Establishing cell polarity in development. Nat Cell Biol 2002; 4 : E39–44. 10. Jaffe LA, Giusti AF, Carroll DJ, Foltz KR. Ca2+ signalling during fertilization of echinoderm eggs. Sem Cell Dev Biol 2001; 12 : 45–51. 11. Stricker SA. Comparative biology of calcium signaling during fertilization and egg activation in animals. Dev Biol 1999; 211 : 157–76. 12. Sardet C, Prodon F, Dumollard R, et al. Structure and function of the egg cortex from oogenesis through fertilization. Dev Biol 2002; 241 : 1–23. 13. C, McDougall A, Houliston E. Cytoplasmic domains in egg. Trends
Cell Biol 1994; 4 : 166–71. 14. Frick JE, Ruppert EE. Primordial germ cells and oocytes of Branchiostoma virginiae (Cephalochordata, Acrania) are flagellated epithelial cells: Relationship between epithelial and primary egg polarity. Zygote 1997; 5 : 139–51. 15. Wylie C. Germ cells. Curr Opin Genet Dev 2000; 10 : 410–3. 16. Matova N, Cooley L. Comparative aspects of animal oogenesis. Dev Biol 2001; 231 : 291–320. 17. Ikenishi K. Germ plasm in Caenorhabditis elegans, Drosophila and Xenopus. Dev Growth Differ 1998; 40 : 1–10. 18. Carre D, Djediat C, Sardet C. Formation of a large Vasa-positive germ granule and its inheritance by germ cells in the enigmatic Chaetognaths. Development 2002; 129 : 661–70. 19. Gard DL. Confocal microscopy and 3-D reconstruction of the cytoskeleton of Xenopus oocytes. Microsc Res Tech 1999; 44 : 388–414. 20. Houston DW, King ML. Germ plasm and molecular determinants of germ cell fate. Curr Top Dev Biol 2000; 50 : 155–81. 21. Kloc M, Bilinski S, Chan AP, et al. RNA localization and germ cell determination in Xenopus. Int Rev Cytol 2001; 203 : 63–91. 22. Chang P, Perez-Mongiovi D, Houliston E. Organisation of Xenopus oocyte and egg cortices. Microsc Res Tech 1999; 44 : 415–29. 23. Kloc M, Zearfoss NR, Etkin LD. Mechanisms of subcellular mRNA localization. Cell 2002; 108 : 533–44. 24. Gard DL. Axis formation during amphibian oogenesis : Re-evaluating the role of the cytoskeleton. Curr Top Dev Biol 1995; 30 : 215–52. 25. Terasaki M, Runft LL, Hand AR. Changes in organization of the endoplasmic reticulum during Xenopus oocyte maturation and activation. Mol Biol Cell 2001; 12 : 1103–16. 26. Verlhac MH, Lefebvre C, Guillaud P, et al. Asymmetric division in mouse oocytes : With or without Mos. Curr Biol 2000; 10 : 1303–6. 27. Fernandez J, Roegiers F, Cantillana V, Sardet C. Formation and localization of cytoplasmic domains in leech and ascidian zygotes. Int J Dev Biol 1998; 42 : 1075–84. 28. Nishida H. Specification of developmental fates in ascidian embryos: Molecular approach to maternal determinants and signaling molecules. Int Rev Cytol 2002; 217 : 227–76. 29. Sasakura Y, Ogasawara M, Makabe KW. Two pathways of maternal RNA localization at the posterior-vegetal cytoplasm in early ascidian embryo. Dev Biol 2000; 220 : 365–78. 30. Sardet C, Nishida H, Prodon F, Sawada K. Maternal mRNAs of PEM and macho 1, the ascidian muscle determinant, associate and move with a rough endoplasmic reticulum network in the egg cortex. Development 2003; 130 : 5839–49. 31. King ML, Zhou Y, Bubunenko M. Polarizing genetic information in the egg: RNA localization in the frog oocyte. BioEssays 1999; 21 : 546–57. 32. Ossipova O, He X, Green J. Molecular cloning and developmental expression of Par-1/MARK homologues XPar-1A and XPar-1B from Xenopus laevis. Gene Expr Patterns 2002; 2 : 145–50. 33. Choi SC, Kim J, Han JK. Identification and developmental expression of par-6 gene in Xenopus laevis. Mech Dev 2000; 91 : 347–50. 34. Ohno S. Intercellular junctions and cellular polarity: The PAR-aPKC complex, a conserved core cassette playing fundamental roles in cell polarity. Curr Opin Cell Biol 2001; 13 : 641–8. 35. Van Eeden F, St Johnston D. The polarisation of the anterior-posterior and dorsal-ventral axes during Drosophila oogenesis. Curr Op Gen Dev 1999; 9 : 396–404. 36. Riechmann V, Ephrussi A. Axis formation during Drosophila oogenesis. Curr Opin Genet Dev 2001; 11 : 374–83. 37. Navarro C, Lehmann R, Morris J. Oogenesis: Setting one sister above the rest. Curr Biol 2001; 11 : R162–5. 38. Lopez-Schier H. The polarisation of the anteroposterior axis in Drosophila. Bioessays 2003; 25 : 781–91. 39. Kemphues K. PARsing embryonic polarity. Cell 2000; 101 : 345–8. 40. Johnstone O, Lasko P. Translational regulation and RNA localization in Drosophila oocytes and embryos. Annu Rev Genet 2001; 35 : 365–406. 41. Cha BJ, Serbus LR, Koppetsch BS, Theurkauf WE. Kinesin I-dependent cortical exclusion restricts pole plasm to the oocyte posterior. Nat Cell Biol 2002; 4 : 592–8. 42. Houchmandzadeh B, Wieschaus E, Leibler S. Establishment of developmental precision and proportions in the early Drosophila embryo. Nature 2002; 415 : 798–802. 43. Blankenship JT, Wieschaus E. Two new roles for the Drosophila AP patterning system in early morphogenesis. Development 2001; 128 : 5129–38. 44. Anderson KV. Pinning down positional information: Dorsal-ventral polarity in the Drosophila embryo. Cell 1998; 95 : 439–42. 45. Dissing M, Giordano H, DeLotto R. Autoproteolysis and feedback in a protease cascade directing Drosophila dorsal-ventral cell fate. Embo J 2001; 20 : 2387–93. 46. Stathopoulos A, Van Drenth M, Erives A, et al. Whole-genome analysis of dorsal-ventral patterning in the Drosophila embryo. Cell 2002; 111 : 687–701. 47. Saunders CM, Larman MG, Parrington J, et al. PLC zeta: A sperm-specific trigger of Ca2+ oscillations in eggs and embryo development. Development 2002; 129 : 3533–44. 48. Suzuki K, Tanaka Y, Nakajima Y, et al. Spatiotemporal relationships among early events of fertilization in sea urchin eggs revealed by multiview microscopy. Biophys J 1995; 68 : 739–48. 49. Berridge MJ, Lipp P, Bootman MD. The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol 2000; 1 : 11–21. 50. Roegiers F, McDougall A, Sardet C. The sperm entry point defines the orientation of the calcium-induced contraction wave that directs the first phase of cytoplasmic reorganization in the ascidian egg. Development 1995; 121 : 3457–66. 51. Dumollard R, Sardet C. Three different calcium wave pacemakers in ascidian eggs. J Cell Sci 2001; 114 : 2471–81. 52. Roegiers F, Djediat C, Dumollard R, et al. Phases of cytoplasmic and cortical reorganizations of the ascidian zygote between fertilization and first division. Development 1999; 126 : 3101–17. 53. Xanthos JB, Kofron M, Tao Q, et al. The roles of three signaling pathways in the formation and function of the Spemann organizer. Development 2002; 129 : 4027–43. 54. Holland LZ. Body-plan evolution in the bilateria: Early antero-posterior patterning and the deuterostome-protostome dichotomy. Curr Opin Genet Dev 2000; 10 : 434–42. 55. Samuel AD, Murthy VN, Hengartner MO. Calcium dynamics during fertilization in C. elegans. BMC Dev Biol 2001; 1 : 8. 56. Golden A. Cytoplasmic flow and the establishment of polarity in C. elegans 1-cell embryos. Curr Opin Genet Dev 2000; 10 : 414–20. 57. Goldstein B. Embryonic polarity: A role for microtubules. Curr Biol 2000; 10 : R820–2. 58. Lyczak R, Gomes JE, Bowerman B. Heads or tails: Cell polarity and axis formation in the early Caenorhabditis elegans embryo. Dev Cell 2002; 3 : 157–66. 59. Rappleye CA, Paredez AR, Smith CW, et al. The coronin-like protein POD-1 is required for anterior-posterior axis formation and cellular architecture in the nematode Caenorhabditis elegans. Genes Dev 1999; 13 : 2838–51. 60. Gonczy P. Mechanisms of spindle positioning: Focus on flies and worms. Trends Cell Biol 2002; 12 : 332–9. 61. Elinson RP, Houliston E. Cytoskeleton in Xenopus oocytes and eggs. Sem Cell Biol 1990; 1 : 349–57. 62. Marrari Y, Terasaki M, Arrowsmith V, Houliston E. Local inhibition of cortical rotation in Xenopus eggs by an anti-KRP antibody. Dev Biol 2000; 224 : 250–62. 63. Miller JR, Rowning BA, Larabell CA, et al. Establishment of the dorsal-ventral axis in Xenopus embryos coincides with the dorsal enrichment of dishevelled that is dependent on cortical rotation. J Cell Biol 1999; 146 : 427–37. 64. Larabell CA, Torres M, Rowning BA, et al. Establishment of the dorso-ventral axis in Xenopus embryos is presaged by early asymmetries in beta-catenin that are modulated by the Wnt signaling pathway. J Cell Biol 1997; 136 : 1123–36. 65. Beckhelling C, Perez-Mongiovi D, Houliston E. Localised MPF regulation in eggs. Biol Cell 2000; 92 : 245–53. 66. Perez-Mongiovi D, Beckhelling C, Chang P, et al. E. Nuclei and microtubule asters stimulate maturation/M phase promoting factor (MPF) activation in Xenopus eggs and egg cytoplasmic extracts. J Cell Biol 2000; 150 : 963–74. 67. Marikawa Y, Elinson RP. Relationship of vegetal cortical dorsal factors in the Xenopus egg with the Wnt/beta-catenin signaling pathway. Mech Dev 1999; 89 : 93–102. 68. Nishida H. Cell fate specification by localized cytoplasmic determinants and cell interactions in ascidian embryos. Int Rev Cytol 1997; 176 : 245–306. 69. Nishida H, Sawada K. macho-1 encodes a localized mRNA in ascidian eggs that specifies muscle fate during embryogenesis. Nature 2001; 409 : 724–9. 70. Takamura K, Fujimura M, Yamaguchi Y. Primordial germ cells originate from the endodermal strand cells in the ascidian Ciona intestinalis. Dev Genes Evol 2002; 212 : 11–8. 71. Seydoux G, Schedl T. The germline in C. elegans: origins, proliferation, and silencing. Int Rev Cytol 2001; 203 : 139–85. 72. Goldstein B. When cells tell their neighbors which direction to divide. Dev Dyn 2000; 218 : 23–9. 73. Labouesse M, Mango SE. Patterning the C. elegans embryo: moving beyond the cell lineage. Trends Genet 1999; 15 : 307–13. 74. Horstadius S. Experimental embryology of echinoderms. London: Clarendon Press, 1973 75. Boveri T. Über die polarität des seeigeleies. Ver der Phys Med Ges zu Wuerzburg 1901; 34 : 145–75. 76. Coffman JA, Davidson EH. Oral-aboral axis specification in the sea urchin embryo. I. Axis entrainment by respiratory asymmetry. Dev Biol 2001; 230 : 18–28. 77. Henry JJ, Raff RA. Evolutionary change in the process of dorsoventral axis determination in the direct developing sea urchin, Heliocidaris erythrogramma. Dev Biol 1990; 141 : 55–69. 78. Gross JM, Peterson RE, Wu SY, McClay DR. LvTbx2/3: A T-box family transcription factor involved in formation of the oral/aboral axis of the sea urchin embryo. Development 2003; 130 : 1989–99. 79. Schroeder TE. Expressions of the prefertilization polar axis in sea urchin eggs. Dev Biol 1980; 79 : 428–43. 80. Sardet C, Chang P. A marker of animal-vegetal polarity in the egg of the sea urchin Paracentrotus lividus. The pigment band. Exp Cell Res 1985; 160 : 73–82. 81. Angerer LM, Angerer RC. Animal-vegetal axis patterning mechanisms in the early sea urchin embryo. Dev Biol 2000; 218 : 1–2. 82. Brandhorst BP, Klein WH. Molecular patterning along the sea urchin animal-vegetal axis. Int Rev Cytol 2002; 213 : 183–232. 83. Emily-Fenouil F, Ghiglione C, Lhomond G, et al. GSK3beta/shaggy mediates patterning along the animal-vegetal axis of the sea urchin embryo. Development 1998; 125 : 2489–98. 84. McClay DR, Peterson RE, Range RC, et al. A micromere induction signal is activated by beta-catenin and acts through notch to initiate specification of secondary mesenchyme cells in the sea urchin embryo. Development 2000; 127 : 5113–22. 85. Sweet HC, Hodor PG, Ettensohn CA. The role of micromere signaling in Notch activation and mesoderm specification during sea urchin embryogenesis. Development 1999; 126 : 5255–65. 86. Beddington RS, Robertson EJ. Axis development and early asymmetry in mammals. Cell 1999; 96 : 195–209. 87. Lu CC, Brennan J, Robertson EJ. From fertilization to gastrulation: Axis formation in the mouse embryo. Curr Opin Genet Dev 2001; 11 : 384–92. 88. Zernicka-Goetz M. Patterning of the embryo: The first spatial decisions in the life of a mouse. Development 2002; 129 : 815–29. 89. Weber RJ, Pedersen RA, Wianny F, et al. Polarity of the mouse embryo is anticipated before implantation. Development 1999; 126 : 5591–8. 90. Gardner RL. Polarity in early mammalian development. Curr Opin Genet Dev 1999; 9 : 417–21. 91. Ciemerych MA, Mesnard D, Zernicka-Goetz M. Animal and vegetal poles of the mouse egg predict the polarity of the embryonic axis, yet are non essential for development. Development 2000; 127 : 3467–74. 92. Piotrowska K, Zernicka-Goetz M. Early patterning of the mouse embryo. Contributions of sperm and egg. Development 2002; 129 : 5803–13. 93. Edwards RG. Ovarian differentiation and human embryo quality. 1. Molecular and morphogenetic homologies between oocytes and embryos in Drosophila, C. elegans, Xenopus and mammals. Reprod Biomed Online 2001; 3 : 138–60. 94. Piotrowska K, Zernicka-Goetz M. Role for sperm in spatial patterning of the early mouse embryo. Nature 2001; 409 : 517–21. 95. Johnson MH. Mammalian development: Axes in the egg ? Curr Biol 2001; 11 : R281–4. 96. Deguchi R, Shirakawa H, Oda S, et al. Spatiotemporal analysis of Ca2+ waves in relation to the sperm entry site and animal-vegetal axis during Ca2+ oscillations in fertilized mouse eggs. Dev Biol 2000; 218 : 299–313. 97. Ozil JP, Huneau D. Activation of rabbit oocytes: The impact of the Ca2+ signal regime on development. Development 2001; 128 : 917–28. 98. Huxley JS. Problems of relative growth. New York : Dial Press, 1932. 99. Chabry LM. Contribution à l’embryologie normale et tératologique des ascidies simples. J Anat Physiol Norm Pathol 1887; 23 : 167–321. 100. Driesch D. The potency of the first two cleavage cells in echinoderm development : Experimental production of partial and double formation. New York, Hafner, 1974 : 1892. |