| |
| Med Sci (Paris). 2004 May; 20(5): 544–549. Published online 2004 May 15. doi: 10.1051/medsci/2004205544.Canaux K2P neuronaux : aspects moléculaires et fonctionnels Christophe Girard and Florian Lesage* Institut de Pharmacologie moléculaire et cellulaire, CNRS UMR 6097, 660, route les Lucioles, Sophia Antipolis, 06560 Valbonne, France |
Les canaux potassiques sont des complexes protéiques qui permettent la diffusion passive et sélective des ions K+ au travers de la membrane plasmique. La concentration intracellulaire d’ion K+ étant plus élevée que la concentration extracellulaire, l’ouverture de ces canaux se traduit par un flux de K+ sortant de la cellule. Cette sortie d’ions positifs provoque un déplacement du potentiel électrique de membrane (Em) vers des valeurs négatives. La force électrostatique générée s’oppose à la sortie du K+. Le potentiel d’équilibre de l’ion K+ (EK) ou potentiel de Nernst est défini par la valeur du potentiel de membrane à laquelle le flux net de K+ est nul. Dans une cellule au repos, les canaux ioniques ouverts sont principalement des canaux K+et par conséquent, la valeur du potentiel de repos est proche du potentiel d’équilibre de l’ion K+ (~ - 90 mV dans de nombreuses conditions physiologiques). Les canaux K+ sont exprimés de façon ubiquitaire au sein de l’organisme. Ils jouent un rôle majeur dans l’homéostasie du K+ et plus généralement dans les fonctions physiologiques associées à une variation de potentiel électrique de membrane, par exemple la transmission synaptique, la contraction musculaire ou la libération d’hormones [
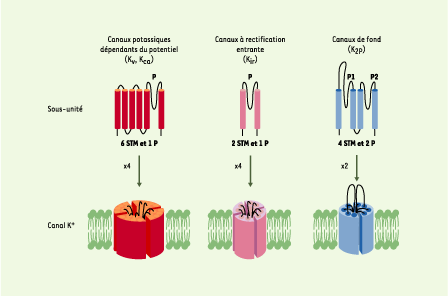
1]. Le rôle majeur des canaux K+ est souligné par le nombre croissant de maladies génétiques auxquelles ils sont associés : maladies des systèmes nerveux et sensoriel (ataxie épisodique, épilepsies infantiles, surdités), maladies cardiaque et musculaire (syndrome du QT long, fibrillation auriculaire, paralysie périodique), maladies pancréatiques (hyperinsulinémie hypoglycémiante infantile) ou encore rénales (syndrome de Bartter) (→). L’électrophysiologie, et notamment la mise au point de la technique de patch clamp (voir l’Encadré de J. Teulon, page 550 de ce numéro), a rendu possible l’étude des canaux ioniques dans leur environnement natif. Ces études ont révélé l’existence d’une grande diversité de courants K+ aux propriétés fonctionnelles et pharmacologiques distinctes. Cette diversité fonctionnelle repose essentiellement sur une étonnante diversité génique. Plus de 75gènes codant pour des sous-unités des canaux K+ ont été identifiés chez les mammifères, dont la majorité est exprimée dans le système nerveux. Ces différents canaux K+ ont en commun un motif de structure conservé appelé domaine P, qui participe à la formation du filtre de sélectivité pour l’ion K+. Toute mutation de ce domaine entraîne soit un changement de sélectivité soit une perte totale d’activité des canaux. Les canaux K+ sont répartis en trois grandes classes selon leurs homologies structurales et leurs propriétés biophysiques : les canaux dépendants du potentiel (KV, KCa), les canaux à rectification entrante (inward rectifier, Kir) et les canaux à deux domaines P (K2P) (Figure 1) [
2,
3]. 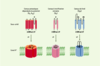 | Figure 1. Structure des différentes classes de canaux K+. Les différentes sous-unités sont réparties en trois grandes classes selon le nombre de segments transmembranaires (STM) et de domaines P, une séquence fortement conservée qui participe à la formation du filtre de sélectivité de ces canaux. Les canaux K+ sont des tétramères de sous-unités à 6 et 2 STM (canaux dépendants du potentiel, KV, ou du calcium KCa), et des dimères de sous-unités à 4 STM (canaux de fond, K2P). Les résidus chargés du voltage sensor des canaux Kv sont indiqués par le signe +. Le domaine P est indiqué par la lettre P. |
Les sous-unités à deux domaines P (notés P1 et P2) ont été identifiées à partir de recherches dans les banques de données issues du séquençage systématique des génomes. Le premier membre cloné de cette classe, appelé TWIK1 (tandem of P domains in a weak inwardly-rectifying K+ channel), possède quatre segments transmembranaires (M1 à M4) [
5]. Depuis, 14 sous-unités K2P ont été identifiées chez les mammifères et classées en six sous-groupes selon leurs homologies structurales et fonctionnelles [
6,
7] (Figure 2). Ces canaux possèdent une large boucle M1P1 extracellulaire qui participe à la dimérisation des sous-unités entre elles [
8] (Figure 1). Les canaux K2P sont ouverts quel que soit le potentiel de membrane. Ils génèrent des courants à rectification sortante, à l’exception des canaux TWIK qui présentent une rectification entrante. Les canaux K2P produisent des courants instantanés qui ne s’inactivent pas au cours du temps. Ces propriétés et leur résistance aux inhibiteurs classiques indiquent que ces courants correspondent à une classe particulière de conductances de fond, enregistrées dans une grande variété de cellules nerveuses (pour revue, voir [
9]). Ouverts à la fois au potentiel de repos et lors de dépolarisations, ces canaux de fond contrôlent le potentiel de repos des cellules et sont aussi susceptibles de contrôler la durée et la fréquence des potentiels d’action neuronaux. Les canaux K2P sont présents dans tous les tissus de l’organisme, cependant chaque canal a un profil d’expression unique. Dans le cerveau, les canaux K2P exprimés sont essentiellement les canaux TWIK1, TREK1 et TREK2 (TWIK1-related K+channel), TRAAK (TWIK1-related arachidonic acid sensitive K+ channel), et TASK1 et TASK3 (TWIK1-related acid-sensitive K+ channel) [
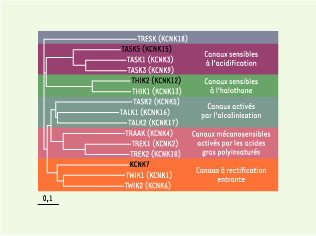
10]  | Figure 2.
Dendrogramme des canaux K2P
. Les canaux K2P sont regroupés en 6 sous-groupes selon leurs homologies de séquences et leurs propriétés fonctionnelles. Parmi les 15 canaux clonés, 12 produisent des courants K+ après expression hétérologue (les sous-unités non fonctionnelles sont indiquées en noir). Le nom des gènes selon la nomenclature HUGO (Human Genome Organization, http://www.gene.ucl.ac.uk/nomenclature/) est indiqué entre parenthèses. |
|
Propriétés des canaux K2P Les canaux TASK1, TASK3 et TASK5 Les canaux TASK1, TASK3 et la sous-unité non fonctionnelle TASK5 ont une forte homologie de séquence avec environ 70 % de conservation. L’adressage à la membrane plasmique des canaux TASK1 et TASK3 est contrôlé par des sous-unités auxiliaires associées [
11,
12]. Leur activité est instantanée, soutenue et ne dépend pas du potentiel. Les courants produits sont relativement insensibles aux bloqueurs classiques des canaux K + [Cs +, Ba 2+, ion tétraéthylammonium (TEA), 4-aminopyridine (4-AP)]. TASK1 est spécifiquement inhibé par des concentrations submicromolaires d’un endocannabinoïde, l’anandamide [
13] (Figure 3). La propriété la plus remarquable des canaux TASK est leur extrême sensibilité aux variations de pH extracellulaire [
14,
15] ( Figure 3). 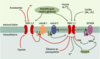 | Figure 3.
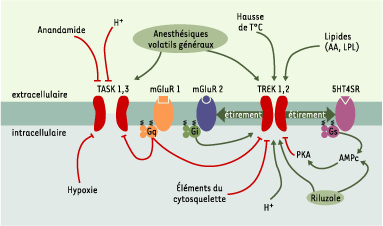
Diverses voies de régulation des canaux TASK et TREK. Dans les systèmes d’expression hétérologue, les canaux TASK sont actifs au repos, contrairement aux canaux TREK dont l’activité basale est faible. Les canaux TASK intègrent une variété de stimulus chimiques et métaboliques qui diminuent leur activité basale, alors que les canaux TREK sont activés par une variété de stimulus chimiques, métaboliques mais également physiques. La caractéristique la plus marquante des canaux TASK concerne leur sensibilité à l’acidose extracellulaire et à l’hypoxie, tandis que les canaux TREK sont principalement activés par l’étirement membranaire, les acides gras polyinsaturés (AA : acide arachidonique ; LPL : lysophospholipides) ou encore la température (T°C). mGluR1,2 : récepteurs métabotropiques au glutamate ; 5HT4SR : récepteur sérotoninergique ; PKA : protéine kinase A. Les voies activatrices sont représentées en vert et les voies inhibitrices en rouge. |
Les canaux TREK1, TREK2 et TRAAK Les canaux TREK1, TREK2 et TRAAK produisent des courants K + de fond, similaires à ceux des canaux TASK. Leurs cinétiques d’activation et de désactivation sont très rapides. Ils sont insensibles aux bloqueurs classiques des canaux K +. Contrairement aux canaux TASK, l’activité au repos des canaux TREK est faible. Cependant, ils sont activés par une grande diversité de mécanismes ( Figure 3). Les canaux TREK sont sensibles aux variations du volume cellulaire [ 7]. Ils sont ouverts par un étirement de la membrane cellulaire (provoquée par une aspiration dans la pipette d’enregistrement) et sont inhibés par une hyperosmolarité extracellulaire qui induit une réduction du volume cellulaire. Le nombre de canaux activés, ainsi que leur réponse à la pression mécanique, augmentent lors de la destruction du cytosquelette par des agents pharmacologiques. La répression permanente de l’activité des canaux TREK par le cytosquelette pourrait rendre compte de la faible activité de ces canaux au repos. Les canaux TREK1 et TREK2, mais pas le canal TRAAK, deviennent constitutivement actifs lors d’une acidose intracellulaire ou lors d’une augmentation de température. Tous ces canaux sont ouverts de manière réversible par les lysophospholipides qui possèdent de larges têtes polaires (lysophosphatidylcholine, lysophosphatidylinositol), ou par les acides gras polyinsaturés comme l’acide arachidonique. Ils sont insensibles à l’application d’acides gras saturés. Enfin, ces canaux sont modulés par les neurotransmetteurs. Les canaux TREK1 et TREK2 sont modulés par des récepteurs couplés aux protéines G. La stimulation de récepteurs couplés aux protéines G q ou G s inhibe TREK1 et TREK2, tandis que celle de récepteurs couplés aux protéines G i active ces canaux. L’inhibition des canaux TREK par les récepteurs couplés aux protéines G s fait intervenir la phosphorylation, par la protéine kinase A, d’une sérine conservée dans TREK1 et TREK2 [ 7,
22]. |
Rôle des canaux K2P dans les neurones Transmission synaptique Grâce à leurs propriétés fonctionnelles et à leur pharmacologie uniques, les canaux TASK ont été identifiés dans de nombreuses structures du système nerveux central. Dans les motoneurones de l’hypoglosse (XIIe paire des nerfs crâniens) et les cellules granulaires du cervelet, des courants de type TASK contrôlent le potentiel de repos. Ils sont inhibés par différents neurotransmetteurs (acétylcholine, sérotonine, norepinéphrine, glutamate) qui agissent via des récepteurs couplés aux protéines G q [
17,
18]. Le blocage par les neurotransmetteurs du courant TASK induit une dépolarisation membranaire et une augmentation de la décharge des potentiels d’action, révélant le rôle de ces canaux dans le contrôle de l’excitabilité neuronale. Ce rôle a été confirmé chez des souris déficientes pour la sous-unité a6 du récepteur GABA A [
19]. Malgré l’absence, chez ces souris, de la conductance Cl- inhibitrice médiée par le récepteur GABA A, le seuil d’excitation nécessaire pour déclencher un potentiel d’action est le même que celui des souris sauvages. Cette compensation est due à la surexpression d’une conductance de type TASK. Ces observations suggèrent une implication des canaux TASK dans le contrôle à long terme de l’excitabilité neuronale. Les canaux TREK ont des propriétés pharmacologiques et électrophysiologiques similaires à celles du canal de type S (serotonin-sensitive) (pour revue, voir [7]). Ce canal K+ de fond intervient dans une forme simple d’apprentissage chez l’aplysie 1. Un pincement de la partie postérieure de l’animal s’accompagne d’une sensibilisation du réflexe de retrait des ouïes. Cette sensibilisation est due à une facilitation présynaptique de la transmission entre les neurones sensoriels et les neurones moteurs de l’arc réflexe. La libération de sérotonine par des interneurones facilitateurs entraîne la fermeture du canal de type S dans les terminaisons présynaptiques des neurones sensoriels. Il s’ensuit une dépolarisation qui aboutit à une libération accrue de neurotransmetteurs et facilite la transmission synaptique qui conduit au retrait des ouïes. Les similitudes entre les canaux TREK et le canal de type S, ainsi que l’expression des canaux TREK dans de nombreuses aires du système nerveux central, suggèrent un rôle de ces canaux dans la régulation de la transmission synaptique chez les mammifères [
20,
21]. 1 Mollusque gastéropode de l’ordre des opisthobranches. Canaux TASK et chémoréception Les canaux TASK pourraient jouer un rôle dans la chémoréception. Ces canaux sont exprimés dans des neurones impliqués dans la régulation centrale de la respiration : les motoneurones et les neurones chémorécepteurs du locus coeruleus [ 22]. Comme les courants TASK, les conductances K + de fond de ces cellules sont sensibles aux variations de pH (dans la gamme physiologique) et sont inhibées par les neurotransmetteurs activant des récepteurs couplés aux protéines G q. L’inhibition de ces courants par l’acidose extracellulaire induit une dépolarisation du potentiel de membrane et une augmentation de l’excitabilité de ces cellules, ce qui accroît la réponse respiratoire au niveau des motoneurones. De manière remarquable, les canaux TASK sont également présents, en périphérie, dans les cellules de type I des corps carotidiens. Dans ces cellules, leur fermeture par l’hypoxie et l’acidose induit une dépolarisation membranaire et la libération de dopamine, ce qui provoque une augmentation réflexe de la ventilation [
23]. Canaux TREK et thermorégulation Les canaux TREK1 présentent une sensibilité inhabituelle à la température. L’expression des canaux TREK1 dans les neurones centraux et périphériques impliqués dans la perception du froid, ainsi que leur sensibilité aux variations de température, font de ces canaux des thermorécepteurs potentiels [
24]. Les neurones sensibles au froid situés dans l’hypothalamus antérieur et dans les ganglions rachidiens dorsaux répondent à une baisse de température par une décharge de potentiels d’action. Dans ces neurones, l’inhibition des canaux TREK1 par le froid pourrait entraîner une dépolarisation propice au développement de ces potentiels d’action. Canaux K2P, cibles des anesthésiques volatils Les anesthésiques volatils généraux provoquent une dépression du système nerveux central associée à l’inconscience, l’amnésie et l’analgésie. Cette dépression est due à une hyperpolarisation du potentiel membranaire neuronal. Les canaux K + de fond sont d’excellents candidats pour expliquer cet effet. Chez le rat, l’activation d’une conductance K + de fond TASK par les anesthésiques volatils provoque une hyperpolarisation et la suppression de l’activité électrique dans les neurones du locus coeruleus, du raphé et de la couche granulaire du cervelet. Cet effet des anesthésiques n’est pas propre aux mammifères puisque, chez l’aplysie, ces composés activent les canaux de type S. Les canaux clonés TREK1 et TREK2 sont activés par des concentrations cliniques d’éther, de chloroforme, d’halothane et d’isoflurane, tandis que les canaux TASK1 et TASK3 sont principalement activés par l’halothane et l’isoflurane [
25] ( Figures 3 et 4). L’activation des canaux TREK et TASK par de faibles concentrations d’anesthésiques volatils peut permettre, au moins en partie, d’expliquer les effets cliniques des anesthésiques volatils. Par exemple, dans les motoneurones, les neurones du raphé et les cellules granulaires du cervelet, l’ouverture des canaux de type TASK pourrait contribuer à l’immobilisation et à l’effet sédatif des anesthésiques, alors que dans le locus coeruleus, elle pourrait expliquer leurs effets analgésiques et hypnotiques [
26,
27]. Canaux K2P et neuroprotection Au cours d’une ischémie cérébrale, la dégradation des phospholipides membranaires par les phospholipases A2, cytosoliques ou sécrétées, entraîne une libération d’acides gras polyinsaturés et de lysophospholipides. Ces dérivés lipidiques préviennent la mort neuronale dans des modèles animaux d’ischémie cérébrale, même lorsqu’ils sont administrés après l’ischémie [ 21,
28]. Les acides gras saturés comme l’acide palmitique n’ont pas d’effet sur la survie neuronale. Il est tentant de proposer un rôle des canaux TREK dans la neuroprotection. Le gonflement des cellules, l’acidose intracellulaire et la production de dérivés lipidiques, qui caractérisent une crise ischémique, pourraient contribuer à l’activation des canaux TREK et TRAAK. Cette activation conduirait à une hyperpolarisation des neurones, ce qui limiterait l’entrée de calcium par les canaux Ca 2+ dépendants du potentiel et les récepteurs NMDA, et fournirait ainsi un mécanisme neuroprotecteur. Toutefois, l’ouverture des canaux TREK présynatiques pourrait provoquer une accumulation de K + dans la fente synaptique ce qui peut être délétère pour les cellules si cet ion n’est pas rapidement réabsorbé par les cellules gliales. Le canal TREK2, présent dans des cultures primaires d’astrocytes de rat, contribue au courant K + de fond exprimé par ces cellules [
29]. Fortement stimulé par l’étirement membranaire, les acides gras tels que l’acide arachidonique, ou encore par l’acidification du milieu intracellulaire, TREK2 pourrait jouer un rôle dans l’homéostasie potassique des cellules non excitables du cerveau et intervenir de façon indirecte dans la neuroprotection. ll est important de noter que d’autres activateurs des canaux TREK et TRAAK tels que les anesthésiques volatils et la température ont également des effets neuroprotecteurs. Enfin, le riluzole (RP 54274), une drogue utilisée pour le traitement de la sclérose amyotrophique latérale et qui agit en ralentissant la dégénérescence des motoneurones, stimule l’activité de ces canaux [
30] ( Figure 4).
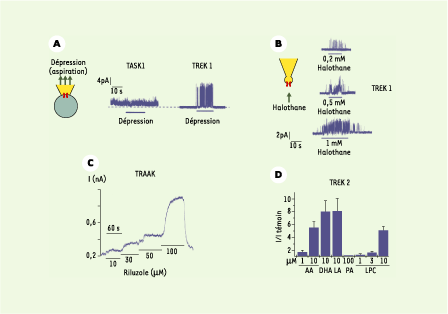
 | Figure 4.
Pharmacologie et régulation des canaux K2P. A. Les canaux TREK sont des canaux mécanosensibles : l’application d’une dépression (par aspiration par exemple) est sans effet sur les canaux TASK mais active les canaux TREK. B. Les canaux K2P sont la cible des anesthésiques volatils : l’halothane active les canaux TREK1 en « patch excisé ». Cette stimulation est réversible et dépendante de la concentration d’anesthésique. C. Le riluzole active les canaux TRAAK. I : intensité du courant enregistré (nA). D. Les acides gras polyinsaturés (AA : acide arachidonique ; DHA : acide docosahexanoïque ; LA : acide linoléique) et les lysophospholipides (LPC : lysophosphatidylcholine) sont de puissants activateurs des canaux TREK, tandis que les acides gras saturés comme l’acide palmitique (PA) n’ont aucun effet. |
|
En donnant accès à une classe de courants K+ qui était peu étudiée en l’absence d’une pharmacologie spécifique, le clonage des canaux K2P a suscité un engouement considérable. Ces canaux sont à l’origine des conductances de fond qui contrôlent l’excitabilité d’un grand nombre de cellules nerveuses. Bien que ces courants soient dits « de fond », leur activité est étroitement contrôlée par de nombreux mécanismes différents. Toute modification de leur activité résulte en de profonds changements de l’excitabilité. L’inhibition de ces canaux par les neurotransmetteurs favorise la transmission synaptique tandis que leur stimulation augmente considérablement la résistance membranaire, ce qui conduit à une diminution globale de l’excitabilité. Leurs rôles physiologiques ne sont pas encore clairement définis. Certains d’entre eux sont probablement impliqués dans la thermorégulation, c’est le cas des canaux TREK1, ou dans la réponse respiratoire à l’hypoxie dans le cas des canaux TASK. L’obtention de souris dont les gènes de ces canaux ont été invalidés et le développement d’une pharmacologie spécifique fourniront des outils essentiels pour étudier finement ces canaux. Enfin, l’activation de certains de ces canaux par les anesthésiques volatils, le riluzole ou les acides gras insaturés font des canaux à deux domaines P des cibles particulièrement prometteuses pour la conception de nouveaux anesthésiques et de nouveaux agents neuroprotecteurs. |
Footnotes |
1. Hille B. Ionic channels in excitable membranes. Sunderland : Sinauer Associates Inc, 1992 : 608 p. 2. Coetzee WA, Amarillo Y, Chiu J, et al. Molecular diversity of K+ channels. Ann NY Acad Sci 1999; 868 : 233–85. 3. Jan LY, Jan YN. Voltage-gated and inwardly rectifying potassium channels. J Physiol 1997; 505 : 267–82. 4. Yamada M, Inanobe A, Kurachi Y. G protein regulation of potassium ion channels. Pharmacol Rev 1998; 50 : 723–60. 5. Lesage F, Guillemare E, Fink M, et al. TWIK-1, a ubiquitous human weakly inward rectifying K+ channel with a novel structure. Embo J 1996; 15 : 1004–11. 6. Lesage F, Lazdunski M. Molecular and functional properties of two-pore-domain potassium channels. Am J Physiol Renal Physiol 2000; 279 : F793–801. 7. Patel AJ, Honore E. Properties and modulation of mammalian 2P domain K+ channels. Trends Neurosci 2001; 24 : 339–46. 8. Lesage F, Reyes R, Fink M, et al. Dimerization of TWIK-1 K+ channel subunits via a disulfide bridge. Embo J 1996; 15 : 6400–7. 9. Lesage F. Pharmacology of neuronal background potassium channels. Neuropharmacology 2003; 44 : 1–7. 10. Talley EM, Solorzano G, Lei Q, et al. CNS distribution of members of the two-pore-domain (KCNK) potassium channel family. J Neurosci 2001; 21 : 7491–505. 11. Girard C, Tinel N, Terrenoire C, et al. p11, an annexin II subunit, an auxiliary protein associated with the background K+ channel, TASK-1. Embo J 2002; 21 : 4439–48. 12. Rajan S, Preisig-Muller R, Wischmeyer E, et al. Interaction with 14-3-3 proteins promotes functional expression of the potassium channels TASK-1 and TASK-3. J Physiol 2002; 545 : 13–26. 13. Maingret F, Patel AJ, Lazdunski M, Honore E. The endocannabinoid anandamide is a direct and selective blocker of the background K+ channel TASK-1. Embo J 2001; 20 : 47–54. 14. Duprat F, Lesage F, Fink M, et al. TASK, a human background K+ channel to sense external pH variations near physiological pH. Embo J 1997; 16 : 5464–71. 15. Rajan S, Wischmeyer E, Xin Liu G, et al. TASK-3, a novel tandem pore domain acid-sensitive K+ channel. An extracellular histiding as pH sensor. J Biol Chem 2000; 275 : 16650–7. 16. Lesage F, Terrenoire C, Romey G, Lazdunski M. Human TREK2, a 2P domain mechano-sensitive K+ channel with multiple regulations by polyunsaturated fatty acids, lysophospholipids, and Gs, Gi, and Gq protein-coupled receptors. J Biol Chem 2000; 275 : 28398–405. 17. Talley EM, Lei Q, Sirois JE, Bayliss DA. TASK-1, a two-pore domain K+ channel, is modulated by multiple neurotransmitters in motoneurons. Neuron 2000; 25 : 399–410 18. Millar JA, Barratt L, Southan AP, et al. A functional role for the two-pore domain potassium channel TASK-1 in cerebellar granule neurons. Proc Natl Acad Sci USA 2000; 97 : 3614–8 19. Brickley SG, Revilla V, Cull-Candy SG, et al. Adaptive regulation of neuronal excitability by a voltage-independent potassium conductance. Nature 2001; 409 : 88–92. 20. Han J, Truell J, Gnatenco C, Kim D. Characterization of four types of background potassium channels in rat cerebellar granule neurons. J Physiol 2002; 542 : 431–44. 21. Lauritzen I, Blondeau N, Heurteaux C, et al. Polyunsaturated fatty acids are potent neuroprotectors. Embo J 2000; 19 : 1784–93. 22. Bayliss DA, Talley EM, Sirois JE, Lei Q. TASK-1 is a highly modulated pH-sensitive ’leak’ K+ channel expressed in brainstem respiratory neurons. Respir Physiol 2001; 129 : 159–74. 23. Buckler KJ, Williams BA, Honore E. An oxygen-, acid- and anaesthetic-sensitive TASK-like background potassium channel in rat arterial chemoreceptor cells. J Physiol 2000; 525 : 135–42. 24. Maingret F, Lauritzen I, Patel AJ, et al. TREK-1 is a heat-activated background K+ channel. Embo J 2000; 19 : 2483–91. 25. Patel AJ, Honore E, Lesage F, et al. Inhalational anesthetics activate two-pore-domain background K+ channels. Nat Neurosci 1999; 2 : 422–6. 26. Washburn CP, Sirois JE, Talley EM, et al. Serotonergic raphe neurons express TASK channel transcripts and a TASK-like pH- and halothane-sensitive K+ conductance. J Neurosci 2002; 22 : 1256–65. 27. Sirois JE, Lynch IC, Bayliss DA. Convergent and reciprocal modulation of a leak K+ current and I(h) by an inhalational anaesthetic and neurotransmitters in rat brainstem motoneurones. J Physiol 2002; 541 : 717–29. 28. Blondeau N, Lauritzen I, Widmann C, et al. A potent protective role of lysophospholipids against global cerebral ischemia and glutamate excitotoxicity in neuronal cultures. J Cereb Blood Flow Metab 2002; 22 : 821–34. 29. Gnatenco C, Han J, Snyder AK, Kim D. Functional expression of TREK-2 K+ channel in cultured rat brain astrocytes. Brain Res 2002; 931 : 56–67. 30. Duprat F, Lesage F, Patel AJ, et al. The neuroprotective agent riluzole activates the two P domain K+ channels TREK-1 and TRAAK. Mol Pharmacol 2000; 57 : 906–12. |