L’initiation de la transcription par les ARN polymérases fait intervenir une machinerie complexe, mais conservée au cours de l’évolution. La protéine TBP (TATA binding protein) est un des facteurs clés dans ce processus. En effet, TBP paraît essentiel pour la transcription par les trois ARN polymérases, pol I, pol II et pol III [ 1– 5].
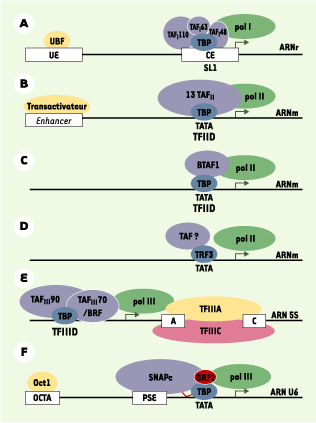
TBP reconnaît l’élément TATA en amont du site d’initiation d’un grand nombre de promoteurs (Figure 1). C’est une protéine bipartite, avec une région aminoterminale variable et un domaine carboxyterminal très conservé. Le domaine aminoterminal présente une importante variabilité de séquence et de taille en fonction des espèces (Figure 2A). Le domaine carboxyterminal est conservé à près de 80 % entre la levure et l’homme. Il adopte une structure en « selle de cheval » (Figure 2D) avec une face concave hydrophobe interagissant avec l’ADN et une face convexe qui interagit avec TFIIA, TFIIB et autres facteurs [ 6– 10].
| Figure 1.
Structure des promoteurs des gènes transcrits par les ARN polymérases I, II et III. TBP (TATA binding protein) est une sous-unité des complexes nécessaires à la transcription par les trois ARN polymérases.A. La transcription par l’ARN polymérase I (Pol I) des gènes codant pour les ARN ribosomiques (ARNr) nécessite la fixation de UBF (upstream binding factor) à l’élément régulateur UE (upstream element) et la fixation du complexe SL1 (selectivity factor 1), contenant TBP et trois TAF (TBP-associated factors), au promoteur proximal CE (core element). B. La transcription par l’ARN polymérase II (pol II) des ARNm peut faire intervenir le complexe TFIID (transcription factor IID), formé de TBP et de treize TAF (représentés ici par un seul disque). C. La transcription par pol II peut aussi se faire par l’intermédiaire du complexe B-TFIID formé de TBP et BTAF1. D.. TRF3 (TBP-related factor) est un nouveau facteur impliqué dans la transcription par pol II. Son interaction avec les TAF reste à démontrer. E.. La transcription par pol III fait intervenir les complexes TFIIIA et TFIIIC qui se fixent sur les éléments intragéniques, par exemple du gène codant pour les ARN ribosomiques 5S (ARN 5S) comme indiqué ici. Le complexe TFIIIB contenant TBP se fixe en amont du gène.F . Dans le cas de la transcription du gène codant pour les petits ARN nucléaires U6 (ARN U6), TBP se fixe sur l’élément TATA et interagit avec le complexe SNAPc (small nuclear RNA-activating protein complex) fixé sur PSE (proximal sequence element) par l’intermédiaire de son domaine aminoterminal. L’activation du gène ARN U6 se fait par le facteur Oct1 (octamer-binding transcription factor 1) fixé à une séquence OCTA (octamer). Pour plus de clarté, les cinq sous-unités du complexe SNAPc sont réprésentées par un seul disque. BRF2 : TFIIB-related factor, subunit of RNA polymerase III transcription initiation factor. |
| Figure 2.
Organisation et structure de la famille des TBP (TATA binding proteins). A. Organisation de TBP de différentes espèces. Le domaine aminoterminal est réprésenté en jaune et la présence des répétitions des résidus glutamines (Q) en noir. Le polymorphisme allélique humain (28-42 glutamines) est indiqué. La structure du mutant TBP∆ N murin (souris ∆N) mentionné dans l’article ainsi que l’épitope FLAG (étiquette génétique) (F) sont également schématisés. L’alignement de TRF1 (TBP-related factor 1) et de la famille TBP sont présentés. Le premier acide aminé du domaine conservé est indiqué pour chacun des TBP. B, C. Alignement de TRF3 et TRF2/TLF (TBP-like factor) et de la famille TBP. La répétition directe qui forme la structure en selle de cheval du domaine conservé est indiquée par les flèches. D. Représentation de la structure en selle de cheval du domaine carboxyterminal conservé de TBP, déterminée par cristallographie aux rayons X. H1, H1’, H2 et H2’ représentent les hélices α et S1-S5 et S1’-S5’ les feuillets β. |
Sa forte conservation et sa présence dans les complexes d’initiation des trois ARN polymérases ont fait de TBP le « facteur de transcription universel ». Des découvertes récentes ont changé notre perspective sur ce caractère universel de TBP.